高一化学电子式结构式的书写方法
高考化学中常见的电子式大全
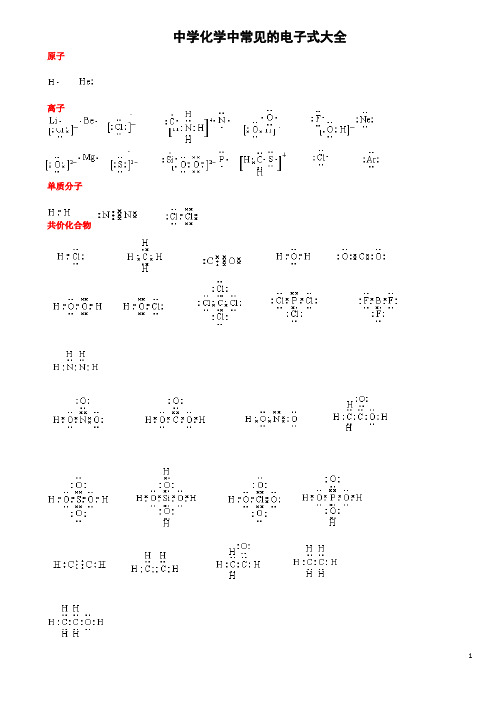
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔OO H Cl O Mg 2+ Cl 2者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
高一化学电子式_结构式书写方法
MgCl2:
HCl:
H2O
书写离子化合物的电子式
K2S:
K+[ :S :]2-K+
: :
CaO:
CaF2: [ F ]-Ca2+[ F ]NaCl: MgCl2:
Na Cl
2
Cl Mg Cl
书写共价化合物电子式的方法:将成键原子的电子式组 合起来,使其达到8电子或2电子稳定结构。 书写H2S、H2O2、CO2电子式:
ⅢA
ⅣA
ⅤA
二、离子电子式书写方法 ⅠA ⅡA Li+ Na+ Be2+ Mg2+ Al3+ ⅢA ⅣA ⅤA ⅥA ⅦA
· · 3· · 2· · [∶N ∶ ] [∶ O∶] [∶F∶] · · · · · · · · 2· · Cl∶] [∶S ∶] [∶ · · · ·
简单阳离子的电子式就是其离子符号;阴离子和 复杂阳离子电子式必须加上中括号并注明电荷数。
原子结构的表示方法
核组成符号极其含义: A ZX
原子结 构的表 示方法 原子结构示意图:S2电子式:在元素符号的周围用小点点表 示原子最外层电子数的式子。
电子排布式
一、原子电子式书写方法 (书写单质分子和化合物电子式的基础) ⅠA ⅡA
· Li · Na
0 ⅥA ⅦA · · · · · · · · · · · O · ∶ F · Be · · · · C · B · · N· · ∶Ne∶ · · · · · · · · · · · · · · · ∶Ar · · ∶ Si · · ∶ Mg · · Cl · · Al · · · S · · P · · · · · · · ·
K
K
高一化学必修二离子键和电子式

+11
281
Na+ +11 2 8
Na+ Cl-
+17 2 8 7
Cl
1.Na+要达到8原 子稳定结构,就 需失去1个电子; Cl-达到8原子稳 定结构需得到1电 子。
Cl- +17 2 8 8
2.钠与氯气反应时, 钠原子的最外电子 层上的1个电子转移 到氯原子的最外层 上,形成带正电的 钠离子和带负电的 氯离子。
3.带相反电荷 的钠离子与氯 离子通过静电 作用结合在一 起,形成与单 质钠与氯气性 质完全不同的 氯化钠。
像上述氯离子与钠离子的反应,它们: 1.通过静电作用结合在一起 2.带相反电荷[是一对阴阳离子相互作用而形
成化合物]
这样由带相反电荷离子之间的相互作用称为 离子键,而由离子键构成的化合物叫做离子 化合物。
“n+”电荷字样。
H+ Na+ Mg2+ Ca2+
(3)阴离子的电子式:不但要画出最外层电子数,
而且还应用于括号“[ ]”括起来,并在右上
角标出所带电荷数。
[ :O····:]2-
[:C·l·:]··
(4)离子化合物的电子式:由阴、阳离子 的电子式组成,但相同离子不能合并
AB型
A2B型
2-
AB2型
(5)用电子式表示离子化合物的形成过程
用电子式表示氯化钠的形成过程:
Na ·+
··
·· C··l · →
Na+ [:C··l :]··
❖ 易错点 ❖ 将箭头“→”写为“=” ❖ 漏标阴离子的中括号,给阳离子多标电子或
符号 ❖ 漏标或错标离子的电荷 ❖ 将多个相同的离子归在一起
高一电子式及化学方程式、离子方程式书写

高一电子式及化学方程式、离子方程式书写一、如何正确书写电子式对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下: 1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的 最外层电子②例子:钠原子 ;镁原子 ;氟原子 2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+ (2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:硫离子 ;氟离子 (3)原子团的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子 ;氢氧根离子 3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成, 但相同的离子不能合并②例子:NaCl 的电子式为 ;K 2S 的电子式为 ,(不能写成 ) (2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出F N H H HH F S 2– Cl Na + Na Mg H H O O K + S 2– K + K 2+ S 2–O – H两原子之间的共用电子对情况②例子:HCl的电子式为;CO2的电子式:③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数5.用电子式表示物质的形成过程如:H2的形成过程+NaCl的形成过程+K2S的形成过程 2 +注意:①用“→”表示形成过程,不用“=”;②“→”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“→”右边是该物质的电子式, 相同的原子不可以合并用电子式表示物质的形成过程①离子化合物的形成过程形成用“→”表示,形成之前为原子的电子式并用弯箭头表示电子得失,形成之后为离子化合物的电子式。
中学化学中常见的电子式大全

中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程常见的20种电子式N 2N N O 2 O O Cl 2 Cl Cl H 2O H O H H 2O 2H O O HCO 2 O C O HclO H O Cl NH 3H N H H PCl 3 Cl P Cl Cl CH 4H H C H H CCl 4 Cl C Cl Cl Cl NaOH O H 〔 〕-Na + Na 2O 2 O O Na + 2-Na + MgCl 2 -Mg 2+ -NH 4Cl+ - CaC 2 Ca 2+ 2- ClCl H H N H H Cl C C-CH 3 —OH如何正确书写电子式(李运强 湖北省大悟县第一中学高一化学组 432800)对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下:1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的最外层电子②例子:钠原子 ;镁原子 ;氟原子2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+(2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷 ②例子:硫离子 ;氟离子 (3)原子团的电子式 ①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子 ;氢氧根离子 3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子:NaCl 的电子式为 ;K 2S 的电子式为 ,(不能写成 ) (2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况②例子:HCl 的电子式为;CO 2的电子式: ③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数5.用电子式表示物质的形成过程如:H 2的形成过程 +NaCl 的形成过程 + HH C H HO F N H HH H F S2– Cl Na + Na Mg H H O OK + S 2– K + Cl H C O O K 2+ S2– O – H H HH H Na Cl Cl Na +K 2S 的形成过程 2 +注意:①用“ → ”表示形成过程,不用“=”;②“ → ”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“ → ”右边是该物质的电子式;③用电子式表示离子化合物的形成过程时,可以在原子之间用箭头表示电子得失的关系,也可以不表示。
(完整版)中学化学中常见的电子式大全(1)
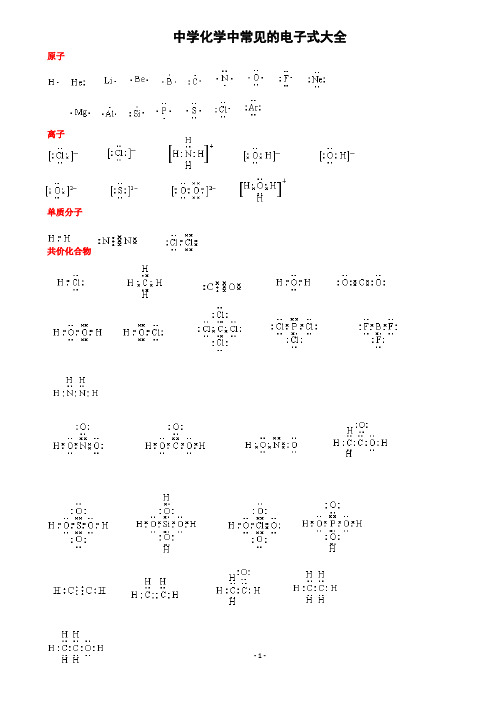
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程常见的20种电子式N 2N NO 2 O O Cl 2 Cl Cl H 2O H O H H 2O 2H O O H CO 2 O C O HclO H O ClNH 3 H N H H PCl 3 Cl P Cl Cl CH 4H H C H H CCl 4 Cl C Cl Cl ClNaOH O H 〔 〕-Na + Na 2O 2 O O Na + 2-Na + MgCl 2 -Mg 2+ -Cl H N HHNH 4Cl+ - CaC 2 Ca 2+ 2- -CH 3 —OH如何正确书写电子式(李运强 湖北省大悟县第一中学高一化学组 432800)对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下:1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的最外层电子②例子:钠原子 ;镁原子 ;氟原子2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+(2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷 ②例子:硫离子 ;氟离子 (3)原子团的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子 ;氢氧根离子 3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子:NaCl 的电子式为 ;K 2S 的电子式为 ,(不能写成 )(2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况ClCl C C HH C H HO F N H H H H FS 2– Cl Na + Na Mg H H O OK + S 2– K + K 2+ S 2– O – H②例子:HCl 的电子式为 ;CO 2的电子式: ③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数5.用电子式表示物质的形成过程如:H 2的形成过程 + NaCl 的形成过程 + K 2S 的形成过程 2 +注意:①用“ → ”表示形成过程,不用“=”;②“ → ”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“ → ”右边是该物质的电子式;③用电子式表示离子化合物的形成过程时,可以在原子之间用箭头表示电子得失的关系,也可以不表示。
高考化学中常见的电子式大全

中学化学中常见的电子式大全原子 离子 单质分子 共价化合物 离子化合物 形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为OO H O ClH Cl OMg 2+ Cl 2Mg 2+NMg 2+NMg 2+3–3–+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高考化学中常见的电子式大全
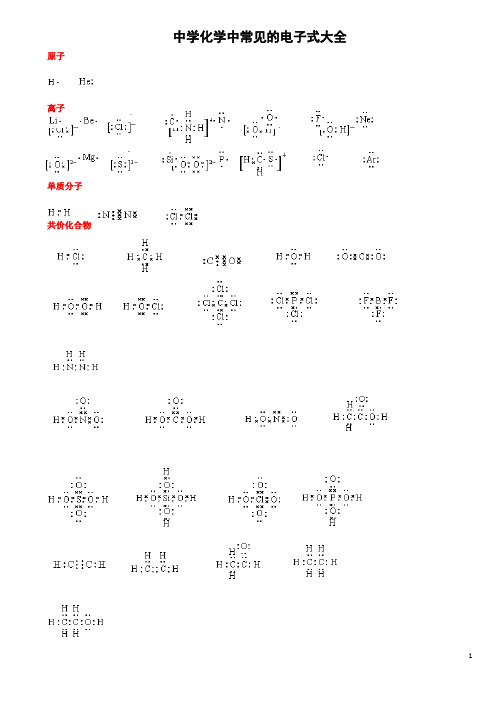
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔OO H Cl O Cl 2者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O带部分负电荷,因此的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 价,的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Mg2+[:O··:]2··
⑵ 用电子式表示硫化钾、MgBr2的形成过程
例:K S
2-
K KSK
Br Mg Br
Br Mg2 Br
注 意
写离子化合物电子式时,离子数目少的微粒写 在中间,离子数目多的微粒逐个写在左右,不 得合并。
课堂练习
1. 用电子式表示下列离子化合物的形成过程: (1)CaO (2)Na2O (3)CaCl2
用电子式化合物的形成过程:
·NO··a··×++××C·×··S×···++·O··×N··a →→NaO··+···[×××·C··S×××·····]O··2-·Na+
· · · · Cl Mg Cl
Cl Mg2 Cl
常见物质的电子式及结构式
:: : : :::
氮气的电子式、结构式
:N N: N ———N
原子结构的表示方法
原子结 构的表 示方法
核组成符号极其含义: ZAX
原子结构示意图:S2-
电子式:在元素符号的周围用小点点表 示原子最外层电子数的式子。
电子排布式
一、原子电子式书写方法 (书写单质分子和化合物电子式的基础)
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
·Li
·Be ·
· ·B ·
·C···
H :N :H H—N—H
H
H
甲烷的电子式、 结构式
: ——
:
H H :C:H
H
H H—C — H
H
甲醇的电子式、结构式
:: ::
__
H
H
H :C :O :H H_ C_ O _ H
H
H
三氯化磷的电子式、结构式
:: : ::
_
::
::
Cl
Cl
:Cl :P :Cl : Cl _ P _ Cl
四氯化碳的电子式 结构式
Na+ Mg2+ Al3+
[∶S··∶]2- [∶C··l∶]-
··
··
简单阳离子的电子式就是其离子符号;阴离子和 复杂阳离子电子式必须加上中括号并注明电荷数。
离子化合物和共价化合物的电子式不同点: (1)电荷:用电子式表示离子化合物的结构需标出阳
离子和阴离子的电荷;而表示共价化合物的结构不 能标电荷。 (2)[ ](方括号):离子化合物中简单阳离子(单 核)就是其离子符号;复杂阳离子(NH4+)需用方括 号括起来,并注明电荷;而共价化合物中不能用方 括号。
三、要求会的化合物的电子式
ⅠA NaH Na2O NaOH Na2O2 Na2S2 ⅡA MgO Mg(OH)2 MgS MgCl2 CaC2
ⅢA BF3 AlCl3
ⅣA CH4 SiH4
CCl4
CO2
CS2
ⅤA N2H3
PH3
PCl3
NH4+
ⅥA H2O ⅦA Cl2
H2S
NaCl
K2S
OH-
H2S
三氟化硼的结构式
F
B
F
F
:: ::
::
NaOH的电子式
Na+ :O :H -
氢氧化钡的电子式
:O:H - Ba2+:O:H -
:: ::
氮化钠的电子式
Na+
Na+ :N:3-Na+
过氧化钠的电子式
::
Na+ :O :O:2N- a+
氯化铵的电子式
H
+
-
H :N :H :Cl :
:: ::
H
:: ::
书写H2S、H2O2、CO2电子式:
A、HCl H Cl
B、N2
NN
C、NaCl Na[+ Cl ]-
D、NaOH Na[+ O H]—
E、Na2O2 Na[+ O O ]2N- a+
F、NH4Cl
[H
H N
]+
-
H [ Cl ]
H
[ 练习]⑴ 用电子式表示氧化镁的形成过程
·Mg ·+
·O·····→
NH3
H2O
HF
: :: ::
: :
H H:C :H
H
H:N.. :H H
H :O :H
H :F :
一般非金属原子最外层有几个单电子就和几个H原
子形成几个共用电子对。
四、用电子式表示化合物的形成过程
亲爱的同学们:你动手写写吧,高考需要你动手! NaCl: CaO: Na2S: MgCl2: HCl: H2O
CaCl2 HCl
H2O2
HClO
离子化合物和共价化合物的电子式书写有何不同?
离子化合物要求有方括号和电荷
共价化合物不能有方括号和电荷
比较C、N、O、F原子的电子式和CH4、NH3、 H2O、HF的电子式,能找到什么规律?
ⅥA
ⅤA
ⅥA
ⅦA
·C···
·· ·N··
·O·····
∶F··· ··
CH4
书写离子化合物的电子式
:: :: ::
:: ::
K2S: K+[ :S :]2-K+
CaO: Ca2+[ O ]2-
CaF2: [ F ]-Ca2+[ F ]-
NaCl: Na Cl
K2O2 :K+[ O:O ]2-K+
2-
Na2O : Na O Na
MgCl2: Cl Mg2 Cl
书写共价化合物电子式的方法:将成键原子的电子式组 合起来,使其达到8电子或2电子稳定结构。
O HH
104°30′(折线型)
O=C=O
180°(直线型)
H
CH HH
N H HH
1Hale Waihona Puke 9°28′(正四面体)107°18′(三角锥形)
·· ·N ·
·
·O·····
∶F··· ··
∶N····e∶
·Na
·Mg ·
· ·Al ·
· ·Si ·
·
·· ·P··
·· ·S ·
··
∶C····l·∶A····r∶
二、离子电子式书写方法
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA
ⅦA
Li+ Be2+
[∶N··∶·· ]3-
[∶O··∶]2··
[∶F··∶]··
次氯酸钠的电子式
Na+ :O :Cl :-
氢化钠的电子式
Na+ :H -
:: ::
氮化镁的电子式
Mg2+:N :3- Mg2+:N :3-Mg2+
::: :::
碳化钙(电石)的电子式
Ca2+ :C C:2-
乙炔的电子式、结构式
H:C C :H H—C ——— C—H
键角
在分子中键和键之间的夹角叫做键角
:: :: : :
::
__
:Cl :
Cl
:Cl :C :Cl :Cl_ C _ Cl
:Cl :
Cl
::: __
一氯甲烷的电子式、结构式
:Cl :
Cl
H :C :H H _ C _ H
H
H
次氯酸的电子式、结构式
:: ::
:::
H :O :Cl :
O
H Cl
氢氰酸的电子式、结构式
H :C N :
H— C ——— N
2.下列用电子式表示化合物的形成过程正确的是( A)
A K O K K [ O ]2 K B Cl Ba Cl [ Cl ] [ Ba ]2 [ Cl ]
C F Mg D H Cl
F Mg 2 [ F ]2 H [ Cl ]
2、用电子式表示共价键的形成过程
+
H×
2+
H× × H
• 指出下列物质含有什么化学键 KCl MgCl2 Cl2 HF CaO H2 O
氯气分子的电子式、结构式
:Cl :Cl : Cl__Cl
:: ::
::
水分子的电子式、结构式
H :O :H
二氧化碳的电子式
O HH
:
O ::C :O O ——C ——O
二硫化碳的电子式
:: ::
::
S ::C ::S S —— C ——S
硫化氢
H :S :H
S
HH
氨分子的电子式、结构式
:: —
