第十一章 S区元素
s区元素

用途概述
金属镁 金属镁
Mg
最轻的一种结构金属,也是用途最大的碱 土金属。世界镁耗量的70 % 用来制造合金, 广泛用于航空航天事业,也用于某些金属冶炼 还原剂。
化学性质
◆ 与氧、硫、氮、卤素反应,形成相应的化合物
单质在空气中燃烧,形成相应的氧化物: Li2O BeO Na2O2 MgO KO2 CaO RbO2 SrO CsO2 Ba2O2
2 Na(s) + CH3CH2OH(l) Na(s) + (x+y) NH3 (l)
2M(s) + 2NH 3 (l) ⎯ → ⎯ 2M
+
+ 2NH
− 2
+ H 2 (g)
碱金属单质的某些典型反应
M3P M3N (M = Li) O2
O2 + CO2
P N2
X2 S
MX (X = 卤素) M2S M2O (M = Li, Na) M2O2 (M = Na, K, Rb, Cs) MO2 (M = K, Rb, Cs) M2CO3
物理性质
S 区单质的熔点变化
Rb
Cs Na K
S 区单质的熔点变化
Li
Be
Mg
Ca
Sr
Ba
自然界中的丰度
*每 100 kg样品中金属克数的对数(以10为底)
自然界中的存在形式
锂辉石: LiAl(SiO 3 ) 2 钠长石: Na [AlSi 3 O 8 ] 钾长石: K [AlSi 3 O 8 ] 光卤石:
e 2- ) 2
如果液氨保持干燥和足够高的纯度(特别是没有过渡金属离子存在), 溶液就相当稳定。 钠溶于某些干燥的有机溶剂(如醚)也会产生溶剂合电子的颜色。 用钠回流干燥这些溶剂时,颜色的出现可看作溶剂处于干燥状态的标志
第十一章-S区元素ppt课件

图片
Be Mg Ca Sr
Ba
Chapter Eleven
5
单质的物理性质:
有金属光泽 密度小 硬度小 熔点低 导电、导热性好
Gc2-705-18.9 图片
s区单质的熔点变化
Chapter Eleven
6
Chapter Eleven
Chapter Eleven
11.2 单质的化学性质
一、与氧、硫、氮、卤素反应
钠长石: NaAlSi3O8
菱镁矿: MgCO3
钾长石: KAlSi3O8
石膏: CaSO4 2H 2O
光卤石:
KCl MgCl2 6H 2O
大理石: CaCO3 萤石 CaF2
明矾石:
天青石: SrSO4
K(AlO)3 (SO4 )2 3H 2O
锂辉石:LiAl(SiO3 )2
重晶石: BaSO4
25
2 锂与镁的相似性: ⑴ 单质与氧作用生成正常氧化物 ⑵ 氢氧化物均为中强碱,且水中溶解度不大 ⑶ 氟化物、碳酸盐、磷酸盐均难溶 ⑷ 氯化物均能溶于有机溶剂中 ⑸ 碳酸盐受热分解,产物为相应氧化物
Chapter Eleven
26
六、S区元素的存在
均以矿物形式存在:
绿柱石:Be3Al2 (SiO3 )6
小阳离子和小阴离子或者大阳离子和大阴离子形 成的化合物的溶解度小,
小阳离子与大阴离子或大阳离子与小阴离子形成 化合物溶解度大。
Chapter Eleven
23
四、含氧酸盐的热稳定性
1. 硝酸盐热稳定性差
2. 碳酸盐
BeCO3 MgCO3 CaCO3 SrCO3 BaCO3
T分 /℃ <100 540
第十一章s、ds、d区常见元素及其主

第11章 s、ds、d区常见元素及其主要化合物CHAP.11 s,ds,d BLOCK ELEMENTS AND THEIR MAIN COMPOUNDS11.1 s区常见元素及其主要化合物s BLOCK MAIN ELEMENTS THEIR MAIN COMPOUNDS11.1.1 s区元素的通性1. s区元素的特点:(1) 碱金属金属性最强,碱土金属次之.IA、IIA元素原子的价电子层构型分别为: ns1、ns2(2)常见氧化值为+1、+2;(3)所生成的化合物多数是离子型;只有Li、Be所形成的化合物具一定共价性.(4)锂与镁两元素性质相近;钙、锶、钡的性质也很接近(5)锂与同族元素相比具许多特殊性质.2. s区的单质:(1)物理性质:有金属光泽;密度小(密度 < 5 g·cm-3为轻金属);熔点低;硬度小;导电、导热性好;光电效应.(2)化学性质:与氧、硫、氮、卤素反应.如:单质在空气中燃烧,能形成相应的氧化物.与水作用: 2M + 2H2O → 2MOH + H2(g)碱金属与水的作用:11.1.2 s区元素的主要化合物1.氧化物:(1)三类氧化物:正常氧化物(O2-):过氧化物(O22-):超氧化物(O2-):(2)形成条件: 直接形成 间接形成正常氧化物 Li,Be,Mg,Ca,Sr,Ba s区所有元素过氧化物 Na,(Ba) 除Be外s区元素超氧化物 (Na),K,Rb,Cs 除Be,Mg,Li外s区元素(3)结构与稳定性:O2-: s22s22p6O22-: KK(s2s)2(s *2s)2(s2px)2(p2p)4(p*2p)4O2-: KK(s2s)2(s *2s)2(s2px)2(p2p)4(p*2p)3键级 键能/ kΦ ·mol-1O2-: 498O22-: 1 142O2-: 3/2 398稳定性: O2- > O2- > O22-(4)性质:与H2O的作用:M2ⅠO + H2O →2MOH(Li→Cs剧烈程度↑)(MⅡO + H2O →2M(OH)2(BeO除外)Na2O2 + 2H2O →2NaOH + H2O22KO2 + 2H2O →2KOH + H2O2 + O2与CO2的反应:Li2O + CO2 →LiCO32Na2O2 + 2CO2 →2Na2CO3 + O24KO2 + 2CO2 →2K2CO3 + 3O2熔点及硬度:较典型的是碱土金属氧化物.BeO MgO CaO SrO BaO熔点/℃ 2530 2852 2614 2430 1918硬度(金刚石=10) 9 5.5 4.5 3.5 3.3M-O核间距/pm 165 210 240 257 277另外要注意, Na2O2在熔融时几乎不分解,但遇棉花,木炭以及其它有机物或铝粉等还原性物质时易发生爆炸.2.氢氧化物:LiOH NaOH KOH RbOH CsOH中强 强 强 强 强Be(OH)2 Mg(OH)2 Ca(OH)2 Sr(OH)2 Ba(OH)2两性 中强 强 强 强(箭头指向) 溶解度增大, 碱性增强碱土金属溶解度(20℃):3.重要盐类及其性质:(1)熔、沸点:绝大多数是离子晶体,但碱土金属卤化物有一定的共价性;Li+、Be2+极化力强,所形成的盐共价性较强.BeCl2 MgCl2 CaCl2 SrCl2 BaCl2熔点 /℃ 405 714 7 876 962离子性增强(2)溶解度:碱金属盐类一般易溶于水;碱土金属盐类除卤化物、硝酸盐外多数溶解度较小.(3)热稳定性:除硝酸盐外,其余盐类均具有较好的稳定性.BeCO3 MgCO3 CaCO3 SrCO3 BaCO3T分 /℃ <100 540 900 1290 1360稳定性 M2CO3>MCO3BaSO4(重晶石) + Na2CO3 → BaCO3 + Na2SO4需注意Be盐以及可溶性Ba盐均有毒.4.锂 、铍的特殊性:例如锂与镁的相似性:单质与氧作用生成正常氧化物;氢氧化物均为中强碱,且水中溶解度不大;氟化物、碳酸盐、磷酸盐均难溶;氯化物均能溶于有机溶剂中;碳酸盐受热分解,产物为相应氧化物.对角线规则:周期系中,某元素及其化合物的性质与它左上方或右下方元素性质的相似性.Li Be B CNa Mg Al Si再如,Be(OH)2与Al(OH)3都是两性氢氧化物.同一周期最外层电子构型相同的金属离子, 左→右,Z+↑,极化作用↑;同族电荷相同的金属离子,上→下,离子半径↑,极化作用↓.11.2 ds区常见元素及其主要化合物ds BLOCK MAIN ELEMENTS AND THEIR MAIN COMPOUNDS11.2 ds区常见元素及其主要化合物具有强的极化力.所形成的二元化合物一般都部分或完全带有共价性.易形成配合物.11.2.1 Cu、Ag及其主要化合物1.铜、银单质的主要特点:溶、沸点较其它过渡金属低;导电性、导热性好,且Ag > Cu > Au;延展性好;化学活泼性较差.2Cu + O2 + H2O + CO2 → Cu2(OH)2CO3(绿)Au、Ag不与O2发生反应,当有沉淀剂或配合剂存在时会发生反应.如:4Ag + 2H2S + O2 → 2Ag2S(黑) + 2H2O再如:4M+O2+2H2O+8CN-→4[M(CN)2]-+4OH-式中M = Cu、Ag、Au.由于难溶物或配合物的生成, Cu、Ag以及Au单质的还原性增强,还能从稀酸溶液中置换出氢气.2Cu+2HCl+4CS(NH2)2→2[Cu(CS(NH2)2)2]+ +H2↑+2Cl-再如:2Ag + 2H+ + 4I-→ 2[AgI2]- + H2↑2. 铜、银主要化合物:铜、银较主要的化合物有氧化物及氢氧化物、卤化物、硝酸盐以及硫酸盐等.(1) 溶解性:氧化物都是难溶于水的共价型碱性化合物, CuO 略显两性;Cu(OH)2两性偏碱性:Cu(OH)2 + 2OH - → [Cu(OH)4]2-(亮蓝色)Cu +、Ag +为18电子构型,相应的盐大多也难溶于水如: CuCl CuBr CuI CuSCN CuCN Cu 2S再如卤化银溶解度: AgCl > AgBr > AgI(2)热稳定性:一般来说,固态时Cu(Ⅰ)的化合物比Cu(Ⅱ)化合物来得稳定.氧化物分解温度: Cu 2O > CuO.银的化合物更不稳定: Cu 2O > Ag 2O2Ag 2O → 4Ag + O 22AgNO 3 → 2Ag + 2NO 2 + O 2此外,许多Ag(Ⅰ)化合物对光敏感:AgX → Ag + 1/2X 2(3)其它较典型的性质:无水CuSO 4具强吸水性,可利用其颜色的转变检验或除去有机液体中微量的水.另外,当有氧存在时,适当加热Cu 2O 能生成CuO,利用这性质可除去氮气中的微量氧:2Cu 2O(暗红色) + O 2→4CuO(黑色)Ag +还有一个典型反应:2Ag + + S 2O 32- → Ag 2S 2O 3↓Ag 2S 2O 3 + H 2O → Ag 2S ↓+ H 2SO 4注意:Ag + + 2S 2O 32-(过量)→ [Ag(S 2O 3)2]3-3.Cu(Ⅰ)与Cu(Ⅱ)的相互转化:Cu +外层价电子构型为3d 10,故高温、固态时Cu(Ⅰ)化合物稳定性高于Cu(Ⅱ)化合物的稳定性. 在水溶液中, 稳定性Cu(Ⅰ) < Cu(Ⅱ)φ θ A/V Cu 2+ +0.159 Cu + +0.52 Cu显然,Cu +易歧化,不稳定.2Cu + =Cu 2+ + Cu, K θ=106.12如:Cu 2O + H 2SO 4 → CuSO 4 + Cu↓+ H 2O若要使Cu(Ⅱ) 转变为Cu(Ⅰ),必须要有还原剂存在,同时要降低Cu(Ⅰ)浓度.如:2Cu 2+ + 4I - → 2CuI↓ + I 2当形成沉淀或配离子时,电对发生了变化,其电极电势同时也发生了改变.再如:Cu 2O + 2HCl → 2CuCl↓ + H 2O4.铜族元素的配合物:有关电对的电极电势:Cu 2+ 0.859V CuI - 0.185V CuCu 2+ 0.438V CuCl 2- 0.241V CuCu 2+ 0.509V CuCl 0.171V CuCu(NH 3)42+ 0.013V Cu(NH 3)2+ -0.128V Cu很明显,有沉淀剂或配位剂存在时Cu(I)稳定性提高(1)Cu(I) 配合物:Cu(I)的配合物多为2配位.如:CuCl2-,CuBr2-,CuI2-,Cu(SCN)2-,Cu(CN)2-2[Cu(OH)4]2- + C6H12O6→ Cu2O↓(暗红色) + C6H12O7 + 2H2O + 4OH-Cu2+ + 2P2O74-(过量)→ [Cu(P2O7)2]6-(蓝色)(3)Ag配合物:Ag的配合物多为2配位.2Ag+ + 2NH3 + H2O→Ag2O↓ + 2NH4+Ag2O + 4NH3 + H2O → 2[Ag(NH3)2]+ + 2OH-银镜反应: [Ag(NH3)2]+能将醛或某些糖类氧化,自身还原为Ag.2[Ag(NH3)2]+ + HCHO + 3OH- → HCOO- + 2Ag↓+ 4NH3 + 2H2O11.2.2Zn、Cd、Hg及其主要化合物1.锌族单质的主要特点:低熔点;汞是室温下唯一的液态金属.易形成合金;如黄铜(Cu-Zn);汞齐(Ag-Hg,Na-Hg等)等.锌和镉化学性质相似,汞的化学活泼性要差得多;4Zn + O2 + CO2 + 3H2O→ ZnCO3 .3Zn(OH)2另外,锌与稀酸的反应难易与锌的纯度有关,越纯越难溶.2.锌族元素的主要化合物:(1)氧化物及氢氧化物:ZnO和Zn(OH)2都是两性物质;Cd(OH)2显两性偏碱性.氢氧化物稳定性变化有以下规律:Zn(OH)2 > Cd(OH)2 > Hg(OH)2 > Hg2(OH)2Hg(OH)2和Hg2(OH)2均极不稳定,特别是后者.Hg2+ + 2OH- →HgO↓ (黄) + H2O(2)卤化物等盐类:许多难溶于水的亚汞盐见光或受热易歧化为Hg(Ⅱ)化合物和单质汞(Hg2Cl2除外).如:Hg22+ + 2I-→ Hg2I2 ↓(草绿色)Hg2I2→HgI2↓(金红色) + Hg↓(黑色).HgI2 + 2I-→ [HgI4]2-[HgI4]2-称为奈斯勒(Nessler)试剂, 碱性条件下与 NH4+ 生成红棕色沉淀,用于鉴定NH4+. Hg2Cl2又称“甘汞”,无毒,见光易分解,是一种直线型共价分子.Hg2Cl2与氨水生成白色HgNH2Cl和黑色的Hg:HgCl2易升华,俗称“升汞”,略溶于水,剧毒,其稀溶液能杀菌.HgCl2分子中Hg以sp杂化形式与Cl结合,也是一种直线型共价分子HgCl2与稀氨水作用生成氨基氯化汞:HgCl2 + 2NH3 →NH2HgCl↓(白色) + NH4Cl若氨水过量:HgCl2 + 4NH3 →[Hg(NH3)4]Cl2 + 2Cl-另外可利用HgCl2在酸性溶液中具氧化性来鉴定Hg2+. 2HgCl2 + SnCl2 →Hg2Cl2↓(白色) + SnCl4Hg2Cl2 + SnCl2 →2Hg↓(黑色) + SnCl4ZnCl2具强吸水性,在水中水解形成配合酸.ZnCl2 + H2O →H[ZnCl2(OH)]水解产物能溶解某些金属氧化物:6H[ZnCl2(OH)] + Fe2O3 →2Fe[ZnCl2(OH)]3 + 3H2O (3)硫化物:ZnS可用于制作白色颜料以及荧光屏等.可利用CdS的黄色来鉴定镉.HgS的溶解度极小,只有在王水中才能溶解.3. Hg(Ⅰ)与Hg(Ⅱ)的相互转化:φ θ A/V Hg2+ +0. 92 Hg+ +0.793 Hg 显然,Hg2+能氧化Hg生成Hg22+:Hg2+ + Hg →Hg22+ K θ= 142如:Hg(NO3)2 + Hg →Hg2(NO3)2若要使Hg22+转化为Hg2+,就必须降低Hg2+的浓度.Hg22+ + S2- →HgS↓+ Hg↓可见,Hg(I)在游离时不歧化,当形成沉淀(除Hg2Cl2)、或配合物时会发生歧化.φθ A/V HgS -0.758V Hg2S -0.598V Hg4.锌族元素配合物:一般形成配位数为4的配合物.如:Zn2+ + 4OH-(过量)→[Zn(OH)4]2-CdS + 2H+ + 4Cl-→[CdCl4]2- + H2S↑HgS + S2-→[HgS2]2-另外,在溶液中Hg2+与Cl-存在如下平衡:Cl- Cl- Cl- Cl-Hg2+ [HgCl]+ [HgCl2] [HgCl3]- [HgCl4]2-再如:3HgS + 12Cl- + 8H+ + 2NO3-→ 3[HgCl4]2-+ 3S↓+ 2NO↑+ 4H2O11.3 d区常见元素及其主要化合物d BLOCK MAIN ELEMENTS AND THEIR MAIN COMPOUNDSd区元素在过渡元素中占据很大的一部分.过渡元素包括ⅢB~Ⅷ族以及ⅠB、ⅡB族.一般分四个系列:第一过渡系:21Sc ~30Zn第二过渡系:39 Θ ~48Cd第三过渡系:57La ~80Hg(不包括镧系元素)第四过渡系:89Ac ~109Une(不包括锕系元素)11.3.1 d区元素通性1.有关原子参数:原子半径:第一电离能:价电子层构型:(n-1)d1-10ns1-2只有Pd较为特殊,4d105s02.氧化值:最显著的特征就是大多数元素具有多种氧化值.例如铬的氧化值可以从-2连续变化到+6.3.主要物理性质:第一过渡系的多种氧化值变化:第一过渡系总变化趋势:从左到右由高氧化值稳定变为低氧化值稳定.第二、三过渡系一般最高氧化值相当稳定,低氧化值较少见.d区同族元素从上到下氧化值的可变性减小,高氧化值趋于稳定.(1)熔点、沸点高;熔点最高的单质:钨(W,3410±20℃)(2)硬度大;硬度最大的金属:铬(Cr),硬度仅次于金刚石.(3)密度大;密度最大的单质:锇(Os,22.48g·cm-3)(4)导电性、导热性、延展性好.4.主要化学性质:(1)金属活泼性:钪钇镧是过渡元素中最活泼的金属,活泼性接近碱土金属.(2)氧化物水合物的酸碱性:(3)易形成配合物:具有未填满电子的d轨道,且离子半径较小,d电子对核的屏蔽作用也较小 铁、钴、镍等元素原子也能形成配合物.许多d区元素水合离子具有特征的颜色过渡元素金属活泼性:总趋势:从左至右活泼性降低.φθ(Ni2+/Ni) = -0.25Vφθ(Pd2+/Pd) = +0.92Vφθ(Pt2+/Pt) = +1.2V(估计值)φθ(Zn2+/Zn) = -0.763Vφθ(Cd2+/Cd) = -0.403Vφθ(Hg2+/Hg) = +0.854V总趋势:从上到下活泼性降低.氧化物水合物的酸碱性:第一过渡系低氧化值的氧化物水合物一般显碱性,但从左到右碱性随离子半径递减; 高氧化值氧化物水合物酸碱性变化规律为:几种水合离子颜色:例如,铁的三价水合离子是淡紫色的.由于水解形成: [Fe(OH)2(H2O)4]+而呈现黄色 概括起来,过渡元素具有以下几个主要特点:金属活泼性较强;同一元素具有多种氧化值;许多元素的水合离子或酸根具有特征的颜色;易形成多种配合物.铬是金属中最硬的,具较强的抗腐蚀性.1.Cr(Ⅲ)化合物:Cr(Ⅲ)化合物较典型的有Cr 2O 3(铬绿)以及Cr(OH)3.(1)酸碱性与溶解性:均为难溶解的两性化合物.Cr(OH)3的两性:Cr 3+以及其它盐溶液的颜色:Cr 2O 3与a -Al 2O 3同晶型,也极难溶(熔)解.使用酸性熔剂,如K 2S 2O 7共熔可转化为可溶性盐:Cr 2O 3 + 3K 2S 2O 7 = Cr 2(SO 4)3 + 3K 2SO 4(2)还原性:φ θ B/V CrO 42- -0. 12 Cr(OH)3 -1.1 Cr(OH)2 -1.4 Cr在碱性介质中Cr 3+具有较强的还原性.2[Cr(OH)4]- + 3H 2O 2 + 2OH -→2CrO 42- + 8H 2O另外,Cr 3+以及[Cr(OH)4]-在水中均易水解2.Cr(Ⅵ)化合物:Cr(Ⅵ)化合物较典型的有H 2CrO 4、H 2Cr 2O 7及其盐.(1)酸性与缩合性:铬酸、重铬酸都是强酸.HCr 2O 7- =Cr 2O 72- + H + K θa2 = 0.85H 2CrO 4 = HCrO 4- + H + K θa1 = 9.55HCrO 4- = CrO 42- + H + K θa2 = 3.2×10-7H 2CrO 4与H 2Cr 2O 7在水中存在以下平衡2CrO 42- + 2H + =2HCrO 4-= Cr 2O 72- + H 2O(黄) pH>6 (橙) pH<22Na 2CrO 4 +H 2SO 4→Na 2Cr 2O 7 + H 2O + Na 2SO 4 Na 2Cr 2O 7 + 2NaOH → 2Na 2CrO 4 + H 2O(2)溶解性:重铬酸盐除Ag 2Cr 2O 7外(K θsp =2.0×10-7)一般较易溶于水.4Ag + + Cr 2O 72- + H 2O = 2Ag 2CrO 4 + 2H +PbCrO 4 Ag 2CrO 4 BaCrO 4(铬黄) (砖红) (柠檬黄)难溶铬酸盐:(3)氧化性:φθ A/V Cr 2O 72- +1. 33 Cr 3+ -0.41 Cr 2+ -0.557 CrCr(Ⅵ)化合物在酸性条件下具较强的氧化性.Cr 2O 72- + 3H 2S + 8H +→2Cr 3+ + 3S↓ + 7H 2OCr 2O 72- + 6Cl - + 14H +→2Cr 3+ + 3Cl 2↑+ 7H 2O2Cr 2O 72- + 2C 2H 5OH + 16H +→ 4Cr 3+ + 3CH 3COOH + 11H 2O铬酸洗液是由饱和K 2Cr 2O 7溶液与浓H 2SO 4配制而成,当洗液发绿时说明该洗液失效.K 2Cr 2O 7 + H 2SO 4(浓)→ K 2SO 4 + 2CrO 3(暗红色针状结晶) + H 2O在酸性介质中要将Cr 3+氧化只有采用强氧化剂,如K 2S 2O 8:2Cr 3++3S 2O 82-+7H 2O→Cr 2O 72-+6SO 42-+14H +氧化值为+3和+6的Cr 在酸碱性介质中的相互转化关系为:有一个典型的反应可以用来鉴定CrO 42-或Cr 2O 72-的存在,也可以用来 鉴定Cr 3+ .Cr2O 72- + 4H 2O 2 + 2H + = 2CrO(O 2)2 + 5H 2O过氧化铬的结构为:过氧化铬很不稳定,在乙醚或戊醇中较稳定:Cr(Ⅲ)、Cr(Ⅵ)化合物均有毒, 且后者毒性更大.Cr3+的鉴定也可以有不同的方法,但是它们都是在过量OH-的条件下用H2O2将Cr3+氧化为CrO42-,然后加入不同的试剂:11.3.3锰的主要化合物酸性介质中的元素电势图(V):1.锰(Ⅳ) 的化合物:锰(Ⅳ) 的化合物最有代表性的当属MnO2.2MnO2 + 2H2SO4→2MnSO4 + 2H2O + O2↑MnO2 + 4HCl → MnCl2 + 2H2O + Cl2↑MnO2在碱性条件下也能被氧化.2MnO2 + 4KOH + O2 → 2K2MnO4 + H2O其它性质还有热稳定性:3MnO2 → Mn2O3 + O2↑MnO2的还原性:2.锰(Ⅱ) 的化合物:锰(Ⅱ) 的化合物较有意义的是锰(Ⅱ)盐,例如MnSO4,可作为动植物生长激素的成分.无水MnSO4具有一定的热稳定性,加热至红热也不分解,与其它几种锰(Ⅱ)盐不同.Mn2+在碱性条件下具有较强的还原性.Mn2+ + OH- → Mn(OH)2 (白)Mn(OH)2 + 1/2O2 → MnO(OH)2(棕)MnO(OH)2 + (x-1)H2O→ MnO2·xH2O(黑褐)Mn2+的还原性:Mn2+在酸性条件下较为稳定,只有用很强的氧化剂(PbO2、BiO3-、S2O82-或H2IO6等,以硝酸酸化)才能将其氧化.2Mn2++5BiO3-+14H+ → 2MnO4-+5Bi3++7H2O此反应能用于鉴定Mn2+3.锰(Ⅵ) 的化合物:锰(Ⅵ) 的化合物中较为稳定的是K2MnO4.锰酸盐在中性或酸性溶液中易发生歧化反应.3 MnO42- + 4H+ → MnO2 + 2MnO4- + 2H2O4.锰(Ⅶ) 的化合物:锰(Ⅶ) 的化合物中应用最广的为KMnO4.高锰酸钾在酸性条件下不稳定.4 MnO4- + 4H+ → 4MnO2 + 3O2 + 2H2O在中性或碱性介质中也会分解.KMnO4氧化能力强,不仅能与许多还原性物质作用,与自身较低氧化值的物质也能反应.2MnO4- + 3Mn2+ + 2H2O → 5MnO2 + 4H+KMnO 4被还原的产物取决于溶液的酸碱性以及与反应时自身的量有关KMnO 4氧化性:介质:酸性: 2MnO 4- + 5H 2S + 6H + → 2Mn 2+ + 5S↓+ 8H 2O6MnO 4- + 5S + 8H + →6Mn 2+ + 5SO 42- + 4H 2O中性: 2MnO 4- + 3SO 32- + H 2O → 2MnO 2↓+ 3SO 42- + 2OH -较浓碱溶液: 2MnO 4- + SO 32- + 2OH - → 2MnO 42- + SO 42- + H 2O相对量例如 MnO 4-酸性介质中与 SO 32-反应:SO 32-过量: 2MnO 4- +5SO 32- +6H + →2Mn 2++5SO 42- +3H 2OMnO 4-过量:最终将得到MnO 211.3.4 铁、钴、镍的主要化合物铁、钴、镍都是中等活泼的金属,且性质相似,一般称为铁系元素.相对来说铁略显活泼些,如它能被浓碱所侵蚀,而钴镍在碱性溶液中较为稳定.1.氧化物与氢氧化物:(1)酸碱性:氧化物中,Fe 2O 3(红棕色)是一种难溶于水的两性偏碱性的物质.氢氧化物中,一般认为Fe(OH)2、Co(OH)2以及新沉淀出来的Fe(OH)3略显两性Fe(OH)3 + 3OH -→[Fe(OH)6]3-(2)氧化还原性:氧化物氧化性:Ni 2O 3(灰黑色) > Co 2O 3(暗褐色) > Fe 2O 3Co 2O 3 + 6H ++ 2Cl -→2Co 2+ + Cl 2↑+ 3H 2O Ni 2O 3 + 6H + + 2Cl -→2Ni 2+ + Cl 2↑+ 3H 2O氢氧化物氧化性:Fe(OH)3(红棕) < Co(OH)3(褐棕) < Ni(OH)3(黑)2Co(OH)3 + 6HCl→2CoCl 2 + Cl 2↑+ 6H 2OFe(OH)3 + 3HCl→FeCl 3 + 3H 2O氢氧化物还原性:Fe(OH)2(白) > Co(OH)2(粉红) > Ni(OH)2(苹果绿)4Fe(OH)2 + O 2 + 2H 2O→ 4Fe(OH)3Co(OH)2初生时为蓝色,放置或加热时转变为粉红色.它被空气中O 2氧化的趋势小些.Ni(OH)2只有用强氧化剂,在强碱性条件下才能得到黑色的NiO(OH).2.一些主要的盐类:(1)水解性: Fe 3+较易水解.[Fe(H 2O)6]2+ (淡绿) =[Fe(OH)(H 2O)5]+ + H +, K θ = 10-9.5[Fe(H 2O)6]3+ (淡紫) =[Fe(OH)(H 2O)5]2+ + H +, K θ = 10-3.05Fe 3+还能发生进一步的水解,形成[Fe(OH)2(H 2O)4]+在较浓的溶液中(1mol·L -1)则形成双聚离子:[(H 2O)4Fe(OH)2Fe(H 2O)4]4+.最后水解产物为Fe(OH)3.(2)氧化还原性:还原性Fe 2+ > Co 2+ > Ni 2+氧化性Fe 3+ < Co 3+ < Ni 3+(3)较为典型的盐:FeSO 4与(NH 4)2SO 4·FeSO 4·6H 2O:FeSO4还原性较强,不太稳定.4Fe2+ + O2 + 4H+→4Fe3+ + 2H2O5Fe2+ + MnO4- + 8H+→5Fe3+ + Mn2+ + 4H2O摩尔盐相对稳定得多CoCl2:CoCl2所含结晶水不同时会呈现不同的颜色.CoCl2·6H2O CoCl2·2H2O CoCl2·H2O CoCl2(粉红) (紫红) (蓝紫) (蓝)FeCl3:FeCl3是一种棕褐色的共价化合物,会升华, 400℃时能以蒸汽状态的双聚分子存在. FeCl3还是一种中等强度氧化剂.2Fe3+ + Cu → 2Fe2+ + Cu2+, K θ= 1014.7可作刻蚀剂.CoCl2的颜色与结晶水:2Fe3+ + Sn2+→ Fe2+ + Sn4+2Fe3+ + H2S → 2Fe2+ + S + 2H+3.配合物:Fe3+、Fe2+易形成配位数6的八面体型配合物;Co2+大多数配合物具有八面体或四面体型,且可以相互转化.[Co(H2O)6]2+ + 4Cl- = [CoCl4]2- + 6H2O(粉红) (蓝)c(HCl): (3mol·L-1) (8mol·L-1)Ni2+可形成各种构型的配合物.(1)与卤素形成的配合物:Fe3+、Co3+与F-能形成稳定的配离子.[FeF6]3-、[CoF6]3-都属外轨型配合物,相对来说前者更稳定些.(2)与氨形成的配离子: Fe2+、Co2+、Ni2+与NH3所形成的配合物稳定性顺序: Fe2+ <Co2+ <Ni2+. [Co(NH3)6]2+易被氧化为[Co(NH3)6]3+.Co2+: 3d74s0,与NH3形成配合物时采取d2sp3杂化(3)与CN-形成的配合物:Fe3+、Fe2+、Co2+、Ni2+都能与CN-形成内轨型的配离子,都很稳定.黄血盐K4[Fe(CN)6]·3H2O(黄), 是由Fe2+与过量的KCN溶液作用所得到.赤血盐K3[Fe(CN)6](深红)是由氯气氧化黄血盐得到这两种配合物有以下灵敏反应可分别用于鉴定Fe3+和Fe2+ :4 Fe3+ + 3[Fe(CN)6]4-→Fe4[Fe(CN)6]3(普鲁士蓝)3 Fe2+ + 2[Fe(CN)6]3-→Fe3[Fe(CN)6]2(滕氏蓝)(4)与SCN-形成的配离子:血红色[Fe(NCS)n]3-n以及蓝色的[Co(NCS)4]2-,可用来鉴定Fe3+以及Co2+:乙醚Co2+ + 4SCN-(过量) → [Co(NCS)4]2-或戊醇11.2常见金属离子的分离与鉴定SEPARATION AND EVALUATION OF MAIN METAL IONS常见金属离子:Ag+、Pb2+、Hg22+、Cu2+、Cd2+、Bi3+ Hg2+、As(Ⅲ,Ⅴ)、Sb(Ⅲ,Ⅴ)、Sn(Ⅱ,Ⅳ)Al3+、Cr3+、Fe3+、Fe2+、Mn2+、Ni2+、Co2+、Zn2+Ca2+、Sr2+、Ba2+、K+、Na+、NH4+、Mg2+ 11.4.1无机定性分析概述1.对鉴定反应的要求以及进行的条件:(1)要求:鉴定反应需有明显外观特征.溶液颜色改变;沉淀生成或溶解;气体产生.(2)条件:溶液酸度:离子浓度: 要满足析出足够的沉淀量.温度:温度升高,浓度增加;温度升高,加快反应速率;温度升高,某些产物分解.催化剂:Ag+2Mn2+ + 5S2O82- + H2O → 2MnO4- + 10SO42- + 16H+溶剂:Cr2O72- + 4H2O2 + 2H+(介质)→2H2CrO6 + 3H2O以戊醇萃取. (蓝色)2.鉴定反应的灵敏度与选择性:(1)灵敏度:检出限量(m):在一定条件下,利用某反应能检出某离子的最小重量( m g ).最低浓度(x):在一定条件下,被检出离子能得到肯定结果的最低浓度(m g / ml)(2)选择性:专属反应: NH4+ + OH-→NH3↑ + H2O选择性反应:(3)提高选择性的途径:控制pH:加入掩蔽剂:3.分别分析和系统分析:(1)分别分析:其它离子共存时,不经分离直接检出某种离子的方法.(2)系统分析: 按一定程序,将离子加以分组分离,然后进行鉴定.组试剂: 应满足:分离完全;反应迅速;沉淀与溶液易分开; 一个组内离子种类不宜太多.4.空白试验和对照试验:(1)空白试验:用蒸馏水代替待检试液所进行的鉴定试验.Fe3+ + NH4SCN→ [Fe(NCS)6]3-血红检查试剂、蒸馏水是否含被鉴定的离子.(2)对照试验: 用已知待检离子的溶液代替未知试液所进行的鉴定试验.2Hg2+ + SnCl2 → Hg2Cl2↓白+ SnCl4Hg2Cl2 + SnCl2 →Hg↓黑+ SnCl4检查试剂是否失效,反应条件是否控制正确11.4.2常见金属离子的系统分析法1.H2S系统分析法:Ag+、Pb2+、Hg22+、Cu2+、Cd2+、Bi3+ Hg2+、As(Ⅲ,Ⅴ)、Sb(Ⅲ,Ⅴ)、Sn(Ⅱ,Ⅳ)Al3+、Cr3+、Fe3+、Fe2+、Mn2+、Ni2+、Co2+、Zn2+Ca2+、Sr2+、Ba2+、K+、Na+、NH4+、Mg2+ 分别检出NH4+、Fe3+、Fe2+2.硫化氢的代用品:硫代乙酰胺:CH3CSNH2 + 2H2O = NH4+ + CH3COO- + H2SCH3CSNH2 + 2OH- = NH3 + CH3COO- + HS-3.两酸两碱系统以及其它方法:以盐酸、硫酸、氨水以及氢氧化钠等为组试剂进行分离鉴定的方法称为两酸两碱系统分析法. 当然,也可以打破以上两种分离鉴定系统,综合利用各类物质的性质不同进行分离鉴定例题:不用硫化氢或其它硫化物试剂, 分离下列离子.Pb2+、Co2+、Bi3+、Ba2+当然,以上并不是最佳分离方案,可有多种方法.。
第11章 s区元素和稀有元素 习题解答

第11章习题解答第11章(03525)重水是由H和18O组成的水。
.()解:错第11章(03526)氢在自然界中主要以单质形式存在。
()解:错第11章(03527)由于H2是双原子分子,所以H2比He的扩散速率小。
.()解:错第11章(03528)氢气是最轻的单质,所以它的熔点和沸点在所有单质中最低。
.()解:错第11章(03529)因为氢分子的极化率大于氦分子的极化率,所以氢的熔点比氦高。
.()解:对第11章(03530)常温下H2的化学性质不很活泼,其原因之一是H-H键键能较大。
()解:对第11章(03531)实验室所用氢气钢瓶应放在室外,这是因为氢气.()。
(A)密度小;(B)扩散快;(C)易燃易爆;(D)导热性好。
解:C第11章(03532)水煤气的主要成分是.()。
(A)CO和N2;(B)CO和O2;(C)CO和H2;(D)CO2和H2O。
解:C第11章(03533)下列氢气制法中,工业上不常采用的是.()。
(A)电解法;(B)水煤气法;(C)甲烷转化法;(D)活泼金属与酸反应。
解:D第11章(03534)下列反应方程式中,不适用于工业制氢的是()。
(A)H2O(电解)→H2+O2;(B)Zn+H2SO4→ZnSO4+H2;(C)C+H2O(g)∆−CO+H2;−→(D)CH4+H2O(g)∆,Ni,Co−−−−CO+H2。
−→解:B第11章(03539)在某些工厂用氢气做冷却剂,这是因为氢气.()。
(A)密度小;(B)扩散快;(C)易燃易爆;(D)导热性好。
解:D第11章(03535)下列氢气制法中,工业上不常采用的是.()。
(A)电解法;(B)水煤气法;(C)甲烷转化法;(D)碱金属氢化物与水反应。
解:D第11章(03536)下列分子或离子不能存在的是.()。
(A)H2;(B)H2+;(C)H22+;(D)H-。
解:C第11章(03537)下列原子、离子和分子中属于反磁性的是.()。
第11章 重要的生命元素

• 氧化镁俗称苦土,是一种碱性白色粉末,难溶于 水,但可与水反应生成Mg(OH)2。氧化镁熔点约 为2850℃,可作耐火材料、润滑剂以及抑酸剂等 使用。
• 氧化钙俗称生石灰,是一种白色块状或粉末状碱 性放固出体 大。 量它 的微 热溶。于氧水化,钙可熔与点水为作26用15生℃成,C具a有(O强H)吸2, 湿性,可作耐火材料和干燥剂。
2. 钠和钾
(1)金属钠和钾 与水反应可释放出大量热 ;
(2) 氢氧化钠(钾) LiOH为中强碱外,其余均为强碱 ; 碱金属氢氧化物中以NaOH最重要。氢氧化钠又称
烧碱,它是实验室常用的重要试剂,也是重要的工 业原料。它能除去空气中的酸性物质如二氧化碳、 二氧化硫、二氧化氮、硫化氢等,NaOH易于融化, 能溶解某些金属氧化物和非金属氧化物,因此常用 于溶解矿物试样。
Fe Ca Mg K Ti
质量分数/% 1.50 1.48 1.39 1.08 0.22
11.1.2 元素的分类
1.金属和非金属元素
按长式周期表中硼—硅—砷—碲—砹和铝—锗— 锑—钋之间的对角线来区分。 位于对角线左下方的都是金属元素; 右上方的都是非金属元素。 对角线附近的锗、砷、锑、碲称为准金属元素。
11.1 元素概述
11.1.1 元素的分布
地球上天然存在的元素主要存在于岩石圈、水圈和 大气圈。
元素在地壳中的含量称为丰度,常用质量 分数表示。
11-1地球上分布最广的10种元素的质量分数
元素符号
O H Si Al Na
质量分数/% 52.32 16.95 1 6.67 5.53 1.95
元素符号
稀有元素也可继续分为:轻稀有金属、高熔点 稀有金属、分散稀有元素、稀有气体、稀土金属、 放射性稀有元素等。
s区、d区、ds区重要元素及其化合物
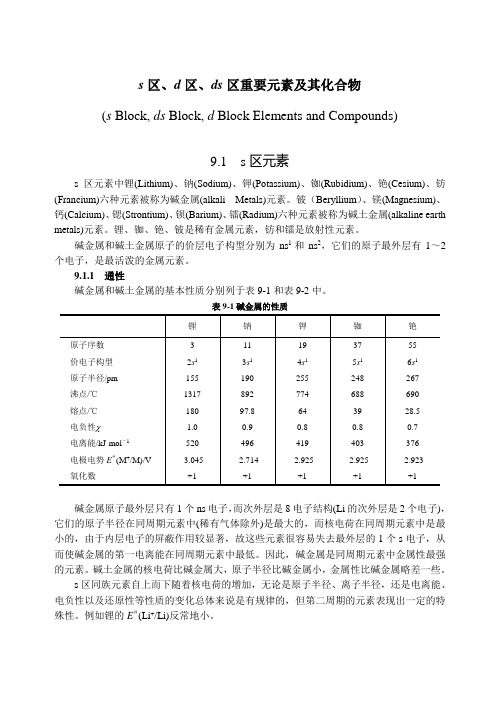
s区、d区、ds区重要元素及其化合物(s Block, ds Block, d Block Elements and Compounds)9.1 s区元素s区元素中锂(Lithium)、钠(Sodium)、钾(Potassium)、铷(Rubidium)、铯(Cesium)、钫(Francium)六种元素被称为碱金属(alkali Metals)元素。
铍(Beryllium)、镁(Magnesium)、钙(Calcium)、锶(Strontium)、钡(Barium)、镭(Radium)六种元素被称为碱土金属(alkaline earth metals)元素。
锂、铷、铯、铍是稀有金属元素,钫和镭是放射性元素。
碱金属和碱土金属原子的价层电子构型分别为ns1和ns2,它们的原子最外层有1~2个电子,是最活泼的金属元素。
9.1.1 通性碱金属和碱土金属的基本性质分别列于表9-1和表9-2中。
表9-1碱金属的性质碱金属原子最外层只有1个ns电子,而次外层是8电子结构(Li的次外层是2个电子),它们的原子半径在同周期元素中(稀有气体除外)是最大的,而核电荷在同周期元素中是最小的,由于内层电子的屏蔽作用较显著,故这些元素很容易失去最外层的1个s电子,从而使碱金属的第一电离能在同周期元素中最低。
因此,碱金属是同周期元素中金属性最强的元素。
碱土金属的核电荷比碱金属大,原子半径比碱金属小,金属性比碱金属略差一些。
s区同族元素自上而下随着核电荷的增加,无论是原子半径、离子半径,还是电离能、电负性以及还原性等性质的变化总体来说是有规律的,但第二周期的元素表现出一定的特殊性。
例如锂的EΘ(Li+/Li)反常地小。
表9-2碱土金属的性质s区元素的一个重要特点是各族元素通常只有一种稳定的氧化态。
碱金属的第一电离能较小,很容易失去一个电子,故氧化数为+1。
碱土金属的第一、第二电离能较小,容易失去2个电子,因此氧化数为+2。
在物理性质方面,s区元素单质的主要特点是:轻、软、低熔点。
s 区 元 素
s 区元素
一、 s区金属
1. s区元素的通性
s区金属又称为成碱金属,包括第Ⅰ A族的碱金属元素Li、Na、K、 Rb、Cs、Fr和第Ⅱ A族的碱土金属元素Be、Mg、Ca、Sr、Ba和Ra。 它们以卤化物、硫酸盐、碳酸盐和硅酸盐存在于地壳中。Rb、Cs在自 然界存在较少,是稀有金属;Fr和Ra是放射性金属,Fr放射性极强,半 衰期极短,在天然放射性衰变和核反应中可形成微量的Fr,而Ra首先被 玛丽·居里(Marie Curie)从沥青油矿中分离出来,其所有的同位素都具 有放射性且寿命最长,如226Ra的半衰期为1602年。
s区元素
成碱金属能与水迅速反应放出氢气,所以不能在水溶 液中用于还原任何物质,但可成为非水介质中有机化学反 应的重要还原剂。同时也是高温条件下从氧化物或氯化物 中制备稀有金属的重要还原剂。当然,这些反应必须在真 空或稀有气体保护下进行。
对比锂和镁的性质,不难发现在它们之间有许多相似 之处,如它们都能与氧或者氮直接化合生成氧化物、氮化 物,它们的氢氧化物、碳酸盐、磷酸盐等都难溶于水。
s 区元素
成碱金属的基本性质列入表8-2中。成碱金属在物理 性质方面表现出金属的外观和良好的导电性,但硬度、熔 点和沸点与其他金属相比很低。这是因为成碱金属成键电 子数少,金属键弱,反映在宏观性质上表现出低熔点、低 沸点和低硬度的特点。第Ⅰ A和第Ⅱ A族元素的电子构型 分别为ns1和ns2,它们能失去1个或2个电子形成氧化数为 +1或+2的离子型化合物。同族中它们的有效核电荷相等, 但自上而下,原子(离子)半径依次增大,电离能、电负 性逐渐降低,金属活泼性增强。
碱金属氢化物中以LiH最稳定,加热到熔点也不分解。其他碱金 属氢化物的稳定性较差。LiH能与AlCl3在无水乙醚中反应生成LiAIH4 (氢配合物):
s区元素及其重要化合物
(2)形成共价键:
a.形成非极性共价键 :如H2单质,表现0氧化态. b.形成极性共价键: 与非金属的元素的原子化 合:HCl,HBr,H2O等,表现“+1”氧化态.
(3)独特的键型 a.氢原子可以填充到许多过渡金属晶格的空隙中,
形成一类非整比化合物,一般称之为金属氢化物。 例:ZrH1.75和LaH2.78
(2)化学性质: H—H,74pm ,D=436KJ/mol 比一般单键
高,接近双键离解能。所以常温下惰性,但特殊条 件下反应迅速进行。
氢的成键特征:
由于氢的电子结构: 1s1,且电负性为x=2.2,与 其他元素的原子化合时,有以下几种成键情况: : (1)形成离子键: KH ,NaH ,CaH2 .
H2. b.p :20.2K ; D2. b.p :23.3K
2020/11/23
二、氢的性质 1.单质氢
(1)物理性质: H——H:无色无臭气体。
m.p:-259.14°C;b.p-252.8°C;临界温度33.19K, 临界压力12.98大气压,气体密度0.0899克/升;
273K时, 1dm3水溶解0.02dm3H2;稍溶于有 机溶剂。分子量最小。分子间作用力弱,所以难液 化,20K时才液化。密度最小, 故常用来填充气球。
一、氢在自然界的分布
1.氢是宇宙中最丰富的元素
地壳三界(大气、水、岩石): 以化合物形式存在。 原子分比:17%,仅次于氧,排第二位。
整个宇宙充满了氢: 氢是太阳大气的主要成份:是太阳发生热核反应的 主要原料 :原子百分比:81.75%; 氢是木星大气的主要成份:根据先锋飞船探测得知, 木星大气含氢原子百分比:82%,氦17%,其他元 素<1%。
普通化学S区元素
S区元素概述
(2) 与水作用 ● 碱金属被水氧化的反应为: 2 M(s) + 2 H2O (l) → 2 M+(aq) + 2 OH-(aq) + H2(g)
Li
●
Na
K
碱土金属被水氧化的反应为:
M(s) + 2 H2O (l)→ M+(aq) + 2 OH-(aq) + H2(g)
远不如相邻碱金属那样剧烈,镁和铍在水和空气中因生成致
S区元素概述
(3) 焰色反应 (flame reaction) 碱金属和碱土金属的化合物在无色火焰中燃烧 时 , 会 呈 现 出 一 定 的 颜 色 , 称 为 焰 色 反 应 (flame reaction)。可以用来鉴定化合物中某元素的存在,特 别是在野外。
元 颜 素 色 Li 深红 670.8 Na 黄 589.2 K 紫 766.5 Rb 红紫 780.0 Cs 蓝 455.5 Ca 橙红 714.9 Sr 深红 687.8 Ba 绿 553.5
密的氧化物保护膜而显得十分稳定。
S区元素概述
Question 2
Solution
锂的标准电极电势比钠或钾的标准电极 电势小,为什么 Li与水反应没有其他金属 与水的反应激烈? Li Na 453.69 370.96 5.3 26.4 K Rb Cs 336.8 312.04 301.55 19.1 17.9 25.8
金属锂
S区元素用途
1. 制造氢化锂、氨化锂和合成有机锂化合物,后者用做
有机化学中的还原剂和催化剂; 2. 制造合金Al-Li(含锂3 % ),因质量轻和强度大而用于空
间飞行器;
3. 制造高功率长效电池(用于手表、计算机、心脏起搏 器等); 4. 同位素(在天然锂中约占7.5%)受中子轰击产生热核 武器的主要原料氚:
s区元素
氘
氘化锂 - 6
锂 – 6元件 (锂 - 铝合金) 反应堆辐照
氢弹 氚
分离纯化
在此裂变中,1kg锂具有的能量大约相当于两万吨优质 煤炭, 比U-235裂变产生的能量还要大8倍。1kg锂至少可
以发出340千瓦的电力。
上页 下页 目录 返回
“摇椅电池” 副篇内容 知识介绍
—安装在笔记本电脑中的锂离子电池是怎样工作的?
间飞行器;
3. 制造高功率长效电池(用于手表、计算机、心脏起搏 器等); 4. 同位素(在天然锂中约占7.5%)受中子轰击产生热核 武器的主要原料氚:
1 0 4 n Li H 2He 6 3 3 1
上页 下页 目录 返回
金属锂
锂矿石冶炼 锂盐
未来的新能源
同位素分离 锂-6
重水生产
金属性、还原性减弱
原子半径减小
电离能、电负性增大
上页 下页 目录 返回
1、几个问题的说明
(1).锂和铍的的特殊性
锂和铍离子半径都特别小(60和31pm)。因此其
极化能力很强,其化合物具有一定的共价性。
尤其是Be2+,离子半径特别小,电荷又高,因而
其化合物的共价性往往超过离子性。
LiI的共价性约为50%;BeI2的共价性约为75%。
的研究中用于高精度计时。
1999年花费65万美元,安放在美国国家标准 和技术研究所.2000万年内误差不超过1 s
最近由中科院研制的铯原子钟, 200万年内误差不超过1 s
上页 下页 目录 返回
金属铍
“轻金属”,70 %~80 % 用来制造铍
铜合金。 金属铍和铍基合金的弹性-质量比
、拉伸应力和导热性都较高,因而用于各 种空间飞行器。还用于制造氧化物陶瓷、
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2. 制备
直接: 2N O 2 a N2O a2 KO2 KO 2
间接: N2O a22N a2N 2Oa
2K 3 1 N0 O K 62 O K N 2
M3 C OMO C2O (g)
3. 化学性质 (1) 与H2O的作用: M2Ι OH2O 2MO(HLi Cs剧烈程度) MIIOH2O M(OH2 )(BeO除外)
注:它们的活泼性有差异
11.2 单质的化学性质
一、与氧、硫、氮、卤素反应
单质在空气中燃烧,形成相应的氧化物:
Li2O Na2O2 KO2
RbO2
BeO MgO CaO SrO
CsO2 Ba2O2
镁
图 C-551-(a)
带
的
燃
烧
2 与水作用 2M + 2H2O → 2MOH + H2(g)
Li
Na
第十一章 S区元素
基本内容
➢11.1 s区元素概述 ➢11.2 单质的化学性质 ➢11.3 氧化物和氢氧化物 ➢11.4 盐类
学习要求:
掌握S区元素的氧化物类型和性质及氢化物的性质, 氢氧化物的碱性及其变化规律, 了解S区元素的电子构型与性质递变规律的关系,以 及锂、铍的特殊性和对角线规则。
11.1 s区元素概述
LiOH 中强
Be(OH)2 两性
NaOH KOH
ห้องสมุดไป่ตู้
强
强
Mg(OH)2 Ca(OH)2
中强
强
RbOH CsOH
强
强
Sr(OH)2 Ba(OH)2
强
强
(箭头指向) 溶解度增大, 碱性增强
碱能腐蚀玻璃,实验室盛放碱液的 试剂瓶应该用 橡皮塞,而不能用玻璃塞,不然时间长会腐蚀而 黏住的。
11.4 盐类
重要盐类:卤化物、硝酸盐、硫酸盐、碳酸盐
Gc2-705-18.9 图片
s区单质的熔点变化
电金原 离属子 能性半 、、径 电还增 负原大 性性 减增 小强
IA
IIA
Li
Be
Na
Mg
K
Ca
Rb
Sr
Cs
Ba
原子半径减小 金属性、还原性减弱 电离能、电负性增大
1.易与H2直接化合成MH、MH2离子型化合物 2.与O2形成正常氧化物、过氧化物、超氧化物 3.易与H2O反应(除Be、Mg外) 4.与非金属作用形成相应的化合物
Ca、Sr、Ba
4M + O2 → 2M2O 2M + O2 → M2O2
M + O2 → MO2 2M + O2 → 2MO
M + O2 → MO2
11.3 氧化物和氢氧化物
一、氧化物 1. 形成三类氧化物
正常氧化物(O2-):Na2O 过氧化物(O22-):Na2O2 超氧化物(O2-)KO2
2M + X2 →2MX M + X2 → MX2
Li
Mg、Ca、 Sr、Ba
N2
6M + N2 → 2M3N 3M + N2 → M3N2
碱金属和碱土金属的一些重要反应
金属
反应物质
反应式
碱金属
Mg、Ca、
S
Sr、Ba
2M + S → M2S M + S → MS
Li
Na
K 、Rb、Cs
O2
碱金属
一、 晶体类型 绝大多数是离子晶体; 但碱土金属卤化物有一定的共价性。
Be2+极化力强 BeCl2 MgCl2 CaCl2 SrCl2 BaCl2
熔点 / ℃ 405 714 782 876 962
离子性增强
二、颜色 一般无色或白色
三、 溶解度 碱金属盐类一般易溶于水; 碱土金属盐类除卤化物、硝酸盐外多数溶解度 较小。
碱金属(IA ): ns1 Li, Na, K, Rb, Cs, Fr
碱土金属(IIA ): ns2 Be, Mg, Ca, Sr, Ba, Ra
都是活泼金属
Gc2-704-18.8
Li
Na
K
Rb Cs
Gc2-711-18.14
图片
Be Mg Ca Sr
Ba
单质的物理性质:
有金属光泽 密度小 硬度小 熔点低 导电、导热性好
Na2O2 2H2O 2NaOH H2O2 2KO2 2H2O 2KOHH2O2 O2
(2)与CO2的作用:
L2iOCO 2 L2iCO 3
2N2O a22C2O 2N2C a O 3O2(g)
4K2O 2C2O 2K 2CO 33O 2(g)
二、 氢氧化物
M 2OM , O H 2O MO MH (2 O ,(除HBe)O外)
3. 稳定性 M2CO3> MCO3
五、 锂 、铍的特殊性 对角线规则
对角线规则 1 内容
Li Be B C Na Mg Al Si
在周期系中某些元素的性质和它左上方或右下方 的另一元素性质的相似性称为对角线规则。
2 锂与镁的相似性: ⑴ 单质与氧作用生成正常氧化物 ⑵ 氢氧化物均为中强碱,且水中溶解度不大 ⑶ 氟化物、碳酸盐、磷酸盐均难溶 ⑷ 氯化物均能溶于有机溶剂中 ⑸ 碳酸盐受热分解,产物为相应氧化物
这些氢化物与水反应生成H2 离子型氢化物时强的还原剂。如 TiCl4+4NaH=Ti+4NaCl+2H2
碱金属和碱土金属的一些重要反应
金属 碱金属 碱土金属
反应物质 H2
碱金属 Ca、Sr、Ba H2O
Mg
碱金属 碱土金属
卤素
反应式 2M + H2 → 2MH
M + H2 → MH2 2M + 2H2O →2MOH+H2 M + 2H2O →M(OH)2+H2 M + H2O(g) →MO + H2
碱金属氢氧化物在水中都是易溶的; 碱土金属氢氧化物在水中的溶解度要比碱金属氢氧化 物要小的多。 Be(OH)2和Mg(OH)2为难溶氢氧化物。
氢 氧 化 物 B e(O H )2 /m 溶 ol· 解 L-1 度8× 10-6
M g(O H )2 C a(O H )2 Sr(O H )2 B a(O H )2 5× 10-4 1.8× 10-2 6.7× 10-2 2× 10-1
溶解规律大致如下:
小阳离子和小阴离子或者大阳离子和大阴离子形 成的化合物的溶解度小,
小阳离子与大阴离子或大阳离子与小阴离子形成 化合物溶解度大。
四、含氧酸盐的热稳定性
1. 硝酸盐热稳定性差
2. 碳酸盐
BeCO3 MgCO3 CaCO3 SrCO3 BaCO3
T分 /℃ <100 540
900 1290 1360
K
Ca
Li
Na
K
三、焰色反应
图 Cpp-262
Ca
Sr
Ba
四、与液氨的作用
2M 23 N ( ( l s ) H ) 2 M 22 N H 2 ( H g
五、与H2反应
碱金属与碱土金属(铍镁除外)在高温下与氢直接化 合,生成离子型氢化物。 2M+H2=2MH(M=Li、Na、K、Rb、Cs) M+H2=MH2(Ca、Sr、Ba)
