甲烷乙烯苯与溴反应的比较
《有机化学基础》方程式默写

《有机化学基础》化学反应方程式默写总结(一)烷烃1.甲烷燃烧: CH 4 +2O 2CO 2 + 2H 2O2.甲烷与氯气在光照条件下反应: CH 4 + 3Cl 2 CHCl 3+ 3HCl CH 4 + 4Cl 2 CCl 4 + 4HClCH 4 + 2Cl 2CH 2Cl 2 + 2HCl3.甲烷高温分解: CH 4 C + 2H 2(二)烯烃乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
加成反应与加聚反应1.乙烯与溴的四氯化碳溶液反应:CH 2=CH 2 + Br 2 CH 2BrCH 2Br2.乙烯与水反应:CH 2=CH 2 + H 2OCH 3CH 2OH3.乙烯的催化加氢:CH 2=CH 2 +H 2CH 3CH 34.乙烯的加聚反应:n CH 2=CH 2浓硫酸170℃点燃5. 乙烯与氯化氢加成:H2C=CH2+HCl CH3CH2Cl6.乙烯与氯气加成:CH2=CH2 + Cl2 CH2ClCH2Cl7. 1—丁烯与氢气催化加成:CH2=CH2CH2CH3 +H2CH3CH2CH2CH38.环己烯催化加氢:H2 +9. 1,3环己二烯催化加氢:2H2 +10. 1,3-丁二烯与溴在温度较低和较高时的反应:CH2=CH—CH=CH2+Br2 CH2BrCH=CHCH2BrCH2=CH—CH=CH2+Br2CH2BrCHBrCH=CH211. 1,1—二氯乙烯加聚:n CCl2=CH212.丙烯加聚:n H2C=CHCH313. 2—甲基—1,3—丁二烯加聚:n(三)炔烃乙炔的制取:CaC2+2H2O CH≡CH↑+Ca(OH)21.乙炔燃烧: 2C2H2 + 5O24CO2 + 2H2O2.乙炔与足量溴的四氯化碳溶液反应:CH≡CH + Br2 CHBr2CHBr23.乙炔与氢气催化加成:CH≡CH + 2H2 CH3CH34.乙炔制聚氯乙烯: CH≡CH +HCl H 2C =CHCl n H 2C =CHCl(四)芳香烃1.苯的燃烧: 2C 6H 6+15O 2 12CO 2 + 6H 2O2.苯的催化加氢:+ 3H 23.苯与液溴催化反应: + Br 2 + HBr4.苯的硝化反应: +HO -NO 2 + H 2O9.苯乙烯与溴的四氯化碳溶液反应:+Br 210.甲苯与浓硝酸、浓硫酸的混合酸1000C 时获得三硝基甲苯:+ 3HO —NO 2 + 3H 2O11、甲苯与氢气加成12、甲苯与Cl2在光照条件下发生取代反应+3H 2催化剂△CH 3 |—CH 313、甲苯与液溴在溴化铁作用下发生取代反应(六)、卤代烃1.氯乙烷在氢氧化钠水溶液中加热反应:CH3CH2Br + NaOH CH3CH2OH + NaBr2.氯乙烷在氢氧化钠醇溶液中加热反应:CH3CH2Br +NaOH CH2=CH2↑+ NaBr + H2O3. 1—溴丙烷与氢氧化钾醇溶液共热:CH3CH2 CH2Br +KOH CH3CH=CH2↑ + KBr + H2O4. 2—氯丙烷与氢氧化钠水溶液共热:CH3CHClCH3 +NaOH CH3CH(OH)CH3+ NaCl5. 2—甲基—2—溴丁烷消去溴化氢:(七)、醇类1.乙醇与钠反应:2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑2.乙醇的燃烧:CH3CH2OH+3O22CO2+3H2O3.乙醇的催化氧化:2CH3CH2OH + O2 2CH3CHO + 2H2O4.乙醇消去反应制乙烯:CH3CH2OH CH2=CH2↑ + H2O5.乙醇分子间脱水制乙醚:2CH3CH2OH CH3CH2OCH2CH3 + H2O (取代反应)6.乙醇与红热的氧化铜反应:CH3CH2OH+CuO CH3CHO+H2O7.乙醇和浓的氢溴酸加热反应制溴乙烷:C2H5OH+ HBr C2H5Br + H2O(八)、酚类(能和FeCl3溶液反应,使溶液呈紫色)1.苯酚与氢氧化钠反应:+ NaOH + H2O2.苯酚钠与CO2反应:—ONa —OH+CO2+H2O +NaHCO33.苯酚与浓溴水反应:+3Br2↓ + 3HBr(九)、醛类1.乙醛的催化加氢:CH3CHO + H2CH3CH2OH(加成反应,还原反应)2.乙醛的催化氧化:2CH3CHO + O22CH3COOH3.银氨溶液的配制:NHAg++NH3·H2O===AgOH↓++4AgOH+2NH3·H2O===[Ag(NH3)2]++OH-+2H2O4.乙醛与银氨溶液反应: CH 3CHO + 2Ag(NH 3)2OH CH 3COONH 4 + 2Ag↓ + 3NH 3 + H 2O5.乙醛与新制氢氧化铜反应: CH 3CHO + 2Cu(OH)2 +NaOHCH 3COONa + Cu 2O↓ + 3H 2O或CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O6、甲醛与苯酚反应制酚醛树脂: 甲醛与苯酚反应:n HCHO + n — + 2n H 2O (缩聚反应)(十)、羧酸1.乙酸与乙醇发生酯化反应:CH 3COOH + CH 3CH 2OH CH 3COOCH 2CH 3 + H 2O2.乙酸与碳酸钠反应:2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑3.乙酸与碳酸氢钠反应:CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑4.两分子乳酸 CH 3CH (OH )COOH 发生酯化反应脱去两分子水形成六元环:2CH 3CHOHCOOH5、乳酸发生缩聚反应形成高分子△—OH 催化剂 △OH —CH 2— | n] [ 浓硫酸△6、乙二醇和对苯二甲酸发生缩聚反应形成高分子化合物:7.甲酸与银氨溶液反应:HCOOH+2Ag(NH3)2OH (NH4)2 CO 3+ 2Ag↓ + 3NH3 + H2O8.甲酸与新制氢氧化铜反应:HCOOH+2Cu(OH)2 +2NaOH Na2 CO3+ Cu2O↓ + 3H2O(十一)、酯类1.乙酸乙酯与H218O混合加入稀硫酸水解:稀硫酸CH3COOCH2CH3 + H218O CH3CO18OH + CH3CH2OH2.乙酸乙酯碱性水解CH3COOC2H5+NaOH CH3COONa+C2H5OH(十二)、糖类1、葡萄糖结构:CH2OH—CHOH—CHOH—CHOH—CHOH—CHO2.葡萄糖燃烧:C6H12O6 + 6O26CO2 + 6H2O3.葡萄糖与银氨溶液反应:CH2OH(CHOH)4CHO + 2Ag(NH3)2OH CH2OH(CHOH)4COONH4+ 2Ag↓ + 3NH3↑ + H2O4.葡萄糖与新制氢氧化铜反应:CH2OH(CHOH)4CHO + 2Cu(OH)2 +NaOH CH2OH(CHOH)4COONa + Cu2O↓ + 3H2O5.葡萄糖被还原为直链己六醇:CH2OH(CHOH)4 CHO + H2CH2OH(CHOH)4CH2OH6.葡萄糖在酒化酶作用下获得乙醇:C6H12O62CH3CH2OH + 2CO2↑7.蔗糖水解:C12H22O11(蔗糖) + H2O C6H12O6(葡萄糖) + C6H12O6(果糖)8.麦芽糖水解:C12H22O11(麦芽糖) + H2O 2C6H12O6(葡萄糖)注意:蔗糖不含醛基,不可以发生银镜反应;麦芽糖可以发生银镜反应。
甲烷、乙烯、苯复习教案

第九单元 有机化合物第1节 甲烷、乙烯、苯考纲点击1.了解有机化合物中碳的成键特征。
2.了解甲烷、乙烯、苯等有机化合物的主要性质。
3.了解乙烯、氯乙烯、苯的衍生物等在化工生产中的重要作用。
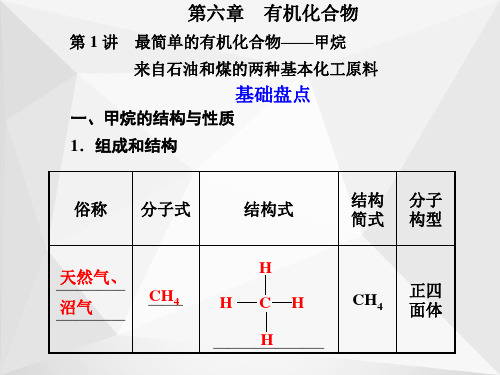
一、甲烷的结构与性质1.烃仅由____、____两种元素组成的有机物叫做烃。
颜色:______。
状态:______。
溶解性:________。
密度比空气____。
4.甲烷的化学性质通常情况下较稳定,与______、______、__________等均不反应。
(1)氧化反应甲烷的燃烧热为-890 kJ·mol -1,甲烷燃烧的热化学方程式为___________________。
(2)取代反应①定义:有机物分子里的某些原子或原子团被其他______________所替代的反应。
②甲烷与氯气的取代反应反应的现象为试管内气体颜色逐渐______,试管壁出现__________,试管中有少量______。
反应方程式为:CH 4+Cl 2――→光CH 3Cl +HCl(第一步)CH 3Cl +Cl 2――→光CH 2Cl 2+HClCH 2Cl 2+Cl 2――→光CHCl 3+HClCHCl 3+Cl 2――→光CCl 4+HCl甲烷的4种氯代物均不溶于水,常温下除__________是气体外,其他3种都是____________。
即时训练1 下列说法中正确的是__________。
①甲烷是平面正方形结构 ②甲烷可以用排水集气法收集 ③甲烷是最简单的烷烃 ④甲烷与Cl 2的混合气为浅绿色,在光照的条件下颜色逐渐变浅 ⑤甲烷的化学性质很稳定,不能与氧气、KMnO 4酸性溶液、强酸、强碱等反应 ⑥“西气东输”输送的气体的主要成分是甲烷二、烷烃的组成、结构与性质1.通式烷烃的通式为__________(n ≥1)。
2.结构特点烃分子中碳原子之间以______结合,剩余价键全部与氢原子结合,使每个碳原子都达到“饱和”,烷烃又叫做饱和烃。
【高中化学】高中化学(人教版)必修2同步教师用书:第3章 第2节 课时2 苯

课时2 苯1.会写苯的分子式、结构式、结构简式。
知道苯分子中的碳碳键是一种介于单键与双键之间的独特的键。
(重点)2.知道苯能够发生氧化反应、加成反应、取代反应,并会写相应的化学方程式。
苯的组成、结构和性质[基础·初探]教材整理1苯的组成和结构1.发现苯是1825年英国科学家法拉第首先发现的,是一种重要的化工原料,主要来自于煤。
2.组成与结构分子式结构式结构简式比例模型C6H6(1)分子构型:平面正六边形结构,分子中6个碳原子和6个氢原子共面。
(2)化学键:6个碳碳键完全相同,是一种介于单键和双键之间的独特的键。
4.芳香烃是分子中含有一个或多个苯环的一类碳氢化合物。
芳香化合物是分子中含苯环的化合物。
其中芳香烃属于芳香化合物。
教材整理2苯的性质1.物理性质 颜色 状态 气味 毒性 在水中的溶解性 熔、沸点 密度(与水相比)无色 液体 特殊气味 有毒不溶于水 较低 比水小 2.苯的化学性质(1)氧化反应①不能(填“能”或“不能”)使酸性高锰酸钾溶液褪色。
②燃烧现象:火焰明亮并带有浓烟。
化学方程式:2C 6H 6+15O 2――→点燃12CO 2+6H 2O 。
(2)取代反应①苯的溴代——生成溴苯化学方程式:。
②硝化反应——生成硝基苯反应温度:保持在50~60 ℃。
化学方程式:。
(3)加成反应——生成环己烷。
化学方程式:。
[探究·升华][思考探究]探究 苯的分子结构及其性质实验1:向试管中加入少量苯,再加入少量溴水,充分振荡。
实验2:向试管中加入少量苯,再加入少量酸性KMnO 4溶液,充分振荡。
请思考探究(1)实验1中现象是什么?说明什么问题?【提示】试管中液体分层,上层为橙红色,下层几乎为无色,说明苯分子结构中不含,苯不溶于水,且密度比水的小。
(2)实验2中现象是什么?说明什么问题?【提示】试管中液体分层,上层无色,下层仍为紫色,说明苯分子中不含,苯不溶于水,且密度比水的小。
(3)苯的分子结构用或表示,哪种更科学?【提示】(4)与是同一物质吗?说明什么?【提示】是同一物质,说明中的6个碳碳键完全相同,是介于单键与双键之间的独特键。
高中化学选择性必修三 第2章第2节 烯烃练习下学期(解析版)

第二章烃第二节烯烃炔烃2.2.1 烯烃一、填空题1.下物质;甲烷;苯;聚乙烯;聚乙炔;丁炔;环己烷;邻二甲苯;苯乙烯。
既能使酸性溶液褪色,又能使溴水因发生化学反应而褪色的是A. B. C. D.【答案】C【解析】甲烷属于饱和烃,不能使酸性溶液褪色,不能使溴水褪色,不符合题意;苯不能使酸性溶液褪色,苯使溴水褪色不是发生反应,是苯萃取溴水中的溴使溴水褪色,不符合题意;聚乙烯不含碳碳双键,不能使酸性溶液褪色,不能使溴水褪色,不符合题意;聚乙炔含有碳碳双键,能被酸性高锰酸钾氧化,使酸性高锰酸钾褪色,能与溴发生加成反应使溴水褪色,符合题意;丁炔含有碳碳三键,能被酸性高锰酸钾氧化,使酸性高锰酸钾褪色,能与溴发生加成反应使溴水褪色,符合题意;环己烷属于环烷烃,具有烷烃的性质,不能使酸性溶液褪色,不符合题意;邻二甲苯,连接苯环的碳原子上含有氢原子,可以被酸性高锰酸钾氧化,使酸性高锰酸钾褪色,不能使溴水因发生化学反应而褪色,不符合题意;苯乙烯含有碳碳双键,能被酸性高锰酸钾氧化,使酸性高锰酸钾褪色,能与溴发生加成反应使溴水褪色,符合题意;故符合题意,故C正确。
2.下列关于乙烯用途、性质、结构叙述正确的是乙烯通入水中即可转化为乙醇乙烯可作香蕉等水果的催熟剂乙烯易与溴水发生加成反应,1mol乙烯消耗1mol溴单质,说明乙烯含有一个碳碳双键乙烯能够被酸性溶液所氧化,说明乙烯结构中含有一个碳碳双键乙烯分子中所有原子在同一个平面.A. B. C. D.【答案】C【解析】乙烯含碳碳双键,为平面结构,可与溴水发生加成反应、与高锰酸钾发生氧化反应,且乙烯具有催熟作用,以此来解答。
乙烯通入水中,在催化剂作用下可转化为乙醇,故错误乙烯具有催熟作用,可作香蕉等水果的催熟剂,故正确;乙烯易与溴水发生加成反应,1mol乙烯消耗1mol溴单质,说明乙烯含有一个碳碳双键,故正确;乙烯能够被酸性溶液所氧化,不能说明碳碳双键的个数,故错误;乙烯分子中所有原子在同一个平面,故正确;故选C。
选修五有机化学实验专题

有机化学科学实验探究:2、甲烷与氯气的光照取代3、石蜡油分解4、乙炔的实验室制取和性质6、乙醇的化学性质乙醇的消去反应7、苯酚的化学性质及其检验注:苯酚与氯化铁显色,也可以作为苯酚的检验方法。
8、醛基的检验注:新制请氧化铜悬浊液中,氢氧化钠应!9、乙酸的化学性质乙酸、碳酸、苯酚的酸性比较①盛有碳酸钠固体的瓶中有10、乙酸乙酯的水解①乙酸乙酯+水②乙酸乙酯+稀硫酸③乙酸乙酯+氢氧化钠溶液①酯层②酯层③酯层酯水解需要、催化,其中催化较慢,反应;催化较快,反应方程式:①催化水解(可逆):②催化水解(不可逆):【适应性训练】1、下列有关试验操作的叙述正确的是A.实验室常用右图所示的装置制取少量的乙酸乙酯B.用50mL酸式滴定管可准确量取25.00mLKMnO4溶液C.用量筒取5.00mL 1.00mol·L-1盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100 mol·L-1盐酸D.在苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出2、下列除去杂质的方法正确的是①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;②除去乙酸乙酯中少量的乙酸:用饱和碳酸氢钠溶液洗涤,分液、干燥、蒸馏;③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;④除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
A.①②B.②④C.③④D.②③3、鉴别苯酚、硫氰化钾、乙酸、氢氧化钠四种溶液,可用的一种试剂是()A.盐酸B.食盐C.新制的氢氧化铜D.氯化铁4、只用水就能鉴别的一组物质是( )A 苯、乙酸、四氯化碳B 乙醇、乙醛、乙酸C 乙醛、乙二醇、硝基苯D 苯酚、乙醇、甘油5、可以将六种无色液体:C2H5OH、AgNO3溶液,C2H5Br、KI溶液,C6H5OH溶液,C6H6区分开的试剂是( ) A.FeCl3溶液B.溴水C.酸性高锰酸钾溶液D.NaOH溶液6、区别乙醛、苯和溴苯,最简单的方法是()A.加酸性高锰酸钾溶液后振荡B.与新制氢氧化铜共热C.加蒸馏水后振荡D.加硝酸银溶液后振荡7、下列除杂方法中正确的一组是()A.溴苯中混有溴,加入碘化钾溶液后用汽油萃取B.乙醇中混有乙酸,加入NaOH溶液后用分液漏斗分液C.乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气D.苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏8、下列除去括号内杂质的有关操作方法不正确的是()A.淀粉溶液(葡萄糖):渗析B.乙醇(乙酸):加KOH溶液,分液C.甲醛溶液(甲酸):加NaOH溶液,蒸馏D.肥皂液(甘油):加食盐搅拌、盐析、过滤9、欲从溶有苯酚的乙醇中回收苯酚,有下列操作: ①蒸馏②过滤③静置分液④加入足量的金属钠⑤通入过量的二氧化碳⑥加入足量的NaOH溶液⑦加入足量的FeCl3溶液⑧加入硫酸与NaBr共热,合理的步骤是( )A.④⑤③B. ⑥①⑤③C. ⑥①⑤②D. ⑧②⑤③10、下列括号内的物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去。
_高中化学第二章烃和卤代烃第二节芳香烃作业课件新人教版选修

(3)苯不能使溴的四氯化碳溶液褪色,但苯可以萃取溴
水中的Br2。
()
(4)烷烃与苯都能与卤素发生取代反应,反应条件相
同。 ( )
提示:(1)× 苯不能使酸性KMnO4溶液褪色,但苯仍然属 于不饱和烃。 (2)× 苯分子中的碳碳键是介于碳碳单键和碳碳双键 之间的特殊的键,不存在碳碳双键。 (3)√ 苯分子中不存在碳碳双键,不能与溴发生加成 反应,但可以萃取溴水中的Br2。
_Ⅰ__和__Ⅱ__均__正确
反应
事实
证明Ⅰ或Ⅱ正确
(2)苯不能使溴的四氯 化碳溶液及酸性高锰 酸钾溶液褪色
苯分子中不存在_碳__碳__双__键__, _Ⅰ__不正确,_Ⅱ__正确
(3)苯的邻二氯代物只 有一种
_Ⅰ__不正确,_Ⅱ__正确
事实
证明Ⅰ或Ⅱ正确
(4)苯的核磁共振氢谱 图中只有一个峰
_Ⅰ__和__Ⅱ__均__正确
【解析】选B。溴苯密度大于水,应在下层,A错误;苯含 碳量较高,燃烧时火焰明亮并带有浓烟,B正确;取代反 应的产物是硝基苯,不是烃,是烃的衍生物,C错误;苯分 子中不含碳碳双键,但在催化剂存在的条件下可与H2发 生加成反应,D错误。
4.制备溴苯的实验装置如图,将液溴从恒压滴液漏斗慢 慢滴入盛有苯和铁粉的烧瓶A。反应结束后,对A中的液 体进行后续处理即可获得溴苯。
(1)写出A中制备溴苯的化学反应方程式__________ ________________。 (2)B中盛放的CCl4的作用是________________。 (3)冷凝管的作用是___________________________,冷 凝管中的水应从____________口进入(填“a”或 “b”)。
褪色
橙红色,下
最简单的有机化合物
键__(_或__三___键__)_两___端__ 的__碳___原__子__与___其__他__ 原__子___或__原__子___团__直__ 接__结___合__生__成___新__的__ 化合物的反应
________________
_量__小___的__化___合__
_物__分___子__结___合__ _成__相___对__分___子__ _质__量___大__的___化__ _合__物___分__子___的__
三、乙烯
1.乙烯、烯烃
分子中含有 碳碳双键( C==C )
的烃叫做烯烃。
乙__烯__是最简单的烯烃,可以用来衡量一个国家的石油化工发展水平。
2.乙烯的结构
HH
HH
分子式:C2H4,电子式:H··C····C··H,结构式为:H—C==C—H 。
3.乙烯的物理性质
颜色: 无色 ,溶解性: 难溶于水 ,密度: 稍小于空气,状 态: 气体 。
2.物理性质 颜色: 无色 ,状态: 气体 ,溶解性: 难溶于水 ,
密度:比空气 小 。
3.化学性质
稳定性 通常情况下不与 强酸、强碱、强氧化剂 反应
燃烧反应 甲
CH4+2O2 点燃 CO2+2H2O(淡蓝色火焰)
烷
取代反应 Cl2
CH4+Cl2 光 CH3Cl+HCl
光 CH3Cl+Cl2
光 CH2Cl2+Cl2
4.乙烯的化学性质
由于 碳碳双键 的存在,使乙烯化学性质活泼,与溴、
KMnO4均可反应。
(①1)燃氧烧化:反C应2H4+3O2—点—燃→2CO2+2H2O;②被酸性高锰
酸钾等强氧化剂所氧化。 (2)加成反应 乙烯与Br2、H2、HCl、H2O等均可发生加成反应,化学方
原创:《烃—甲烷、乙烯、苯》 复习学案

《烃—甲烷、乙烯、苯》复习学案北师大株洲附校张老师【学习目标】1、了解有机化合物中碳的成健特征。
了解有机化合物同分异构现象。
2、了解甲烷、乙烯、苯等烃的主要性质。
3、了解有机化合物发生反应的类型。
4、了解煤、石油、天然气等综合利用的意义。
了解乙烯、氯乙烯、苯的衍生物等在化工生产中的重要作用。
【自主学习】一、有机化学的一些基本概念2有机物的结构特点:①在有机物中,由于碳原子半径小及最外层有___个价电子,碳原子形成个共价键。
②碳原子之间.....可以相互形成共价键,可形成________键、_______键和_______键。
③碳原子之间可形成碳链或碳环的连接方式。
④有机物分子中的化学键的类型为_________, 形成____晶体。
3 多数..有机物的性质特点:○1溶解性:______溶于水,易溶于_____。
○2燃烧:易○3熔点:低○4电离情况非电解质,难电离○5反应特点:慢,副反应多。
4有机物种类繁多的原因:5、○1分子式:表示一个分子中所含各元素的原子个数....的式子(无结构意义)○2最简式:也称实验式。
仅表示各元素的原子个数比...的式子。
○3结构式:用短线.........的式子。
..表示分子中原子间的价键及原子排列次序○4结构简式:表明分子中原子排列次序的简化..的结构式、6 “基”:分子中一类不带电荷....不能独自稳定存在的原子或原子团。
(如CH3CH2CH3分子中有两个甲基、一个乙基、一个丙基。
乙二醇分子由两个羟基和一个烃基构成)(有机反应多数为自由基之间的反应。
自由基的产生:分子中的共价键断裂产生的不带电荷....的含有未成对电子的原子团............。
)“根”即离子。
它带电荷,能稳定存在。
(无机化学中的概念)烃基:烃分子去掉氢原子后的剩余部分一价基用-R 表示烷基:烷烃分子去掉氢原子后的剩余部分一价烷基的通式-C n H2n+1(熟记:C3H7—有2种,C4H9 --有4种)7同系物:有机物是划分为“同系物”进行研究的,结构相似的划分为一个“系列”。
