甲烷、乙烯、苯与溴反应的比较
《有机化学基础》方程式默写

《有机化学基础》化学反应方程式默写总结(一)烷烃1.甲烷燃烧: CH 4 +2O 2CO 2 + 2H 2O2.甲烷与氯气在光照条件下反应: CH 4 + 3Cl 2 CHCl 3+ 3HCl CH 4 + 4Cl 2 CCl 4 + 4HClCH 4 + 2Cl 2CH 2Cl 2 + 2HCl3.甲烷高温分解: CH 4 C + 2H 2(二)烯烃乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
加成反应与加聚反应1.乙烯与溴的四氯化碳溶液反应:CH 2=CH 2 + Br 2 CH 2BrCH 2Br2.乙烯与水反应:CH 2=CH 2 + H 2OCH 3CH 2OH3.乙烯的催化加氢:CH 2=CH 2 +H 2CH 3CH 34.乙烯的加聚反应:n CH 2=CH 2浓硫酸170℃点燃5. 乙烯与氯化氢加成:H2C=CH2+HCl CH3CH2Cl6.乙烯与氯气加成:CH2=CH2 + Cl2 CH2ClCH2Cl7. 1—丁烯与氢气催化加成:CH2=CH2CH2CH3 +H2CH3CH2CH2CH38.环己烯催化加氢:H2 +9. 1,3环己二烯催化加氢:2H2 +10. 1,3-丁二烯与溴在温度较低和较高时的反应:CH2=CH—CH=CH2+Br2 CH2BrCH=CHCH2BrCH2=CH—CH=CH2+Br2CH2BrCHBrCH=CH211. 1,1—二氯乙烯加聚:n CCl2=CH212.丙烯加聚:n H2C=CHCH313. 2—甲基—1,3—丁二烯加聚:n(三)炔烃乙炔的制取:CaC2+2H2O CH≡CH↑+Ca(OH)21.乙炔燃烧: 2C2H2 + 5O24CO2 + 2H2O2.乙炔与足量溴的四氯化碳溶液反应:CH≡CH + Br2 CHBr2CHBr23.乙炔与氢气催化加成:CH≡CH + 2H2 CH3CH34.乙炔制聚氯乙烯: CH≡CH +HCl H 2C =CHCl n H 2C =CHCl(四)芳香烃1.苯的燃烧: 2C 6H 6+15O 2 12CO 2 + 6H 2O2.苯的催化加氢:+ 3H 23.苯与液溴催化反应: + Br 2 + HBr4.苯的硝化反应: +HO -NO 2 + H 2O9.苯乙烯与溴的四氯化碳溶液反应:+Br 210.甲苯与浓硝酸、浓硫酸的混合酸1000C 时获得三硝基甲苯:+ 3HO —NO 2 + 3H 2O11、甲苯与氢气加成12、甲苯与Cl2在光照条件下发生取代反应+3H 2催化剂△CH 3 |—CH 313、甲苯与液溴在溴化铁作用下发生取代反应(六)、卤代烃1.氯乙烷在氢氧化钠水溶液中加热反应:CH3CH2Br + NaOH CH3CH2OH + NaBr2.氯乙烷在氢氧化钠醇溶液中加热反应:CH3CH2Br +NaOH CH2=CH2↑+ NaBr + H2O3. 1—溴丙烷与氢氧化钾醇溶液共热:CH3CH2 CH2Br +KOH CH3CH=CH2↑ + KBr + H2O4. 2—氯丙烷与氢氧化钠水溶液共热:CH3CHClCH3 +NaOH CH3CH(OH)CH3+ NaCl5. 2—甲基—2—溴丁烷消去溴化氢:(七)、醇类1.乙醇与钠反应:2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑2.乙醇的燃烧:CH3CH2OH+3O22CO2+3H2O3.乙醇的催化氧化:2CH3CH2OH + O2 2CH3CHO + 2H2O4.乙醇消去反应制乙烯:CH3CH2OH CH2=CH2↑ + H2O5.乙醇分子间脱水制乙醚:2CH3CH2OH CH3CH2OCH2CH3 + H2O (取代反应)6.乙醇与红热的氧化铜反应:CH3CH2OH+CuO CH3CHO+H2O7.乙醇和浓的氢溴酸加热反应制溴乙烷:C2H5OH+ HBr C2H5Br + H2O(八)、酚类(能和FeCl3溶液反应,使溶液呈紫色)1.苯酚与氢氧化钠反应:+ NaOH + H2O2.苯酚钠与CO2反应:—ONa —OH+CO2+H2O +NaHCO33.苯酚与浓溴水反应:+3Br2↓ + 3HBr(九)、醛类1.乙醛的催化加氢:CH3CHO + H2CH3CH2OH(加成反应,还原反应)2.乙醛的催化氧化:2CH3CHO + O22CH3COOH3.银氨溶液的配制:NHAg++NH3·H2O===AgOH↓++4AgOH+2NH3·H2O===[Ag(NH3)2]++OH-+2H2O4.乙醛与银氨溶液反应: CH 3CHO + 2Ag(NH 3)2OH CH 3COONH 4 + 2Ag↓ + 3NH 3 + H 2O5.乙醛与新制氢氧化铜反应: CH 3CHO + 2Cu(OH)2 +NaOHCH 3COONa + Cu 2O↓ + 3H 2O或CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O6、甲醛与苯酚反应制酚醛树脂: 甲醛与苯酚反应:n HCHO + n — + 2n H 2O (缩聚反应)(十)、羧酸1.乙酸与乙醇发生酯化反应:CH 3COOH + CH 3CH 2OH CH 3COOCH 2CH 3 + H 2O2.乙酸与碳酸钠反应:2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑3.乙酸与碳酸氢钠反应:CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑4.两分子乳酸 CH 3CH (OH )COOH 发生酯化反应脱去两分子水形成六元环:2CH 3CHOHCOOH5、乳酸发生缩聚反应形成高分子△—OH 催化剂 △OH —CH 2— | n] [ 浓硫酸△6、乙二醇和对苯二甲酸发生缩聚反应形成高分子化合物:7.甲酸与银氨溶液反应:HCOOH+2Ag(NH3)2OH (NH4)2 CO 3+ 2Ag↓ + 3NH3 + H2O8.甲酸与新制氢氧化铜反应:HCOOH+2Cu(OH)2 +2NaOH Na2 CO3+ Cu2O↓ + 3H2O(十一)、酯类1.乙酸乙酯与H218O混合加入稀硫酸水解:稀硫酸CH3COOCH2CH3 + H218O CH3CO18OH + CH3CH2OH2.乙酸乙酯碱性水解CH3COOC2H5+NaOH CH3COONa+C2H5OH(十二)、糖类1、葡萄糖结构:CH2OH—CHOH—CHOH—CHOH—CHOH—CHO2.葡萄糖燃烧:C6H12O6 + 6O26CO2 + 6H2O3.葡萄糖与银氨溶液反应:CH2OH(CHOH)4CHO + 2Ag(NH3)2OH CH2OH(CHOH)4COONH4+ 2Ag↓ + 3NH3↑ + H2O4.葡萄糖与新制氢氧化铜反应:CH2OH(CHOH)4CHO + 2Cu(OH)2 +NaOH CH2OH(CHOH)4COONa + Cu2O↓ + 3H2O5.葡萄糖被还原为直链己六醇:CH2OH(CHOH)4 CHO + H2CH2OH(CHOH)4CH2OH6.葡萄糖在酒化酶作用下获得乙醇:C6H12O62CH3CH2OH + 2CO2↑7.蔗糖水解:C12H22O11(蔗糖) + H2O C6H12O6(葡萄糖) + C6H12O6(果糖)8.麦芽糖水解:C12H22O11(麦芽糖) + H2O 2C6H12O6(葡萄糖)注意:蔗糖不含醛基,不可以发生银镜反应;麦芽糖可以发生银镜反应。
苯 课件

【解析】选A。苯分子不是单、双键交替结构,故不能与
Br2发生加成反应生成
;苯分子中环上六个化
学键完全相同,这种结构的特殊性决定了苯易发生取代反
应(如与溴反应生成
,与混酸反应生成
),能发生加成反应(生成环己烷),难氧
化 等性质,故选A。
5.某同学要以“研究某分子的结构”为题目做一次探究活 动,下面是其活动记录,请你补全所缺内容。 (1)理论推测 他根据苯的凯库勒式,推测苯分子中有两种不同的碳碳键, 即________和________,因此它可以使紫色的酸性KMnO4溶 液褪色。 (2)实验验证 他取少量的上述溶液加入试管中,然后加入苯,充分振荡, 发现_______________________________________ ______________________________________________。
答案:(1) (2)① 取代 ②
某化学课外小组用下图所示的装置制取溴苯。先向分液漏 斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活 塞关闭)中。
【思考探究】 (1)请你写出A中反应的化学方程式。 提示:A中反应的化学方程式为
(2) C中盛放CCl4的作用是什么? 提示:由于溴易挥发,HBr中含有溴蒸气,所以用CCl4除去 溴化氢气体中的溴。
3.下列反应中属于取代反应的是( ) A.苯与溴水混合振荡后分层 B.苯在镍作催化剂时与氢气的反应 C.苯在空气中燃烧 D.苯在溴化铁存在时与溴的反应 【解析】选D。A项只是萃取,未发生化学反应;B项为加成 反应;C项苯发生氧化反应;D项苯与溴发生的反应为取代 反应。
4.以苯为原料,不能通过一步反应而制得的有机物是( )
(4)实验证明,苯分子中的6个碳原子间的化学键完全相 同,是一种介于碳碳单键和碳碳双键之间的独特的键;苯 分子中的6个碳原子和6个氢原子都在同一个平面上,为了
有机化学基础化学方程式

有机反应方程式一烷烃1.甲烷燃烧: 2·P34CH4 +2O2CO2 + 2H2O2.甲烷与氯气在光照条件下反应2·P56CH4 + 3Cl2CHCl3+ 3HClCH4 + 4Cl2CCl4 + 4HCl CH4 + 2Cl2CH2Cl2 + 2HCl3.甲烷在一定条件下可被氧化成一氧化碳和氢气2·P562CH4+O22CO+4H24.甲烷高温分解2·P56 CH4 C + 2H2二烯烃1.乙烯与溴的四氯化碳溶液反应2·P60 CH2=CH2 + Br2 CH2BrCH2Br3.乙烯与水反应2·P60 CH2=CH2 + H2O CH3CH2OH4.乙烯的催化氧化制乙醛2·P77 2CH2=CH2 + O22CH3CHO5.乙烯的催化氧化制乙酸2·P77 CH2=CH2 + O22CH3COOH6.乙烯的催化加氢2·P64 CH2=CH2 +H2CH3CH38.乙烯的加聚反应2·P78 n CH2=CH29.乙烯与氯气在一定条件下生成氯乙烯3·P46 CH2=CH2 + Cl2CH2=CHCl+HCl10.乙烯与氯气加成3·P46 CH2=CH2 + Cl2 CH2ClCH2Cl12. 1—丁烯与氢气催化加成3·P47 CH2=CH2CH2CH3 +H2CH3CH2CH2CH313.环己烯催化加氢3·P49H2 +14. 1,3环己二烯催化加氢3·P492H2 +16. 1,3-丁二烯与溴在温度较低和较高时的反应3·P42CH2=CH—CH=CH2+Br2 CH2BrCH=CHCH2BrCH2=CH—CH=CH2+Br2CH2BrCHBrCH=CH2 17. 1,1—二氯乙烯加聚3·P47n CCl2=CH218.丙烯加聚3·P47n H2C=CHCH319. 2—甲基—1,3—丁二烯加聚3·P47n三炔烃1.乙炔燃烧2·P37 2C2H2 + 5O24CO2 + 2H2O2.乙炔与足量溴的四氯化碳溶液反应2·P60 CH≡CH + Br2 CHBr2CHBr23.乙炔与氢气催化加成3·P47 CH≡CH + 2H2 CH3CH34.乙炔制聚氯乙烯2·P60CH≡CH +HCl H2C=CHCl n H2C=CHCl四芳香烃1.苯的燃烧2·P62 2C6H6+15O212CO2 + 6H2O2.苯的催化加氢3·P49 + 3H23.苯与液溴催化反应3·P51 + Br2+ HBr4.苯的硝化反应3·P51 +HO-NO2+ H2O9.苯乙烯与溴的四氯化碳溶液反应3·P56+Br210.甲苯与浓硝酸、浓硫酸的混合酸1000C时获得三硝基甲苯3·P53+ 3HO—NO2 + 3H2O六、卤代烃1.氯乙烷在氢氧化钠水溶液中加热反应3·P64CH3CH2Br + NaOH CH3CH2OH + NaBr2.氯乙烷在氢氧化钠醇溶液中加热反应2·P63CH3CH2Br +NaOH CH2=CH2↑+ NaBr + H2O 4. 1—溴丙烷与氢氧化钾醇溶液共热3·P65CH3CH2 CH2Br +KOH CH3CH=CH2↑ + KBr + H2O —氯丙烷与氢氧化钠水溶液共热3·P65CH3CHClCH3 +NaOH CH3CHOHCH3+ NaCl6. 2—甲基—2—溴丁烷消去溴化氢3·P65七、醇类1.乙醇与钠反应3·P672CH3CH2OH + 2Na 2CH3CH2ONa + H2↑2.乙醇的燃烧2·P34 CH3CH2OH+3O22CO2+3H2O3.乙醇的催化氧化2·P662CH3CH2OH + O2 2CH3CHO + 2H2O4.乙醇制乙烯3·P69 CH3CH2OH CH2=CH2↑ + H2O5.乙醇制乙醚3·P69 2CH3CH2OH CH3CH2OCH2CH3 + H2O6.乙醇与红热的氧化铜反应3·P88CH3CH2OH+CuO CH3CHO+H2O7.浓硫酸、乙醇和溴化钠加热反应制溴乙烷3·P68C2H5OH+NaBr+H2SO4C2H5Br+NaHSO4 + H2O八、酚类1.苯酚与氢氧化钠反应3·P73 + NaOH + H2O2.苯酚与溴水反应3·P73+3Br2↓ + 3HBr九、醛类1.乙醛的催化加氢3·P80CH3CHO + H2CH3CH2OH2.乙醛的催化氧化2·P662CH3CHO + O22CH3COOH3.乙醛与银氨溶液反应3·P80CH3CHO + 2AgNH32OH CH3COONH4+ 2Ag↓ + 3NH3 + H2O4.乙醛与新制氢氧化铜反应3·P80CH3CHO + 2CuOH2 +NaOH CH3COONa + Cu2O↓ + 3H2O5.甲醛与苯酚制酚醛树脂3·P80十、羧酸1.乙酸与乙醇发生酯化反应2·P68CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O2.乙酸与碳酸钠反应2·P67 2CH3COOH+Na2CO3==2CH3COONa+H2O+CO2↑4.两分子乳酸脱去两分子水3·P862CH3CHOHCOOH7.甲酸与银氨溶液反应3·P84HCOOH+2AgNH32OH NH42 CO 3+ 2Ag↓ + 3NH3 + H2O8.甲酸与新制氢氧化铜反应3·P84HCOOH+2CuOH2 +2NaOH Na2 CO3+ Cu2O↓ + 3H2O9.甲酸与碳酸钠反应3·P842HCOOH+Na2CO32HCOONa+H2O+CO2↑十一、糖类1.葡萄糖燃烧2·P45 C6H12O6 + 6O26CO2 + 6H2O2.葡萄糖与乙酸完全酯化3·P91CH2OHCHOH4CHO+5CH3COOH CH3COOCH2CHOOCCH3CHO+5H2O3.葡萄糖与银氨溶液反应3·P91CH2OHCHOH4CHO + 2AgNH32OH CH2OHCHOH4COONH4+ 2Ag↓ + 3NH3↑ + H2O4.葡萄糖与新制氢氧化铜反应2·P71CH2OHCHOH4CHO + 2CuOH2 +NaOH CH2OHCHOH4COONa + Cu2O↓ + 3H2O5.葡萄糖被还原为直链己六醇3·P91CH2OHCHOH4 CHO + H2CH2OHCHOH4CH2OH6.葡萄糖在酒化酶作用下获得乙醇2·P72C6H12O62CH3CH2OH + 2CO2↑7.蔗糖水解3·P93 C12H22O11蔗糖+ H2O C6H12O6葡萄糖+ C6H12O6果糖8.麦芽糖水解2·P71 C12H22O11麦芽糖+ H2O 2C6H12O6葡萄糖9.淀粉水解2·P47 C6H10O5n淀粉+ nH2O n C6H12O6葡萄糖10.纤维素水解2·P45C6H10O5n纤维素+ nH2O n C6H12O6葡萄糖11.纤维素燃烧2·P46 C6H10O5n纤维素+ 6nO26nCO2 + 6nH2O十二、酯类1.乙酸乙酯与H218O混合加入稀硫酸水解3·P13CH3COOCH2CH3 + H218O CH3CO18OH + CH3CH2OH2.油脂的氢化以油酸甘油酯加氢为例3·P993.油脂的皂化反应以硬脂酸甘油酯为例3·P99。
选修五有机化学实验专题

有机化学科学实验探究:2、甲烷与氯气的光照取代3、石蜡油分解4、乙炔的实验室制取和性质6、乙醇的化学性质乙醇的消去反应7、苯酚的化学性质及其检验注:苯酚与氯化铁显色,也可以作为苯酚的检验方法。
8、醛基的检验注:新制请氧化铜悬浊液中,氢氧化钠应!9、乙酸的化学性质乙酸、碳酸、苯酚的酸性比较①盛有碳酸钠固体的瓶中有10、乙酸乙酯的水解①乙酸乙酯+水②乙酸乙酯+稀硫酸③乙酸乙酯+氢氧化钠溶液①酯层②酯层③酯层酯水解需要、催化,其中催化较慢,反应;催化较快,反应方程式:①催化水解(可逆):②催化水解(不可逆):【适应性训练】1、下列有关试验操作的叙述正确的是A.实验室常用右图所示的装置制取少量的乙酸乙酯B.用50mL酸式滴定管可准确量取25.00mLKMnO4溶液C.用量筒取5.00mL 1.00mol·L-1盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100 mol·L-1盐酸D.在苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出2、下列除去杂质的方法正确的是①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;②除去乙酸乙酯中少量的乙酸:用饱和碳酸氢钠溶液洗涤,分液、干燥、蒸馏;③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;④除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
A.①②B.②④C.③④D.②③3、鉴别苯酚、硫氰化钾、乙酸、氢氧化钠四种溶液,可用的一种试剂是()A.盐酸B.食盐C.新制的氢氧化铜D.氯化铁4、只用水就能鉴别的一组物质是( )A 苯、乙酸、四氯化碳B 乙醇、乙醛、乙酸C 乙醛、乙二醇、硝基苯D 苯酚、乙醇、甘油5、可以将六种无色液体:C2H5OH、AgNO3溶液,C2H5Br、KI溶液,C6H5OH溶液,C6H6区分开的试剂是( ) A.FeCl3溶液B.溴水C.酸性高锰酸钾溶液D.NaOH溶液6、区别乙醛、苯和溴苯,最简单的方法是()A.加酸性高锰酸钾溶液后振荡B.与新制氢氧化铜共热C.加蒸馏水后振荡D.加硝酸银溶液后振荡7、下列除杂方法中正确的一组是()A.溴苯中混有溴,加入碘化钾溶液后用汽油萃取B.乙醇中混有乙酸,加入NaOH溶液后用分液漏斗分液C.乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气D.苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏8、下列除去括号内杂质的有关操作方法不正确的是()A.淀粉溶液(葡萄糖):渗析B.乙醇(乙酸):加KOH溶液,分液C.甲醛溶液(甲酸):加NaOH溶液,蒸馏D.肥皂液(甘油):加食盐搅拌、盐析、过滤9、欲从溶有苯酚的乙醇中回收苯酚,有下列操作: ①蒸馏②过滤③静置分液④加入足量的金属钠⑤通入过量的二氧化碳⑥加入足量的NaOH溶液⑦加入足量的FeCl3溶液⑧加入硫酸与NaBr共热,合理的步骤是( )A.④⑤③B. ⑥①⑤③C. ⑥①⑤②D. ⑧②⑤③10、下列括号内的物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去。
_高中化学第二章烃和卤代烃第二节芳香烃作业课件新人教版选修

(3)苯不能使溴的四氯化碳溶液褪色,但苯可以萃取溴
水中的Br2。
()
(4)烷烃与苯都能与卤素发生取代反应,反应条件相
同。 ( )
提示:(1)× 苯不能使酸性KMnO4溶液褪色,但苯仍然属 于不饱和烃。 (2)× 苯分子中的碳碳键是介于碳碳单键和碳碳双键 之间的特殊的键,不存在碳碳双键。 (3)√ 苯分子中不存在碳碳双键,不能与溴发生加成 反应,但可以萃取溴水中的Br2。
_Ⅰ__和__Ⅱ__均__正确
反应
事实
证明Ⅰ或Ⅱ正确
(2)苯不能使溴的四氯 化碳溶液及酸性高锰 酸钾溶液褪色
苯分子中不存在_碳__碳__双__键__, _Ⅰ__不正确,_Ⅱ__正确
(3)苯的邻二氯代物只 有一种
_Ⅰ__不正确,_Ⅱ__正确
事实
证明Ⅰ或Ⅱ正确
(4)苯的核磁共振氢谱 图中只有一个峰
_Ⅰ__和__Ⅱ__均__正确
【解析】选B。溴苯密度大于水,应在下层,A错误;苯含 碳量较高,燃烧时火焰明亮并带有浓烟,B正确;取代反 应的产物是硝基苯,不是烃,是烃的衍生物,C错误;苯分 子中不含碳碳双键,但在催化剂存在的条件下可与H2发 生加成反应,D错误。
4.制备溴苯的实验装置如图,将液溴从恒压滴液漏斗慢 慢滴入盛有苯和铁粉的烧瓶A。反应结束后,对A中的液 体进行后续处理即可获得溴苯。
(1)写出A中制备溴苯的化学反应方程式__________ ________________。 (2)B中盛放的CCl4的作用是________________。 (3)冷凝管的作用是___________________________,冷 凝管中的水应从____________口进入(填“a”或 “b”)。
褪色
橙红色,下
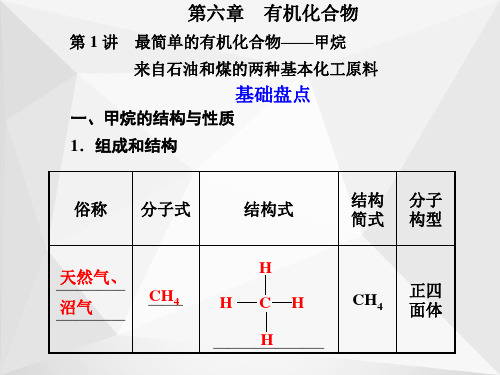
最简单的有机化合物
键__(_或__三___键__)_两___端__ 的__碳___原__子__与___其__他__ 原__子___或__原__子___团__直__ 接__结___合__生__成___新__的__ 化合物的反应
________________
_量__小___的__化___合__
_物__分___子__结___合__ _成__相___对__分___子__ _质__量___大__的___化__ _合__物___分__子___的__
三、乙烯
1.乙烯、烯烃
分子中含有 碳碳双键( C==C )
的烃叫做烯烃。
乙__烯__是最简单的烯烃,可以用来衡量一个国家的石油化工发展水平。
2.乙烯的结构
HH
HH
分子式:C2H4,电子式:H··C····C··H,结构式为:H—C==C—H 。
3.乙烯的物理性质
颜色: 无色 ,溶解性: 难溶于水 ,密度: 稍小于空气,状 态: 气体 。
2.物理性质 颜色: 无色 ,状态: 气体 ,溶解性: 难溶于水 ,
密度:比空气 小 。
3.化学性质
稳定性 通常情况下不与 强酸、强碱、强氧化剂 反应
燃烧反应 甲
CH4+2O2 点燃 CO2+2H2O(淡蓝色火焰)
烷
取代反应 Cl2
CH4+Cl2 光 CH3Cl+HCl
光 CH3Cl+Cl2
光 CH2Cl2+Cl2
4.乙烯的化学性质
由于 碳碳双键 的存在,使乙烯化学性质活泼,与溴、
KMnO4均可反应。
(①1)燃氧烧化:反C应2H4+3O2—点—燃→2CO2+2H2O;②被酸性高锰
酸钾等强氧化剂所氧化。 (2)加成反应 乙烯与Br2、H2、HCl、H2O等均可发生加成反应,化学方
高一化学烯烃试题答案及解析

高一化学烯烃试题答案及解析1.苯与乙烯相比较,下列叙述不正确的是A.都容易发生取代反应B.苯不能被KMnO4氧化C.苯只能在特殊条件下发生加成反应D.都能在空气中燃烧【答案】A【解析】苯能发生取代反应和加成反应,乙烯可以发生加成反应,因此A选项是错误的【考点】考查有机物苯与乙烯性质的相关知识点。
2.巴豆酸的结构简式为CH3CH="CHCOOH" 现有:①氯化氢,②溴水,③纯碱溶液,④酸性KMnO4溶液, ⑤乙醇,试根据其结构特点,判断在一定条件下能与巴豆酸反应的物质组合是A.只有②④⑤B.只有①③④C.只有①②③D.都可以【答案】D【解析】巴豆酸的结构简式为CH3CH=CHCOOH,官能团是碳碳双键和羧基,所以可与氯化氢、溴水发生加成反应,羧基与纯碱发生复分解反应,与酸性KMnO4溶液发生氧化反应,与乙醇发生酯化反应,所以答案选D。
【考点】考查官能团的化学性质3. CH4中混有CH2=CH2, 欲除去CH2=CH2得到CH4, 最好依次通过哪一组试剂( )A.澄清石灰水、浓硫酸B.KMnO4酸性溶液、浓硫酸C.溴水、浓硫酸D.浓硫酸、KMnO4酸性溶液【答案】C【解析】CH2=CH2能够与溴水发生反应产生1,2-二溴乙烷留在溶液中,若使用KMnO4酸性溶液乙烯会变为CO2气体,而混入了杂质。
而甲烷是不能发生反应,所以通过盛有溴水的洗气瓶就可以除去乙烯,然后再把气体通过盛有浓硫酸的洗气瓶就可以干燥甲烷,从而得到纯净、干燥的甲烷。
因此选项是C。
【考点】考查混合气体中杂质的除去方法的知识。
4.欧盟正考虑在欧盟范围内全面禁止使用塑料袋。
下列有关说法正确的是A.塑料垃圾可直接露天焚烧B.实施“禁塑令”有助于遏制白色污染C.纤维素、油脂、蛋白质均属于有机高分子D.聚丙烯结构式为:【答案】B【解析】A项塑料垃圾直接露天焚烧,会给环境带来污染,错误;B项实施“禁塑令”能有助于遏制白色污染,正确;C项油脂不属于高分子化合物,错误;D项聚丙烯正确的结构简式为,错误。
化学烃类知识点总结

化学烃类知识点总结一、烃的概念与分类。
(一)概念。
烃是仅由碳和氢两种元素组成的有机化合物,也被称为碳氢化合物。
(二)分类。
1. 饱和烃。
- 烷烃。
- 通式为C_nH_2n + 2(n≥slant1)。
- 分子中的碳原子之间都以单键结合成链状,碳原子剩余的价键全部跟氢原子相结合,使每个碳原子的化合价都达到“饱和”。
- 例如甲烷CH_4,是最简单的烷烃,其结构为正四面体,碳原子位于正四面体的中心,四个氢原子位于正四面体的四个顶点。
- 环烷烃。
- 通式为C_nH_2n(n≥slant3)。
- 分子中碳原子之间以单键相互结合成环状结构,其余价键与氢原子结合。
如环己烷C_6H_12。
2. 不饱和烃。
- 烯烃。
- 通式为C_nH_2n(n≥slant2)。
- 分子中含有碳碳双键(C = C)官能团。
例如乙烯C_2H_4,其结构为平面型分子,碳碳双键键能小于碳碳单键键能的两倍,所以双键中有一个键较易断裂。
- 炔烃。
- 通式为C_nH_2n - 2(n≥slant2)。
- 分子中含有碳碳三键(C≡ C)官能团。
如乙炔C_2H_2,是直线型分子,碳碳三键键能小于碳碳单键和碳碳双键键能之和,其中有两个键较易断裂。
- 芳香烃。
- 分子中含有苯环结构的烃。
苯C_6H_6是最简单的芳香烃。
- 苯的结构特点:苯分子中的六个碳原子和六个氢原子都在同一平面上,苯环中的碳碳键是一种介于单键和双键之间的独特的键。
二、烃的物理性质。
(一)状态。
1. 常温常压下,C_1 - C_4的烃为气态,如甲烷、乙烷、丙烷、丁烷(包括正丁烷和异丁烷)。
2. C_5 - C_16的烃一般为液态,如汽油(主要成分是含C_5 - C_11的烃)、煤油(主要成分是含C_11-C_16的烃)等。
3. C_17及以上的烃为固态,如石蜡等。
(二)沸点。
1. 随着碳原子数的增加,烃的沸点逐渐升高。
2. 在碳原子数相同的情况下,支链越多,沸点越低。
例如正戊烷、异戊烷和新戊烷,沸点由高到低的顺序为正戊烷>异戊烷>新戊烷。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无 ___
甲烷、乙烯、苯的比较Fra bibliotek甲烷分子式 结构简式 结构特点 性质
CH4 CH4
乙烯
C2H4
苯
C6H6
正四面体
碳碳双键, 平面四边形
介于单键和双 键之间的一种 特殊的键,平 面正六边形
取代反应
加成反应
取代反应、 加成反应
甲烷、乙烯、苯的比较
甲烷、乙烯、苯与溴反应的比较
试剂 条件 反应类型 产物
苯
主要生成溴苯 ——————— ______ FeBr ________ ____反应 纯液溴 3催化 取代 和溴化氢 ———— _____ 光照
甲烷 ______ 溴蒸气 溴的 _____ CCl4 乙烯 _____ 溶液 _____
生成多种产物 ____反应 ______________ 取代 的混合物 ___________
甲烷 含碳量 燃烧现象 与KMnO4 取代 75%
淡蓝色火焰
乙烯 85.7%
火焰明亮, 有黑烟
苯 92.3%
火焰明亮, 有浓烟
不褪色 光照,纯卤 素气态单质
褪色
不褪色, 分层 纯液溴、浓 硝酸
加成
X2、HX、 H2、H2O
H2
