人教版化学选修三1.1《原子结构》第二节最新课件PPT
合集下载
人教版高中化学选修3-物质结构与性质--第二节-原子结构与元素的性质(第2课时)省公开课获奖课件说课

新课标人教版高中化学课件系列
选修3 物质构造与性质 第一章 原子构造与性质 第二节 原子构造与元素旳性质 第2课时
2024/10/5
1
元素周期律
【教学目旳】
能说出元素电离能、电负性旳涵义, 能应用元素旳电离能阐明元素旳某些 性质。
2024/10/5
2
元素周期律
二、元素周期律
1.定义
元素旳性质随( 核电荷数 )旳递增发生周
3、已知在200C 1mol Na失去1 mol电子需吸收650kJ能
× 量,则其第一电离能为650KJ/mol。 × 4、Ge旳电负性为1.8,则其是经典旳非金属
5、气态O原子旳电子排布为:
× 6、 半径:K+>Cl-
×
√ 7、酸性 HClO4>H2SO4 ,碱性:NaOH > Mg(OH)2
8、第一周期有2*12=2,第二周期有2*22=8,则第五周
D.钾旳第一电离能比镁旳第一电离能大.
K〈Na〈Mg
2024/10/5
16
元素周期律
2、在下面旳电子构造中,第一电离能最小旳
原子可能是 ( C )
A.ns2np3
B.ns2np5
C.ns2np4
D.ns2np6
2024/10/5
17
元素周期律
(三)电负性(阅读课本P18)
1、基本概念
化学键:元素相互化合,相邻旳原子之间产生旳 强烈旳化学作用力,形象地叫做化学键。
(第ⅡA元素和第ⅤA元素旳反常现象怎样解释?) ⅤA半充斥、 ⅡA全充斥构造
2)同主族旳元素自上而下第一电离能逐渐降低。
2024/10/5
12
元素周期律
3、电离能旳意义:
选修3 物质构造与性质 第一章 原子构造与性质 第二节 原子构造与元素旳性质 第2课时
2024/10/5
1
元素周期律
【教学目旳】
能说出元素电离能、电负性旳涵义, 能应用元素旳电离能阐明元素旳某些 性质。
2024/10/5
2
元素周期律
二、元素周期律
1.定义
元素旳性质随( 核电荷数 )旳递增发生周
3、已知在200C 1mol Na失去1 mol电子需吸收650kJ能
× 量,则其第一电离能为650KJ/mol。 × 4、Ge旳电负性为1.8,则其是经典旳非金属
5、气态O原子旳电子排布为:
× 6、 半径:K+>Cl-
×
√ 7、酸性 HClO4>H2SO4 ,碱性:NaOH > Mg(OH)2
8、第一周期有2*12=2,第二周期有2*22=8,则第五周
D.钾旳第一电离能比镁旳第一电离能大.
K〈Na〈Mg
2024/10/5
16
元素周期律
2、在下面旳电子构造中,第一电离能最小旳
原子可能是 ( C )
A.ns2np3
B.ns2np5
C.ns2np4
D.ns2np6
2024/10/5
17
元素周期律
(三)电负性(阅读课本P18)
1、基本概念
化学键:元素相互化合,相邻旳原子之间产生旳 强烈旳化学作用力,形象地叫做化学键。
(第ⅡA元素和第ⅤA元素旳反常现象怎样解释?) ⅤA半充斥、 ⅡA全充斥构造
2)同主族旳元素自上而下第一电离能逐渐降低。
2024/10/5
12
元素周期律
3、电离能旳意义:
人教版高中化学选修三1.1《原子结构》课件 (共106张PPT)

电子排布式
电子排布图
小结:
方法导引
解答基态原子电子排布问题的一般思路:
能量最低原则
确定原子序数 泡利不相容原理 洪特规则
能级排布
电子排布
巩固练习
1、某元素原子序数为24,试问:
(1)该元素电子排布式: 1s2 2s22p6 3s23p63d5 4s1
(2)它有 4 个能层; 7 个能级;占有 15 个原子轨道。 (3)此元素有 6 个未成对电子;它的价电子 数是 6 。
洪特规则
对于基态原子,电子在能量相同 的轨道上排布时,将尽可能分占不同 的轨道并且自旋方向相同。
C :1s2 2s22p2
√
科学研究
C
N
O
1.每个原子轨道上最多能容纳____ 2 个电子, 且自旋方向_______ 不同 ——泡利原理 2.当电子排在同一能级时有什么规律? 当电子排布在同一能级的不同轨道时, 首先单独占一个轨道,而且自旋 总是___________________ 相同 ——洪特规则 方向______
铁Fe: 1s22s22p63s23p63d64s2 钴Co:
;
; ; ;
1s22s22p63s23p63d74s2
镍Ni: 1s22s22p63s23p63d84s2
练习:请写出第四周期21—36号元素原子 的基态电子排布式。
铜Cu:1s22s22p63s23p63d104s1 锌Zn:1s22s22p63s23p63d104s2 ; ;
钠 Na
铝 Al
原子结构示意图
电子排布式
Li: 1s22s1
练一练
请写出4~10号元素原子的电子排布式。
4
铍Be
1s2 2s2
人教版化学选修三第一节原子结构ppt

选修3《物质结构与性质》
.
第一章 原子结构与性质
第一节 原子结构
.
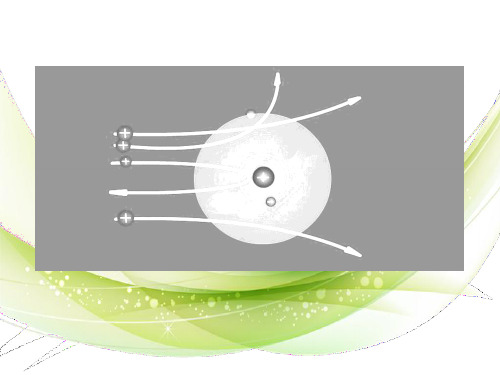
一、原子结构
质子
原子
原子核 中子
核外电子
原子核的体积很小,体积只占原子体积的几千亿分之一 ,电子在原子内有”广阔”的运动空间。核外电子由于 原子核的吸引力绕核做高速运转(光速),那么多电子 的原子核外,电子又是怎样运动的呢?彼此间会不会为 了占领空间而“打架”呢?
低
高
近
远
二、能层与能级
能层
一
二三
四 五六 七
符号n
n=1 n=2 n=3 n=4 n=5 n=6 n=7
最多容纳 电子数
2
8
18
32
50
… …
【学与问】1.原子核外电子的每一个能层最多可容纳 的电子数与能层的序数(n)间存在什么关系?
能层最多可容纳的电子数为2n2个。
二、能层与能级
(2)能级s,p,d,f
3、下列各电子能层中,不包含 d 能级的是 (
) CD
A、N能层 B、M能层 C、L能层 D、K能层
人教版化学选修三第一章第一节-原子 结构54 ppt
人教版化学选修三第一章第一节-原子 结构54 ppt
总结:
①能层的能级数等于该能层序数。 ②任一能层的能级总是从s能级开始。 ③在每一能层中,能级符号与能量大小的顺序是 :ns<np<nd<nf…
分别是1、3、5、7的2
人教版化学选修三第一章第一节-原子 结构54 ppt
倍
人教版化学选修三第一章第一节-原子 结构54 ppt
课堂练习
1、以下能级符号正确的是( AD )
A、6s B、2d C、3f D、7p
.
第一章 原子结构与性质
第一节 原子结构
.
一、原子结构
质子
原子
原子核 中子
核外电子
原子核的体积很小,体积只占原子体积的几千亿分之一 ,电子在原子内有”广阔”的运动空间。核外电子由于 原子核的吸引力绕核做高速运转(光速),那么多电子 的原子核外,电子又是怎样运动的呢?彼此间会不会为 了占领空间而“打架”呢?
低
高
近
远
二、能层与能级
能层
一
二三
四 五六 七
符号n
n=1 n=2 n=3 n=4 n=5 n=6 n=7
最多容纳 电子数
2
8
18
32
50
… …
【学与问】1.原子核外电子的每一个能层最多可容纳 的电子数与能层的序数(n)间存在什么关系?
能层最多可容纳的电子数为2n2个。
二、能层与能级
(2)能级s,p,d,f
3、下列各电子能层中,不包含 d 能级的是 (
) CD
A、N能层 B、M能层 C、L能层 D、K能层
人教版化学选修三第一章第一节-原子 结构54 ppt
人教版化学选修三第一章第一节-原子 结构54 ppt
总结:
①能层的能级数等于该能层序数。 ②任一能层的能级总是从s能级开始。 ③在每一能层中,能级符号与能量大小的顺序是 :ns<np<nd<nf…
分别是1、3、5、7的2
人教版化学选修三第一章第一节-原子 结构54 ppt
倍
人教版化学选修三第一章第一节-原子 结构54 ppt
课堂练习
1、以下能级符号正确的是( AD )
A、6s B、2d C、3f D、7p
人教版高中化学选修三课件:第一章 第二节 第二课时 元素周期律(29张PPT)

电负性
1.电负性 (1)概念 ①键合电子:原子中用于形成 化学键 的电子。 ②电负性:用来描述不同元素的原子对 键合电子 吸引力 的大小。电负性越大的原子,对键合电子的吸引力 越大 。 (2)衡量标准 电负性是由美国化学家 鲍林 提出的,他以氟的电负性为 4.0 作为相对标准,得出了各元素的电负性。
5.已知元素的电负性和原子半径一样,也是元素的一种基本性质,下表给
出14种元素的电负性:
元素 Al B Be C Cl F Li Mg N Na O P S Si
电负 1.5 2.0 1.5 2.5 3.0 4.0 1.0 1.2 3.0 0.9 3.5 2.1 2.5 1.8
1.离子半径大小比较的规律 (1)同种元素的离子半径:阴离子大于原子,原子大于阳离 子,低价阳离子大于高价阳离子。如r(Cl-)>r(Cl),r(Fe)>r(Fe2+) >r(Fe3+)。 (2)电子层结构相同的离子,核电荷数越大,半径越小。如 r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。 (3)带相同电荷的离子,电子层数越多,半径越大。如r(Li+) <r(Na+)<r(K+)<r(Rb+)<r(Cs+),r(O2-)<r(S2-)<r(Se2-)<r(Te2-)。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)电负性是人为规定的一个相对数值,不是绝对标准 ( √ )
(2)元素电负性的大小反映了元素对键合电子引力的大小( √ )
(3)元素的电负性越大,则元素的非金属性越强
ቤተ መጻሕፍቲ ባይዱ
(√ )
(4)同一周期电负性最大为稀有气体元素
人教版化学选修三原子结构课件PPT(55页)

1、 氢元素是宇宙中最丰富的元素。 2、宇宙年龄距今约140亿年,地 球年龄已有46亿年。 3、地球上的元素绝大多数是金属, 非金属仅有22种。
人教版化学选修三原子结构课件PPT(5 5页)
人教版化学选修三原子结构课件PPT(5 5页)
原子的结构
质子
原子核
原子
中子
核外电子
核电荷数=核内质子数=核外电子数
B.C 1s22s22p2
C.He 1s12s1
D.Cl 1s22s22p63s23p5
2.书写下列原子的电子排布式
S Fe Sc V Se Ga Br
3.下列各原子或离子的电子
排布式错误的是( D )
A Al 1s22s22p63s23p1 B O2- 1s22s22p6 C Na+ 1s22s22p6 D Si 1s22s22p2
处于最低能量的原子叫做基态原子
当基态原子的电子吸收能量后, 电子会跃迁到较高能级,变成 激发态原子
不同元素的原子发生跃迁时会吸收 或释放不同的能量 表现为光的形式
用光谱仪摄取 得到各种元素的电子的 吸收光谱或发射光谱
可利用原子光谱上的特征谱线来鉴 定元素,称为光谱分析
课堂练习
1、判断下列表达是正确还是错误 1)1s22p1属于基态; 2)1s22s2 2p63s2 3p63d54s1属于激发态; 3)1s22s2 2p63d1属于激发态; 4)1s22s2 2p63p1属于基态;
1
1s
1
2
2
2s,2p
4
8
3
3s,3p,3d
9
18
4 4s,4p,4d,4f 16
32
n
——
n2
2n2
人教版化学选修三原子结构课件PPT(5 5页)
人教版化学选修三原子结构课件PPT(5 5页)
原子的结构
质子
原子核
原子
中子
核外电子
核电荷数=核内质子数=核外电子数
B.C 1s22s22p2
C.He 1s12s1
D.Cl 1s22s22p63s23p5
2.书写下列原子的电子排布式
S Fe Sc V Se Ga Br
3.下列各原子或离子的电子
排布式错误的是( D )
A Al 1s22s22p63s23p1 B O2- 1s22s22p6 C Na+ 1s22s22p6 D Si 1s22s22p2
处于最低能量的原子叫做基态原子
当基态原子的电子吸收能量后, 电子会跃迁到较高能级,变成 激发态原子
不同元素的原子发生跃迁时会吸收 或释放不同的能量 表现为光的形式
用光谱仪摄取 得到各种元素的电子的 吸收光谱或发射光谱
可利用原子光谱上的特征谱线来鉴 定元素,称为光谱分析
课堂练习
1、判断下列表达是正确还是错误 1)1s22p1属于基态; 2)1s22s2 2p63s2 3p63d54s1属于激发态; 3)1s22s2 2p63d1属于激发态; 4)1s22s2 2p63p1属于基态;
1
1s
1
2
2
2s,2p
4
8
3
3s,3p,3d
9
18
4 4s,4p,4d,4f 16
32
n
——
n2
2n2
化学人教版选修3:1.1《原子结构课件》课件(共76张PPT)

(3)洪特规则
当电子排布在同一能级的不同轨道时,总是优 先单独占据一个轨道,而且自旋方向相同
当同一能级的电子排布为全充满、半充满状态时具 有较低的能量和较大的稳定性
7、轨道表示式
写出基态铜原子的电子排布式、轨道表示式
写出Fe、Fe2+、Fe3+的电子排布式
写出Br、I 电子排布式、轨道表示式、价 电子排布式、价电子轨道表示式
3、原子的构成
原子
{
原子核 { 中子 核外电子
质子
二、核外电子排布规律
1、核外电子的运动特征
①、电子具有波粒二象性,不遵循经典的力学理论, 遵循量子力学规律。 ②、没有固定的运动轨迹,也无法测出某一时刻具 体位置,遵循概率率分布统计规律。
2、能层与能级
(1)能层 在多电子的原子核外电子的能量是不同的,按 电子的能量差异,可以将核外电子分成不同的 能层。
吸收能量 基态原子 激发态原子 释放能量
吸收能量
1s22s22p63s2 (4)原子光谱:
释放能量
1s22s22p63s13p1
不同元素的原子的核外电子发生跃迁时会吸收 或释放不同频率的光,可以用光谱仪摄取各种 元素的电子的吸收光谱或发射光谱,总称为原 子光谱。
锂、氦、汞的发射光谱
锂、氦、汞的吸收光谱
1.一个电子排布为1s22s22p63s23p1的元素最可 能的价态是( ) A +1 B +2 C +3 D -1
2.构造原理揭示的电子排布能级顺序,实质是 各能级能量高低,若以 E 表示某能级的能量, 下列能量大小顺序中正确的是 A.E(3s)>E(2s)>E(1s) B.E(3s)>E(3p)>E(3d) C.E(4f)>E(4s)>E(3d) D.E(5s)>E(4s)>E(4f)
化学选修三《原子结构与元素的性质》PPT课件(原文)

❖ 5、掌握原子半径的变化规律 ❖ 6、能说出元素电离能的涵义,能应用元素的电离
能说明元素的某些性质
❖ 7、进一步形成有关物质结构的基本观念,初步认 识物质的结构与性质之间的关系
❖ 8、认识主族元素电离能的变化与核外电子排布的 关系
❖ 9、认识原子结构与元素周期系的关系,了解元素 周期系的应用价值
(G)碱 酸 s区、d区、ds区的元素最外层电子数为1-2个电子,在反应中易失去,所以都是金属。
最高价氧化物对应的水化物的酸性逐渐
;
(横行) 第6周期:32 种元素 查阅资料,比较锂和镁在空气中燃烧的产物,铍和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸性的强弱,说明对角线规则,并用这
些元素的电负性解释对角线规则。
元素(除第一周期外)是 __碱_金__属___, 1、进一步认识周期表中原子结构和位置、价态、元素数目等之间的关系
试确定32号元素在周期表中的位置。 d区元素:包含第IIIB族到VIII族元素。
最外层电
子排布为_n_s____,每一周期的最后一种元素都 1 每个纵行的价电子层的电子总数是否相等?主族元素的价电子数和族序数有何关系?
样多,而是随着周期序号的递增渐渐增多。
元素周期系周期发展像螺壳上的螺旋
一、原子结构与元素周期表
1. 为什么副族元素又称为过渡元素?
副族元素处于金属元素向非金属元素过渡的 区域,因此,又把副族元素称为过渡元素。
2.为什么在元素周期表中非金属元素主要集中在右上角 三角区内(如图)?处于非金属三角区边缘的元素常被 称为半金属或准金属。为什么?
镧 La – 镥 Lu 共15 种元素称镧系元素 已知一元素的价层电子结构为3d54s2,试确定其在周期表中的位置。
电负性相差不大的两种非金属元素化合,通常形成共价键;
能说明元素的某些性质
❖ 7、进一步形成有关物质结构的基本观念,初步认 识物质的结构与性质之间的关系
❖ 8、认识主族元素电离能的变化与核外电子排布的 关系
❖ 9、认识原子结构与元素周期系的关系,了解元素 周期系的应用价值
(G)碱 酸 s区、d区、ds区的元素最外层电子数为1-2个电子,在反应中易失去,所以都是金属。
最高价氧化物对应的水化物的酸性逐渐
;
(横行) 第6周期:32 种元素 查阅资料,比较锂和镁在空气中燃烧的产物,铍和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸性的强弱,说明对角线规则,并用这
些元素的电负性解释对角线规则。
元素(除第一周期外)是 __碱_金__属___, 1、进一步认识周期表中原子结构和位置、价态、元素数目等之间的关系
试确定32号元素在周期表中的位置。 d区元素:包含第IIIB族到VIII族元素。
最外层电
子排布为_n_s____,每一周期的最后一种元素都 1 每个纵行的价电子层的电子总数是否相等?主族元素的价电子数和族序数有何关系?
样多,而是随着周期序号的递增渐渐增多。
元素周期系周期发展像螺壳上的螺旋
一、原子结构与元素周期表
1. 为什么副族元素又称为过渡元素?
副族元素处于金属元素向非金属元素过渡的 区域,因此,又把副族元素称为过渡元素。
2.为什么在元素周期表中非金属元素主要集中在右上角 三角区内(如图)?处于非金属三角区边缘的元素常被 称为半金属或准金属。为什么?
镧 La – 镥 Lu 共15 种元素称镧系元素 已知一元素的价层电子结构为3d54s2,试确定其在周期表中的位置。
电负性相差不大的两种非金属元素化合,通常形成共价键;
人教版高中化学选修三第一章第一节 原子结构 课件(共54张PPT)
二、10电子微粒和18电子微粒 1.10电子微粒
【典例3】 已知A、B、C、D四种物质分别是由短周 期元素组成的微粒,它们之间有如图所示的转化关系,且A 是一种含有18电子的微粒,C是一种含有10电子的微粒。请 完成下列各题:
(1)若A、D分别是两种气态单质分子,写出A与B反应的 化学方程式:________________;
是O2置换H2S中的S。问题(4)中H、O形成的原子个数为1:1 的化合物是H2O2,N、H形成的化合物分子中电子数也为18 的分子只能是N2H4。
[答案] (1) (2)X(或氧) 2H2S+O2===2H2O+2S↓ (3)NH4HSO4
点燃 (4)N2H4+2H2O2=====N2+4H2O
2.(2012·长沙模考)下列有关化学用语使用正确的是 ()
A.硫原子的结构示意图: B.11H2、12H2、31H2是氢的三种同位素 C.原子核内有10个中子的氧原子:188O D.金刚石和石墨、甲烷和乙烷都属于同素异形体
解析 硫原子的结构示意图应为
A项错误。同位
素的研究对象是原子,但B选项中三种粒子是氢的单质,故
(4)若D是一种含有22个电子的分子,则符合如图关系的 A的物质有________(写化学式,如果是有机物则写相应的结 构简式)。
[解析] 本题把指定电子数目的有关微粒作为命题素 材,着重考查考生的有序思维能力。寻找10电子、18电子、 22电子微粒,必须从元素周期表出发,遵循由原子到分子, 再到离子的思考途径,列出相应的微粒。关于18电子微粒的 推断,对有序思维的要求更高,技巧性更强,我们可以以推 断10电子微粒的思路来进行分析,对数字18作一拆分,把18 拆成9+9,找出F2后会使18电子微粒的推断打开一个大“空
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例1 若某基态原子的外围电子排布为
B 4d15s2,则下列说法正确的是( )
A.该元素基态原子中共有3个电子 B.该元素原子核外有5个电子层 C.该元素原子最外层共有3个电子 D.该元素原子M能层共有8个电子
例3 下列粒子中,电子排布式为
AC 1s22s22p63s23p6的有(
)
A.Sc3+ B.Mg2+ C.Cl- D.Br-
的能量处于最低状态,简称能量最低原理。
2、基态原子与激发态原子
处于最低能量的原子叫做基态原子,当基态 原子的电子吸收能量后,电子会跃迁到较高能 级,变成激发态原子。
[跟进练习] 根据下列电子排布,处于 激发态的原子是( C )
A.1s22s22p1 B.1s22s22p63s23p4
C.1s22s12p1 D.1s22s22p4
随原子核电荷数递增,原子核外电子 的排布遵循如左图的排布顺序,填满一个 能级再添一个新能级。这个排布顺序被称 为构造原理。
2.电子排布式
能层序数
能级符号
该能级上排布 的电子数
Na: 1s22sK22pL63s1 M
Fe: 1s22sK22pL63s23p6M3d64sN2
注:书写电子排布式时,能层低的能级写在左边,不能按填充顺序 写(电子按能量由低到高顺序填充,遵循构造原理)
C.E(5s)>E(4f)>E(4s)>E(3d)
D.E(5s)>E(4s)>E(4f)>E(3d)
学生阅读见课本P7-8
1、什么是能量最低原理? 2、什么是基态原子、激发态原子?
它们如何转化? 3、什么是光谱?光谱分析?
归纳总结
四、能量最低原理、基态与激发态、光谱
1、能量最低原理 原子的电子排布遵循构造原理能使整个原子
ns < (n-2)f < (n-1)d < np (n为能层序数)
3.简化电子排布式 如: Na:1s22s22p63s1
简化为
[Ne]3s1
表示钠的内层电子排布与稀有气体 元素Ne的核外电子排布相同 试写出8号、14号、26号元素的简化排布式吗?
外围电子排布(价电子排布式)
价电子:即能够影响元素化合价的电子。 主族元素:价电子即为最外层电子。 过渡元素:将过渡元素原子的电子排布式中符
C. He 1s12s1
D. Cl 1s22s22p63s23p5
5.书写 Kr Br 电子排布式;
6.下列各原子或离子的电子排
布式错误的是( D )
A. Al 1s22s22p63s23p1 B. O2- 1s22s22p6 C. Na+ 1s22s22p6 D. Si 1s22s22p2
课后巩 固 练 习
复习回忆
1、原子核外的电子的每一个能层最多可容纳的电子 数与能层的序数间有什么关系?
2n2
2、不同的能层分别有多少个能级?与能层的序数间
有什么关系?
能层序数=能级个数
3、英文字母相同的不同能级中所容纳的电子数是否
相同?各级上所能容纳的电子数分别是多少?
相同.如:1s2 2s2 3s2
分别是1、3、5、7的2 倍
1、1~36号元素的原子核外电子排布式 2、1~36号元素原子简化核外电子排布式
第一章原子结构与性质
第一节原子结构 (第三课时)
复习回忆
一、构造原理: 1、不同层不同能级可由下面的公式得出: ns < (n-2)f < (n-1)d < np (n为能层序数)
2.电子排布式
3.简化电子排布式
例题解析
3、基态、激发态相互转化与Байду номын сангаас量的关系
基态原子
吸收能量
激发态原子
释放能量
①光(辐射)是电子释放能量的重要形式之一;
②在日常生活中,我们看到的许多可见光, 如灯光、霓虹灯光、激光、焰火等都与原子 核外电子发生跃迁释放能量有关。
4、光谱与光谱分析
(1)光谱:不同元素的原子发生跃迁时会吸收 或放出不同的光,可以用光谱仪摄取各种元素的 电子吸收光谱或发射光谱,总称原子光谱。
合稀有气体的原子电子排布式的部分省略掉 后剩余的式子。
试写出8号、14号、26号元素的价电子排布式吗?
按能量由低到高的顺序排列,正确的一组是
(C )
A.1s、2p、3d、4s B.1s、2s、3s、2p
C.2s、2p、3s、3p D.4p、3d、4s、3p
4.下列各原子的电子排布正确的是
BD
A. Be 1s22s12p1 B. C 1s22s22p2
课堂练习
1、以下能级符号正确的是( AD )
A、6s B、2d C、3f D、7p
2、若n=3,以下能级符号错误的是( B )
A.n p B.n f C.n d D.n s
3、下列各电子能层中,不包含 d 能级的是
(CD)
A、N能层 B、M能层 C、L能层 D、K能层
探究一
1、知道了原子核外电子的能层和能级可容 纳的最多电子数,是否就可以得出各种原 子的电子排布规律呢?
2、如果原子的核外电子完全按能层次序排 布,填满一个能层再开始填下一个能层。 那钾原子的电子排布为什么不是2、8、9, 而是2、8、8、1?
阅读课本P6
三、构 造 原 理
1、构造原理
电子填充的先后顺序 (构造原理)
1s2s2p3s3p4s3d4p5s 4d5p6s 4f5d6p7s5f6d7p
……
电子填入轨道次序图
第一能级组 1s
第二能级组 2s
2p
能量相近的 能级划为一 组,称为能级
组
第三能级组 3s
3p
第四能级组 4s 3d 4p
第五能级组 5s 4d 5p
第六能级组 6s 4f 5d 6p
第七能级组 7s 5f 6d 7p
通式:ns、(n-2)f、(n-1)d、np
课堂练习
写出下列元素基态原子的电子排布式:
例4 下列化学用语,不能表示氯离子的是
(B) A.Cl- B.
C.
D.1s22s22p63s2 3p6
例5 构造原理揭示的电子排布能级顺序,实质是
AB 各能级能量高低。若以E(nl)表示某能级的能量,以下
各式中正确的是( )
A.E(4s)>E(3s)>E(2s)>E(1s)
B.E(3d)>E(4s)>E(3p)>E(3s)
1、C 3、Si 5、Ti 7、Br 9、Cs
2、O 4、P 6、Mn 8、As 10、I
构造原理中排布顺序的实质
------各能级的能量高低顺序 1)相同能层的不同能级的能量高低顺序 :
ns<np<nd<nf 2)英文字母相同的不同能级的能量高低顺序:
1s<2s<3s<4s;2p<3p<4p; 3d<4d 3) 不同层不同能级可由下面的公式得出:
B 4d15s2,则下列说法正确的是( )
A.该元素基态原子中共有3个电子 B.该元素原子核外有5个电子层 C.该元素原子最外层共有3个电子 D.该元素原子M能层共有8个电子
例3 下列粒子中,电子排布式为
AC 1s22s22p63s23p6的有(
)
A.Sc3+ B.Mg2+ C.Cl- D.Br-
的能量处于最低状态,简称能量最低原理。
2、基态原子与激发态原子
处于最低能量的原子叫做基态原子,当基态 原子的电子吸收能量后,电子会跃迁到较高能 级,变成激发态原子。
[跟进练习] 根据下列电子排布,处于 激发态的原子是( C )
A.1s22s22p1 B.1s22s22p63s23p4
C.1s22s12p1 D.1s22s22p4
随原子核电荷数递增,原子核外电子 的排布遵循如左图的排布顺序,填满一个 能级再添一个新能级。这个排布顺序被称 为构造原理。
2.电子排布式
能层序数
能级符号
该能级上排布 的电子数
Na: 1s22sK22pL63s1 M
Fe: 1s22sK22pL63s23p6M3d64sN2
注:书写电子排布式时,能层低的能级写在左边,不能按填充顺序 写(电子按能量由低到高顺序填充,遵循构造原理)
C.E(5s)>E(4f)>E(4s)>E(3d)
D.E(5s)>E(4s)>E(4f)>E(3d)
学生阅读见课本P7-8
1、什么是能量最低原理? 2、什么是基态原子、激发态原子?
它们如何转化? 3、什么是光谱?光谱分析?
归纳总结
四、能量最低原理、基态与激发态、光谱
1、能量最低原理 原子的电子排布遵循构造原理能使整个原子
ns < (n-2)f < (n-1)d < np (n为能层序数)
3.简化电子排布式 如: Na:1s22s22p63s1
简化为
[Ne]3s1
表示钠的内层电子排布与稀有气体 元素Ne的核外电子排布相同 试写出8号、14号、26号元素的简化排布式吗?
外围电子排布(价电子排布式)
价电子:即能够影响元素化合价的电子。 主族元素:价电子即为最外层电子。 过渡元素:将过渡元素原子的电子排布式中符
C. He 1s12s1
D. Cl 1s22s22p63s23p5
5.书写 Kr Br 电子排布式;
6.下列各原子或离子的电子排
布式错误的是( D )
A. Al 1s22s22p63s23p1 B. O2- 1s22s22p6 C. Na+ 1s22s22p6 D. Si 1s22s22p2
课后巩 固 练 习
复习回忆
1、原子核外的电子的每一个能层最多可容纳的电子 数与能层的序数间有什么关系?
2n2
2、不同的能层分别有多少个能级?与能层的序数间
有什么关系?
能层序数=能级个数
3、英文字母相同的不同能级中所容纳的电子数是否
相同?各级上所能容纳的电子数分别是多少?
相同.如:1s2 2s2 3s2
分别是1、3、5、7的2 倍
1、1~36号元素的原子核外电子排布式 2、1~36号元素原子简化核外电子排布式
第一章原子结构与性质
第一节原子结构 (第三课时)
复习回忆
一、构造原理: 1、不同层不同能级可由下面的公式得出: ns < (n-2)f < (n-1)d < np (n为能层序数)
2.电子排布式
3.简化电子排布式
例题解析
3、基态、激发态相互转化与Байду номын сангаас量的关系
基态原子
吸收能量
激发态原子
释放能量
①光(辐射)是电子释放能量的重要形式之一;
②在日常生活中,我们看到的许多可见光, 如灯光、霓虹灯光、激光、焰火等都与原子 核外电子发生跃迁释放能量有关。
4、光谱与光谱分析
(1)光谱:不同元素的原子发生跃迁时会吸收 或放出不同的光,可以用光谱仪摄取各种元素的 电子吸收光谱或发射光谱,总称原子光谱。
合稀有气体的原子电子排布式的部分省略掉 后剩余的式子。
试写出8号、14号、26号元素的价电子排布式吗?
按能量由低到高的顺序排列,正确的一组是
(C )
A.1s、2p、3d、4s B.1s、2s、3s、2p
C.2s、2p、3s、3p D.4p、3d、4s、3p
4.下列各原子的电子排布正确的是
BD
A. Be 1s22s12p1 B. C 1s22s22p2
课堂练习
1、以下能级符号正确的是( AD )
A、6s B、2d C、3f D、7p
2、若n=3,以下能级符号错误的是( B )
A.n p B.n f C.n d D.n s
3、下列各电子能层中,不包含 d 能级的是
(CD)
A、N能层 B、M能层 C、L能层 D、K能层
探究一
1、知道了原子核外电子的能层和能级可容 纳的最多电子数,是否就可以得出各种原 子的电子排布规律呢?
2、如果原子的核外电子完全按能层次序排 布,填满一个能层再开始填下一个能层。 那钾原子的电子排布为什么不是2、8、9, 而是2、8、8、1?
阅读课本P6
三、构 造 原 理
1、构造原理
电子填充的先后顺序 (构造原理)
1s2s2p3s3p4s3d4p5s 4d5p6s 4f5d6p7s5f6d7p
……
电子填入轨道次序图
第一能级组 1s
第二能级组 2s
2p
能量相近的 能级划为一 组,称为能级
组
第三能级组 3s
3p
第四能级组 4s 3d 4p
第五能级组 5s 4d 5p
第六能级组 6s 4f 5d 6p
第七能级组 7s 5f 6d 7p
通式:ns、(n-2)f、(n-1)d、np
课堂练习
写出下列元素基态原子的电子排布式:
例4 下列化学用语,不能表示氯离子的是
(B) A.Cl- B.
C.
D.1s22s22p63s2 3p6
例5 构造原理揭示的电子排布能级顺序,实质是
AB 各能级能量高低。若以E(nl)表示某能级的能量,以下
各式中正确的是( )
A.E(4s)>E(3s)>E(2s)>E(1s)
B.E(3d)>E(4s)>E(3p)>E(3s)
1、C 3、Si 5、Ti 7、Br 9、Cs
2、O 4、P 6、Mn 8、As 10、I
构造原理中排布顺序的实质
------各能级的能量高低顺序 1)相同能层的不同能级的能量高低顺序 :
ns<np<nd<nf 2)英文字母相同的不同能级的能量高低顺序:
1s<2s<3s<4s;2p<3p<4p; 3d<4d 3) 不同层不同能级可由下面的公式得出:
