波谱分析第三章CNMR谱
有机波普解析 第三节 碳谱的应用(13C NMR)

CH3×2
COOH s
C-OH
s
178.6
71.6
28.1
化合物C4H6O2,根据如下13C NMR谱图确定结构。
Shift 173.7 136.1 128.0 17.6 Mult. s s t q
COOH C= CH2= CH3
O HO C
CH3 C CH2
化合物C7H14O,根据如下 NMR谱图确定结构。
Shift 180.8 33.8 26.8 22.4 13.58 Mult. s t t t q
COOH CH2 CH2 CH2 CH3 CH3CH2CH2CH2COOH
化合物C6H10O ,根据如下13C NMR谱图确定结构. O
CH3 CH CH CH2 C
16.7 123.9 130.6 49.4 207.1
CH3
24.9
HC=CH CH2 C=O
CH3 CH3
化合物C5H7O2 N,根据如下13C NMR谱图确定结构.
CH3
C=O
C
CH2-O
N
CH2
9.4 H 3C 18.32
27.4 CH2 O O O
O C 59.9 CH 2 O
51.3 CH 2 15.41 CH 2 C 21.50 CH2 57.40 CH2 N 11.69 CH3 12.40 CH3 C N
第三节 碳谱的应用
碳谱的应用
13C
NMR的解析步骤与1H NMR类似,
首先要排除溶剂峰和杂质峰,重要的是不
要遗漏谱图中季碳等的谱峰。
例题1 按给出结构对图上各个碳信号进行归属
C2、C6、C3、C5
C1
C9
C8 C4 C10
成都中医药大学-波谱分析课件第三章NMR-3
CH2OH
4''''
2''''
3''
6''
4'' 10''
5''
CH3OOC1 HO
CH
2 9'
1'
O
8' 7'
2'''
2' 1'''
3'
OH
3'''
OH
4'''
5''' 6'''
6'
10'
5'
4'
OH O
OH
CH
1''
OH 1''''
O 2''
9''
8''
7''
CH2OH
3'''' 4'''' 2''''
❖ 6,推出结构单元,并进一步组合成若干可能的 结构式)(注意估算δ值)
❖ 7,对推出的结构进行指认归属验证 ❖ 8,当有氢谱时,应把氢谱和碳谱结合起来一起
分析
❖ 例3.9
❖ C8H10O2 ❖ 1,不饱和度 ❖ 2,对称性 ❖ 3,C的分区 ❖ 4,C的级数 ❖ 5,推出结构单元 ❖ 6,归属验证
❖ 13C-1H之间的偶合常数很大,且裂分数遵 守n+1规律。 1J ≈ 120-250Hz 2J ≈ 0-60Hz 3J ≈ 10Hz
有机化合物波谱解析第三章 核磁共振(NMR)

• 目的要求 • 1. 掌握核的能级跃迁与电子屏蔽效应的关系以及
影响化学位移的主要因素,能根据化学位移值初步 推断氢或碳核的类型 • 2. 掌握磁不等同的氢或碳核、1H-NMR谱裂分情况、 偶合常数
• 3. 掌握低级偶合中相邻基团的结构特征,并能初 步识别高级偶合系统
• 4. 掌握常见13C-NMR谱的类型及其特征 • 5. 熟悉发生核磁共振的必要条件及其用于有机化
合物结构测定的基本原理
• 6. 了解脉冲傅立叶变换核磁共振测定方法的原理 • 7. 了解1H-NMR及13C-NMR的测定条件以及简化图谱
的方法,并能综合应用图谱提供的各种信息初步判 断化合物的正确结构
主要内容
• 1. 核磁共振原理 • 2. 核磁共振仪器 • 3. 氢核磁共振(1H-NMR) • 碳核磁共振(13C-NMR) •
然而,要给出尖锐的NMR峰,以提高分 辨率,需要驰豫时间长,互相矛盾,最佳 半衰期范围在0.1-1秒,相应的谱线宽度为 1cps。
4)核的进动与核的共振
质子在外加磁场作用下,产生怎样的动力方式呢? E=μHB0
ΔE0
E=-μHB0 HB00 陀螺在与重力作用方向吸偏差时,就产生摇头动力, 称为进动。核磁矩在静磁场环境中围绕B0以ω角频 率进动,称之为拉摩尔(Larmor)进动.
• BN = B0 - ·B0
• BN = B0·(1 - ) • 氢核外围电子云密度的大小,与其相邻
原子或原子团的亲电能力有关,与化学 键 子 高 ·B的 云 场0亦类密;小C型度H;有大3-共关,O,振。·氢吸B如0核收大CH外出,3-围现共Si电振在,子吸低氢云收场核密出。外度现围小在电,
B0
二、产生核磁共振的必要条件
[核磁共振共振波谱学讲义]第三章—NMR实验技术基础(2数据采集)
![[核磁共振共振波谱学讲义]第三章—NMR实验技术基础(2数据采集)](https://img.taocdn.com/s3/m/fef85b9d51e79b8968022696.png)
第三章 NMR 实验技术基础2 数据采集在现代脉冲Fourier 变换核磁谱仪上,核磁矩在一系列脉冲作用下产生横向磁化,横向磁化围绕外磁场进动并在探头的检测线圈中产生感生电流,经放大及ADC 数字化后记录下来。
这种时域信号称为FID(free-induction decay)或interferogram 。
前者专门指检测线圈中检测到的信号,后者既可指FID ,也可指多维谱中间接维中检测的信号。
数字化的FID 通常经Fourier 变换产生对应的频域信号即通常意义上的核磁共振谱,数字化处理是现代脉冲Fourier 变换核磁谱仪的一个典型特征。
a 采样定理在信号处理中最常用也最容易实现的是周期采样,即采样的时间间隔固定。
记时间间隔为∆t,有著名的采样定理:若一个连续时域信号的最高频率成分的频率不超过f c ,则周期采样信号系列S(k ∆t)能再现原信号的条件是:12∆t f c ≥ 通常称f tn =12∆为Nyquist frequency 换一种说法,采样频率不能低于信号最高频率的2倍。
(1) 满足采样定理时,原信号可由离散信号系列S(k ∆t)复原:s t S k t c ft k t n k ()()sin {()}=-=-∞∞∑∆∆2π 此处sin ()sin()c x x x =可检测到的最高信号频率为±采样频率/2,其间隔称为谱宽: SW f tn ==21∆ (2) 当信号频率超过Nyquist 频率时,将产生折叠现象(folding/aliasing),在频谱上表现为谱宽范围内的一个信号,如:当时域信号为复数系列时:两个频率成分νν02=+mf n a 与νa 在频谱上出现在同一位置. 前者的时域信号为:Ae Ae Ae Ae Ae Ae Ae Ae Ae i t i t i t i mf t i mf t i t i m i t i t n a n a a a ωθπνθπνθπνθππνθππνθπνθ++++++++======22222222220()这正是后者的时域信号,因而两种频率成分在时域的离散采样不可区分,也就是说,一个离散时间系列变换到的频谱具有有限带宽。
波谱解析-CNMR

四、弛豫时间
2、 T1与分子结构的关系
(1) C上直接连H数(N)对T1的影响---N多,T1小。
T1值的大小与分子内部运动有关,在刚性分子中,
偶合常数
•
共振峰面积
弛豫时间
二、化学位移 1 影响化学位移的因素
(1)碳键的杂化程度 p171
杂化方式
碳类型
sp3
烷基C
sp
炔基C
烯基C sp2
羰基C
化学位移 (ppm)
0~50(0~60)
磁场 高
50~80(60~90)
100~150
160~210
低
(150~220)
二、化学位移 1 影响化学位移的因素
• 3、测定时间长,因此要求仪器稳定性好,并 有脉冲傅里叶变换装置。
• 4、 吸收峰强度一般不能代表C原子数目,即 不成严格的比例关系,但是当2个C原子等价 而峰重叠时,峰高亦随C原子数增加而明显地 增加。
• (三)13C–NMR波谱的参数 •
1H–NMR:
13C–NMR :
化学位移
化学位移
•
偶合常数
3 13C与13C的偶合
4 13C与F、P的偶合
四、弛豫时间
1 定义 核磁共振时,处于低能级的原子核吸收射频能 量,跃迁到高能级,当处于高、低能级核的数目 相等时,则不再发生能量吸收,这种现象称为饱 合。但事实上,处于高能级的原子核可通过不同 的途径释放出能量返回到低能级,这种能量转移 过程称弛豫。
有机波谱NMR2010-3,4-CNMR

邻近基团的各向异性效应
– 异丙基上的两个甲基
• 与手性碳原子相连,受到较大的各向异性效应的影 响,碳的化学位移差别较大
• 与非手性碳原子相连,受各向异性的影响较小,其 化学位移的差别也较小
β和γ位置上碳核屏蔽降低
酰胺、酰基卤化物、醚和酐:在所有情况下的
屏蔽都大于母体酸
醋酸中的-CH3 氢被-CH3取代:羧基13C信号出
现在低场,δ值较高
13C-NMR的取代基位移
-OH的甲基化位移
– 无论醇、酚-OH,甲基化后,α-C低场位移,β-C高场 位移
-3.1
H3CO R
-2.9 +9.2
– 大环环烷
• (CH2)16δC:26.7 • 环烷中有苯环:各C受到不同的 屏蔽或去屏蔽, 在苯环平面上
方屏蔽区的δC可达26.2。
H键 使>C=O的电子云↓,δC↑ 缺电子效应 如果碳带正电荷,即缺少电子,屏蔽
作用大大减弱,化学位移处于低场。
叔丁基正碳离子的δC达到327.8; 由于存在共振,羰基的δC处于较低场。
H3CO R
+10.5
OCH 3
R
-4.5 +3.7
H3CO R CH2 R R
+3.3 -3.0 -0.8 -1.0
- OH的酰化位移
– 醇-OH: α-C低场位移,β-C高场位移
– 酚-OH: α-C高场位移,β-C低场位移
-3.9
AcO R
-3.4 +3.6
AcO R
+2.4
波谱分析第三章CNMR谱

δc的大小为:δ双键碳>δ三键碳>δ饱和碳
范围:120~240 70~110 -20~100
2.碳原子的电子云密度
碳的化学位移与其核外围电子云密度有关,核 外电子云密度增大,屏蔽效应增强,δc值向 高场位移。
①碳正离子δc值出现在较低场是由于碳正离 子电子短缺,强烈去屏蔽作用所致。如:
② 共轭效应
3.取代烷烃的δc的计算公式 δc(i)=对应烷烃的δc+∑取代基参数 注意取代类型:正取代和异取代的区别
取代基参数请见教材141也表5-4 4.环烷烃及其衍生物
当环烷烃有环张力时,δc位于较高场,五元 环以上的环烷烃,δc都在26ppm左右。
相应的杂环化合物,由于受杂原子电负性的影 响,δc低场位移。
请看下面的例子:
共轭双键化合物,中间碳原子因键级减小, δc值减
小,移向高场。例如,在丁二烯分子中,如果只考虑 取代基的诱导效应,乙烯基应大于乙基,丁二烯的C2 化学位移值应大于140.2ppm,而实际上由于共轭效 应使C2的化学位移向高场移动,为137.2ppm。
③诱导效应
与电负性取代基相连,使碳核外围电子云密 度降低,δc值增大,向低场位移,取代基电 负性愈大,低场位移愈明显。如:
用时,将恢复羰基原来的δc值。例如,苯乙 酮的羰基碳的δc值为195.7ppm,当邻位有甲 基取代时,降低了羰基与苯环的共轭程度,使 羰基碳的δc值向低场移动;当邻二甲基取代 时,由于空间阻碍,羰基与苯环难以继续处于 同一平面,破坏了共轭作用,使羰基恢复到普 通酮的δc值为205.5ppm(如丙酮206.7ppm)。
13C-1H偶合常数 1JCH的大小一般在120到 300Hz范围,决定 1JCH值大小的最重要因素是 C-H键的s电子成分,近似有:
成都中医药大学-波谱分析课件第三章NMR-2

❖ CH2上的两个H的化学等价性 ❖ X-CH2CH2-Y ❖ X-CH2CHYZ (与手性C相连的CH2,化学不等价)
3,环的翻转导致的化学等价:
常温下翻转,等价 (与固定环区别)
常见的化学不等价情况
1,单键不能快速旋转时,同碳上的两个相同基 团不是化学等价的。特别是带有双键性质的单键
❖ 1,化学不等价,一定是磁不等同的。 ❖ 2,化学等价,不一定磁等同 ❖ A,化学等价,磁等同的情况
CH3CH2OH CH3CH2O CH2CH3
❖ B,化学等价,磁不等同的情况
Ha
ba
F1 c
X
c
b
bˊ
Hb
F2
bˊ aˊ
a
aˊ
N
常见的自旋系统
❖核磁共振氢谱谱图的分类 (低级偶合:一级谱图 高级偶合: 二级谱图) ❖自旋系统的分类与命名 ❖常见的自旋系统
7.450
7.400
7.350
7.300
7.250
7.200
7.150
7.100
7.050
7.000
4.偶合常数 J
偶合使得吸收信号裂分为多重峰,多重峰中 相邻两个峰之间的距离称为偶合常数(J),单 位为赫(Hz)。
J的数值大小表示两个质子间相互偶合(干 扰)的大小,可判断化合物片断的结构。
Ha Ha Hb
3Jaaˊ(180o ) 8~12Hz 3Jaeˊ(60o) 或 3Jeaˊ 2~4Hz 3Jeeˊ (60o) 1~3Hz ~ 2.5Hz
烯烃
用于判断烯烃取代基的位置
远程偶合
超过叁键的偶合称之远程偶合。 远程偶合(4J, 5J)的偶合常数一般较小, 在0 ~ 2Hz 范围。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.3
13C-NMR谱中的偶合现象
及各种去偶方法
3.3.1 碳谱中的偶合现象 1. 13C -1H偶合 13C -1H偶合为碳谱中最重要的偶合作用, 偶合作用的大小用 1J表示,除此之外还有 13C -1H的远程偶合。另外还存在13C -13C的偶 合,但可以忽略,为什么? 由于磁旋比的差别,CHn基团是典型的AXn体 系。
5.烯烃及其衍生物 烯烃碳的化学位移估算:(P144表5-7) δ c=123.3+∑取代基参数+空间校正项 6.炔烃及其衍生物 炔烃碳的化学位移估算:(P145表5-8,9) δ c=71.9+∑取代基参数 7.苯环碳的δ c的估算:(P146表5-10) δ c=128.5+∑取代基参数
1JCH的应用
3.2.4.1烷烃 1.开链烷烃第i个13C原子的δ c(i)的加合公式 δ c(i)=-2.6+9.1nα+9.4nβ-2.5nγ +0.3nδ 例如:正己烷 CH3CH2CH2CH2CH2CH3 δ c1=13.7(13.7) δ c2=22.8(22.8) δ c3=31.9(31.9) 2.支链烷烃第i个13C原子的δ c(i)的计算公式 在开链烷烃的计算公式基础上加校正项(S) 校正项(S)请参见教材140页表5-3
13C-1H偶合常数 1JCH的大小一般在120到 300Hz范围,决定 1JCH值大小的最重要因素是
C-H键的s电子成分,近似有: 1J =5 × (s﹪) CH (s﹪)为C-H键的s电子所占的百分数 1J=125Hz 例如:CH4 (sp3,s﹪=25) CH2=CH2(sp2,s﹪=33) 1J=157Hz 1J=159Hz C6H6 (sp2,s﹪=33) 1J=249Hz CH≡CH(sp,s﹪=50)
⑤增加核磁共振碳谱灵敏度最经济和最有效的 方法是脉冲Fourier变换技术(PFT)与各种 去偶技术相结合。 3.1.2 13C-NMR的特点: 1.化学位移范围宽(0~250); 2. 13C-NMR给出不与氢相连的碳的共振吸收 峰; 3.碳原子的驰豫时间较长; 驰豫时间主要指T1, T1从几毫秒到几百秒, 且能被准确测定。由于不同结构类型的13C核 其T1时间不同,从而有助于推断结构。
ቤተ መጻሕፍቲ ባይዱ
3.取代烷烃的δ c的计算公式 δ c(i)=对应烷烃的δ c+∑取代基参数 注意取代类型:正取代和异取代的区别 取代基参数请见教材141也表5-4 4.环烷烃及其衍生物 当环烷烃有环张力时,δ c位于较高场,五元 环以上的环烷烃,δ c都在26ppm左右。 相应的杂环化合物,由于受杂原子电负性的影 响,δ c低场位移。 烷基取代基的引入,使环烃的α-碳,β-碳的δ 值低场位移,γ -碳的δ 值高场位移。
其中有关羰基碳对结构决定尤为有用,各种羰 基碳的化学位移如下: 酮类:188~288ppm 醛类:185~208ppm 酸类:165~182ppm 酯与酰胺:155~180ppm
3.2.4 13C化学位移经验式的估算。
影响13C化学位移的因素很多,理论计算还不 够完善,核磁共振碳谱的解析往往比氢谱更为 困难。在进行未知物的鉴定,标识碳谱峰时, 常采用一些经验的计算方法。这些方法都是根 据已经累积的13C化学位移资料,归纳整理后, 找出的预测δ c的经验规律。
例如1: 13C屏蔽与电子激发能的关系
烷烃碳 10 10~50 芳烃和烯烃碳 8 100~150 羰基碳 7 150~220
电子激发能 ΔE/eV δ c/ppm
2.π电子密度的影响
N
N
N
3.2.2 影响13C化学位移的主要因素 1.碳的杂化轨道 碳的杂化在很大程度上决定13C的化学位移的 范围。不同碳核杂化的屏蔽常数大小为: σ sp2<σ sp<σ sp3
δ c的大小为:δ
双键碳>δ 三键碳>δ 饱和碳
范围:120~240
70~110
-20~100
2.碳原子的电子云密度 碳的化学位移与其核外围电子云密度有关,核 外电子云密度增大,屏蔽效应增强,δ c值向 高场位移。 ①碳正离子δ c值出现在较低场是由于碳正离 子电子短缺,强烈去屏蔽作用所致。如:
4.其它影响 ①溶剂的影响:不同溶剂测试的碳谱,其δ c 值改变在几个ppm到十几个ppm。 ②氢键的影响:氢键的形成使C=O中碳核的电 子云密度降低,δ c值低场位移。 ③温度的影响:温度的改变可使δ c值有几个 ppm的位移。当分子有构型、构象变化或有交 换过程时,谱线的数目、分辨率、形状都将随 温度变化而明显改变。
②酮:δ c=o 210±10ppm a.α-C上取代基数目增加,δ c稍向低场位移 b. β-二酮烯醇式δ c=o 较酮式高场位移10ppm c. α,β-不饱和醛酮由于π -π 共轭,δ c=o 高场 位移5~10ppm,β烯碳则低场位移。 ③羧酸及其衍生物 羰基与具有孤对电子的杂原子相连时,羰基 碳原子的电子短缺现象得以缓和,δ c=o 较 醛酮高场位移至155~185ppm范围。
①取代烷基的密集性 当碳原子上的氢被烷基取代后,其δ c值也就 相应增大。另外,取代的烷基越大、越具分支, 则碳原子的δ c值也越大。在下列系列化合物 中, δ c值从左到右逐渐增大。
②γ –旁式效应 电负性基团使α、β–碳原子的化学位移值移向 低场,却使γ –碳原子的化学位移值移向高场。 这种影响称γ –邻位交叉效应或γ –旁式效应 (γ -gauche effect),该效应在链烃或六元环 化合物中普遍存在。 请同学们讨能: a.为什么链烃中电负性基团使α、β–碳原子的 化学位移值移向低场,却使γ –碳原子的化学 位移值移向高场? b.在取代环己烷中又会如何?
由于1J很大,造成碳谱谱线相互重叠,给碳谱 解析带来困难,因此记录碳谱时必须对质子去 偶。除了s电子的成分以外,取代基电负性对 1J也有影响,随取代基电负性的增加而相应增 加。 另外2JCH、3JCH 、4JCH也存在,在碳谱中称为 远程偶合。2JCH值的变化范围为-5至60Hz; 3J 值在十几Hz之内,它和取代基及空间位置 CH 有关,Karplus方程近似成立。 注:在芳环中,3JCH﹥ 2JCH 除少数特殊情况,4JCH一般小于1 Hz。
3.2.3 主要结构的13Cδ 值的范围 不同的13C化学位移的变化范围一般从0到 220ppm,但应熟记下列主要结构的13Cδ 值的 范围:
C≡C C=O 150~220 苯环碳 C=C 100~150 70~90 C –X 50~80
烷烃类饱和碳 0~60
-
-
-
-
200
150
100
50
0
第三章 核磁共振碳谱
13C-NMR
学习目的
通过本章的学习,应明确核磁共振碳谱 研究的对象,理解核磁共振碳谱的特点及各种 去偶技术,掌握不同类型 13C的化学位移及其 影响因素,了解 13C核的弛豫机理及弛豫时间 的应用,掌握核磁共振碳谱的解析。
本章主要内容
3.1 核磁共振碳谱概述 3.2 13C的化学位移 3.3 13C-NMR谱中的偶合现象及各种去偶方法 3.4 弛豫 3.5 核磁共振碳谱的解析
3.1核磁共振碳谱概述
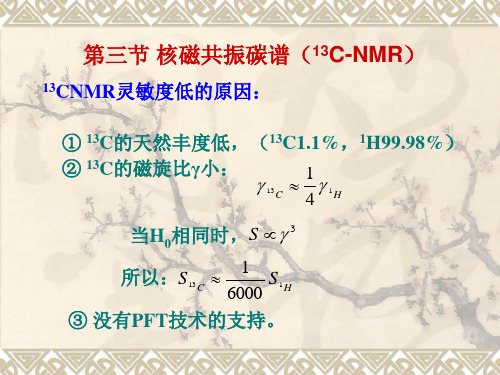
3.1.1 13C NMR基本原理 自旋量子数I=1/2的13C核的NMR原理与1H是同 样的。但是13C核与1H核相比,由于13C 核的 磁旋比只有1H核的1/4,而核磁共振测定的灵 敏度是与磁旋比的立方成正比(S∝γ 3),因 此在核数目相同的情况下,13C NMR谱的灵敏 度只有1H NMR的1/64。同时考虑到1H和13C 的自然丰度的差别,1H(99.98﹪) 13C (1.1﹪),所以碳谱的灵敏度只有氢谱的1/5800。
3.立体效应 δ c对分子的构型十分敏感,碳核与碳核或与 其他核相隔几个键时,其间的相互作用会大大 减弱。但若空间接近,彼此会强烈影响。在 van der Waals距离内紧密排列的原子或原子 团会互相排斥,将核外电子云彼此推向对方核 的附近,从而增加屏蔽作用,使化学位移向高 场移动。具体有以下两个方面:
如果采用和核磁共振氢谱同样的方法做核磁共 振碳谱,它的信号就非常微弱,被埋在仪器的 噪音之中,不能检出。因此提高核磁共振碳谱 灵敏度的方法有: ①对被测化合物的13C富集; ②增加给定体积下样品的浓度或给定浓度下样 品的体积; ③从Boltzmann分布式可知,降低样品温度或 增加磁场强度,可提高核磁共振碳谱的灵敏度 ④采用多次扫描,并将每次扫描的结果储存于 计算机中,由计算机累加平均;
共轭双键化合物,中间碳原子因键级减小, δ c值减 小,移向高场。例如,在丁二烯分子中,如果只考虑 取代基的诱导效应,乙烯基应大于乙基,丁二烯的C2 化学位移值应大于140.2ppm,而实际上由于共轭效 应使C2的化学位移向高场移动,为137.2ppm。
③诱导效应 与电负性取代基相连,使碳核外围电子云密 度降低,δ c值增大,向低场位移,取代基电 负性愈大,低场位移愈明显。如:
共轭羰基化合物,羰基碳的化学位移移向高 场,δ c值减小,当由于空间阻碍破坏共轭作 用时,将恢复羰基原来的δ c值。例如,苯乙 酮的羰基碳的δ c值为195.7ppm,当邻位有甲 基取代时,降低了羰基与苯环的共轭程度,使 羰基碳的δ c值向低场移动;当邻二甲基取代 时,由于空间阻碍,羰基与苯环难以继续处于 同一平面,破坏了共轭作用,使羰基恢复到普 通酮的δ c值为205.5ppm(如丙酮206.7ppm)。 请看下面的例子:
