高考化学专题复习——盐类的水解PPT课件
合集下载
化学选修四 盐类的水解(全部完整)ppt课件

盐类的水解
ppt课件完整
1
【知识回顾】 根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
酸 + 碱 == 盐 + 水 (中和反应)
强酸 酸
弱酸
强碱 碱
弱碱
1、强酸强碱盐 NaCl、 K2SO4
生成的盐 2、强酸弱碱盐 FeCl3、NH4Cl 3、强碱弱酸盐 CH3COONa、K2CO3
4、弱酸弱碱盐 CH3COONH4、(NH4)2CO3
CH3COOH+OH-
CH3COONa+H2O
CH3COOH+NaOH
ppt课件完整
8
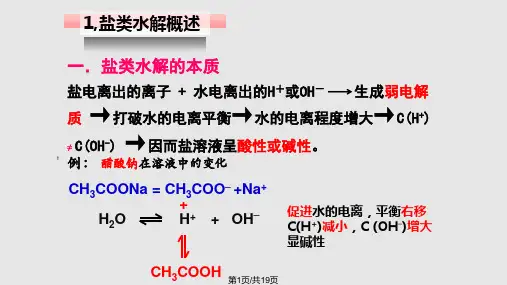
CH3COONa溶于水时, CH3COONa电离出的 CH3COO_和水电离出的H+结合生成难电离的
CH3COOH ,消耗了溶液中的H+ ,使水的电离平 衡向右移动,产生更多的OH_ ,建立新平衡时,
_
C(OH )
CH3COONa溶液中存在哪些电离? CH3COONa溶液中存在哪些离子?哪些微 粒可能发生相互作用?
ppt课件完整
7
强碱弱酸盐 CH3COONa
Na+ + CH3COO-
H2O
+ OH- + H+
平衡向右移动
溶液中:C(OH-)>C(H+),呈碱性。
离子方程式:
CH3COOH
CH3COO-+H2O 化学方程式:
相对大小 c(H+)=c(OH-)
溶液中的 粒子
有无弱电 解质生成
Na+、Cl-、H+、 OH-、H2O
无
c(H+)>c(OH-) c(H+)<c(OH-)
ppt课件完整
1
【知识回顾】 根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
酸 + 碱 == 盐 + 水 (中和反应)
强酸 酸
弱酸
强碱 碱
弱碱
1、强酸强碱盐 NaCl、 K2SO4
生成的盐 2、强酸弱碱盐 FeCl3、NH4Cl 3、强碱弱酸盐 CH3COONa、K2CO3
4、弱酸弱碱盐 CH3COONH4、(NH4)2CO3
CH3COOH+OH-
CH3COONa+H2O
CH3COOH+NaOH
ppt课件完整
8
CH3COONa溶于水时, CH3COONa电离出的 CH3COO_和水电离出的H+结合生成难电离的
CH3COOH ,消耗了溶液中的H+ ,使水的电离平 衡向右移动,产生更多的OH_ ,建立新平衡时,
_
C(OH )
CH3COONa溶液中存在哪些电离? CH3COONa溶液中存在哪些离子?哪些微 粒可能发生相互作用?
ppt课件完整
7
强碱弱酸盐 CH3COONa
Na+ + CH3COO-
H2O
+ OH- + H+
平衡向右移动
溶液中:C(OH-)>C(H+),呈碱性。
离子方程式:
CH3COOH
CH3COO-+H2O 化学方程式:
相对大小 c(H+)=c(OH-)
溶液中的 粒子
有无弱电 解质生成
Na+、Cl-、H+、 OH-、H2O
无
c(H+)>c(OH-) c(H+)<c(OH-)
盐类的水解ppt课件

思考2:CH3COONa、NaClO同样为强碱弱酸盐溶液,但浓度相 同时,NaClO溶液的pH却比CH3COONa溶液的大,这是为什么?
越弱越水解
一、盐类的水解
弱酸阴离子
1、概念
或弱碱阳离子
在水溶液中,盐电离出来的离子跟水电离出来的 H+或 OH- 结合生成
弱电解质的反应,叫做盐类的水解。
弱酸或 弱碱
碱性
酸性
中性
碱性
酸性
c(H+)和 c(OH-)的 相对大小
c(H+) =
c(OH-)
c(H+) <
c(OH-)
c(H+) >
c(OH-)
c(H+) =
c(OH-)
c(H+) <
c(OH-)
c(H+) >
c(OH-)
谁强显谁性
同强显中性
任务二:探究盐溶液呈现不同酸碱性的原因
1、分析NH4Cl溶液呈ቤተ መጻሕፍቲ ባይዱ性的原因
HCO3– + OH–
第二步水解: HCO3– + H2O
H2CO3 + OH– 第二步水解程度很小
平衡时溶液中H2CO3 的浓度很小,不会放出CO2 气体
任务三:盐类水解的离子方程式
5、离子方程式
(3)多元弱碱阳离子 多元弱碱的阳离子水解较复杂,按一步水解处理。 多元强Fe酸Cl弱3水碱解盐的离子方程式:
NH4Cl = Cl- + NH4+
+
H2O
H+ + OH-
平衡向右移动
NH3· H2O
水的电离平衡正向移动,当达到平衡时溶液中c(H+) >c(OH-),溶液呈酸性。
越弱越水解
一、盐类的水解
弱酸阴离子
1、概念
或弱碱阳离子
在水溶液中,盐电离出来的离子跟水电离出来的 H+或 OH- 结合生成
弱电解质的反应,叫做盐类的水解。
弱酸或 弱碱
碱性
酸性
中性
碱性
酸性
c(H+)和 c(OH-)的 相对大小
c(H+) =
c(OH-)
c(H+) <
c(OH-)
c(H+) >
c(OH-)
c(H+) =
c(OH-)
c(H+) <
c(OH-)
c(H+) >
c(OH-)
谁强显谁性
同强显中性
任务二:探究盐溶液呈现不同酸碱性的原因
1、分析NH4Cl溶液呈ቤተ መጻሕፍቲ ባይዱ性的原因
HCO3– + OH–
第二步水解: HCO3– + H2O
H2CO3 + OH– 第二步水解程度很小
平衡时溶液中H2CO3 的浓度很小,不会放出CO2 气体
任务三:盐类水解的离子方程式
5、离子方程式
(3)多元弱碱阳离子 多元弱碱的阳离子水解较复杂,按一步水解处理。 多元强Fe酸Cl弱3水碱解盐的离子方程式:
NH4Cl = Cl- + NH4+
+
H2O
H+ + OH-
平衡向右移动
NH3· H2O
水的电离平衡正向移动,当达到平衡时溶液中c(H+) >c(OH-),溶液呈酸性。
高考化学专题复习 盐类水解复习PPT课件
例:写出Na2CO3水解的离子方程式
CO32-+H2O HCO3-+H2O
HCO3-+OHH2CO3+OH-
高考化学专题复习 盐类水解复习PPT课件
高考化学专题复习 盐类水解复习PPT课件
盐溶液呈现不同酸碱性的原因
4)多元弱碱盐的水解,用总的水解离子方程式表示。 例:写出CuSO4水解的离子方程式 Cu2++ 2H2O Cu(OH)2+2H+ 5)对于部分发生相互促进双水解的盐类,因水解彻 底,故用“=”,同时有沉淀和气体产生。
高考化学专题复习 盐类水解复习PPT课件
盐溶液呈现不同酸碱性的原因
6、盐类水解的规律
有弱才水解 越弱越水解 谁强显谁性
无弱不水解 都弱都水解 都强显中性
高考化学专题复习 盐类水解复习PPT课件
高考化学专题复习 盐类水解复习PPT课件
例1 有下列盐溶液: ①KNO3 ②AgNO3 ③K2CO3 ④FeCl3 ⑤ K2SO4 ⑥NaClO ⑦NH4Cl 呈酸性的是___②_④__⑦__,呈碱性的是__③__⑥____, 呈中性的是___①_⑤____。
高考化学专题复习 盐类水解复习PPT课件
高考化学专题复习 盐类水解复习PPT课件
例2 等物质的量浓度的下列物质的溶液,其pH
由小到大的顺序排列正确的是
①CH3COONa ⑤Al2(SO4)3 A.①②③④⑤
②NaOH ③NaNO3 ④HCl B.⑤④③②①
C√.④⑤③①②
D.④⑤②①③
高考化学专题复习 盐类水解复习PPT课件
高考化学专题复习 盐类水解复习PPT课件
思维启迪
比较相同浓度的溶液pH大小的方法
(1)先把所给溶液按酸性、中性、碱性分类,再按电离和水解 规律排序。 (2)等浓度酸性溶液的pH:强酸<弱酸<强酸弱碱盐。等浓度 碱性溶液的pH:强碱>弱碱>强碱弱酸盐。
高三一轮复习盐类的水解PPT课件
CH3COOH 第1页/共19页
二.盐类水解的特点
(1)水解程度一般较小,不能进行到底。
如: 0.1mol/LNa2CO3 ,水解部分只占4%。
(2)水解可促进水的电离。
(3)水解可看作中和反应的逆向反应。 所以水解反应是吸热反应。
?水解与中和反应是否互为可逆反应
水解
盐+ 水
酸 +碱
中和
第2页/共19页
在蒸发溶液过程中不断通入HCl气体。在干燥的HCl气流中加热。 第14页/共19页
如何通过FeCl3 溶液制得 FeCl3 固体?
加热AlCl3·6H2O 得 AlCl3 ?
第15页/共19页
练习
1,下列阴离子,其中最易结合H+的是( C )
A.C6H5O- B.CH3COO- C.OH-
D.CO32- E.Cl -
第10页/共19页
4.泡沫灭火器的原理
Al2(SO4)3 和 NaHCO3溶液:
混合前
Al 3+ + 3H2O HCO3– + H2O
Al(OH)3 + 3H + H2CO3 + OH –
混合后 Al 3+ + 3HCO3– Al(OH)3 + 3CO2
内筒(玻璃)装有Al2(SO4)3溶液 外筒(钢制)装有NaHCO3溶液
溶液的酸碱性决定于两者水解的程度,可能双水解
(5)碱性:等浓度时 Na2CO3 > NaHCO3 越弱越水解
第3页/共19页
四.水解方程式的书写方法:
(1)因为水解程度小,要用
,无“↑”、无
“↓”,不稳定物(NH3·H2O,H2CO3等)不分 解。
高三一轮复习盐类的水解 ppt课件

2质021/3的/30 量浓度大小为
.
6
4、有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液 各25 mL,物质的量浓度均为0.1 mol·L-1,下列
说法正确的是 ( C )
A.3种溶液pH的大小顺序是③>②>① B.若将3种溶液稀释相同倍数,pH变化最大的是② C.若分别加入25 mL 0.1 mol·L-1的盐酸后,pH 最大的是① D.若3种溶液的pH均为9,则物质的量浓度的大小 顺序是③>①>②
如Al2S3 水解 Al3++3H2O Al(OH)3+3H+ S2-+H2O HS-+OH- HS-+H2O H2S+OH2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑ CH3COONH4+H2O CH3COOH+ NH3.H2O
2021/3/30
13
四、盐类水解的应用
1、判断溶液的酸碱性或pH大小
Fe3+ +3H2O Fe (OH)3+3H+
1、用可逆符号:
分步水解 以第一步为主
2、多元弱酸根离子分步水解,第一步较易发生,水
2021/3解/30 方程式一般只需写第一步的水解.
5
练习:
1、相同物质的量浓度的NaX、NaY、NaZ三种溶液
的pH分别为7、8、9,则相同物质的量浓度的 HX、
HY、HZ的酸性强弱顺序为 HX>HY>HZ 。
4
判断下列盐溶液的酸碱性,写出水解离子方程式
NH4NO3 Na2CO3 KAl(SO4)2
NH4++H2O NH3·H2O+H+
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
__碱___性___
pH__>__7
栏目 导引
第八章 水溶液中的离子平衡
四、水解方程式的书写 1.一般要求
气体、沉淀不标“↑”或
一般盐类水 ⇨水解产物很少⇨
解程度很小
“↓”,易分解产物如 NH3·H2O等不写其
分解产物的形式
例如:NH4Cl 水解的离子方程式为 _N_H__+ 4_+__H__2O________N_H__3·_H_2_O_+ ___H_+____。
栏目 导引
第八章 水溶液中的离子平衡
已知 25 ℃时部分弱电解质的电离平衡常数数据如表所
示:
化学式 CH3COOH
H2CO3
电离平 K=1.8×10-5
衡常数
K1=4.3×10-7 K2=5.6×10-11
物质的量浓度均为 0.1 mol·L-1 的几种溶液:
HClO K= 3.0×10-8
① CH3COOH ②HClO ③NaClO ④H2CO3 ⑤Na2CO3
第八章 水溶液中的离子平衡
第三讲 盐类的水解
第八章 水溶液中的离子平衡
[2017 高考导航]
考纲要求
真题统计
命题趋势
2015,卷Ⅱ
由于盐类水解涉
1.了解盐类水解 10T(B);
及知识面较广,除了作
的原理。
2014,卷Ⅰ
为热点继续考查之外,
2.了解影响盐 8T(AC)、
将盐类水解的知识与
类水解程度的 27T(2)③;
栏目 导引
第八章 水溶液中的离子平衡
3.有下列八种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④CH3COONa ⑤CH3COOH ⑥NaHCO3 ⑦Cu(NO3)2 ⑧CH3COONH4 (1)溶液呈酸性的有_②__⑤__⑦___,呈碱性的有__③__④__⑥__,呈中性 的有__①__⑧____。 (2)写出②、③、⑦溶液中发生水解的离子方程式: _N_H__+ 4 _+__H_2_O____N__H_3_·__H__2O__+__H_+_________________________; C_O__23-_+__H__2_O___H__C_O__3-_+__O_H__-_、__H__C_O_3-_+__H__2_O____H_2_C__O_3_+__O_H__-; _C_u_2_+_+__2_H_2_O_____C_u_(_O__H_)_2+__2_H__+_____________________。
盐的类型 强酸强碱盐
实例 是否水解
NaCl、KNO3 否
水解的离子
溶液的酸碱性 溶液的 pH (25 ℃)
__中__性____ pH_=___7
强酸弱碱盐 NH4Cl、 Cu(NO3)2 是
NH+4 、Cu2+
___酸__性___
pH__<__7
弱酸强碱盐
CH3COONa、 Na2CO3 是
CH3COO-、 CO23 -
一、实质
盐电离→弱弱酸碱的的阴阳离离子子→→结结合合OHH+-
→生成弱电解质→破
坏了水的电离平衡 →水的电离程度增大→c(H+)≠c(OH-)→
溶液呈碱性或酸性。
栏目 导引
二、特点
第八章 水溶液中的离子平衡
可逆 酸碱中和
栏目 导引
第八章 水溶液中的离子平衡
三、水解的规律 有弱才水解,越弱越水解;谁强显谁性,同强显中性。
栏目 导引
第八章 水溶液中的离子平衡
1.下列离子方程式中,属于水解反应的是( C )
A.HCOOH+H2O HCOO-+H3O+
B.CO2+H2O
HCO- 3 +H+
C.CO23-+H2O
HCO- 3 +OH-
D.HS-+H2OFra bibliotekS2-+H3O+
解析:A、D 项是电离方程式,B 项是 CO2 溶于水后的电离
栏目 导引
第八章 水溶液中的离子平衡
名师点拨 (1)判断盐溶液的酸碱性,需先判断盐的类型,因此需熟练记 忆常见的强酸、强碱和弱酸、弱碱。 (2)盐溶液呈中性,无法判断该盐是否水解。例如:NaCl 溶 液 呈 中 性 , 是 因 为 NaCl 是 强 酸 强 碱 盐 , 不 水 解 ; 而 CH3COONH4 溶液呈中性,是因为 CH3COO-和 NH+ 4 的水解 程度相当,即水解过程中 H+和 OH-消耗量相等,所以 CH3COONH4 溶液仍呈中性。
过程,C 项正确。
栏目 导引
第八章 水溶液中的离子平衡
2.等体积的下列溶液,阴离子的总浓度最大的是( A ) A.0.2 mol·L-1 K2S B.0.1 mol·L-1 Ba(OH)2 C.0.2 mol·L-1 NaCl D.0.2 mol·L-1 (NH4)2SO4 解析:表面上看,四个选项中阴离子浓度都等于 0.2 mol·L-1, 但由于 A 中 S2-能水解:S2-+H2O HS-+OH-,每减少 1 个 S2-同时增加 2 个阴离子,阴离子总数增多,故 0.2 mol·L -1 K2S 溶液中阴离子总浓度大于 0.2 mol·L-1。
栏目 导引
第八章 水溶液中的离子平衡
2.三种类型的盐的水解方程式的书写 (1)多元弱酸盐的水解:分步进行,以第一步为主,一般只写 第一步水解。 例如:Na2CO3 的水解离子方程式为 _C__O_23_-_+__H_2_O_______H__C_O__3-_+__O__H_-____。 (2)多元弱碱盐水解:方程式一步写完。 例如:FeCl3 的水解离子方程式为 _F_e_3_+_+__3_H_2_O_______F_e_(_O__H_)_3+__3__H_+___。 (3)有些阴、阳离子相互促进的水解:水解相互促进进行到底 时,书写时要用“===”、“↑”、“↓”等。 例如:NaHCO3 与 AlCl3 混合溶液的反应离子方程式为 _A__l3_+_+__3_H__C_O__- 3 _=_=_=_A_l_(O__H__)3_↓__+__3_C_O__2_↑_______。
其他知识有机结合在
主要因素。 2014,卷Ⅱ 7T(B)、一起进行考查,将是今
3.了解盐类水 11T(CD);
后命题的基本方向。复
解的应用。 2013,卷Ⅰ 9T; 习备考时,注意掌握离
2013,卷Ⅱ 10T(D) 子浓度大小的比较。
2017高考化学复习
第八章 水溶液中的离子平衡
考点一 盐类的水解及其规律
⑥NaHCO3 ⑦CH3COONa,pH 由小到大排列的顺序是( C )
pH__>__7
栏目 导引
第八章 水溶液中的离子平衡
四、水解方程式的书写 1.一般要求
气体、沉淀不标“↑”或
一般盐类水 ⇨水解产物很少⇨
解程度很小
“↓”,易分解产物如 NH3·H2O等不写其
分解产物的形式
例如:NH4Cl 水解的离子方程式为 _N_H__+ 4_+__H__2O________N_H__3·_H_2_O_+ ___H_+____。
栏目 导引
第八章 水溶液中的离子平衡
已知 25 ℃时部分弱电解质的电离平衡常数数据如表所
示:
化学式 CH3COOH
H2CO3
电离平 K=1.8×10-5
衡常数
K1=4.3×10-7 K2=5.6×10-11
物质的量浓度均为 0.1 mol·L-1 的几种溶液:
HClO K= 3.0×10-8
① CH3COOH ②HClO ③NaClO ④H2CO3 ⑤Na2CO3
第八章 水溶液中的离子平衡
第三讲 盐类的水解
第八章 水溶液中的离子平衡
[2017 高考导航]
考纲要求
真题统计
命题趋势
2015,卷Ⅱ
由于盐类水解涉
1.了解盐类水解 10T(B);
及知识面较广,除了作
的原理。
2014,卷Ⅰ
为热点继续考查之外,
2.了解影响盐 8T(AC)、
将盐类水解的知识与
类水解程度的 27T(2)③;
栏目 导引
第八章 水溶液中的离子平衡
3.有下列八种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④CH3COONa ⑤CH3COOH ⑥NaHCO3 ⑦Cu(NO3)2 ⑧CH3COONH4 (1)溶液呈酸性的有_②__⑤__⑦___,呈碱性的有__③__④__⑥__,呈中性 的有__①__⑧____。 (2)写出②、③、⑦溶液中发生水解的离子方程式: _N_H__+ 4 _+__H_2_O____N__H_3_·__H__2O__+__H_+_________________________; C_O__23-_+__H__2_O___H__C_O__3-_+__O_H__-_、__H__C_O_3-_+__H__2_O____H_2_C__O_3_+__O_H__-; _C_u_2_+_+__2_H_2_O_____C_u_(_O__H_)_2+__2_H__+_____________________。
盐的类型 强酸强碱盐
实例 是否水解
NaCl、KNO3 否
水解的离子
溶液的酸碱性 溶液的 pH (25 ℃)
__中__性____ pH_=___7
强酸弱碱盐 NH4Cl、 Cu(NO3)2 是
NH+4 、Cu2+
___酸__性___
pH__<__7
弱酸强碱盐
CH3COONa、 Na2CO3 是
CH3COO-、 CO23 -
一、实质
盐电离→弱弱酸碱的的阴阳离离子子→→结结合合OHH+-
→生成弱电解质→破
坏了水的电离平衡 →水的电离程度增大→c(H+)≠c(OH-)→
溶液呈碱性或酸性。
栏目 导引
二、特点
第八章 水溶液中的离子平衡
可逆 酸碱中和
栏目 导引
第八章 水溶液中的离子平衡
三、水解的规律 有弱才水解,越弱越水解;谁强显谁性,同强显中性。
栏目 导引
第八章 水溶液中的离子平衡
1.下列离子方程式中,属于水解反应的是( C )
A.HCOOH+H2O HCOO-+H3O+
B.CO2+H2O
HCO- 3 +H+
C.CO23-+H2O
HCO- 3 +OH-
D.HS-+H2OFra bibliotekS2-+H3O+
解析:A、D 项是电离方程式,B 项是 CO2 溶于水后的电离
栏目 导引
第八章 水溶液中的离子平衡
名师点拨 (1)判断盐溶液的酸碱性,需先判断盐的类型,因此需熟练记 忆常见的强酸、强碱和弱酸、弱碱。 (2)盐溶液呈中性,无法判断该盐是否水解。例如:NaCl 溶 液 呈 中 性 , 是 因 为 NaCl 是 强 酸 强 碱 盐 , 不 水 解 ; 而 CH3COONH4 溶液呈中性,是因为 CH3COO-和 NH+ 4 的水解 程度相当,即水解过程中 H+和 OH-消耗量相等,所以 CH3COONH4 溶液仍呈中性。
过程,C 项正确。
栏目 导引
第八章 水溶液中的离子平衡
2.等体积的下列溶液,阴离子的总浓度最大的是( A ) A.0.2 mol·L-1 K2S B.0.1 mol·L-1 Ba(OH)2 C.0.2 mol·L-1 NaCl D.0.2 mol·L-1 (NH4)2SO4 解析:表面上看,四个选项中阴离子浓度都等于 0.2 mol·L-1, 但由于 A 中 S2-能水解:S2-+H2O HS-+OH-,每减少 1 个 S2-同时增加 2 个阴离子,阴离子总数增多,故 0.2 mol·L -1 K2S 溶液中阴离子总浓度大于 0.2 mol·L-1。
栏目 导引
第八章 水溶液中的离子平衡
2.三种类型的盐的水解方程式的书写 (1)多元弱酸盐的水解:分步进行,以第一步为主,一般只写 第一步水解。 例如:Na2CO3 的水解离子方程式为 _C__O_23_-_+__H_2_O_______H__C_O__3-_+__O__H_-____。 (2)多元弱碱盐水解:方程式一步写完。 例如:FeCl3 的水解离子方程式为 _F_e_3_+_+__3_H_2_O_______F_e_(_O__H_)_3+__3__H_+___。 (3)有些阴、阳离子相互促进的水解:水解相互促进进行到底 时,书写时要用“===”、“↑”、“↓”等。 例如:NaHCO3 与 AlCl3 混合溶液的反应离子方程式为 _A__l3_+_+__3_H__C_O__- 3 _=_=_=_A_l_(O__H__)3_↓__+__3_C_O__2_↑_______。
其他知识有机结合在
主要因素。 2014,卷Ⅱ 7T(B)、一起进行考查,将是今
3.了解盐类水 11T(CD);
后命题的基本方向。复
解的应用。 2013,卷Ⅰ 9T; 习备考时,注意掌握离
2013,卷Ⅱ 10T(D) 子浓度大小的比较。
2017高考化学复习
第八章 水溶液中的离子平衡
考点一 盐类的水解及其规律
⑥NaHCO3 ⑦CH3COONa,pH 由小到大排列的顺序是( C )
