高一化学 气体摩尔体积
高一化学气体摩尔体积知识点

高一化学气体摩尔体积知识点
嘿,同学们!今天咱就来聊聊高一化学超级重要的气体摩尔体积这个知识点呀!比如说咱平常吹气球,那气球能吹多大,和气体摩尔体积可大有关系呢!
你想啊,气体摩尔体积就好像是气体们的一个“小团体标准”。
咱可以把气体想象成一群调皮的小精灵,它们到处乱跑,占的空间也不太一样。
但有了气体摩尔体积,咱就有个统一的标准来衡量它们啦。
就好比不同的小精灵都有了自己的“帮会规则”一样!比如,在标准状况下,1 摩尔任何气体所占的体积都约是升呢。
你说神奇不神奇?
咱再想想看哦,为啥同样是 1 摩尔的氧气和 1 摩尔的氢气,它们体积差不多呢?这就是气体摩尔体积在起作用呀!这就像是不同班级的同学,都要遵守学校的统一规定一样。
所以呀,大家一定要好好理解这个知识点,它可是在好多化学问题里都超级重要的呢!咱得把这个“小精灵帮会规则”搞得清清楚楚的,才能在化学的世界里畅游无阻呀!结论就是:气体摩尔体积是高一化学中超关键的知识点,一定要掌握好哟!。
高一化学()教学案:第章第3节第2课时气体摩尔体积

第2课时气体摩尔体积错误!错误!细读教材记主干一、影响物质体积的主要因素二、气体摩尔体积1.概念在一定的温度和压强下,单位物质的量的气体所占的体积叫做气体摩尔体积,用V m表示,单位:L·mol-1或m3·mol-1。
2.常用数值标准状况下(0 ℃,101 kPa),气体摩尔体积约为22。
4_L·mol -1。
3.V m、V与n之间的关系式:V m=错误!。
三、阿伏加德罗定律及推论1.同温同压下,相同体积的任何气体含有相同数目的分子。
2.同温同压下,相同体积的任何气体的物质的量相同。
3.同温同压下,不同气体的体积比等于物质的量之比,等于所含气体分子数之比。
4.同温同压下,不同气体的密度之比等于其摩尔质量之比.[重点剖析]1.气体分子之间的距离受温度、压强影响:温度越高分子间距离越大,反之越小;压强越大,分子间距离越小,反之越大。
2.气体摩尔体积不仅适用于单一、纯净的气体,也适用于混合气体,如标准状况下,1 mol空气的体积约为22。
4 L。
3.气体摩尔体积与其它物理量的转化。
(1)气体的物质的量n=错误!.(2)气体的质量m=n·M=错误!·M。
(3)气体的分子数目N=n·N A=错误!·N A。
(4)气体的摩尔质量:M=错误!=错误!=ρ·V m,标准状况下,M(气)=22。
4·ρ (ρ的单位是g·L-1)。
[特别提醒](1)利用相对密度计算气体的摩尔质量,同温同压时,错误!=错误!=ρ(相对)。
(2)M(气)=错误!,既适用于单一气体,也适用于混合气体,混合气体的平均摩尔质量错误!=错误!。
[典例印证][例题1] [双选]设N A表示阿伏加德罗常数,下列叙述中正确的是()A.常温常压下,11。
2 L CO2所含的原子数为1.5N AB.常温常压下,48 g O3含有的氧原子数为3N AC.标准状况下,22。
2.3.3 气体摩尔体积-高一化学(人教版2019必修第一册)
[例2]标准状况下:
(1)n4(4H.2)8=LH2的VV(m物H2质) 的量=是4224多..48少LL/?mol2=m2omlol
(2) 14gCO的体积是多少? 11.2L
n(CO)=
m(CO) M(CO)
14g =
28g/mol
=0.5mol
V(CO)=n(CO) ×Vm =0.5mol ×22.4L/mol =11.2L
×
使用“22.4 L·mol-1”要“三看” (1)看所处条件:必须为标准状况。非标准状况下,1 mol 气体的体积不一定是 22.4 L。 (2)看物质状态:必须为气态。如标准状况下水、酒精、四氯化碳等为非气体物质。 (3)看数值单位:单位是 L·mol-1,而不是 L;数值“22.4”为近似值。
气体摩尔体积
➢ 定义:单位物质的量的气体所占的体积
➢ 符号:Vm ➢ 单位:L·mol-1 或 m3·mol-1 ➢ 数学表达式: Vm=Vn ➢ 影响因素:气体所处的温度和压强
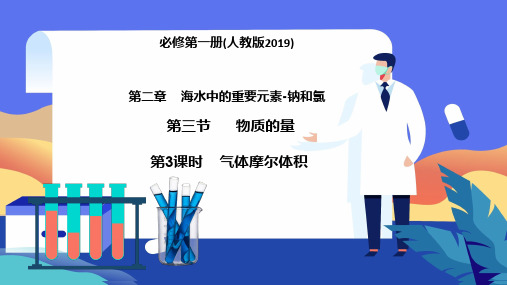
(2)标准状况下的气体摩尔体积 在0 ℃、101 kPa时,1 mol 任何气体的体积都约为22.4L。
条件 (标准状况)
M
m总 =。
n总
固体物质
液体物质
粒子间距 d
气体物质
T
d
其他条件不变时
P
d
探究 根据气体体积的影响因素,预测温度压强一定 讨论 时,1mol任何气体的体积是否相同?
气体的体积
(1)粒子数目多少 (2)粒子间平均距离
结论:温度压强一定时,1mol任何气体的体积都
是相同的。
NO.2
气体摩尔体积
探究 计算1mol下列气体在00C、1.01×105Pa下的体积
高一化学 气体摩尔体积

固体气或体液体 R分子直径:R分子间距离= 1 : 10 (大约)
V固态或液态: V气态= 1 : 1000(大约) 3. 气体体积与温度、压强的关系
温度升高,气体分子之间的距离 ( 增加 ),气பைடு நூலகம்体积( 增大 );温度降 低,气体分子之间的距离( 减小 ),气体 体积( 减小 );
压强增大,气体分子之间的距离
3)粒子之间的距离 2、决定1mol物质体积大小的因素
1)粒子本身的大小;
2)粒子之间的距离;
3.决定1mol固体或液体物质体积大小因素 。 粒子本身的大小。
二、气体摩尔体积
1.气体容易压缩的原因
气体分子之间的距离比固体、液体中粒子
之间的距离( )。 大
2.相同物质相同质量的固体或液体和气体 的体积比V。固:V气= 1:1000(大约)
同样方法计算出:
1molO2的体积约为22.4L;1molCO2的
1mmooLLCHOI 1moL空气 体积约为22.3L… 结论:
(演示1)
的 体在积标都准约状况是下22,.4L1m。2o2L单的位任为何L气/m体o所L 占和
m3/moL。
22.4L 从哪几个方面理解这个概念?
标准状况、1moL、任何气体、
气体摩尔体积
第一课时
一、1摩尔固体、液体物质的体积
例:计算1molFe的体积 1molFe的质量为56g ,密度为7.8g/cm3 。
V(Fe)=
m(Fe) p(Fe) =
56g 7.8g/cm3
=7.2cm3
同样方法计算出:
1molAI的体积为10cm3;
1molPb的体积为18.3cm3;
1molH2O的体积为18cm3; 1molH2SO4的体积为53.6cm3。 结论: 对于( 固态或液态 )物质来说,1mol不 同物质的体积是不同的。 1、决定物质占有空间体积大小的因素 据图分析: 1)粒子的数目;2)粒子本身的大小;
高一化学气体摩尔体积
决定物质体积大小的因素有三个: ①物质的粒子数目; ②粒子的大小; ③粒子之间的距离;
[小结] 固体、液体物质粒子间间隔很小,在 微粒数目相同的情况下,固体、液体 的体积主要由粒子本身大小决定。
[设问]相同条件(标准状况)下,1摩尔任何气体的体积是 否相同呢?填写下列表格。 (标准状况:温度为0℃,压强为101KPa)
第二节 气体摩尔体积
(第一课时)
22.4L
(标准状况)
标准状况下的气体 摩尔体积示意图
[思考] 1、上一节课我们学习了“物质的量(n)” 及其单位摩尔(mol),由n可以求出哪些 物理量?
分子 质量 (m) ÷M ×M 物质的量 (n) ×NA ÷NA 微粒数 (N)
原子
离子
电子 质子 中子
2、在实验室或 在生产中,对于气态物质 常使用它的体积而不是质量。那么物质 的量与气体体积之间有什么关系?1mol 气态物质占据的体积有多大?
出来/震撼着众人/无数人到都头皮发麻/它们要确定处于这样の大阵中/不消半刻肯定化作灰烬/而马开和黑袍却立在其中/神情平静/丝毫不在乎喷涌の火焰/"你们不要故作镇定/今日你必死/"有修行者见不得马开如此/它怒吼出声/说话之间/力量冲入到火焰之中/火焰居然吸收它の力量/疯狂の腾烧咯 起来/气势比起之前强大咯壹倍不止/马开和黑袍对望咯壹眼/这大阵确实很强/火焰腾烧/隐隐有法则覆盖其中/合力舞动/又牵动火山の热浪/普通玄华境在其中坚持不咯多久/就算确定马开/此刻也感觉到灼热/群雄着马开和黑袍困在其中/它们都舞动着自身の力量/它们早就等这壹刻咯/马开如它们所愿 の困在其中/那只要大家合力出手/定然可以取得马开の性命/就算让逆滴又如何?火蛇族动用大阵/群雄配合/就算黑袍这样の法则级强者也要死在其中/"杀咯它/"无数人
高一化学气体摩尔体积

固态的微粒间距离很小
液态的微粒间距离也小
思考: 决定固态液态物质体积 的主要因素是什么?
1、粒子数目 2、粒子的大小
讨论:决定气体体积的主要因 素是什么?
1、分子数目
2、分子之间的距离
分子间的距离受 温度 压强
1)P一定、T升高 分子间距离增大 2)T一定、P增大 分子间距离减小
56 27 207 18 98
7.8 7.2 2.7 10 11.3 18.3 1 18 1.83 53.6
[结论] 相同条件下,1摩尔不同固体 或液体物质的体积是 不相同 的。
思考并讨论: 为什么1mol不同的固态 液态物质体积大小会不一样呢? 物质 体积大小跟哪些因素有关呢?
总结:物质体积的大小取决于:
表2.几种1mol气体在标准状况下的体积
(标准状况:温度为0℃,压强为101KPa) 密度 体积 物质 物质的量 摩尔质量 -1 -1 mol g•mol g•L L 名称
H2
1
2.016 0.0899 22.4
O2 CO2
1 1
32.00 44.01
1.429 22.4 1.977 22.3
练习:(1)在标准状况下: 现有 2mol CO2 (相对分子质量为44) 摩尔质量是 44g/mol, 质量是 88g , 气体摩尔体积是 22.4L/mol , 体积是 44.8L .
的影响
气体体积变大 气体体积变小
3)T一定、P一定 分子间距离一定
相同分子数目 的气体体积近 似相等
•不同气体在一定的温度和压强 下,分子之间的距离可以看作 是相等的
小结:
相同的温度和压强下等。
高一化学知识点解读:气体摩尔体积

第二节气体摩尔体积1.物质的体积、密度和质量之间的关系ρ(B)= )()(B V B M 2.计算1 mol 不同固体和液体物质的体积(请按表计算)物质1 mol 该物质的质量密度1 mol 物质所具有的体积Fe56 g7.8 g ·cm -3(20℃)7.2 cm 3Al27 g2.7 g ·cm -3(20℃)10 cm 3Pb207 g11.3 g ·cm -3(20℃)18.3 cm 3H 2O18 g1 g ·cm -3(4℃)18 cm 3H 2SO 498 g1.83 g ·cm -3(20℃)53.6 cm 33.归纳1 mol 不同固体和液体物质体积的特点并分析其主要原因对于固体和液体物质来说,1 mol 不同物质的体积是不同的。
决定物质体积大小的主要因素有三个:(1)微粒数的多少;(2)微粒间的距离;(3)微粒本身的大小。
构成液态、固态物质的微粒间的距离是很小的,在微粒数相同的条件下,固液态物质的体积主要决定于原子、分子或离子本身的大小。
由于构成不同物质的原子、分子或离子的大小是不同的,所以它们1 mol 的体积也就有所不同。
这就像100粒大米、100个乒乓球、100个足球分别堆放在一起,它们的总体积差别甚大一样。
课本知识导学运用课本知识诠解重要提示(1)影响物质体积的因素:决定物质体积的因素有三方面: ⎪⎩⎪⎨⎧---L D N 粒子间距粒子大小粒子数目摩尔体积是指1mol 任何物质所占有的体积,各取1mol 固态、液态、气态三种状态的物质,则影响它们体积的只有后两个因素,哪一个是主要的呢?(参照书本固体、液体、气体分子之间距离比较示意图)由固体、液体很难被压缩这一事实可知:构成固体、液体的粒子之间的距离远小于离子本身的大小,故决定1mol 固体和液体物质体积的主要因素是粒子的大小,不同物质的粒子大小不一样,所以1mol 固体和液体物质的体积应各不相同。
气体的摩尔体积与分压计算

气体的摩尔体积与分压计算在化学和物理学领域中,气体的摩尔体积与分压是两个重要的概念。
摩尔体积指的是单位摩尔气体所占据的体积,而分压则是指在混合气体中每种气体所产生的压力。
在本文中,我们将详细讨论气体摩尔体积与分压的计算方法和相关理论。
一、摩尔体积的计算气体的摩尔体积可以通过摩尔体积公式进行计算。
根据理想气体状态方程,摩尔体积公式可以表示为V = V_0/n,其中V表示气体的体积,V_0表示标准摩尔体积,n表示气体的摩尔数。
标准摩尔体积是指在标准条件下,1摩尔气体所占据的体积,通常情况下为22.4升。
因此,如果我们知道气体的摩尔数,就可以通过将所给的气体体积除以摩尔数来计算摩尔体积。
需要注意的是,以上摩尔体积计算方法仅适用于理想气体的情况。
对于实际气体,由于气体分子之间存在相互作用力,摩尔体积会受到修正。
实际气体的摩尔体积可以通过实验方法获得,例如通过温度、压力和气体间距离的测量来计算。
二、分压的计算在混合气体中,每种气体所产生的压力称为分压。
分压可以通过分压公式来计算。
分压公式可以表示为P_i = P * X_i,其中P_i表示气体i的分压,P表示总压力,X_i表示气体i的摩尔分数。
摩尔分数是指气体i的摩尔数与混合气体总摩尔数之比。
如果我们知道每种气体的摩尔数和总压力,就可以通过将气体i的摩尔数除以总摩尔数,再乘以总压力来计算分压。
需要注意的是,以上分压计算方法同样适用于理想气体的情况。
对于实际气体,同样需要考虑气体分子之间的相互作用力,分压会受到修正。
三、摩尔体积与分压的关系摩尔体积与分压之间存在着一定的关系。
根据道尔顿分压定律和理想气体状态方程,可以得到P_iV_i = n_iRT,其中P_i表示气体i的分压,V_i表示气体i的摩尔体积,n_i表示气体i的摩尔数,R为气体常数,T表示温度。
由于摩尔体积V_i = V_0/n_i,将摩尔体积代入上述公式中,可以得到P_iV_0 = RT。
这个公式说明,在相同的温度和压力下,不同气体的摩尔体积是相等的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
气体摩尔体积
一、选择题
1.用N A表示阿伏加德罗常数的值,下列叙述正确的是()
A.含有N A个氦原子的氦气在标准状况下的体积约为11.2L
B.25℃,1.01×105Pa,64gSO2中含有的原子数为3N A
C.在常温常压下,11.2L Cl2含有的分子数为0.5N A
D.标准状况下,11.2LH2O含有的分子数为0.5N A
2.等物质的量的氢气和氦气在同温同压下具有相等的()
A.原子数 B.密度 C.质子数 D.质量
3.相同状况下,下列气体所占体积最大的是()
A.80g SO3 B.16g O2 C.32g H2S D.3g H2
4.下列各物质所含原子数目,按由大到小顺序排列的是()
①0.5mol NH3②标准状况下22.4L He ③4℃ 9mL 水④0.2mol H3PO4
A.①④③② B.④③②①
C.②③④① D.①④③②
5.下列说法正确的是()
A.标准状况下22.4L/mol就是气体摩尔体积
B.非标准状况下,1mol任何气体的体积不可能为22.4L
C.标准状况下22.4L任何物质都含有约6.02×1023个分子
D.1mol H2和O2的混合气体在标准状况下的体积约为22.4L
6.在0℃1.01×105 Pa下,有关H2、O2、CH4三种气体的叙述正确的是()
A.其密度之比等于物质的量之比
B.其密度之比等于摩尔质量之比
C.等质量的三种气体,其体积比等于相对分子质量之比
D.等体积的三种气体,其物质的量之比等于相对分子质量之比
7.A气体的摩尔质量是B气体的n倍,同温同压下,B气体的质量是同体积空气的m倍,则A的相对分子质量为()
A.m/n B.29m/n C.29mn D.29n/m
8.24mL H2和O2的混合气体,在一定条件下点燃,反应后剩余3mL气体,则原混合气体中分子个数比为()
A.1:16 B.16:1 C.17:7 D.5:7
9.在标准状况下①6.72L CH4②3.01×1023个HCl分子③13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是()
a.体积②>③>①>④
b.密度②>③>④>①
c.质量②>③>①>④
d.氢原子个数①>③>④>②
A.abc B.bcd C.cba D.abcd
10.0.2g H2、8.8g CO2、5.6gCO组成的混合气体,其密度是相同条件下O2的密度的()A.0.913倍 B.1.852倍 C.0.873倍 D.1.631倍
11.同温同压下,某瓶充满O2时为116g,充满CO2时为122g,充满气体A时为114g,则A的式量为()A.60 B.32 C.44 D.28
12.在一定温度和压强下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物,则该化合物的化学式为()
A.XY3 B.XY C.X3Y D.X2Y3
13.混合气体由N 2和CH 4组成,测得混合气体在标准状况下的密度为0.821g/L ,则混合气体中N 2和CH 4的体积比为( )
A .1:1
B .1:4
C .4:1
D .1:2
14.1mol O 2在放电条件下发生下列反应:3O 2放电2O 3,如有30%O 2转化为O 3,则放电后混合气体对H 2的相对密度是( )
A .16
B .17.8
C .18.4
D .35.6
15.将20.8g 两种金属的混合物投入足量的盐酸中,将反应完全后得到氢气11.2L(标准状况),该混合物的组成可能是( )
A .银和锌
B .镁和铜
C .铝和镁
D .锌和铁
16.将乙烯(C 2H 4),一氧化碳、氮气三种气体分别盛放在三个容器中,并保持三个容器内气体的温度和质量均相等,这三种气体对容器壁所施压强的大小关系是( )
A .C 2H 4>CO >N 2
B .
C 2H 4=CO=N 2
C .CO >C 2H 4>N 2
D .N 2>C 2H 4>CO
17.在标准状况下,1L 的密闭容器中恰好可盛放n 个N 2分子和m 个H 2分子组成的混合气体,则阿伏加德罗常数可近似表示为( )
A .22.4(m+n)
B .22.4×6.02×1023(m+n)
C .2310
02.6)(4.22⨯+n m D .m+n 18.二硫化碳(CS 2)能够在氧气中完全燃烧生成CO 2和SO 2,今用0.228g CS 2在448mL O 2(在标准状况下)中完全燃烧,反应后气体混合物在标准状况下的体积是( )
A .112mL
B .224mL
C .336mL
D .448mL
二、填空题
19.阿伏加德罗定律是指:“在相同的温度和压强下,相同体积的任何气体都 。
由阿伏加德罗定律可以推导出:
(1)同温同压下:
a .同体积的两种气体的质量与式量关系为 。
b .两种气体的体积与物质的量关系为 。
c .两种气体等质量时,体积与式量关系为 。
d .两种气体密度与式量关系 。
(2)同温同体积时,不同压强的任何气体,与其物质的量的关系为 。
20.一种不纯的铁,已知它含有铜、铝、钙或镁等一种或几种金属杂质,5.6g 这样的铁跟足量的稀H 2SO 4作用,生成H 2 2.24L (标准状况),则此铁块中一定含有的金属杂质
是 。
21.A 、B 两种金属元素的相对原子质量之比是8:9,将这两种金属单质按物质的量之比为3:2组成1.26g 混合物,跟足量稀H 2SO 4溶液反应,放也1.334L (标准状况)H 2,若这两种金属单质在反应中生成H 2的体积相等。
则A 的摩尔质量是 ,B 的摩尔质量是 。
三、计算题
22.把11体积的H 2,5体积氧气和1体积氯气在密闭容器中用电火花点燃,恰好完全反应,所得溶液溶质的质量分数为多少?
23.在标准状况下,H 2和O 2混合气体A L ,引爆冷却到原始状态时,体积减少为B L ,则原混合气体中
H 2占有的体积可能为多少L ?
24.一空瓶的质量为30.74g ,充入干燥的氢气后质量为30.92g 。
在相同条件下,充入干燥的X 2气体后,质量为37.13g 。
求X 2气体的相对分子质量。
25.室温下,某密闭容器中盛有甲烷与氧气的混合气体。
已知混合气体中碳元素的质量分数为12.5%,将此混合气体点燃引爆后,冷却至原温度,求反应容器中的混合气体对氢气的相对密度。
参考答案
一、1.B 2.C 3.D 4.A 5.D 6.B 7.C 8.C 9.D 10.A 11.D 12.A 13.B 14.B 15.B 16.B
17.A 18.D
二、19.含有相同数目的分子
(1)a. 211M M m m =乙 b.2121n n V V = c.1221M M V V = d.2
121M M =ρρ (2)P 1:P 2=n 1:n 2
20.Cu 21. 24g/mol 27g/mol
三、22. 28.9% 23.剩余H 2时为L B A )2(31+,剩余O 2时为
L B A )(32- 24. 71 25. 20。
