2018届二轮复习 化学反应中的热效应 专题卷(全国通用)
化学反应的热力学与热效应练习题

化学反应的热力学与热效应练习题热力学是研究能量转化规律以及能量转化过程中所伴随的其他物理和化学性质变化的学科。
在化学反应中,热力学起着非常重要的作用,它可以帮助我们理解反应的方向、速率以及能量转化的方式。
本文为大家提供几道关于化学反应热力学与热效应的练习题,帮助大家巩固所学知识。
1. 根据下面的反应方程式写出反应的反热。
2. 计算下面反应的焓变值:2H2(g) + O2(g) → 2H2O(l)3. 结合下面的数据计算反应的焓变值:反应1: C(graphite) + 2H2(g) → CH4(g) ΔH1 = ?反应2: C(graphite) + 2H2(g) + O2(g) → CH3OH(l) ΔH2 = -726 kJ反应3: CO(g) + 2H2(g) → CH3OH(l) ΔH3 = -91 kJ反应4: CO2(g) + 2H2(g) → CH3OH(l) ΔH4 = -195 kJ反应5: CO2(g) + 4H2(g) → CH4(g) + 2H2O(l) ΔH5 = ?反应6: CH3OH(l) → CH4(g) + 1/2O2(g) ΔH6 = ?4. 结合下面的反应焓变值计算反应的焓变值:反应1: 2H2(g) + O2(g) → 2H2O(g) ΔH1 = -572 kJ反应2: H2(g) → H2(g) + 1/2O2(g) ΔH2 = -286 kJ反应3: 2H2(g) → 2H2(g) + O2(g) ΔH3 = ?5. 如下为反应方程式和各反应物和产物的焓变值,请根据热力学定律判断该反应是放热还是吸热反应。
反应:2H2(g) + O2(g) → 2H2O(g) ΔH = -484 kJ答案与解析:1. 例如:2H2(g) + O2(g) → 2H2O(l) 反热为 -483.6 kJ2. 反应的焓变值为ΔH = -484 kJ解析:根据化学方程式,反应物的摩尔数系数为2,产物的摩尔数系数为2,所以焓变值也是反应方程式右边各物质的摩尔数系数与它们的焓变之和。
2018年高考化学(课标版)二轮复习+题型专项练+题型五化学反应与能量+Word版含解析(6)

gaokaoq高考圈-高中生升学规划平台题型五化学反响与能量+1.(2021XX十校模拟)研究说明N2O与CO在Fe作用下发生反响的能量变化及反响历程如下列图,以下说法错误的选项是()A. 反响总过程H<0B.Fe+使反响的活化能减小+C.FeO 也是该反响的催化剂D.Fe++N 2O FeO++N 2、 FeO+ +CO Fe++CO 2两步反响均为放热反响2.(2021XXXX二模):①2C(s)+O2(g)2CO(g)H =-217 kJ mol·-1② C(s)+H 2O(g)CO(g)+H 2(g)H=b kJ ·mol -1。
H — H、 O— H 和 O O 键的键能分别为 436 kJ ·mol-1、 462 kJ ·mol-1和 495 kJ ·mol -1 ,那么 b 为()A.+352B.+132C.-120D.-3303.(2021XXXX一模)以下装置由甲、乙局部组成(如下列图 ),甲是将废水中乙二胺 [H 2N(CH 2)2NH 2]氧化为环境友好物质形成的化学电源。
当电池工作时,以下说法错误的选项是()A. 甲中 H +透过质子交换膜由左向右移动B.M 极电极反响式 :H2N(CH2)2NH 2+4H2O-16e -2CO2↑ +N2↑++16HC.一段时间后 ,乙中 CuSO4溶液浓度根本保持不变D.当 N 极消耗0.25 mol O 2时 ,那么铁极增重 16g4.(2021XXXX三模):mol·-1①2H 2(g)+O 2(g)2H 2O(l)H=-571.6 kJ②2CH 3OH(l)+3O 2(g)2CO2(g)+4H 2O(l)H=-1 452 kJ mol·-1③H + (aq)+OH -(aq)H2O(l)H =-57.3 kJ mol·-1以下说法正确的选项是()A.H 2 (g)的燃烧热为 142.9 kJ mol·-1B.同质量的 H2(g) 和 CH 3OH(l) 完全燃烧 ,H2(g) 放出的热量多C. H2SO4(aq)+ Ba(OH) 2(aq)BaSO4(s)+H 2O(l)H=-57.3 kJ mol·-1D.3H 2(g)+CO 2(g)CH3OH(l)+H 2O(l)H=+131.4 kJ mol·-1? 导学号 40414148?5.(2021丰台区二模) 混合动力汽车(HEV) 中使用了镍氢电池,其工作原理如下列图 :1gaokaoq高考圈-高中生升学规划平台其中 M 为储氢合金 ,MH 为吸附了氢原子的储氢合金,KOH 溶液作电解液。
2018届二轮复习 有机化学基础 专题卷(全国通用) (1)

有机化学基础1.某饱和一元酯C5H10O2,在酸性条件下水解生成甲和乙两种有机物,乙在铜的催化作用下能被氧化为醛,满足以上条件的酯有()A.10种B.6种C.9种D.7种答案 B2.下列有关同分异构体数目的叙述中正确的是()A.C5H12有2种同分异构体B.分子式为C4H10O且能与金属钠反应的有机物有4种C.甲苯的一氯取代物只有3种D.C8H10中属于芳香烃的同分异构体只有三种答案 B3.分子式为C6H12O2的有机物,该物质能发生银镜反应,且在酸性条件下水解为A和B。
不考虑立体异构,满足条件的有机物的同分异构体共有()A.8种B.12种C.15种D.20种答案 A4.化合物A(C8H8O3)是由冬青树的叶经蒸汽蒸馏而得,因此又名冬青油。
它常用作饮料、牙膏、化妆品的香料,也用于制取止痛药、杀虫剂等。
化合物A有如下图所示转化关系(部分反应产物已略去):已知以下信息:①A的核磁共振氢谱表明其有六种不同化学环境的氢,且1 mol A与溴水反应最多消耗2 mol Br2;②羧酸盐与碱石灰共热可发生反应,如实验室制甲烷:CH3COONa+NaOH CH4↑+Na2CO3。
回答下列问题:(1)K的结构简式为。
(2)B→D的反应方程式为。
(3)F→H的反应类型为;按系统命名法命名,H的名称为。
(4)A的结构简式为。
(5)A的同分异构体中苯环上只有两个取代基且能发生银镜反应和显色反应的共有种,其中核磁共振氢谱有八种不同化学环境的氢原子的是和(写结构简式)。
答案(1)HCOOCH3(2)+NaOH+Na2CO3(3)取代反应2,4,6-三溴苯酚(4)(5)95.已知:①CH3CH CHCH2CH3 CH3COOH+CH3CH2COOH②R—CH CH2R—CH2—CH2—Br香豆素的核心结构是芳香内酯A,A经下列步骤可转变为水杨酸。
请回答下列问题:(1)下列有关A、B、C的叙述中不正确的是。
a.C中核磁共振氢谱共有8种峰b.A、B、C均可发生加聚反应c.1 mol A最多能和5 mol氢气发生加成反应d.B能与浓溴水发生取代反应(2)B分子中有2种含氧官能团,分别为和(填官能团名称),B→C的反应类型为。
高考化学二轮复习反应热与盖斯定律学案(全国通用)

2018届高三化学二轮复习自主导学案专题六 反应热与盖斯定律【高考分析】【课堂探究】1.联氨(又称联肼,N 2H 4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:(1)联氨分子的电子式为_____________,其中氮的化合价为____________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________。
(3)①2O 2(g)+N 2(g)=N 2O 4(l) △H 1②N 2(g)+2H 2(g)=N 2H 4(l) △H 2 ③O 2(g)+2H 2(g)=2H 2O(g) △H 3④2 N 2H 4(l) + N 2O 4(l)= 3N 2(g)+ 4H 2O(g) △H 4=-1048.9kJ/mol上述反应热效应之间的关系式为△H 4=________________,联氨和N 2O 4可作为火箭推进剂的主要原因为_________________________________________________。
【答案】(1)N H H N HH ;-2(2)NaClO+2NH 3=N 2H 4+NaCl+H 2O (3)△H 4=2△H 3-2△H 2-△H 1 ;2.已知反应2HI (g )=H 2(g) + I 2(g)的△H=+11kJ ·mol -1,1molH 2(g )、1molI 2(g )分子中化学键断裂时分别需要吸收436KJ 、151KJ 的能量,则1molHI (g )分子中化学键断裂时需吸收的能量为______________kJ 。
2993.(2014全国高考I 卷)乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。
回答下列问题: (2)已知:甲醇脱水反应①2CH 3OH(g)=CH 3OCH 3(g)+H 2O(g)H 1=-23.9KJ ·mol -1甲醇制烯烃反应②2CH 3OH(g)=C 2H 4 (g)+2H 2O(g)H 2=-29.1KJ ·mol -1乙醇异构化反应③CH 3CH 2OH(g)=CH 3OCH 3(g))H 3=+50.7KJ ·mol -1则乙烯气相直接水合反应C 2H 4 (g)+H 2O(g)=C 2H 5OH(g)H = KJ ·mol -1-45.5【规律方法/知识总结】——————————————[解题方法指导]——————————————首先需要熟练掌握盖斯定律,其次,平时积累起来的计算机巧在反应热的计算中基本适用。
高考化学二轮复习 专题13 化学反应中的热效应(含解析)
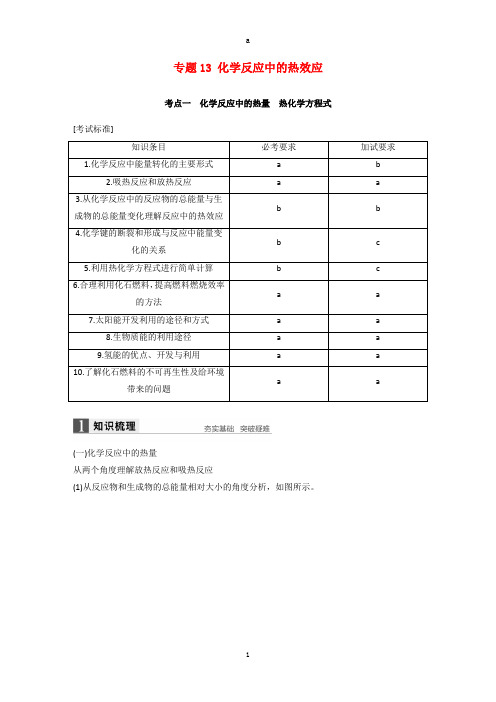
专题13 化学反应中的热效应考点一化学反应中的热量热化学方程式[考试标准]知识条目必考要求加试要求1.化学反应中能量转化的主要形式a b2.吸热反应和放热反应a a3.从化学反应中的反应物的总能量与生b b成物的总能量变化理解反应中的热效应4.化学键的断裂和形成与反应中能量变b c化的关系5.利用热化学方程式进行简单计算b c6.合理利用化石燃料,提高燃料燃烧效率a a的方法7.太阳能开发利用的途径和方式a a8.生物质能的利用途径a a9.氢能的优点、开发与利用a a10.了解化石燃料的不可再生性及给环境a a带来的问题(一)化学反应中的热量从两个角度理解放热反应和吸热反应(1)从反应物和生成物的总能量相对大小的角度分析,如图所示。
(2)从反应热的量化参数——键能的角度分析(3)记忆常见的放热反应和吸热反应放热反应:①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属跟酸的置换反应;⑤物质的缓慢氧化等。
吸热反应:①大多数分解反应;②盐类的水解和弱电解质的电离;③Ba(OH)2·8H2O与NH4Cl 反应;④碳和水蒸气、C和CO2的反应等。
(二)热化学方程式的书写1.注明反应条件反应热与测定条件(温度、压强等)有关。
绝大多数反应是在25 ℃、101 kPa下进行的,可不注明。
2.注明物质状态常用s、l、g、aq分别表示固体、液体、气体、溶液。
3.注意符号单位ΔH应包括“+”或“-”(“+”可省略)、数字和单位(kJ·mol-1)。
4.注意守恒关系(1)原子守恒和得失电子守恒;(2)能量守恒。
5.区别于普通方程式一般不标注“↑”、“↓”以及“点燃”、“加热”等。
6.注意热化学方程式的化学计量数热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,可以是整数,也可以是分数。
且化学计量数必须与ΔH 相对应,如果化学计量数加倍,则ΔH 也要加倍。
正误辨析正误判断,正确的打“√”,错误的打“×” (1)物质发生化学变化都伴有能量的变化(√) (2)放热反应不需要加热就能发生,吸热反应不加热不能发生 (×) (3)伴有能量变化的物质变化都是化学变化 (×) (4)化学反应中的能量变化不是单一的(√) (5)化学键断裂要吸收热量,也必定发生化学变化(×) (6)书写热化学方程式时,任何情况下都没必要注明反应条件 (×) (7)C(石墨,s)===C(金刚石,s) ΔH >0说明石墨比金刚石稳定(√)(8)已知:500 ℃、30 MPa 下,N 2(g)+3H 2(g)高温高压催化剂2NH 3(g) ΔH =-92.4 kJ·mol -1,将1.5 mol H 2和过量的N 2在此条件下充分反应,放出热量46.2 kJ(×)题组一 全面认识化学反应中的能量变化1.(2016·浙江乐清市芙蓉中学高一5月月考)下列反应属于吸热反应的是( ) A .稀硫酸与氢氧化钾溶液反应 B .碳与二氧化碳的反应 C .锌与稀硫酸的反应 D .生石灰变成熟石灰的反应 答案 B2.(2016·宁波市北仑中学高一期中)图为反应2H 2(g)+O 2(g)===2H 2O(g)的能量变化示意图。
2018届二轮 热学 专题卷 (全国通用)

第1讲热学高考命题轨迹考情分析本专题主要考查对物理概念和物理规律的理解以及简单的应用,比如热学的基本概念、气体实验定律、热力学定律等知识,对于热学的基本概念和热力学定律往往以选择题的形式出现,而气体实验定律往往以玻璃管或汽缸等为载体通过计算题的形式考查.知识方法链接1.分子动理论2.固体、液体(1)晶体和非晶体(2)液晶的性质液晶是一种特殊的物质,既可以流动,又可以表现出单晶体的分子排列特点,在光学物理性质上表现出各向异性.(3)液体的表面张力使液体表面有收缩到球形的趋势,表面张力的方向跟液面相切.(4)饱和汽压的特点液体的饱和汽压与温度有关,温度越高,饱和汽压越大,且饱和汽压与饱和汽的体积无关.(5)相对湿度某温度时空气中水蒸气的压强与同一温度时水的饱和汽压的百分比.即:B=pp s×100%.3.气体(1)(2)气体分子运动特点(3)对气体压强的理解①气体对容器壁的压强是气体分子频繁碰撞的结果,温度越高,气体分子密度越大,气体对容器壁因碰撞而产生的压强就越大.②地球表面大气压强可认为是大气重力产生的.4.热力学定律与气体实验定律知识结构真题模拟精练1.[物理——选修3-3](2017·全国卷Ⅰ·33(1))氧气分子在0 ℃和100 ℃温度下单位速率间隔的分子数占总分子数的百分比随气体分子速率的变化分别如图1中两条曲线所示.下列说法正确的是________.图1A.图中两条曲线下的面积相等B.图中虚线对应于氧气分子平均动能较小的情形C.图中实线对应于氧气分子在100 ℃时的情形D.图中曲线给出了任意速率区间的氧气分子数目E.与0 ℃时相比,100 ℃时氧气分子速率出现在0~400 m/s 区间内的分子数占总分子数的百分比较大答案ABC解析根据题图图线的物理意义可知,曲线下的面积表示总分子数,所以图中两条曲线下的面积相等,选项A正确;温度是分子平均动能的标志,且温度越高,速率大的分子所占比例较大,所以图中实线对应于氧气分子平均动能较大的情形,虚线对应于氧气分子平均动能较小的情形,选项B、C正确;根据曲线不能求出任意区间的氧气分子数目,选项D错误;由图线可知100 ℃时的氧气分子速率出现在0~400 m/s区间内的分子数占总分子数的百分比比0 ℃时的百分比小,选项E错误.2.[物理——选修3-3](2017·全国卷Ⅱ·33(1))如图2所示,用隔板将一绝热汽缸分成两部分,隔板左侧充有理想气体,隔板右侧与绝热活塞之间是真空.现将隔板抽开,气体会自发扩散至整个汽缸.待气体达到稳定后,缓慢推压活塞,将气体压回到原来的体积.假设整个系统不漏气.下列说法正确的是____________.图2A.气体自发扩散前后内能相同B.气体在被压缩的过程中内能增大C.在自发扩散过程中,气体对外界做功D.气体在被压缩的过程中,外界对气体做功E.气体在被压缩的过程中,气体分子的平均动能不变答案ABD解析因为汽缸、活塞都是绝热的,隔板右侧是真空,所以理想气体在自发扩散的过程中,既不吸热也不放热,也不对外界做功.根据热力学第一定律可知,气体自发扩散前后,内能不变,选项A正确,选项C错误;气体被压缩的过程中,外界对气体做功,气体内能增大,又因为一定质量的理想气体的内能只与温度有关,所以气体温度升高,分子平均动能增大,选项B、D正确,选项E错误.3.[物理——选修3-3](2017·全国卷Ⅲ·33(1))如图3所示,一定质量的理想气体从状态a出发,经过等容过程ab到达状态b,再经过等温过程bc到达状态c,最后经等压过程ca回到初态a.下列说法正确的是______.图3A.在过程ab中气体的内能增加B.在过程ca中外界对气体做功C.在过程ab中气体对外界做功D.在过程bc中气体从外界吸收热量E.在过程ca中气体从外界吸收热量答案ABD解析在过程ab中,体积不变,气体对外界不做功,压强增大,温度升高,内能增加,故选项A正确,C错误;在过程ca中,气体的体积缩小,外界对气体做功,压强不变,温度降低,内能变小,气体向外界放出热量,故选项B正确,E错误;在过程bc中,温度不变,内能不变,体积增大,气体对外界做功,由热力学第一定律可知,气体要从外界吸收热量,故选项D正确.4.(2017·江西鹰潭市一模)下列关于热学问题的说法正确的是________.A.一个孤立系统总是从熵小的状态向熵大的状态发展,熵值较大代表着较为无序B.物体的内能在宏观上只与其温度和体积有关C.如果封闭气体的密度变小,分子平均动能增加,则气体的压强可能不变D.某气体的摩尔质量为M、密度为ρ,用N A表示阿伏加德罗常数,每个气体分子的质量为m0,每个气体分子的体积为V0,则为m0=MN A,V0=m0ρE .密封在容积不变的容器内的气体,若温度升高,则气体分子对器壁单位面积上的平均作用力增大 答案 ACE解析 根据熵增加原理,一个孤立系统总是从熵小的状态向熵大的状态发展,故A 正确.物体的内能在宏观上与其物质的量、温度和体积有关,故B 错误;如果封闭气体的密度变小,可知其体积增大;温度是分子平均动能的标志,分子平均动能增加,即气体的温度升高;根据理想气体的状态方程:pVT =C 可知,气体的压强可能不变,故C 正确;气体的分子之间的距离较大,使用公式:V 0=m 0ρ求出的结果是每一个分子所占空间的大小,不是分子的体积,故D 错误;密封在容积不变的容器内的气体,若温度升高,根据理想气体的状态方程:pVT =C 可知气体的压强增大,再根据压强的定义可知气体分子对器壁单位面积上的平均作用力增大,故E 正确.5.(2017·广东广州市模拟)对于一定量的理想气体,下列说法正确的是________. A .当气体温度变化时,气体内能一定变化 B .若气体的内能不变,其状态也一定不变 C .若气体的压强和体积都不变,其内能也一定不变 D .若气体的温度随时间不断升高,其压强也一定不断增大 E .气体温度每升高1 K 所吸收的热量与气体经历的过程有关 答案 ACE解析 温度是分子平均动能的标志,温度发生变化时,分子的平均动能一定发生变化,而理想气体的内能仅仅与温度有关,所以当它的温度发生变化时,内能一定改变,故A 正确;由理想气体的状态方程pVT =C ,若气体的压强、体积不变,则T 一定不变,故内能一定不变,故C 正确;反之则不对,故B 错误;由理想气体的状态方程pVT =C 知,温度T 升高,pV 一定增大,但压强不一定增大,故D 错误;气体的温度每升高1 K ,内能的变化是相同的,而内能的变化与吸收的热量以及外界对气体做的功两个因素有关,所以气体的温度每升高1 K 所吸收的热量与气体经历的过程有关,故E 正确.6.(2017·湖南衡阳市第一次联考)关于生活中的热学现象,下列说法正确的是________. A .夏天和冬天相比,夏天的气温较高,水的饱和汽压较大,在相对湿度相同的情况下,夏天的绝对湿度较大B .民间常用“拨火罐”来治疗某些疾病,方法是用镊子夹一棉球,沾一些酒精,点燃,在罐内迅速旋转一下再抽出,迅速将火罐开口端紧压在皮肤上,火罐就会紧紧地被 “吸”在皮肤上,其原因是,当火罐内的气体体积不变时,温度降低,压强增大C.盛有氧气的钢瓶,在27 ℃的室内测得其压强是9.0×106 Pa.将其搬到-3 ℃的工地上时,测得瓶内氧气的压强变为7.8×106 Pa,通过计算可判断出钢瓶漏气D.汽车尾气中各类有害气体排入大气后严重污染了空气,想办法使它们自发地分离,既清洁了空气又变废为宝E.一辆空载的卡车停于水平地面,在缓慢装沙过程中,若车胎不漏气,胎内气体温度不变,不计分子间势能,则胎内气体向外界放热答案ACE知识方法链接1.应用气体实验定律的三个重点环节:(1)正确选择研究对象:对于变质量问题要保证研究质量不变的部分;对于多部分气体问题,要各部分独立研究,各部分之间一般通过压强找联系.(2)列出各状态的参量:气体在初、末状态,往往会有两个(或三个)参量发生变化,把这些状态参量罗列出来会比较准确、快速的找到规律.(3)认清变化过程:准确分析变化过程以便正确选用气体实验定律.2.气体压强的计算(1)力平衡法:选取与气体接触的液柱(或活塞)为研究对象进行受力分析,得到液柱(或活塞)的受力平衡方程,求得气体的压强.(2)等压面法:在连通器中,同一种液体(中间不间断)同一深度处压强相等.液体内深h处的总压强p=p0+ρgh,p0为液面上方的压强.固体密封的气体一般用力平衡法,液柱密封的气体一般用等压面法.3.气体做功特点(1)一般计算等压变化过程的功,即W=p·ΔV,然后结合其他条件,利用ΔU=W+Q进行相关计算.(2)注意符号正负的规定.若研究对象为气体,对气体做功的正负由气体体积的变化决定.气体体积增大,气体对外界做功,W<0;气体体积减小,外界对气体做功,W>0.真题模拟精练7.[物理——选修3-3](2017·全国卷Ⅰ·33(2))如图4所示,容积均为V 的汽缸A 、B 下端有细管(容积可忽略)连通,阀门K 2位于细管的中部,A 、B 的顶部各有一阀门K 1、K 3;B 中有一可自由滑动的活塞(质量、体积均可忽略).初始时,三个阀门均打开,活塞在B 的底部;关闭K 2、K 3,通过K 1给汽缸充气,使A 中气体的压强达到大气压p 0的3倍后关闭K 1.已知室温为27 ℃,汽缸导热.图4(ⅰ)打开K 2,求稳定时活塞上方气体的体积和压强; (ⅱ)接着打开K 3,求稳定时活塞的位置;(ⅲ)再缓慢加热汽缸内气体使其温度升高20 ℃,求此时活塞下方气体的压强. 答案 (ⅰ) V22p 0 (ⅱ)B 的顶部 (ⅲ)1.6p 0解析 (ⅰ)设打开K 2后,稳定时活塞上方气体的压强为p 1,体积为V 1.依题意,被活塞分开的两部分气体都经历等温过程.由玻意耳定律得 p 0V =p 1V 1① (3p 0)V =p 1(2V -V 1)② 联立①②式得 V 1=V 2③p 1=2p 0④(ⅱ)打开K 3后,由④式知,活塞必定上升.设在活塞下方气体与A 中气体的体积之和为V 2(V 2≤2V )时,活塞下气体压强为p 2,由玻意耳定律得 (3p 0)V =p 2V 2⑤ 由⑤式得 p 2=3VV 2p 0⑥由⑥式知,打开K 3后活塞上升直到B 的顶部为止; 此时p 2=32p 0(ⅲ)设加热后活塞下方气体的压强为p 3,气体温度从T 1=300 K 升高到T 2=320 K 的等容过程中,由查理定律得p 2T 1=p 3T 2⑦将有关数据代入⑦式得 p 3=1.6p 0⑧8.[物理——选修3-3](2017·全国卷Ⅱ·33(2))一热气球体积为V ,内部充有温度为T a 的热空气,气球外冷空气的温度为T b .已知空气在1个大气压、温度为T 0时的密度为ρ0,该气球内、外的气压始终都为1个大气压,重力加速度大小为g . (ⅰ)求该热气球所受浮力的大小; (ⅱ)求该热气球内空气所受的重力;(ⅲ)设充气前热气球的质量为m 0,求充气后它还能托起的最大质量. 答案 (ⅰ)Vgρ0T 0T b (ⅱ)Vgρ0T 0T a(ⅲ)Vρ0T 0(1T b -1T a)-m 0解析 (ⅰ)设1个大气压下质量为m 的空气在温度为T 0时的体积为V 0,密度为 ρ0=m V 0①在温度为T 时的体积为V T ,密度为 ρ(T )=m V T②由盖-吕萨克定律得 V 0T 0=V T T③ 联立①②③式得 ρ(T )=ρ0T 0T ④气球所受到的浮力为 F =ρ(T b )gV ⑤ 联立④⑤式得 F =Vgρ0T 0T b⑥(ⅱ)气球内热空气所受的重力为 G =ρ(T a )Vg ⑦ 联立④⑦式得 G =Vgρ0T 0T a⑧(ⅲ)设该气球还能托起的最大质量为M ,由力的平衡条件得 Mg =F -G -m 0g ⑨ 联立⑥⑧⑨式得M =Vρ0T 0(1T b -1T a)-m 0⑩9.[物理——选修3-3](2017·全国卷Ⅲ·33(2))一种测量稀薄气体压强的仪器如图5(a)所示,玻璃泡M 的上端和下端分别连通两竖直玻璃细管K 1和K 2.K 1长为l ,顶端封闭,K 2上端与待测气体连通;M 下端经橡皮软管与充有水银的容器R 连通.开始测量时,M 与K 2相通;逐渐提升R ,直到K 2中水银面与K 1顶端等高,此时水银已进入K 1,且K 1中水银面比顶端低h ,如图(b)所示.设测量过程中温度、与K 2相通的待测气体的压强均保持不变.已知K 1和K 2的内径均为d ,M 的容积为V 0,水银的密度为ρ,重力加速度大小为g .求:图5(ⅰ)待测气体的压强;(ⅱ)该仪器能够测量的最大压强. 答案 (ⅰ)ρπgh 2d 24V 0+πd 2(l -h )(ⅱ)πρgl 2d 24V 0解析 (ⅰ)水银面上升至M 的下端使玻璃泡中气体恰好被封住,设此时被封闭气体的体积为V ,压强等于待测气体的压强p .提升R ,直到K 2中水银面与K 1顶端等高时,K 1中水银面比顶端低h ;设此时封闭气体的压强为p 1,体积为V 1,则 V =V 0+14πd 2l ①V 1=14πd 2h ②由力学平衡条件得 p 1=p +ρgh ③整个过程为等温过程,由玻意耳定律得 pV =p 1V 1④ 联立①②③④式得 p =ρπgh 2d 24V 0+πd 2(l -h )⑤ (ⅱ)由题意知h ≤l ⑥ 联立⑤⑥式有p ≤πρgl 2d 24V 0⑦ 该仪器能够测量的最大压强为p max =πρgl 2d 24V 0⑧ 10.(2017·福建福州市3月质检) 某同学用粗细均匀,一端封闭一端开口的U 形玻璃细管,用水银封闭一定量空气,空气可近似看成理想气体,如图6所示.在室温t =27 ℃,大气压强p 0=75 cmHg 时进行实验,先是开口朝上竖直放置时,测得两管水银面高差h =5 cm ,封闭空气柱的长度L 1=15 cm ,开口端玻璃管足够长.图6(1)将左右两玻璃管缓慢平躺在水平桌面时,求封闭空气柱的长度L 2;(2)接着缓慢将玻璃管开口朝下竖直放置,若左侧玻璃管仍有水银存在,求这时封闭空气柱的长度L 3;(3)为确保(2)问中左侧玻璃管始终有水银,则左侧玻璃管总长度L 至少多长?答案 (1)16 cm (2)30 cm 或20 cm (3) 20 cm解析 (1)对封闭气体,玻璃管开口朝上时:p 1=p 0+h =80 cmHgV 1=L 1S =15S平躺在水平桌面时:p 2=p 0=75 cmHgV 2=L 2S因为等温过程,由玻意耳定律得p 1V 1=p 2V 2解得L 2=16 cm(2)当开口朝下竖直放置时,设封闭空气柱长度改变量为ΔL ,此时封闭气体的状态:p 3=p 0-h -2ΔL =(70-2ΔL ) cmHgV 3=(L 1+ΔL )S =(15+ΔL )S由开口向上到开口向下,依然认为是等温过程由玻意耳定律得p 1V 1=p 3V 3得80×15S =(70-2ΔL )(15+ΔL )S解得ΔL 2-20ΔL +75=0即(ΔL -15)(ΔL -5)=0得ΔL 1=15 cm ,ΔL 2=5 cm空气柱长度L 3=L 1+ΔL 1=30 cmL 3′=L 1+ΔL 2=20 cm(3)为确保第(2)问中左侧玻璃管始终有水银,则左侧玻璃管总长度L至少为:L=L1+ΔL2=(15+5) cm=20 cm11.(2017·山东枣庄市一模)如图7所示,两端开口的U型管粗细均匀,左右两管竖直,底部的直管水平.水银柱的长度如图中标注所示,水平管内两段空气柱a、b的长度分别为10 cm、5 cm.在左管内缓慢注入一定量的水银,稳定后右管的水银面比原来升高了h=10 cm.已知大气压强p0=76 cmHg,求向左管注入的水银柱长度.图7答案21.5 cm解析设初状态a、b两部分空气柱的压强为p1,由题意知:p1=90 cmHg因右管水银面升高的高度10 cm<12 cm,故b空气柱仍在水平直管内.设末状态a、b两部分空气柱的压强为p2,则:p2=100 cmHg设末状态a、b两部分空气柱的长度分别为L a2、L b2.对a部分空气柱,根据玻意耳定律:p1L a1S=p2L a2S对b部分空气柱,根据玻意耳定律:p1L b1S=p2L b2S代入数据解得:L a2=9 cm,L b2=4.5 cm设左管所注入的水银柱长度为L,由几何关系得:L=2h+(L a1+L b1)-(L a2+L b2)代入数据解得:L=21.5 cm.12.(2017·福建厦门市3月质检)如图8所示,内壁光滑的水平放置的汽缸被两个活塞分成A、B、C三部分,两活塞间用轻杆连接,活塞厚度不计,在E、F两处设有限制装置,使左边活塞只能在E、F之间运动,E、F之间的容积为0.1V0.开始时左边活塞在E处,A部分的容积为V0,A缸内气体的压强为0.9p0(p0为大气压强),温度为297 K;B部分的容积为1.1V0,B 缸内气体的压强为p0,温度恒为297 K,C缸内为真空.现缓慢加热A汽缸内气体,直至399.3 K.求:图8(1)活塞刚离开E处时的温度T E;(2)A缸内气体最后的压强p.答案(1)330 K(2)1.1p0解析(1)活塞刚要离开E时,A缸内气体体积V0保持不变,根据平衡方程得p E=p0①对A缸内气体,由查理定律得:0.9p0 T1=p0 T E②T1=297 K③联立①②③解得:T E=330 K(2)随A缸内气体温度继续增加,A缸内气体压强增大,活塞向右滑动,B缸内气体体积减小,压强增大.设A缸内气体温度到达T2=399.3 K时,活塞向右移动的体积为ΔV,且未到达F处根据活塞平衡方程可得:p A=p B=p④对A缸内气体,根据理想气体状态方程可得:0.9p0·V0T1=p A·(V0+ΔV)T2⑤对B缸内气体,由玻意耳定律可得:p0·1.1V0=p B·(1.1V0-ΔV)⑥联立④⑤⑥解得:ΔV=0.1V0,p=1.1p0此时活塞刚好移动到F所以此时A缸内气体的最后压强p=1.1p0.专题规范练题组1高考真题体验1.[物理——选修3-3](2016·全国卷Ⅰ·33)(1)关于热力学定律,下列说法正确的是________.A.气体吸热后温度一定升高B.对气体做功可以改变其内能C.理想气体等压膨胀过程一定放热D.热量不可能自发地从低温物体传到高温物体E.如果两个系统分别与状态确定的第三个系统达到热平衡,那么这两个系统彼此之间也必定达到热平衡(2)在水下气泡内空气的压强大于气泡表面外侧水的压强,两压强差Δp与气泡半径r之间的关系为Δp =2σr,其中σ=0.070 N /m.现让水下10 m 处一半径为0.50 cm 的气泡缓慢上升.已知大气压强p 0=1.0×105 Pa ,水的密度ρ=1.0×103 kg/m 3,重力加速度大小g =10 m/s 2. (ⅰ)求在水下10 m 处气泡内外的压强差;(ⅱ)忽略水温随水深的变化,在气泡上升到十分接近水面时,求气泡的半径与其原来半径之比的近似值.答案 (1)BDE (2)(ⅰ)28 Pa (ⅱ)32解析 (1)气体内能的改变ΔU =Q +W ,故对气体做功可以改变气体内能,B 选项正确;气体吸热为Q ,但不确定外界做功W 的情况,故不能确定气体温度变化,A 选项错误;理想气体等压膨胀,W <0,由理想气体状态方程pV T=C ,p 不变,V 增大,气体温度升高,内能增大,ΔU >0,由ΔU =Q +W ,知Q >0,气体一定吸热,C 选项错误;由热力学第二定律知D 选项正确;根据热平衡性质知E 选项正确.(2)(ⅰ)由公式Δp =2σr 得Δp =2×0.0705×10-3Pa =28 Pa 水下10 m 处气泡内外的压强差是28 Pa.(ⅱ)气泡上升过程中做等温变化,由玻意耳定律得p 1V 1=p 2V 2①其中,V 1=43πr 31② V 2=43πr 32③ 由于气泡内外的压强差远小于10 m 深处水的压强,气泡内压强可近似等于对应位置处的水的压强,所以有p 1=p 0+ρgh 1=1×105 Pa +1×103×10×10 Pa=2×105 Pa =2p 0④p 2=p 0⑤将②③④⑤代入①得,2p 0×43πr 31=p 0×43πr 322r 31=r 32r 2r 1=32 2.[物理——选修3-3](2016·全国卷Ⅱ·33)(1) 一定量的理想气体从状态a 开始,经历等温或等压过程ab 、bc 、cd 、da 回到原状态,其p —T 图象如图1所示,其中对角线ac 的延长线过原点O .下列判断正确的是________.图1A .气体在a 、c 两状态的体积相等B .气体在状态a 时的内能大于它在状态c 时的内能C .在过程cd 中气体向外界放出的热量大于外界对气体做的功D .在过程da 中气体从外界吸收的热量小于气体对外界做的功E .在过程bc 中外界对气体做的功等于在过程da 中气体对外界做的功(2)一氧气瓶的容积为0.08 m 3,开始时瓶中氧气的压强为20个大气压.某实验室每天消耗1个大气压的氧气0.36 m 3.当氧气瓶中的压强降低到2个大气压时,需重新充气.若氧气的温度保持不变,求这瓶氧气重新充气前可供该实验室使用多少天.答案 (1)ABE (2)4天解析 (1)由理想气体状态方程pV T =C 得,p =C VT ,由题图图象可知,V a =V c ,选项A 正确;理想气体的内能只由温度决定,而T a >T c ,故气体在状态a 时的内能大于在状态c 时的内能,选项B 正确;由热力学第一定律ΔU =Q +W 知,cd 过程温度不变,内能不变,则Q =-W ,选项C 错误;da 过程温度升高,即内能增大,则吸收的热量大于对外界做的功,选项D 错误;由理想气体状态方程知:p a V a T a =p b V b T b =p c V c T c =p d V d T d=C ,即p a V a =CT a ,p b V b =CT b ,p c V c =CT c ,p d V d =CT d .设过程bc 中压强为p 0=p b =p c ,过程da 中压强为p 0′=p d =p a .由外界对气体做功W =p ·ΔV 知,过程bc 中外界对气体做的功W bc =p 0(V b -V c )=C (T b -T c ),过程da 中气体对外界做的功W da =p 0′(V a -V d )=C (T a -T d ),T a =T b ,T c =T d ,故W bc =W da ,选项E 正确.(2)方法一 设氧气开始时的压强为p 1,体积为V 1,压强变为p 2(2个大气压)时,体积为V 2.根据玻意耳定律得p 1V 1=p 2V 2①重新充气前,用去的氧气在p 2压强下的体积为V 3=V 2-V 1②设用去的氧气在p 0(1个大气压)压强下的体积为V 0,则有p 2V 3=p 0V 0③设实验室每天用去的氧气在p 0下的体积为ΔV ,则氧气可用的天数为N =V 0ΔV④ 联立①②③④式,并代入数据得N =4(天)⑤方法二 对氧气瓶内的氧气,由于温度保持不变,由玻意耳定律和总质量不变得 p 1V 1=np 2V 2+p 3V 1其中p 1=20个大气压 V 1=0.08 m 3p 2=1个大气压 V 2=0.36 m 3p 3=2个大气压代入数值得n =4(天)3.[物理——选修3-3](2016·全国卷Ⅲ·33)(1)关于气体的内能,下列说法正确的是________.A .质量和温度都相同的气体,内能一定相同B .气体温度不变,整体运动速度越大,其内能越大C .气体被压缩时,内能可能不变D .一定量的某种理想气体的内能只与温度有关E .一定量的某种理想气体在等压膨胀过程中,内能一定增加(2) 一U 形玻璃管竖直放置,左端开口,右端封闭,左端上部有一光滑的轻活塞.初始时,管内汞柱及空气柱长度如图2所示.用力向下缓慢推活塞,直至管内两边汞柱高度相等时为止.求此时右侧管内气体的压强和活塞向下移动的距离.已知玻璃管的横截面积处处相同;在活塞向下移动的过程中,没有发生气体泄漏;大气压强p 0=75.0 cmHg.环境温度不变.(保留三位有效数字)图2答案 (1)CDE (2)144 cmHg 9.42 cm解析 (1)质量和温度都相同的气体,虽然分子平均动能相同,但是不同的气体,其摩尔质量不同,即分子个数不同,所以分子总动能不一定相同,A 错误;宏观运动和微观运动没有关系,所以宏观运动速度大,内能不一定大,B 错误;根据pV T=C 可知,如果等温压缩,则内能不变;等压膨胀,温度增大,内能一定增大,C 、E 正确;理想气体的分子势能为零,所以理想气体的内能与分子平均动能有关,而分子平均动能和温度有关,D 正确.(2)设初始时,右管中空气柱的压强为p 1,长度为l 1;左管中空气柱的压强为p 2=p 0,长度为l 2.活塞被下推h 后,右管中空气柱的压强为p 1′,长度为l 1′;左管中空气柱的压强为p 2′,长度为l 2′.以cmHg 为压强单位.由题给条件得p 1=p 0+(20.0-5.00) cmHg =90 cmHg ,l 1=20.0 cm ①l 1′=(20.0-20.0-5.002) cm =12.5 cm ② 由玻意耳定律得p 1l 1S =p 1′l 1′S ③联立①②③式和题给条件得p 1′=144 cmHg ④依题意p 2′=p 1′,l 2=4 cm ⑤l 2′=4.00 cm +20.0-5.002cm -h =11.5 cm -h ⑥ 由玻意耳定律得p 2l 2S =p 2′l 2′S ⑦联立④⑤⑥⑦式和题给条件得h ≈9.42 cm.4.[物理——选修3-3](2015·全国卷Ⅰ·33)(1)下列说法正确的是________.A .将一块晶体敲碎后,得到的小颗粒是非晶体B .固体可以分为晶体和非晶体两类,有些晶体在不同方向上有不同的光学性质C .由同种元素构成的固体,可能会由于原子的排列方式不同而成为不同的晶体D .在合适的条件下,某些晶体可以转化为非晶体,某些非晶体也可以转化为晶体E .在熔化过程中,晶体要吸收热量,但温度保持不变,内能也保持不变(2) 如图3所示,一固定的竖直汽缸由一大一小两个同轴圆筒组成,两圆筒中各有一个活塞.已知大活塞的质量为m 1=2.50 kg ,横截面积为S 1=80.0 cm 2;小活塞的质量为m 2=1.50 kg ,横截面积为S 2=40.0 cm 2;两活塞用刚性轻杆连接,间距为l =40.0 cm ;汽缸外大气的压强为p=1.00×105 Pa ,温度为T =303 K .初始时大活塞与大圆筒底部相距l 2,两活塞间封闭气体的温度为T 1=495 K .现汽缸内气体温度缓慢下降,活塞缓慢下移.忽略两活塞与汽缸壁之间的摩擦,重力加速度大小g 取 10 m/s 2.求:图3(ⅰ)在大活塞与大圆筒底部接触前的瞬间,汽缸内封闭气体的温度;(ⅱ)缸内封闭的气体与缸外大气达到热平衡时,缸内封闭气体的压强.答案 (1)BCD (2)(ⅰ)330 K (ⅱ)1.01×105 Pa解析 (1)晶体有固定的熔点,并不会因为颗粒的大小而改变,即使敲碎为小颗粒,仍旧是晶体,选项A 错误;固体分为晶体和非晶体两类,有些晶体在不同方向上光学性质不同,表现为晶体具有各向异性,选项B 正确;同种元素构成的固体可能由于原子的排列方式不同而形成不同的晶体,如金刚石和石墨,选项C 正确;晶体的分子排列结构如果遭到破坏就可能形成非晶体,反之亦然,选项D 正确;熔化过程中,晶体要吸热,温度不变,但是内能增大,选项E 错误.(2)(ⅰ)大小活塞在缓慢下移过程中,受力情况不变,汽缸内气体压强不变,由盖—吕萨克定律得V 1T 1=V 2T 2初状态V 1=l 2(S 1+S 2),T 1=495 K 末状态V 2=lS 2代入可得T 2=23T 1=330 K (ⅱ)对大、小活塞受力分析则有m 1g +m 2g +pS 1+p 1S 2=p 1S 1+pS 2可得p 1=1.1×105 Pa缸内封闭的气体与缸外大气达到热平衡过程中,气体体积不变,由查理定律得p 1T 2=p 2T 3T 3=T =303 K解得p 2=1.01×105 Pa5.[物理-选修3-3](2015·全国卷Ⅱ·33)(1)关于扩散现象,下列说法正确的是________.A .温度越高,扩散进行得越快B .扩散现象是不同物质间的一种化学反应C .扩散现象是由物质分子无规则运动产生的D .扩散现象在气体、液体和固体中都能发生E .液体中的扩散现象是由于液体的对流形成的。
2018届高考化学二轮复习 化学反应与能量 专题卷(全国通用)

化学反应与能量第Ⅰ卷(选择题,共50分)一、选择题(本大题共20小题,每小题2.5分,共50分。
每小题只有一个选项符合要求)1.下列图片所示内容的能量转化方式为化学能转化为热能的是()答案 C解析钻木取火是机械能转化为热能,A项错误;电炉取暖是电能转化为热能,B项错误;酒精燃烧是化学能转化为热能,C项正确;手机充电是电能与化学能的相互转化,D项错误。
2.已知反应X+Y===M+N为放热反应,对该反应的下列说法中正确的是()A.X的能量一定高于M和N的能量B.X和Y的总能量一定高于M和N的总能量C.Y的能量一定高于N的能量D.因该反应为放热反应,故不必加热就可发生答案 B解析X+Y===M+N为放热反应,说明反应物的总能量一定高于生成物的总能量,即X和Y的总能量一定高于M和N的总能量,B 项正确,A 、C 项均错误;有些放热反应加热后才能发生,如铝热反应,D 项错误。
3.已知w g 液态苯(C 6H 6)完全燃烧生成2 mol CO 2气体和1 mol 液态水,并放出m kJ 的热量,下列能正确表示苯燃烧热的热化学方程式的是( )A .2C 6H 6(l)+15O 2(g)===12CO 2(g)+6H 2O(l) ΔH =-2m kJ·mol -1B.13C 6H 6(l)+52O 2(g)===2CO 2(g)+H 2O(l) ΔH =-m kJ·mol -1 C .C 6H 6(l)+152O 2(g)===6CO 2(g)+3H 2O(l) ΔH =-m kJ·mol -1 D .C 6H 6(l)+152O 2(g)===6CO 2(g)+3H 2O(l) ΔH =-3m kJ·mol -1答案 D解析 25 ℃,101 kPa 时,1 mol 物质完全燃烧生成稳定的化合物时放出的热量为该物质的燃烧热,故热化学方程式中可燃物的化学计量数为1,A 、B 项错误。
化学反应的热效应专题复习(含答案)

化学反应的热效应专题复习1.对下列化学反应的热现象的说法不.正确的是()①化学反应中的能量变化都表现为热量变化②化学反应发生过程中一定有能量变化③吸热反应需要加热后才能发生④化学反应吸收或放出热量的多少与参加反应的物质的多少有关A.①②B.②③C.①③D.②④解析:选C。
化学反应中的能量变化,通常主要表现为热量的变化,还有可能表现为光能、电能等,①错误;不同的物质所具有的能量不同,只要物质发生变化,能量就会变化,且能量变化的多少与参加反应的物质多少成正比,②、④正确;吸、放热反应与反应条件无关,③错误。
2.已知反应X+Y===M+N为放热反应,对该反应的说法正确的是()A.X的能量一定高于MB.Y的能量一定高于NC.X和Y的总能量一定高于M和N的总能量D.因为该反应为放热反应,故不必加热就可发生解析:选C。
该反应为放热反应,所以X和Y的总能量一定高于M和N的总能量,放热反应的发生有的需要加热,如煤的燃烧、铝热反应等。
3.下列属于吸热反应的是()A.金属钠与水的反应B.氢气燃烧C.浓硫酸的稀释D.Ba(OH)2·8H2O和NH4Cl(固体)混合解析:选D。
活泼金属与水(或酸)的反应、燃烧均为放热反应;浓H2SO4溶于水为放热过程;Ba(OH)2·8H2O与NH4Cl反应为吸热反应,D正确。
4.(2011年南京高一检测)化学反应A2+B2===2AB的能量变化如图所示,则下列说法正确的是()A.该反应是吸热反应B.断裂1 mol A—A键和1 mol B—B键能放出x kJ能量C.断裂2 mol A—B键需要吸收y kJ的能量D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量解析:选C。
从能量变化图上可以看出,反应物总能量高于生成物总能量,该反应是放热反应,A、D错;断键时要吸收能量,B错,C正确。
5.如图所示,把试管小心地放入盛有(20 ℃)碳酸饮料的烧杯中,试管中开始放入几小块铝片,再用滴管滴加5 mL浓NaOH溶液于试管中,试回答下列问题:(1)实验中观察到的现象是________________________________________________________________________ ________________________________________________________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学反应中的热效应1.图K16-1下列四组选项中,全部符合图K16-1中阴影部分的能源是( )A.潮汐能、煤炭、石油B.海洋能、地热能、核能C.天然气、水能、生物能D.风能、太阳能、沼气2.已知反应A+B===C+D的能量变化如图K16-2所示,图K16-2下列说法正确的是( )A.该反应为放热反应B.该反应为吸热反应C.反应物的总能量高于生成物的总能量D.该反应只有在加热条件下才能进行3.强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。
分别向 1 L 0.5 mol·L-1的NaOH溶液中加入:①稀醋酸、②浓H2SO4、③稀硝酸,恰好完全反应的热效应分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是( ) A.ΔH1>ΔH2>ΔH3 B.ΔH2<ΔH1<ΔH3C.ΔH1=ΔH2=ΔH3 D.ΔH1>ΔH3>ΔH24.根据碘与氢气反应的热化学方程式①I2(g)+H2(g)2HI(g) ΔH=-9.48 kJ/mol②I2(s)+H2(g) 2HI(g) ΔH=+26.48 kJ/mol下列判断正确的是( )A.254 g I2(g)中通入 2 g H2(g),反应放热9.48 kJB.1 mol 固态碘与 1 mol 气态碘所含的能量相差17.00 kJC.反应①的产物比反应②的产物稳定D.反应②的反应物总能量比反应①的反应物总能量低5.在催化剂作用下,H2O2发生分解,其反应能量随反应的过程变化如图K16-3:图K16-3下列说法正确的是( )A.H2O2分解反应的ΔH>0B.催化剂的加入使反应的热效应减小C.催化剂的加入提高了H2O2的分解率D.催化剂通过改变反应历程、降低反应的活化能来提高H2O2分解速率6.H2和I2在一定条件下能发生反应H2(g)+I2(g)2HI(g) ΔH=-a kJ·mol-1。
已知:图K16-4下列说法正确的是( )A.H2、I2和HI分子中的化学键都是非极性共价键B.断开 2 mol HI分子中的化学键所需吸收能量约为(c+b+a) kJC.相同条件下,1 mol H2(g)和 1 mol I2(g)的总能量小于 2 mol HI(g)的总能量D.向密闭容器中加入 2 mol H2(g)和 2 mol I2(g),充分反应后放出的热量为2a kJ 7.合成二甲醚的三步反应如下:2H2(g)+CO(g)CH3OH(g) ΔH12CH3OH (g)CH3OCH3 (g)+H2O(g) ΔH2CO(g)+H2O(g)CO2(g)+H2(g) ΔH3则3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)的ΔH是( )A.ΔH=2ΔH1+ΔH2+ΔH3B.ΔH=ΔH1+ΔH2+ΔH3C.ΔH=ΔH1+2ΔH2+2ΔH3D.ΔH=2ΔH1+ΔH2-ΔH38.运载火箭以液氢为燃烧剂,液氧为氧化剂。
已知:①H2(g) ===H2(l) ΔH=-0.92 kJ·mol-1②O2(g) ===O2(l) ΔH=-6.84 kJ·mol-1③图K16-5下列说法正确的是( )A.2 mol H2(g)与 1 mol O2(g)所具有的总能量比 2 mol H2O(g)所具有的总能量低B.氢气的燃烧热为ΔH=-241.8 kJ·mol-1C.火箭中液氢燃烧的热化学方程式为2H2(l)+O2(l) ===2H2O(g) ΔH=-474.92 kJ·mol -1D.H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量9.一定条件下,用甲烷可以消除氮的氧化物的污染。
已知:①CH4(g)+4NO2(g) ===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1②CH4(g)+4NO(g) ===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160 kJ·mol-1下列选项不正确的是( )A.CH4(g)+2NO2(g) ===N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1B.CH4(g)+4NO2(g) ===4NO(g)+CO2(g)+2H2O(l) ΔH<ΔH1C.若用 0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJD.若用标准状况下 2.24 L CH4还原NO2至N2,整个过程中转移的电子为 0.8 mol10.某实验小组用 0.50 mol·L-1NaOH溶液和 0.50 mol·L-1硫酸溶液进行中和热的测定。
图K16-6(1)写出该反应的热化学方程式[生成 1 mol H2O(l)时的反应热为-57.3 kJ·mol-1]:________________________________________________________________________。
(2)取 50 mL NaOH溶液和 30 mL 硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:②近似认为 0.50 mol·L-1NaOH溶液和 0.50 mol·L-1硫酸溶液的密度都是 1.0 g·mL-1,中和后生成溶液的比热容c=4.18 J/(g·℃)。
则生成 1 mol H2O(l)时的反应热ΔH=________(取小数点后一位)。
11.燃煤厂为减少SO2的排放,可采取以下措施:(1)洗涤含SO2的烟气,下列物质可作洗涤剂的是________。
a .浓氨水b .NaHCO 3c .FeCl 3d .NaHSO 3(2)将煤转化为清洁气体燃料,过程如图K167所示:图K16-7已知:反应①生成 1 mol CO(g)的反应热ΔH =-110.5 kJ/mol ,反应②生成 1 mol H 2O(g)的反应热ΔH =-241.6 kJ/mol ,焦炭与水蒸气反应的热化学方程式是________________________________________________________________________。
12.(1)室温下,2 g 苯(C 6H 6)完全燃烧生成液态水和CO 2,放出83.6 kJ 的热量,写出 1 mol C 6H 6完全燃烧的热化学方程式:_________________________________。
若 1 g 水蒸气转化成液态水时放出2.44 kJ 的热量,则室温下 1 mol C 6H 6完全燃烧生成水蒸气时的ΔH 为__________________。
(2)已知:Fe 2O 3(s)+32C(s) ===32CO 2(g)+2Fe(s) ΔH =+234.1 kJ/molC(s)+O 2(g) ===CO 2(g) ΔH =-393.5 kJ/mol 则2Fe(s)+32O 2(g) ===Fe 2O 3(s)的ΔH 为________。
(3)已知下列两个热化学方程式:H 2(g)+O 2(g) ===H 2O(l) ΔH =-285.8 kJ/molC 3H 8(g)+5O 2(g) ===3CO 2(g)+4H 2O(l) ΔH =-2 220.0 kJ/mol①实验测得H2和C3H8的混合气体共 5 mol,完全燃烧生成液态水时放热6 262.5 kJ,则混合气体中H2和C3H8的体积之比约为________。
②已知:H2O(l) ===H2O(g) ΔH=+44.0 kJ/mol求丙烷燃烧生成CO2和气态水的ΔH为_______________。
答案及部分解析1.D2.B [解析] 根据题给图像知,反应物的总能量低于生成物的总能量,该反应为吸热反应,A、C错误;某些吸热反应不需要加热也可以发生,D错误。
3.D [解析] 因醋酸的电离吸热,浓硫酸溶于水放热,则恰好完全反应时放出的热量为②>③>①,所以ΔH2<ΔH3<ΔH1,故选D。
4.D [解析] 因为反应为可逆反应,所以不能进行彻底,放热小于9.48 kJ,A错误;由盖斯定律②-①得,I 2(s) I2(g) ΔH=+35.96 kJ/mol,B错误;一样稳定,都是气态的碘化氢,C错误;对于同一物质,固态物质的能量比气态物质能量低,因此反应②的反应物总能量比反应①的反应物总能量低,正确,选D。
5.D [解析] 根据图可知反应物能量高,生成物能量低,过氧化氢的分解属于放热反应,A 错误;催化剂能改变反应的活化能,不能改变反应的热效应,B错误;催化剂仅能改变化学反应速率,不能改变反应物的分解率,C错误;催化剂通过改变反应历程、降低反应的活化能来提高H2O2分解速率,D正确。
6.B [解析] A项,HI分子中的化学键是极性键;B项,由热化学方程式可知,反应放出a kJ的能量,其中断开1 mol I2和1 mol H2中的化学键共吸收(b+c) kJ的能量,则形成2 molHI 分子中的化学键需放出(a +b +c) kJ 的能量,那么断开2 mol HI 分子中的化学键就需吸收(a +b +c) kJ 的能量;C 项,反应是放热反应,所以1 mol H 2(g)和1 mol I 2(g)的总能量高于2 mol HI(g)的总能量;D 项,反应是可逆反应,放出的热量应小于2a kJ 。
7.A [解析] 已知合成二甲醚的三步反应如下: ①2H 2(g)+CO(g)CH 3OH(g) ΔH1 ②2CH 3OH(g)CH 3OCH 3(g)+H 2O(g) ΔH2③CO(g)+H 2O(g)CO 2(g)+H 2(g) ΔH3由盖斯定律可知,通过①×2+②+③可得所求反应方程式,则ΔH =2ΔH 1+ΔH 2+ΔH 3,故选A 。
8.C [解析] 由图像分析,2 mol H 2(g)与1 mol O 2(g)反应生成2 mol H 2O(g),放出483.6 kJ 的热量,故2 mol H 2 (g)与1 mol O 2(g)所具有的总能量比2 mol H 2O(g)所具有的总能量高,A 项错误;氢气的燃烧热是指1 mol 氢气完全燃烧生成液态水时放出的热量,故氢气的燃烧热ΔH =-483.6+882kJ ·mol -1=-285.8 kJ ·mol -1,B 项错误;③2H 2(g)+O 2(g)===2H 2O(g) ΔH =-483.6 kJ ·mol -1,①H 2(g)===H 2(l) ΔH =-0.92 kJ ·mol -1,②O 2(g)===O 2(l) ΔH =-6.84 kJ ·mol -1,根据盖斯定律,由③-①×2-②可得2H 2(l)+O 2(l)===2H 2O(g) ΔH =-474.92 kJ ·mol -1,C 项正确;H 2O(g)生成H 2O(l)为物理变化,不存在化学键的断裂和生成,D 项错误。
