钠及钠的化合物
高一化学钠及其化合物笔记

高一化学钠及其化合物笔记
1.钠的基本性质:钠是一种银白色的金属,在空气中易氧化,与水反应产生氢气和氢氧化钠。
2. 钠的化合物:钠主要形成氯化钠、碳酸钠、硫酸钠等化合物。
3. 氯化钠:氯化钠是钠的最常见化合物,被广泛用于食品加工和腌制,也是制备其他钠化合物的重要原料。
4. 碳酸钠:碳酸钠是一种重要的工业原料,用于玻璃制造、纺织工业、造纸工业等。
5. 硫酸钠:硫酸钠是一种重要的化学原料,在制造洗涤剂、颜料、纤维素等方面具有广泛的应用。
6. 钠与生命:钠在人体中起着重要的作用,参与调节细胞内外液体的平衡,维持神经、肌肉等组织的正常功能。
7. 钠的危害:过量的摄入钠会引起高血压、心脏病等健康问题,需要合理控制钠的摄入量。
8. 钠的环境影响:含钠的废水对水生生物和水环境具有一定的危害,需要加强环保措施,减少钠的排放。
- 1 -。
几种重要的金属化合物钠和钠的化合物

白色固体 -2价 价 常温 不稳定
Na2O+H2O=2NaOH Na2O+CO2=Na2CO3
生成条件 稳定性 与水反应 与CO2反应 特性 用途
— —
强氧化性、 强氧化性、漂白性 供氧剂、 供氧剂、漂白剂
三 碳酸钠和碳酸氢钠 俗 名
Na2CO3 俗 名 纯碱或苏打 NaHCO3 小苏打 —— 结晶水合物 Na2CO3.10H2O
碳酸钠和碳酸氢钠的相互转变
2NaHCO3 = Na2CO3 + H2O + CO2
固体
△
NaHCO3 + NaOH = Na2CO3 + CO2 + H2O = 2NaHCO3
溶液
Na2CO3
正盐
CO2 + H2O 加OH—或△
NaHCO3
酸式盐
表2:碳酸钠与碳酸氢钠的比较 :
碳酸钠 化学式 式量 俗名 颜色状态 水溶性 与酸反应 热稳定性 用途 碳酸氢钠
Na2CO3 106 纯碱、 纯碱、苏打 白色粉末
(250C溶解度为 克) 溶解度为33克 溶解度为
NaHCO3 84 小苏打 细小白色晶体
(250C溶解度为 克) 溶解度为9克 溶解度为
Na2CO3+2HCl=2NaCl+H2O+CO2 ↑ NaHCO3+HCl=NaCl+H2O+CO2 ↑
NaHCO3
白色粉未,加水部分溶 白色粉未 加水部分溶 解,感受不到热量变化
仍有固体残留 溶液变微红色
加水部分溶解, 加水部分溶解,溶液 的碱性比Na 的碱性比 2CO3弱
溶液变红色
加水先变成含结晶 水的晶体, 水的晶体,溶液的 碱性比NaHCO3强 碱性比
金属钠和铝有关的化学反应方程式

金属钠与铝的化学方程式总结一、钠及钠的化合物1.呼吸面具中发生的反应化学:2Na 2O 2+2H 2O=4NaOH+O 2↑2Na 2O 2+2CO 2 =2Na 2CO 3+O 22、钠在空气中缓慢氧化化学: 4Na+O 2=2Na 2O (白色固体,不稳定)3、钠在空气或氧气中加热或点燃(写出生成物的颜色)化学: 2Na+O 2 = Na 2O 2 (淡黄色固体,稳定)4、钠与水的反应(写出反应的现象) 化学: 2Na+2H 2O=2NaOH+H 2 ↑离子:2Na+2H 2O=2Na ++2OH -+H 2 ↑同学们,钠和水的反应你会了吗?5、钠投入到硫酸铜溶液中(写出反应的现象:有气体生成 、还有蓝色絮状沉淀)化学: 2Na + 2 H 2O + CuSO 4=Cu(OH)2↓+H 2 ↑ + Na 2SO 4离子:2Na +2H 2O +Cu 2+ +2OH - = 2 Na + + Cu(OH)2↓ + H 2 ↑红:生成碱性物质,使酚酞变红点燃浮:钠的密度比水的密度小游:生成了气体,推动小球四处游动响:反应放热,是周围的水迅速汽化 熔:钠的熔点低于1000C6、钠投入到氯化铁溶液中(写出反应的现象:有气体生成,有红褐色沉淀)化学:6Na + 6H2O + 2FeCl3=2Fe(OH)3↓+3H2 ↑ + 6NaCl离子: 6Na + 6H2O + 2Fe3+ = 2Fe(OH)3↓+ 3H2 ↑ + 6Na+7、氧化钠和水反应化学: Na2O+H2O=2NaOH离子: Na2O+H2O=2Na++2OH -8、过氧化钠和水反应化学: 2Na2O2+2H2O=4NaOH+O2↑离子: 2Na2O2+2H2O=4Na++4OH-+O2↑9、氧化钠和二氧化碳反应化学: Na2O+CO2=Na2CO310、过氧化钠和二氧化碳反应(用双线桥法标出电子转移情况)失去2×e-化学:2Na2O2+2CO2 =2Na2CO3+O 2得到2×e-11、氧化钠和盐酸反应化学: Na2O+2HCl=2NaCl+H2O 离子: Na2O+2H+=2Na++H2O 12、过氧化钠和盐酸反应化学:2Na2O2+4HCl=4NaCl+2H2O+O2↑离子: 2Na2O2+4H+=4Na++2H2O+O2↑13、碳酸钠和盐酸反应(1)向碳酸钠溶液加入少量盐酸化学:Na2CO3+HCl =NaHCO3 +NaCl 离子: CO32-+H+=HCO3-(2)向碳酸钠溶液加入过量盐酸化学:Na2CO3+2HCl=2NaCl+H2O+CO2↑离子: CO32-+2H+= H2O+CO2↑14、向碳酸氢钠溶液加入盐酸反应化学:NaHCO3+HCl=NaCl+H2O+CO2↑离子:HCO3-+H+= H2O+CO2↑a、分别向碳酸钠和碳酸氢钠溶液中加入盐酸,碳酸氢钠先放出气体。
钠及钠的化合物详解

三、碳酸钠和碳酸氢钠
往饱和氢氧化钠溶液、饱和Na2CO3溶液中通 入过量CO2后有什么现象?原因?
S(g) NaOH Na2CO3 NaHCO3 30℃ 109 21.5 9.6
复习:
1、钠保存在煤油中,煤油的作用是什么?
四、氢氧化钠
3、NaOH的保存(固体、溶液) 4、NaOH固体的称量 5、氢氧化钠的制法: ① ②碱金属的相似性和递变性
⑴结构的相似性和递变性 ①相似性: 最外层只有一个电子,在化学反应中容易失去一 个电子,形成+1价的离子。化合物形式相同。 ②递变性: 电子层数: 原子半径:
碱金属的相似性和递变性
10.用途差异: Na2O用途不广泛, Na2O2用途比较 广泛,可做供氧剂、漂白剂、杀菌剂、消毒剂等。
三、钠的碳酸盐和碳酸氢盐
1.俗名差异:Na2CO3俗名纯碱、苏打等; NaHCO3俗名小苏打。
2.溶解性差异:二者均溶解于水,但Na2CO3的 溶解度大于NaHCO3的。
3.水解程度差异:二者均为弱酸盐,水解使溶 液显碱性,但Na2CO3水解程度大于NaHCO3的。 水解原理应用如泡沫灭火剂、去油污等。
2、钠与氯气反应的现象?
3、钠着火,能否用水或CO2灭火?为什么?
4、钠在下来溶液中反应的剧烈程度: 0.1mol/L的硫酸溶液、盐酸溶液、乙醇溶 液、醋酸溶液?
三、碳酸钠和碳酸氢钠
1.俗名差异 2.溶解性差异
3.水解程度差异 4.热稳定性差异 5.与酸反应速率差异 6.与NaOH反应差异 如何鉴别碳酸钠与碳酸氢钠?
4.热稳定性差异:Na2CO3很稳定,一般不分解; NaHCO3不稳定,受热分解。 5.与酸反应速率差异:二者都能与酸反应 Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2↑ 从反应过程看:CO32-→HCO3-→H2CO3→H2O+CO2因此 跟相同浓度的强酸反应产生CO2的速率NaHCO3大于 Na2CO3的。因此泡沫灭火剂常用NaHCO3。 6.与碱反应差异:Na2CO3不能与碱发生中和反应, NaHCO3中含有没完全中和的H+,故能继续与碱反应。 HCO3-+OH-= CO32-+H2O
钠和钠的化合物常用化学方程式

钠和钠的化合物常用化学方程式一、钠1.钠在氧气中燃烧:2Na+O2Na2O22.钠在氯气中燃烧:2Na+Cl22NaCl3.钠常温条件下和氧气反应:4Na+O2===2Na2O4.钠和硫共热:2Na+S Na2S5.钠和水反应:2Na+2H2O===2NaOH+H2↑2Na+2H2O===2Na++2OH-+H2↑6.钠和稀盐酸反应:2Na+2HCl===2NaCl+H2↑2Na+2H+===2Na++H2↑7.钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O===Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O===2Na++Cu(OH)2↓+H2↑8.向氯化铝溶液中加入少量钠:6Na+2AlCl3+6H2O===6NaCl+2Al(OH)3↓+3H2 ↑6Na+2Al3++6H2O===6Na++Al(OH)3↓+3H2 ↑9.向氯化铝溶液中加入足量钠:4Na+AlCl3+2H2O===NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O===4Na++AlO2-+2H2↑二、氧化钠1.氧化钠和水反应:Na2O+H2O===2NaOH Na2O+H2O===2Na++2OH-2.氧化钠及二氧化碳反应:Na2O+CO2===Na2CO33.氧化钠及盐酸反应:Na2O+2HCl===2NaCl+H2O Na2O+2H+===2Na++H2O4.向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O===Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O===Cu(OH)2↓+2Na+5.向氯化铝溶液中加入少量氧化钠:3Na2O+2AlCl3+3H2O===2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6.向氯化铝溶液中加入足量氧化钠:2Na2O+AlCl3===NaAlO2+3NaCl2Na2O+Al3+===AlO2-+4Na+三、过氧化钠1.过氧化钠及水反应:2Na2O2+2H2O===4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2.过氧化钠及二氧化碳反应:2Na2O2+2CO2===2Na2CO3+O2↑3.过氧化钠及盐酸反应:2Na2O2+4HCl===4NaCl+2H2O+O2↑2Na2O2+4H+===4Na++2H2O+O2↑4.向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O===2Cu(OH)2↓+4Na++O2↑5.向氯化铝溶液中加入少量过氧化钠:6Na2O2+4AlCl3+6H2O===4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O===4Al(OH)3↓+12Na++3O2↑6.向氯化铝溶液中加入过量过氧化钠:2Na2O2+AlCl3+2H2O===NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O===AlO2-+4Na++O2↑7.过氧化钠及硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O===4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O===4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1.向氢氧化钠溶液中通入少量二氧化碳:2NaOH+CO2===Na2CO3+H2O2OH-+CO2===CO32-+H2O2.向氢氧化钠溶液中通入过量二氧化碳:NaOH+CO2===NaHCO3OH-+CO2===HCO3-3.向氢氧化钠溶液中通入少量二氧化硫:2NaOH+SO2===Na2SO3+H2O 2OH-+SO2===SO32-+H2O4.向氢氧化钠溶液中通入过量二氧化硫:NaOH+SO2===NaHSO3OH-+SO2===HSO3-5.碳酸氢钠溶液及氢氧化钠溶液混合:NaHCO3+NaOH===Na2CO3+H2OHCO3-+OH-===CO32-+H2O6.向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH===CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-===CaCO3↓+H2O7.向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH===CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-===CaCO3+CO32-+2H2O五、碳酸钠1.碳酸钠溶液及澄清石灰水反应:Na2CO3+Ca(OH)2 ===CaCO3↓+2NaOHCO32-+Ca2+===CaCO3↓2.碳酸钠溶液及氯化钡溶液混合:Na2CO3+BaCl2===BaCO3↓+2NaClCO32-+Ba2+===BaCO3↓3.碳酸钠溶液滴入少量盐酸:Na2CO3+HCl===NaHCO3+NaClCO32-+H+===HCO3-4.碳酸钠溶液滴入足量盐酸:Na2CO3+2HCl===2NaCl+CO2↑+H2OCO32-+2H+===CO2↑+H2O5.碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH===2CH3COONa+CO2↑+H2OCO32-+2CH3COOH===2CH3COO-+CO2↑+H2O6.碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O===2NaHCO3CO32-+CO2+H2O===2HCO3-7.向饱和碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O===2NaHCO32Na++CO32-+CO2+H2O===2NaHCO3↓8.碳酸钠溶液及氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O===2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O===2Al(OH)3↓+3CO2↑9.碳酸钠溶液及氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O===2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O===2Fe(OH)3↓+3CO2↑六、碳酸氢钠1.碳酸氢钠溶液滴入盐酸:NaHCO3+HCl===NaCl+CO2↑+H2OHCO3-+H+===CO2↑+H2O2.碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH===CH3COONa+CO2↑+H2OHCO3-+CH3COOH===CH3COO-+CO2↑+H2O3.碳酸氢钠溶液及氯化铝溶液混合:3NaHCO3+AlCl3===Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+===Al(OH)3↓+3CO2↑4.碳酸氢钠溶液及氯化铁溶液混合:3NaHCO3+FeCl3===Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+===Fe(OH)3↓+3CO2↑5.碳酸氢钠溶液及氢氧化钠溶液混合:NaHCO3+NaOH===Na2CO3+H2OHCO3-+OH-===CO32-+H2O6.碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2===CaCO3↓+NaOH+H2OCa2++HCO3-+OH-===CaCO3↓+H2O7.碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-===CaCO3↓+CO32-+2H2O8.碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O。
常见金属元素(一):钠和钠的化合物
钠
Na
Na+
钠与非金属的反应
氧钠的氧化
与硫反应
2Na+S=Na2S
所以实验室通常将钠保存在煤油里。
实际也是以水合离子的形态存在的,
要用
钠的主要用途
•制过氧化物
•钠、钾合金做原子反应堆的导热剂
钠钾合金做原子反应堆的导热剂
•制取钛、锆、铌、钽等金属
例如:
例如
高温
Na+TiCl4(熔融)4NaCl+Ti
•制高压钠灯
】某研究性学习小组拟用如图装置进行实验,以证
】⑶第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。
为检验是
外有生成为验否有Na2SO4生成,他们设计了如下方案:
将装置中反应后的固体溶解于水—BaCl2溶液
B Cl
→白色沉淀—稀HNO3溶液→仍有部分白色沉
淀不溶解,证明有Na2SO4上述方案是否合理?
淀不溶解证明有
________________。
请简要说明两点理由:
①____________________________________
②____________________________________
____________________________________。
钠及其化合物最全整理

钠及其化合物一、钠1>介绍:在地壳中钠的含量为2.83%,居第六位,主要以钠盐的形式存在,如食盐(氯化钠)、智利硝石(硝酸钠)、纯碱(碳酸钠)等。
钠也是人体肌肉和神经组织中的主要成分之一。
已发现的钠的同位素共有15种,包括钠19至钠33,其中只有钠23是稳定的,其他同位素都带有放射性。
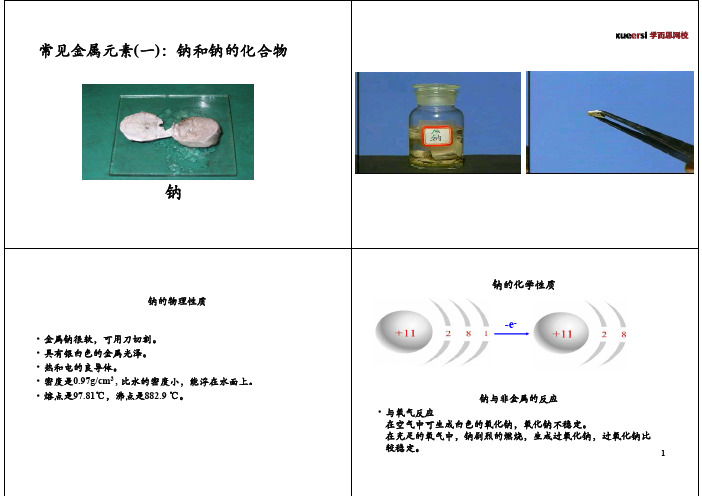
2>物理性质:钠是一种质软(可以用小刀切)、银白色,有金属光泽的金属,具有良好的导电性、导热性、密度比水小,比煤油大(P na=0.979g/cm³),钠的熔点是97.81℃,沸点是882.9℃。
钠单质还具有良好的延展性,硬度低。
钾钠合金(液态)是原子堆导热剂。
单质还具有良好的延展性,硬度也低。
3>化学性质:钠原子的最外层只有一个电子,很容易失去,所以有强还原性。
因此,钠的化学性质非常活波,在与其他物质发生强还原反应时,做还原剂。
都是由0价升为+1价。
金属性强,其离子氧化性弱。
4>与非金属反应①钠与氢气的反应2Na+H2=△=2NaH (固态氢化物,含氢二元化合物,白色固体)②钠与氧气反应1、在空气中缓慢氧化使钠表面变暗,生成不稳定的白色固体4Na+O2==2Na2O(白色固体)2、在空气或氧气中燃烧生成淡黄色固体(黄色火焰)2Na+O2=△/点燃=Na2O2(淡黄色固体)Ⅰ、常温下钠在空气中的变化A: 实验现象:切去外皮的金属放置在空气中,过一会儿,切面上的的变化为银白色变暗。
B: 变化的原因:常温下,钠与空气中的氧气发生反应,在钠表面生成了一层(薄)氧化物(Na2O),白色。
C:实验结论:常温条件下,金属钠在空气中就会发生明显变化。
这说明:钠比铁、镁、铝等金属的活泼性强。
Ⅱ、在加热条件下钠在空气中的变化实验现象:取一小块钠放在坩埚上加热,发生的现象为钠剧烈燃烧,产生黄色火焰,生成一种淡黄色固体。
注:在常温下和加热条件下,钠在空气中变化的比较:a:加热条件下反应更剧烈;b:产物不同,常温生成Na2O,加热生成Na2O2c:钠在空气中点燃时,迅速熔化为一个闪亮的小球,发出黄色火焰,生成过氧化钠(Na2O2)和少量超氧化钠(Na2O4)。
钠和钠的化合物知识点总结

(1)钠的物理性质:银白色、质软、熔沸点低、密度比水小、导电导热性好。
钠要保存在石蜡油或煤油中;发生火灾有钠时,用沙土灭火。
与氧气:4Na+O 2=2Na :O2Na+O 2点燃NaQ^厂:=(黄色火焰)与硫:2Na+S==Na :S(2)钠的化学性质-X 与卤素:2Na+C1:点燃2NaCl与水:2Na+2H 2O==2NaOH+H 2t与酸:2Na+2HC1==2NaCl+Hzt J 与盐溶液:2Na+2H )OYuSO 尸CuQHM+NadSCh+H :t例题1:下面关于金属钠的描述正确的是()A. 钠的化学性质很活泼,在自然界里不能以游离态存在B. 钠离子和钠原子都具有较强的还原性C. 钠能把钛皓等金属从它们的盐溶液中还原出来D. 钠和钾的合金在室温下呈液态,可作原子反应堆的导热剂解析:钠的化学性质很活泼,具有很强的还原性,易和空气中的氧气、水蒸气反应,故在自 然界只能以化合态存在。
钠和盐溶液反应时,首先与水发生了反应,所以钠虽然还原性很强,但不能从盐溶液中置换出一些金属单质。
钠和钾是电的良导体,其合金室温下呈液态,可作 原子反应堆的导热剂。
答案:AD例题2:钠与水反应时产生的各种现象如下:①钠浮在水面上②钠沉在水底③钠熔化成小球④小球迅速游动逐渐减小,最后消失⑤发出嘶嘶的声音⑥滴入酚酥后溶液显红色其中正确的一组是() A.③©⑤B.全部C.①②③⑤⑥D.①③④⑤⑥解析:金属钠与水反应的现彖及原因分析是:熔成光亮的小球(说明反应放热,钠的熔点低),在水面上四处游动(说明钠的密度小于水的密度,并有气体产生),发出嘶嘶的响声(说明反应剧烈和有气体产生),滴入酚駄后溶液呈红色(说明生成物呈碱性)。
答案:D :例题3:将4.6g 钠放入95.6g 水中,所得溶液的质量分数是()A ・46%E.7.7% C ・8%D ・10%解析:解此题要注意如卞几点:①Na 投入水中得到的溶质是NaOH,故求溶液中溶质的质量分数就是求生成的NaOH 的质量分数:②Na 投入水中还要消耗一部分水;③反应中有H :产生,所以溶液的质量在反应前后有变化,因而通过化学方程式可以进行计算。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(5)红:反应后水溶液变红 (溶液显碱性)
2e
2Na + 2H2O → 2NaOH + H2
还原剂 氧化剂
3、钠与酸的反应
比与水反应还激烈;先与酸反应,过量的Na再与水反应。
2Na + 2HCl → 2NaCl + H2 4、钠与盐溶液反应
2Na
+
O2
点→燃
-1
Na2O2
(淡黄色 固体)
2Na + S → Na2 S(研磨易爆炸)
点燃
2Na + Cl2→ 2NaCl (白烟)
2、钠与水的反应
⑴浮:钠投入水中,浮在水面上 (钠的密度比水的密度小)
⑵熔:熔成银白色光亮的小球 (与水反应放热且钠的熔点较低)
⑶游:小球在水面上迅速四处游动 (有气体生成推动小球)
金属Na、K等除外。
10、一般活泼金属能从盐中置换出不活泼金属,但对 非常活泼的金属Na、K等除外。如:
2Na + CuSO4 + 2H2O →Cu(OH)2↓ + H2↑+ Na2SO4
(二)焰色反应
实 ①将铂丝防在酒精灯外焰上灼烧至火焰颜色与原来相同; 验步骤:②焰用颜铂色丝;蘸取待测碳酸钠溶液放在外焰上灼烧,观察火
电子层数: Li<Na<K<Rb<Cs 原子半径Li<Na<K<Rb<Cs
▪ (2)规律与特例 ▪ 1、通常的合金多呈固态,而K、Na合金为液态。 ▪ 2、银白色(铯略带金色); ▪ 3、碱金属单质在空气或氧气中燃烧: Li2O、
Na2O2 、 KO2 。 ▪ 4、碱金属单质密度一般随核电荷数增多而增大,
酸性: CH3COOH >C6H5OH >H2O>C2H5OH
(三)钠的存在、保存与制取
元素存在形态:
游离态(以单质形态存在)
化合态(以化合物形态存在)
存在:钠在自然界里没有游离态,只能以化合态
存在。食盐(NaCl) 纯碱(Na2CO3· 10H2O) 硝酸钠(NaNO3)
保存:隔绝空气和水,加煤油密封。
↑
CuSO4
溶液
钠溶解,放出无色无 味气体,有蓝色沉淀
2Na+2H2O+CuSO4 → Na2SO4+H2↑+Cu(OH)2↓
先与水反应生成碱,再考虑碱与盐的反应!
5、钠与有机物的反应
2Na+2C2H5OH 2C2H5ONa+H2↑
2Na+2CH3COOH 2CH3COONa+H2 ↑ 2Na+2C6H5OH 2C6H5ONa+H2 ↑
教学目标:
▪ 1、了解钠和钠氧化物的重要物理性质 ▪ 2、关注钠和钠的氧化物在生产、生活中的
应用实例 ▪ 3、了解钠与氧气、水、酸、碱、盐等物质
的反应情况
▪ 4、了解氧化钠与水、酸、碱等物质反应情况 ▪ 5、过氧化钠与H2O、CO2反应情况
▪ 6、碳酸钠和碳酸氢钠、氢氧化钠等在生产和生 活中的应用
由弱到强 常温、能 常温、能
加热、能 不能 与氧化性酸 与王水
与碱反应 与水反应 铝、锌与强碱溶液反应
与水中H+ 常温能 加热、能
不能
与盐溶液 与水反应 前面的金属置换后面的金属
碱热分解 不分解 受热分解
常温分解
存在形式 化合态
化合、游离 游离
冶炼方法 电解法(K-Al) 热还原法
热分解法 淘取
三、碱金属——代表物:金属钠
*一般说来,金属原子的半径越 大 ,最外层电子数 越 少 ,金属的还原性越 强 ,金属的熔沸点、硬度 越小。
二、由金属活动顺序表分析金属知识的规律
金属活动 性顺序表
金属性
KCaNa Mg Al Zn Fe H Cu Hg Ag Pt Au
Sn
Pb
由强到弱
Mn+氧化性 与O2反应 常温易 与酸中H+ 剧烈
说明:
同步训练
1、锂不可能具有的性质是( ) A 锂在空气中燃烧可生成Li2O2 ;AD B 锂很软,用小刀可以切割; C 锂比金属铯的熔点高; D 金属锂可以保存在煤油或液体石蜡中。
▪ 7、碳酸钠和碳酸氢钠、氢氧化钠等重要的物理 性质
▪ 8、比较碳酸钠和碳酸氢钠的溶解性、热稳定性 ▪ 9、碳酸钠和碳酸氢钠与酸的反应, ▪ 10、掌握碳酸钠和碳酸氢钠的鉴别方法 ▪ 11、CO32-、HCO3-与其他离子的水解反应
重要的金属知识回顾
一、金属通性
1.物理通性有 延展性 、导电性 、导热性 。 2.化学通性是 还原 性。主要表现在金属能与 非金属 、 水 、 酸 、 某些盐 反应。
若将钠分别投入饱和NaCl、 CuSO4 、 NH4Cl、 FeCl3 、FeCl2 、Al2(SO4)3溶液中。写出反应的离子 方程式或化学方程式。
现象
化学方程式
饱和 NaCl
钠溶解,放出无色无 味气体、析出晶体
2Na+2H2O→2NaOH+H2↑
饱和
NH4Cl
钠溶解,有刺激性气 味气体放出
2Na+2 NH4Cl → 2NaCl+H2↑+2NH3
但ρK<ρNa。 ▪ 5、碱金属单质与水反应剧烈,
但Li与水反应缓慢( Li OH溶解度小)。 ▪ 6、碱金属单质因其活动性强多保存在煤油中,
而ρ Li < ρ煤油,因此只能保存在液体石蜡中。
7、<酸Na式2C盐O3的溶解度一般大于正盐,但溶解度NaHCO3 8、NaH、CaH2,中的氢显-l价。 9、试剂瓶中的药品取出后,一般不能放回原瓶,但
制取:电解熔融的氯化钠
(四)钠的用途
1、制Na2O2 (和氧气反应) 2、制Na-K合金,做原子反应堆导热剂
(钠的导热性) 3、高压钠灯 (黄光射程远,透雾力强) 4、还原贵重金属(钠具有还原性)。
小结
碱金属的相似性和递变性
⑴结构的相似性和递变性 ①相似性: 最外层一个电子,化学反应中容易失去一个电子,形成 +1价的离子。化合物形式相同。 ②递变性:
③用盐酸洗净铂丝,在外焰上灼烧至火焰无色后,再蘸 取碳酸钾溶液在外焰上灼烧,透过蓝色的钴玻璃观察火 焰的颜色。
注 意:①②每钾的次的焰实焰色验色的必必干须须扰用透。盐过)酸蓝洗色净的铂钴丝玻,璃并观灼察烧。至(火避焰免与钠原等来杂相质同;
几种金属的焰色:
Li
Na
紫红 黄
K
Ca
Sr
Ba
Cu
紫
砖红 洋红 黄绿 绿
极易失去最外层的一个电子 +11 2 8
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性顺序表
钠的化学性质: 非常活泼,为强还原剂
(一)钠的物理性质:银白色金属、质软、 熔点低 (二)钠的化学性质:
1、钠与非金属单质反应
4Na + O2 → 2Na2O
