锗的性质
锗元素的性质及应用

锗元素的性质及应用锗是一种灰白色的金属元素,化学符号为Ge,原子序数为32,在周期表中属于碳族元素。
锗的性质及应用主要表现在以下几个方面:1. 物理性质:锗具有比较高的熔点(937.4)和沸点(2830),相对密度为5.32g/cm³。
它是一种半导体材料,具有优良的电导率,在室温下电导率约为电解质的10⁻⁴倍。
2. 化学性质:锗具有较强的化学惰性,不溶于大部分常见的酸和碱溶液。
然而,在浓硝酸和浓氢氟酸中,锗会被氧化为Ge(IV)的离子形式。
此外,锗能与氧气发生反应生成氧化锗(GeO₂)。
3. 热稳定性:锗的热稳定性较好,它可以在高温下长时间保持物理和化学属性的稳定性。
这使得锗常常被用于一些高温工艺中,如制造高温热电偶和热敏元件。
4. 半导体性质:由于锗是一种半导体材料,它可以在一定条件下改变其导电性能。
这种特性使锗广泛应用于电子学领域,包括传感器、集成电路和光电器件等。
5. 光学性质:锗具有优良的光学特性,它对紫外线和红外线的透过率较高,并且具有较大的折射率。
这使得锗被广泛应用于光学设备和仪器中,如光学透镜、光纤和红外传感器等。
锗的应用领域如下:1. 半导体器件:由于锗是一种半导体材料,它被广泛用于制造半导体器件,如二极管和晶体管等。
锗材料可以用于高速电子元件和集成电路,具有较高的工作温度和电导率。
2. 光电领域:由于锗材料具有优良的光学特性,它可用于红外传感器和红外探测器等光电器件。
锗还可以用于制造激光器和光电耦合器等设备,广泛应用于通信和传感技术领域。
3. 热敏材料:由于锗的热稳定性较好,它可以用于制造热敏元件,如温度传感器和热电偶等。
由于锗材料对温度的响应较快,因此常用于测量高温环境中的温度变化。
4. 医学应用:锗材料在医学领域也有一定的应用。
锗纳米颗粒可以用于制造抗肿瘤药物,具有较高的生物相容性。
此外,锗材料还可以用于制备人工骨骼和关节假体等医疗器械。
5. 其他应用:锗材料还可以用于制造合金材料,如铁锗合金和银锗合金等。
锗的性质及其化合物

锗的性质及其化合物锗的物理性质锗的物理性质锗是银白色晶体(粉末状呈暗蓝色),熔点937.4℃,沸点2830℃,密度5.35g/cm³,莫氏硬度6.0~6.5,室温下,晶态锗性脆,可塑性很小。
锗具有半导体性质,在高纯锗中掺入三价元素(如铟、镓、硼)、得到P型锗半导体;掺入五价元素(如锑、砷、磷),得到N型锗半导体。
化合价为+2和+4。
第一电离能7.899电子伏特。
锗有着良好的半导体性质,如高电子迁移率和高空穴迁移率等。
晶体结构:晶胞为面心立方晶胞,每个晶胞含有四个金属原子。
据X射线研究证明,锗晶体里的原子排列与金刚石差不多。
结构决定性能,所以锗与金刚石一样硬而且脆。
锗的化学性质锗的化学性质锗化学性质稳定,不溶于水、盐酸、稀苛性碱溶液。
在常温下不与空气或水蒸气作用,但在600~700℃时,与氧气反应能很快生成二氧化锗。
在加热情况下,锗能在氧气、氯气和溴蒸气中燃烧。
锗与盐酸、稀硫酸不起作用,但浓硫酸在加热时,锗会缓慢溶解。
在硝酸、王水中,锗易溶解。
碱溶液与锗的作用很弱,但熔融的碱在空气中,能使锗迅速溶解。
锗易溶于熔融的氢氧化钠或氢氧化钾,生成锗酸钠或锗酸钾。
在过氧化氢、次氯酸钠等氧化剂存在下,锗能溶解在碱性溶液中,生成锗酸盐。
锗的氧化态为+2和+4。
锗与碳不起作用,所以在石墨坩埚中熔化,不会被碳所污染。
锗的化合物锗的化合物锗与氧、卤素、酸、碱等物质反应都能生成化合物。
锗有两种氧化物:二氧化锗(GeO2)和一氧化锗(GeO)。
锗共有四种已知的四卤化物:四碘化锗(GeI4)为固体,四氟化锗(GeF4)为气体,其余两种为挥发性液体。
锗还能与氧族元素生成二元化合物,例如二硫化物、二硒化物(GeSe2)、一硫化物(GeS)、一硒化物(GeSe)及碲化物(GeTe)。
甲锗烷(GeH4)是一种结构与甲烷相近的化合物。
有机锗化合物(organogermanium compound):四氯化锗与二乙基锌反应生成四乙基锗(Ge(C2H5)4)R4Ge型(其中R为烃基)的有机锗烷,如四甲基锗(Ge(CH3)4)及四乙基锗,是由锗前驱物四氯化锗及甲基亲核剂反应而成。
金属锗精炼

金属锗精炼金属锗精炼是一种将锗矿石加工提炼出高纯度金属锗的工艺过程。
锗是一种化学元素,属于碳族元素,具有类似硅的性质。
它是一种重要的半导体材料,在电子工业、光电子技术和太阳能电池等领域有广泛的应用。
金属锗的精炼过程通常包括以下几个步骤:矿石选矿、矿石破碎、矿石浸出、浸出液处理、溶液纯化和锗的电积等。
矿石选矿是将含锗的矿石从矿石矿石中分离出来的过程。
常见的锗矿石有锗铅矿、锗锌矿和锗银矿等。
矿石选矿的目的是通过物理和化学方法将锗矿石与其他矿石分离,获得含锗矿石。
接下来,矿石破碎是将选矿后的矿石进行粉碎,使其颗粒度适合后续处理。
常用的破碎设备有颚式破碎机、圆锥破碎机和制球机等。
然后,矿石浸出是将矿石中的锗溶解出来的过程。
常用的浸出方法有酸浸法、氧化浸法和氯化浸法等。
其中,酸浸法是最常用的方法,通常使用浓硫酸或浓盐酸进行浸出。
浸出液处理是将浸出液中的杂质去除的过程。
浸出液中常常含有铁、铜、铅、锌等杂质,需要通过沉淀、过滤、萃取等方法进行处理,以提高锗的纯度。
溶液纯化是将经过浸出液处理的溶液进行进一步纯化的过程。
常用的纯化方法有溶剂萃取法、离子交换法和蒸馏法等。
这些方法可以去除溶液中的有机物、无机杂质和金属离子等,提高锗的纯度。
锗的电积是将经过溶液纯化的锗溶液进行电解,将锗沉积在阴极上。
电积是一种常用的方法,通过电流作用,使锗离子还原为金属锗。
通过以上精炼过程,可以获得高纯度的金属锗。
高纯度的金属锗具有优异的导电性能和半导体特性,被广泛应用于电子工业。
它可以用于制造晶体管、集成电路和光电子元器件等,推动了电子技术的发展。
金属锗精炼过程中需要注意控制各个环节的工艺参数,以确保产品的质量。
同时,对废弃物和尾矿的处理也是一个重要的环节,要采取环保措施,防止污染环境。
金属锗精炼是一项复杂的工艺过程,通过矿石选矿、矿石破碎、矿石浸出、浸出液处理、溶液纯化和锗的电积等步骤,可以获得高纯度的金属锗。
金属锗在电子工业和光电子技术等领域有着广泛的应用,对推动科技进步和经济发展具有重要意义。
锗_元素周期表

特性拟硅锗
原子质量72 72.59
密度(g/cm3) 5.5 5.35
熔点(℃)高947
颜色灰色灰色
氧化物种类耐火(refractory)二氧化物耐火二氧化物氧化物密度(g/cm3)4.7 4.7
氧化性弱碱弱碱
)氯化物熔点100℃以下86℃ (GeCl
4氯化物密度(g/cm3)1.9 1.9
克莱门斯·温克勒
年份
价格($/kg)[49]
1999 1,400
2000 1,250
2001 890
2002 620
2003 380
2004 600
2005 660
2006 880
2007 1,240
2008 1,490
2009 950
GeS2 + 3O2→ GeO2 + 2SO2
在这个过程中,部份锗会进到所产生的灰尘中,而剩下的锗则被转化
GeO2 + 4HCl → GeCl4 + 2H2O
GeO2 + 2Cl2→ GeCl4 + O2
的GeO2适用于制造锗玻璃。
纯二氧化锗与氢反应后被还原成锗,用这种还原方式所得的锗,适用于红外线光学或半导体工业:GeO2 + 4H2→ Ge + 2H2O
GeO2 + C → Ge + CO2
应用[编辑]
图为典型的单模光纤。
氧化锗用于掺杂二氧化硅核心(1号)。
1. 核心 8 µm
2. 包层 125 µm。
锗知识

立志当早,存高远锗知识锗为银灰色金属,密度5.35 克,熔点937.4℃,沸点2830℃。
室温下,晶态锗性脆,可塑性很小。
锗的化学性质稳定,常温下锗在空气中不被氧化,但在加热时,锗能在氧气、氯气和溴蒸气中燃烧。
锗不与水作用,不溶于盐酸和稀硫酸,硝酸和热的浓硫酸能将金属锗氧化为二氧化锗,锗还溶于王水。
锗易溶于熔融的氢氧化钠或氢氧化钾,生成锗酸钠或锗酸钾。
在过氧化氢、次氯酸钠等氧化剂存在下,锗能溶解在碱性溶液中,生成锗酸盐。
锗具有半导体性质,在高纯锗中掺入三价元素(如铟、镓、硼)、得到P 型锗半导体;掺入五价元素(如锑、砷、磷),得到N 型锗半导体。
锗通常以分散状态存在于其他矿物中,独立的矿物很少。
可从含锗的氧化铅锌矿、闪锌矿和煤灰中回收锗。
锗的提取方法是首先将锗的富集物用浓盐酸氯化,制取四氯化锗,再用盐酸溶剂萃取法除去主要的杂质砷,然后经石英塔两次精馏提纯,再经高纯盐酸洗涤,可得到高纯四氯化锗,用高纯水使四氯化锗水解,得到高纯二氧化锗。
一些杂质会进入水解母液,所以水解过程也是提纯过程。
纯二氧化锗经烘干煅烧,在还原炉的石英管内用氢气于650-680℃还原得到金属锗。
锗在电子工业中的用途已逐渐被硅代替。
但由于锗的电子和空穴迁移率较硅高,在高速开关电路方面,锗比硅的性能好。
锗主要用来生产低功率半导体二极管三极管,锗在红外器件、γ辐射探测器方面有着新的用途,金属锗能让2-15 微米的红外线通过,又和玻璃一样易被抛光,能有效地抵制大气的腐蚀,可用以制造红外窗口、三棱镜和红外光学透镜材料。
锗还与铌形成化合物,用作超导材料。
用氧化锗制造的玻璃有较高的折射率和色散性能,可用于广角照像镜头和显微镜。
锗及其化合物

锗及其化合物锗(旧译作鈤)是一种化学元素,它的化学符号是Ge,原子序数是32,原子量72.64。
在化学元素周期表中位于第4周期、第IVA族。
锗单质是一种灰白色准金属,有光泽,质硬,属于碳族,化学性质与同族的锡与硅相近,不溶于水、盐酸、稀苛性碱溶液,溶于王水、浓硝酸或硫酸,具有两性,故溶于熔融的碱、过氧化碱、碱金属硝酸盐或碳酸盐,在空气中较稳定,在自然界中,锗共有五种同位素:70,72,73,74,76,在700℃以上与氧作用生成GeO2,在1000℃以上与氢作用,细粉锗能在氯或溴中燃烧,锗是优良半导体,可作高频率电流的检波和交流电的整流用,此外,可用于红外光材料、精密仪器、催化剂。
锗的化合物可用以制造荧光板和各种折射率高的玻璃。
锗、锡和铅在元素周期表中是同属一族,后两者早被古代人们发现并利用,而锗长时期以来没有被工业规模的开采。
这并不是由于锗在地壳中的含量少,而是因为它是地壳中最分散的元素之一,含锗的矿石是很少的。
锗粉末状呈暗蓝色,结晶状,为银白色脆金属。
化合价+2和+4。
第一电离能7.899电子伏特,是一种稀有金属,重要的半导体材料,不溶于水。
基本信息锗化学性质稳定,常温下不与空气或水蒸汽作用,但在600~700℃时,很快生成二氧化锗。
与盐酸、稀硫酸不起作用。
浓硫酸在加热时,锗会缓慢溶解。
在硝酸、王水中,锗易溶解。
碱溶液与锗的作用很弱,但熔融的碱在空气中,能使锗迅速溶解。
锗与碳不起作用,所以在石墨坩埚中熔化,不会被碳所污染。
锗在元素周期表上的位置正好夹在金属与非金属之间,因此具有许多类似于非金属的性质,这在化学上称为“亚金属”,外层电子排布为4s²4p²。
但它的化学性质类似于临近族的元素,尤其是砷和锑。
化学上或毒物学上重要的锗化合物很少。
锗的二氧化物,一种微溶于水的白色粉末,形成锗酸,这类似于硅酸。
四氯化锗是一种不稳定的液体,四氟化锗是一种气体,它们很容易在水中水解。
氢化锗(锗烷)是一种相对稳定的气体。
锗---简介
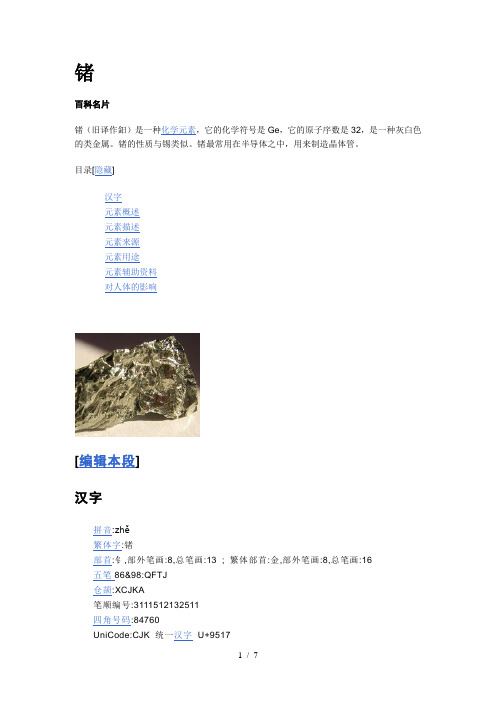
锗百科名片锗(旧译作鈤)是一种化学元素,它的化学符号是Ge,它的原子序数是32,是一种灰白色的类金属。
锗的性质与锡类似。
锗最常用在半导体之中,用来制造晶体管。
目录[隐藏]汉字元素概述元素描述元素来源元素用途元素辅助资料对人体的影响[编辑本段]汉字拼音:zhě繁体字:锗部首:钅,部外笔画:8,总笔画:13 ; 繁体部首:金,部外笔画:8,总笔画:16五笔86&98:QFTJ仓颉:XCJKA笔顺编号:3111512132511四角号码:84760UniCode:CJK 统一汉字U+9517基本字义● 锗zhěㄓㄜˇ◎一种金属元素,灰白色结晶,质脆,是重要的半导体材料。
汉英互译◎锗germanium germanium n.[编辑本段]元素概述元素名称:锗元素符号:Ge元素英文名称:Germanium元素类型:金属元素原子体积:(立方厘米/摩尔) 13.6元素在宇宙中的含量:(ppm) 0.2元素在太阳中的含量:(ppm) 0.2元素在海水中的含量:(ppm) 太平洋表面0.00000035地壳中含量:(ppm)1.8相对原子质量:72.61氧化态:Main Ge+2, Ge+4化学键能:(kJ /mol)Ge-H 288Ge-C 237Ge-O 363Ge-F 464Ge-Cl 340Ge-Ge 163原子序数:32质子数:32中子数:41摩尔质量:73所属周期:4所属族数:IVA电子层排布:2-8-18-4晶体结构:晶胞为面心立方晶胞,每个晶胞含有4个金属原子。
晶胞参数:a = 565.75 pmb = 565.75 pmc = 565.75 pmα = 90°β = 90°γ = 90°莫氏硬度:6声音在其中的传播速率:(m/S)5400电离能(kJ/ mol)M - M+ 762.1M+ - M2+ 1537M2+ - M3+ 3302M3+ - M4+ 4410M4+ - M5+ 9020M5+ - M6+ 11900M6+ - M7+ 15000M7+ - M8+ 18200M8+ - M9+ 21800M9+ - M10+ 27000颜色和状态:银白色固体密度:5.35克/立方厘米熔点:938.25℃沸点:2833℃热光系数:dn/dT≈0.0004/K (25~150°C)原子半径:122皮米,Ge4+半径53皮米发现人:文克勒发现年代:1886年发现过程:1886年,德国的文克勒在分析硫银锗矿时,发现了锗的存在;后由硫化锗与氢共热,制出了锗[1]。
锗元素用途

锗元素用途锗是一种重要的无机元素,其化学符号为Ge,原子序数为32、它是一种半金属元素,在自然界中主要以硫化锗的形式存在,可以通过冶炼和纯化得到高纯度的锗。
锗具有许多重要的用途,包括电子、光学、太阳能等领域。
首先,锗在电子领域有着重要的应用。
由于锗具有良好的半导体特性,它被广泛用于制造半导体器件,如二极管、晶体管和集成电路等。
锗材料具有低的禁带宽度,可以在较低的电压下工作,因此被用于制造较低功耗的电子设备。
此外,锗还可以用于制造激光器、光电器件和红外探测器等。
其次,锗在光学领域也有重要的应用。
锗具有良好的光学性质,特别是在红外光谱范围内具有高透过率。
这使得锗成为制造红外光学器件的重要材料,如红外透镜、红外窗口和红外滤光片等。
锗还可以用于制造红外激光器和红外光纤等。
另外,锗在太阳能领域也有广泛的应用。
锗可以用于制造太阳能电池,其中锗被用作光催化层材料,可以增强太阳能电池的吸收能力和转化效率。
锗太阳能电池具有高效、稳定和可靠的特性,适用于各种环境条件下的太阳能利用。
此外,锗还被用于制造其他各种器件和材料。
例如,锗可以用作核反应堆中的中子辐射探测器材料,以监测和测量中子的强度和能量。
锗还可以用于制造特种玻璃,如红外传感器窗口和红外光纤窗口等。
此外,锗还可以用作化学催化剂和金属膜的添加剂。
总结起来,锗是一种用途广泛的无机元素。
它在电子、光学、太阳能等领域都有重要的应用。
锗材料具有优异的半导体和光学性质,可以用于制造各种电子器件、光学器件和太阳能电池。
锗的应用有助于推动电子和能源科技的发展,并为人们的生活带来更多的便利和创新。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
锗在室温下是稳定的,但也会生成GeO单层膜,时间长了会逐渐变成GeO2单层膜。
而当锗的表面吸附了水蒸气便破坏了氧化膜的钝化性质,而生成厚的氧化物。
锗在较高温度下便氧化,且伴随有失重的现象,原因是生成了GeO,因其有较强的挥发性。
研究者研究了锗表面氧化的过程,先在600℃时用CO还原锗,以排除锗表面的结合氧或吸附氧。
再在25~400℃,10kPa的氧压下氧化锗,仅1min即形成了第一氧化层。
当温度超过250℃很快形成第二氧化层。
再升高温度,氧化速度显著变慢。
在400℃氧化3h,形成厚度为1.75nm的GeO2膜。
锗在不同溶剂中的腐蚀溶解行为不同。
n型锗的溶解电位比p型略正,所以在相同溶液中前者的溶解速度较快。
锗易溶于加氧化剂的热酸、热碱和H2O2中。
难溶于稀硫酸、盐酸和冷碱液。
锗在100℃的水中是不溶的,而在室温下饱和氧的水中,溶解速度接近1ug/(cm.h)。
1.H2O2对锗的溶解
室温下3%的H2O2能缓慢地溶解块状的锗,升温到90~100℃时溶解速度加快。
n型锗在100℃的H2O2中的溶解速度受H2O2浓度的影响。
(1)锗被氧化为GeO,在表面形成单层GeO
Ge+H2O2=GeO
(2)进一步氧化为GeO2
GeO+H2O2=GeO2+H2O
(3)GeO2+H2O=H2GeO3
当溶液中有碱存在时,锗酸与碱作用生成锗酸钠,而加速锗的溶解。
H2GeO3+NaOH=Na2GeO3+2H2O
2.锗在硫酸中的溶解
90℃时浓硫酸与块状锗有微量反应,历时一周锗的损失量为1%。
3.锗在硝酸中的溶解
浓硝酸能腐蚀块状锗的表面。
锗在硝酸中的溶解速度受硝酸的浓度、搅拌速度、温度等因素的影响。
4.锗与碱液的作用
氢氧化钠和氢氧化钾水溶液与锗的作用很慢,但是熔融的氢氧化钠、氢氧化钾、Na2CO3、Na2O2、NaB4O7能迅速地溶解各种形态的锗,生成碱金属的锗酸盐。
5.锗在某些盐溶液中的溶解
锗可溶于某些电解质溶液,如硫酸钠、钾的氯化物、硝酸盐、氯化铯、氯化镧等。
与其他物质的作用
加热时粉状的锗在氯和溴中能燃烧,生产四卤化锗,加热时干燥的HCl气体能腐蚀锗。
第二节锗的氧化物
锗的氧化物有一氧化锗GeO和二氧化锗GeO2
一氧化锗
GeO在室温下是稳定的,但当温度高于550℃即被空气氧化生成GeO2,在该温度下如果缺氧,则GeO会升华。
GeO很容易被含氨的H2O2溶液氧化。
硫酸、盐酸和苛性碱对GeO不能浸蚀,而发烟硝酸可缓慢氧化GeO。
二氧化锗GeO2
单质锗或GeS在氧气中灼烧,或用浓硝酸氧化都可制得GeO2。
GeO2在氯酸、硝酸和硫酸溶液中的溶解度随酸的浓度增加而减小。
GeO2在HCl、HBr和HI中的溶解度随酸的浓度增加而增加,酸度达到最大值后,溶解度反而减小。
GeO2易溶于NaOH,其溶解度随碱液的浓度增大而增大。
二氯化锗
在室温下GeCl2能被氧慢慢氧化成GeO2和GeCl4。
GeCl2与Cl2、Br2容易反应,与Cl2作用生成GeCl4。
GeCl2为不稳定化合物,稍微加热就分解为GeCl4与金属锗。
它与干的氧气作用生成GeCl4和GeO2。
采用GeCl4氢还原能外延生长锗单晶膜,此种外延膜有较高的纯度,晶体完整性好,可用于制造光敏和光电元件。
