(人教版)化学选修四思维导图:2-2影响化学反应速率的因素(含答案)
高中化学人教版选修四 2-2 影响化学反应速率的因素 课件(24张)

如果分子间能够发生化学反应: 应用 应用2 1: :
碰撞理论 反应速率理论本质探讨
分子具有 n =n × 活化分子 活 总 相互 分子 有效碰撞 化学 有合适的取向 足够能量 2 、压强 碰撞 运动 其他条件不变, 压强增大 → →C增大 →V↑ 增大压强,气体 压强对于反应速率的 其他条件不变 1、反应物分子必须 体积缩小,浓度 压强只对于有气体参
科学探究
碰撞理论解释各外界因素对速率的影响
体积减小 如果分子间能够发生化学反应:
压强对反应速率的影响
例、在N2+3H2
=
2NH3中,当其他外界条件不变时:
减小体系压强,该反应的速率怎么变? 在反应中保持体系容积不变,充入N2 ,反应的速率怎 么变? 在反应中保持体系容积不变,充入He,反应的速率怎么 变?
钻 隧 道
活化分子能 量
反应物平均能量
反应物平均能量
生成物平均能量
生成物平均能量
解释:
“对可逆反应而言, 催化剂既能催化正反 友情提醒: 应又能催化逆反应” 试利用如图原理加以 使用催化剂同等程 度的增大(减慢)、 解释?
能量
活化分子具有能量
活化分子 能量
反应物平均能量
反应物平均能量
生成物平均能量
探究实验
温度对化学反应速率的影响 结 论
其它条件相同时,升高
快
慢
温度,反应速率加快;
反之,降低温度,反应 热水 冷水 速率减慢。
5mL0.1mol/L的H2S + 5mL0.1mol/LNa2S
科学探究
已知:4H++4I-+O2=2I2+2H2O 现有1mol/L KI溶液、
(人教版)化学选修四思维导图:2-2影响化学反应速率的因素(含答案)
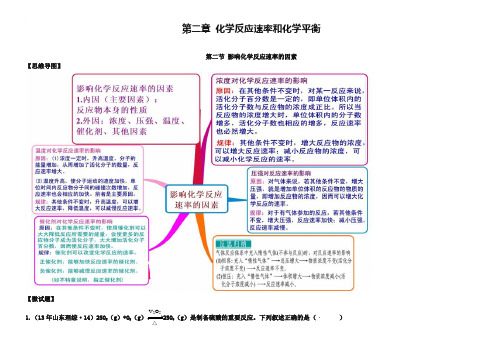
第二章化学反应速率和化学平衡第二节影响化学反应速率的因素【思维导图】【微试题】V2O51.(13年山东理综·14)2SO2(g)+O2(g)2SO3(g)是制备硫酸的重要反应。
下列叙述正确的是()△A .催化剂V 2O 5不改变该反应的逆反应速率B .增大反应体系的压强,反应速度一定增大C .该反应是放热反应,降低温度将缩短反应达到平衡的时间则时间间隔t 1~t 2内,SO 3(g )生成的平均速率为2121c c u t t -=- D .在t 1、t 2时刻,SO 3(g )的浓度分别是c 1,c 2,【答案】B2.等质量的铁与过量的盐酸在不同的试验条件下进行反应,测定在不同时间t 产生氢气体积v 的数据,根据数据绘制得到图1,则曲线a 、b 、c 、d 所对应的试验组别可能是( )组别 c(HCl)(mol·L-1) 温度(℃) 状态1 2.0 25 块状2 2.5 30 块状3 2.5 50 粉末状 42.530粉末状A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3【答案】C3.把铝条放入盛有过量稀盐酸的试管中,不影响...氢气产生速率的因素是()A.盐酸的浓度 B.铝条的表面积 C.溶液的温度 D.加少量Na2SO4【答案】D4.(海南16分)下表是稀硫酸与某金属反应的实验数据:实验序号金属质量/g金属状态C(H2SO4)/mol·L-1V(H2SO4)/mL溶液温度/℃金属消失的时间/s反应前反应后1 0.10 丝0.5 50 20 34 5002 0.10 粉末0.5 50 20 35 503 0.10 丝0.7 50 20 36 2504 0.10 丝0.8 50 20 35[: 2005 0.10 粉末0.8 50 20 36 256 0.10 丝 1.0 50 20 35 1257 0.10 丝 1.0 50 35 50 508 0.10 丝 1.1 50 20 34 1009 0.10 丝 1.1 50 30 44 40分析上述数据,回答下列问题:(1)实验4和5表明,对反应速率有影响,反应速率越快,能表明同一规律的实验还有(填实验序号);(2)仅表明反应物浓度对反应速率产生影响的实验有(填实验序号);(3)本实验中影响反应速率的其他因素还有,其实验序号是。
人教版选修4 化学:2.2 影响化学反应速率的因素 课件(20张PPT)

第二节 影响化学反应速率的因素
影响化学反应速率的因素有哪些?
主要因素
下列内事部实因能素说明影响化物学质反本应身速的率结的构决和定性性质因素
D 是A.反Cu外应能部物与因本浓素身硝性酸质浓压 温反的度强 度应是,(反而应不反体)应与系物浓的浓盐温度酸度增反升大应高
v
B.Cu与浓硝酸反催应…化比…剂与稀硝投酸入反正应催快化剂
v 反应速率加快
理论延伸—解释压强对速率影响
改变压强的方法 体积不变,充入与反应无关的气体
C 单位体积内活
化分子数不变 活不变 有效碰撞几率不变
v 反应速率不变 不变
理论延伸—解释压强对速率影响
保持恒压的方法
充入与反应无关的气体保持恒压
C 单位体积内活
化分子数不变 活减小 有效碰撞几率减小
v 反应速率不变 减小
增加
反应物
总能增量 加
增加
生成
增加物总
增加 增加
液
化学反应速率
能量
加快
能量
加快
加快
分析
红色→黑色: 2Cu+O2=Δ== 2CuO
黑色→红色:
2
2
Δ2
22
乙醛(刺激性气味液体)
(1)+(2) ×2得
铜丝在实验中作催化剂
催化剂改变反应历程的原理——参与反应——“先进去,后出 来 ”——反应前后的质量和化学性质不变!
4.恒压时充入与反应“无关”的气体(如He等),反应 速率如何变化?
理论延伸—解释压强对速率影响
改变压强的方法
减小体积
单位体积内活
C 化分子数增多 活
有效碰撞几率增多
2.2影响化学反应速率的因素

化学变化中的碰撞理论是?
分 子 运 动 相 互 碰 撞 分子具 有足够 能量 活化 分子
分子有合适的 取向
化学变化中的碰撞理论是?
分 子 运 动 分子具 有足够 能量 活化 分子 有 效 碰 撞
相 互 碰 撞
分子有合适的 取向
化学变化中的碰撞理论是?
生成物 反应过程
能量 活化分子具有的最低能量
特点:能量比反应 物分子平均能量高
反应物平均能量
活化分子百分数(活%) 活化分子数(n活) = 反应物分子总数(n ) 总
100%
生成物 平均能量
化学反应的历程
活化 能 合理 取向的 碰撞
普通 分子
活化 分子
有效 碰撞
新物质
能量
影响化学反应速率的因素
催化剂的选择性还存在于哪些方面?
科学探究1
科学探究3
注意事项 1)同一催化剂能同等程度的改变化学反应 的速率。
2)催化剂只能改变反应速率,不能将不反 应变成反应 3)催化剂有一定的选择性和活化温度: 4)催化剂中毒:催化剂的活性往往因接触 少量杂质而明显下降,甚至遭到破坏,这种现 象叫催化剂中毒。催化剂中毒会严重影响反应 的顺利进行。工业上为了防止催化剂中毒,要 把原料进行净化除去毒物。
加入试 硫酸溶液、淀粉 唾液、淀粉溶 液 溶液、碘水 剂 蓝色很难褪去 蓝色很快褪去 碘水
唾液对该反应的催化效果更好
反应现
象
催化剂是有选择性的
结 论
科学探究ห้องสมุดไป่ตู้
1.双氧水分解
2.高锰酸钾氧化草酸
3.淀粉水解
科学探究1
湖南长郡卫星远程学校
2.2.2 影响化学反应速率的因素 温度、催化剂对化学反应速率的影响 教学设计(含解析) 人教版高中化学选修4

(人教版选修4)第二章《化学反应速率和化学平衡》教学设计第二节影响化学反应速率的因素(第二课时温度、催化剂对化学反应速率的影响)【科学探究】已知4H++4I―+O2 == 2I2 +2H2O ,现有1 mol/L KI溶液、0.1 mol/L H2SO4溶液和淀粉溶液,请探究溶液出现蓝色的时间与温度的关系。
【交流】试剂种类及用量 2 mL KI溶液、2滴淀粉溶液、2 mL 稀硫酸实验温度①室温②冰水混合物试剂加入顺序及理由分别向2 mL KI溶液滴加2滴淀粉溶液后,再分别加入2 mL 稀硫酸。
因为在不加酸的情况下,O2不能氧化I―实验现象①室温的一组溶液快出现蓝色结论其他条件相同时,升高温度反应速率加快,降低温度反应速率减慢【问题讨论1】对吸热反应和放热反应,温度对反应速率的影响规律是否相同?【交流】其他条件不变时,升高温度,不管是吸热反应还是放热反应,反应物分子的能量增加,使一部分原来能量较低的分子变成活化分子(如图所示)→活化分子百分数增加→有效碰撞次数增多→反应速率增大。
因此,升高温度均可以增大反应速率。
反之,降低温度均可以降低反应速率。
如图:【问题讨论2】通常情况下,你认为温度、浓度、压强对反应速率的影响谁更强一些呢?在日常生活中有哪些应用?【交流1】一般而言,温度对化学反应速率的影响比浓度、压强等对化学反应速率的影响要大,【交流】当其他条件不变时,使用催化剂,化学反应速率增大。
【问题讨论2】请从微观角度对上述规律作出解释。
【交流】使用催化剂→改变了反应的路径(如下图),反应的活化能降低→活化分子的百分数增大→单位时间内有效碰撞几率增加→反应速率加快。
如下图所示:【小组讨论1】我们在讨论催化剂对化学反应速率的影响时,还应注意哪些问题?【交流1】催化剂有正、负之分,一般情况下的催化剂是指正催化剂。
【交流2】催化剂有选择性,不同的化学反应的催化剂不相同,催化剂具有一定的活化温度。
【小组讨论2】根据催化剂对化学反应速率的影响实质,分析催化剂对可逆反应中的正、逆反应速率的影响是否相同?【交流】因催化剂对化学反应速率的影响是降低反应的活化能,增加有效碰撞次数,对正、逆反应的影响是相同的,所以催化剂对正、逆反应速率的影响相同。
高中化学人教版选修四 2-2 影响化学反应速率的因素 课件(18张)

【注意】
a. 压强对固体和液体( b. 对于反应物和生 成物都有气体的可逆 讨论:在N2+3H2 反应, 2NH3中,当其他外界 条件不变时: 增大压强,正、逆
【实验探究】 不同温 度条件下同浓度硫酸与 5mL0.1mo Na2S2O3溶液的反应 + 5mL0.1m
快
慢
热水
冷水
Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
三、温度对反应速率的影响
当其他条件不变时, 【理论探究】为什么升 升高温度,化学反应 升高温 温度会影响反应速率呢 即单位 度: 速率增大。降低温度, 体积内 单位体 活化 化学反应速率减小。 有效碰 分子总 积内活
科学探究
已知:
+ 4H +4I
【 +O2=2I2+2H2O 其它条件相同时, 结 【注意】 现有 1mol/L KI 溶 ( 1 )反应若是可 温度高,出现蓝色 论】 ( 2 )一般,温度 液、 逆反应,升高温度,
【实验探究】 双氧 水中加入MnO2前 后的反应对比
2H2O2
MnO2
2H2O+O2↑
【结论】 (2 1)催化剂具有选择性 )其它条件不变时,
四、催化剂对反应速率的影响
催化剂能大大 能 量 地改变化学反 E1 无催化反应 E 催化反应 2 应的速率; ΔH 反应过程 (1)使用催化剂能改变
【理论探究】为什么 使用 降低 加入催化剂会影响反 活化分 活化分 催化 活化 应速率呢? 有效碰 化学反 子的数 子的百 剂 能 目增多 撞次数 分比增 应速率 增多 大 加快
小结
影响
影响化学反应速率的外因
单位体积内 分子 总数
人教化学选修4第二章第二节 影响化学反应速率的因素(共21张PPT)

2、温度对化学反应速率的影响。
实验:
Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O
现象: 生成黄色沉淀 结论: 温度高的溶液先出现浑浊
规律:其他条件不变时,升高温度,可以增 大反应速率,降低温度,可以减慢反应速率。
3、催化剂对化学反应速率的影响。
实验:
o ↑ 2H2O2 = 2H2 + O2
A、10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
B、10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4 各5 mL,加水10mL
C 、20℃ 时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
人教版化学高二选修四
第二节 影响化学反应速率的因素
想一想?
在日常的生活和学习中,我们 如何判断一个反应的快慢呢?
实验探究1:取两支试管,各加入10gMg粉和Fe粉,然后加入 5mL 0.1mol/L H2SO4,观察现象。 实验探究2:取两支试管,各加入4mL 0.01mol/L的KMnO4酸 性溶液,然后加0.1mol/L的H2C2O4溶液2mL,记录溶液褪色时 间;向另一支试管中加入0.2mol/L的H2C2O4溶液,分别记录溶 液褪色时间。
压强增大 → 体积减小 其他条件不变
→C增大 →V↑
规律:对于有气体参加的反应,若 其他条件不变,增大压强,气体体积缩 小,浓度增大,反应速率加快;减小压 强,反应速率减慢。
发散思考: 压强对于任意化学反应的速率都
有影响吗?
压强对反应速率的影响
思考:在N2+3H2 2NH3中,当其他外界 条件不变时:
人教版 高中化学选修四 第二章 第二节 影响化学反应速率的因素

加入试剂 及用量
实验现象
4mL 0.01mol/L KMnO4
2mL 0.1mol/L H2C2O4
2mL0.2mol/L H2C2O4
紫色褪去
紫色褪去
褪色时间
长
短
结论
浓度较大H2C2O4溶液的反应更快些
原因(用 碰撞理论 解释)
练一练
增大反应物浓度,可以增大单位体积内反应分子数目( √ )
增大反应物浓度,可以增大单位体积内活化分子数目 ( √ )
【小结】
增大压强,气体体积减小,增大了反应物浓度, 单位体积内活化分子数目增多,但是活化分子百 分数不变。
【思考与交流】
在恒温恒容的条件下,向某密闭容器中通入稀 有气体(或与反应物和生成物均不反应的气 体),反应速率如何变化?
容器的体积不变,反应物的浓度不变,速率不变。
【思考与交流】
在恒温恒压的条件下,向某密闭容器中通入稀 有气体(或与反应物和生成物均不反应的气 体),反应速率如何变化?
增大反应物浓度,可以增大单位体积内活化分子的百分数(×)
反应物浓度增大,单位时间内有效碰撞增多
(√ )
一定条件下,反应物浓度越大,反应所需活化能越小 (×)
二、压强对反应速率的影响
对于气体反应:增大压强(减小容器容积),相当 于增大反应物的浓度,反应速率加快。
练一练
对于有气体参加的反应 一定条件下增大压强,化学反应速率加快 ( √ ) 增大压强,单位体积内活化分子数目增多( √ ) 增大压强,单位体积内有效碰撞几率增多( √ ) 增大体系的压强,反应所需的活化能变小 (×)
0.1mol/L Na2S2O3 5mL 0.1mol/L H2SO4 5mL
低
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章 化学反应速率和化学平衡
第二节 影响化学反应速率的因素
【思维导图】
【微试题】
1.(13年山东理综·14)2SO 2(g )+O 2(g )
2SO 3(g )是制备硫酸的重要反应。
下列叙述正确的是( )
A .催化剂V 2O 5不改变该反应的逆反应速率
B .增大反应体系的压强,反应速度一定增大
△
V 2O 5
C .该反应是放热反应,降低温度将缩短反应达到
平衡的时间
则时间间隔t 1~t 2内,SO 3(g )
生成的平均速率为21
21
c c u t t -=- D .在t 1、t 2时刻,SO 3(g )的浓度分别是c 1,c 2,【答案】
B
2.等质量的铁与过量的盐酸在不同的试验条件下进行反应,测定在不同时间t 产生氢气体积v 的数据,根据数据绘制得到图1,则曲线a 、b 、c 、d 所对应的试验组别可能是( )
A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3
【答案】C
3.把铝条放入盛有过量稀盐酸的试管中,不影响
...氢气产生速率的因素是()A.盐酸的浓度B.铝条的表面积C.溶液的温度D.加少量Na2SO4【答案】D
4.(海南16分)下表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题:
(1)实验4和5表明,对反应速率有影响,反应速率越快,能表明同一规律的实验还有(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有(填实验序号);
(3)本实验中影响反应速率的其他因素还有,其实验序号是。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:。
【答案】(1)固体反应物的表面积;表面积越大;1、2 (2)1、3、4、6、8(或2、5)(3)反应温度;6、7(或8、9)(4)因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近。
【解析】本题考查影响化学反应速率的因素,侧重实验探究浓度对反应速率的影响,注意表格中的数据分析即可解答,题目难度不大;
(1)实验4和5,金属和稀硫酸的量相同,金属的状态不同,可知固体的表面积越大反应速率越快,
故答案为:固体反应物的表面积;表面积越大;1和2;
(2)仅表明反应物浓度对反应速率产生影响的实验,金属的状态就应该相同,或者为丝状,或者为粉末,
故答案为:1、3、4、6、8或2、5;
(3)本实验中,反应温度也影响化学反应速率,如实验6和7或8和9,故答案为:反应温度;6和7或8和9;
(4)由于所以反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,所以实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,故答案为:因为所以反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近.。
