(人教版)化学选修四思维导图_1_1化学反应与能量的变化(含答案)
人教版化学选修四第一节化学反应与能量的变化

H2(g)+Cl2(g)=2HCl(g) ∆H =-
184.6KJ/mol
人教版化学选修四第一章 第一节 化学反应与能量的变化(共20张PPT)
人教版化学选修四第一章 第一节 化学反应与能量的变化(共20张PPT)
人教版化学选修四第一章 第一节 化学反应与能量的变化(共20张PPT)
★kJ/mol的含义: 每mol反应的焓变
人教版化学选修四第一章 第一节 化学反应与能量的变化(共20张PPT)
★书写热化学方程式的注意事项小结
1、化学方程的右边必须写上△H,并用“空格”隔开, △H: 吸热用“+”,放热用:“-”,单位是kJ/mol或J/mol 2、需注明反应的温度和压强,如不注明条件,即指: 25℃ 1.01×105Pa;
人教版化学选修四第一章 第一节 化学反质的量和反应热的关系的化学方程式
H1H24422((.19gg.k8))++Jk/JI12m2/(mOgo2)ol1(=20lg01=0)k=℃=Pa==H=2=O2(Hg)I(g△)H△=H-=-
2、热化学方程式需注明反应时的温度和压强。 对于 25℃ 101kPa时进行的反应可不注明。
普通化学方程式不需注明温度和压强。
人教版化学选修四第一章 第一节 化学反应与能量的变化(共20张PPT)
人教版化学选修四第一章 第一节 化学反应与能量的变化(共20张PPT)
热化学方程式
能表示参加反应物质的量和反应热的关系的化学方程式
H2H24822((15gg..88))++kkJJ1212//mmOO22oo((llgg))====HH22OO((gl))
人教版高中化学选修四1.1 化学反应与能量的变化(第一课时)教学课件精品课件PPT

ΔH= E(生成物能量)- E (反应物能量)宏观
能 量
反应物
能 量
生成物
放热
△H<0
吸热
△H>0
生成物 反应过程
反应物 反应过程
放热反应: ΔH<0或 ΔH为“-” 吸热反应: ΔH>0 或ΔH为“+”
H2+Cl2=2HCl
ΔH=[436 kJ/mol+243 kJ/mol]- 431 kJ/mol×2=-183kJ/mol
共价键放出的能量
键能恒取正值
思考与交流
1、你所知道的化学反应中有哪些是放热反应? 活泼金属与水或酸的反应、酸碱中和反应、 燃烧反应、多数化合反应、铝热反应
2、你所知道的化学反应中有哪些是吸热反应?
多数的分解反应、氯化铵固体与氢氧化钡晶体 的反应、水煤气的生成反应、炭与二氧化碳生 成一氧化碳
练习
1、1molC与1molH2O(g)反应失成lmol CO(g)和 1mol H2(g),需要吸收131.5kJ的热量,该反应的 反应热为△H=__+__1_3_1_._5___kJ/mol。 2.下列说法正确的是 CD (A)需要加热方能发生的反应一定是吸热反应 (B)放热的反应在常温下一定很易发生 (C)反应是放热的还是吸热的必须看反应物和
从键能角度看: ΔH=反应物总键能-生成物总键能(微观)
思考
➢ 规定放热反应的ΔH 为
体系
“-”,是站在谁的角度?
-
+
体系还是环境?
环境
放热反应中
体系向环境做正功,释放能量→放热反应 体系向环境做负功,得到能量→吸热反应
小结
∆H= E E (生成物的总能量)- (反应物的总能量)
∆H= E E (反应物分子化学键断裂时所吸收的总能量)- (生成物分
高中化学选修4-1.1 化学反应与能量变化 课件 (共14张PPT)

3.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续
进行,直至反应完全生成新物质硫化亚铁。该现象说明了( B ) A、该反应是吸热反应 B、该反应是放热反应 C、铁粉和硫粉在常温下可以发生反应 D、生成物硫化亚铁的总能量高于反应物铁粉和硫粉的总能量 4.由图分析,有关叙述正确的是( D ) A.A―→B+C和B+C―→A两个反应吸收或放出的能 量不等 B.A―→B+C是放热反应 C.A具有的能量高于B和C具有的能量总和 D.A―→B+C是吸热反应,则B+C―→A必然是 放热 反应
焓变与反应热关系: 恒压条件下,反应的热效应等于焓变。
思考:化学反应过程中为什么会有能量的变化?
放热吸热的决定因素:反应物和生成物所具有的总能量的相对大小
ΔH=生成物总能量-反应物总能量(宏观)
能 量 反应物 放热 △H<0 能 量 吸热
生成物
△H>0
生成物 反应过程
反应物 反应过程
反应热的表示方法:
课后作业
课时训练1
结论: ΔH决定于反应物的总能量与生成物的总能量的相对大小, ΔH决定于反应物的总键能与生成物的总键能的相对大小。
物质的稳定性:键能越大,物质越稳定;能量越低,物质越稳定。
小试牛刀
1.下列过程中,需要吸收能量的是( C ) A.H+H=H2 B.H+Cl=HCl C.I2→I+I D.S+O2=SO2 2.下列变化中, 属于放热反应的是 ( B ) A.Ba(OH)2·8H2O与NH4Cl的反应 B.点燃的镁条在二氧化碳中继续燃烧 C.灼热的碳与二氧化碳的反应 D.水凝结成冰
3.在一定条件下,A和B反应可生成C和D,其能量变化如下:
吸热 填“吸热”或“放热”) 若E1﹤ E2,则该反应为____( 反应,该反应的反应热为 ΔH=(E2-E1) kJ· mol-1
(人教版)高中化学选修四:思维导图、微试题全册精品导学案
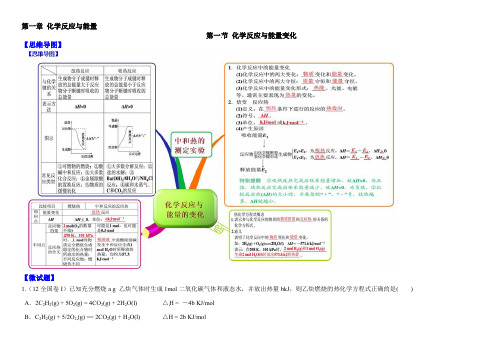
第一章化学反应与能量第一节化学反应与能量变化【思维导图】【微试题】1.(12全国卷I)已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( ) A.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l) △H = -4b KJ/molB.C2H2(g) + 5/2O2(g) == 2CO2(g) + H2O(l) △H = 2b KJ/molC.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l) △H = -2b KJ/molD.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l) △H = b KJ/mol【答案】C2.(2014年全国理综试题)已知(1)H2(g)+1/2O2(g) = H2O(g) △H1= a kJ·mol-1(2)2H2(g)+O2(g) = 2H2O(g) △H2= b kJ·mol-1(3)H2(g)+ 1/2O2(g) = H2O(l) △H3= c kJ·mol-1(4)2H2(g)+O2(g) = 2H2O(l) △H4= d kJ·mol-1下列关系式中正确的是( )A.a<b<c<0 B.b>d>0 C.2a=b<0 D.2c= d>0 【答案】C3. (2012·大纲全国理综,9)反应A+B→C(ΔH<0)分两步进行:①A+B→X(ΔH>0),②X→C(ΔH<0)。
下列示意图中,能正确表示总反应过程中能量变化的是()【答案】D4.实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:实验次数起始温度t1/℃终止温度t2/℃盐酸NaOH溶液1 20.2 20.3 23.72 20.3 20.5 23.83 21.5 21.6 24.9试完成下列问题:(1)实验时用环形玻璃棒搅拌溶液的方法是_____________________________________,不能用铜丝搅拌棒代替环形玻璃棒的理由是__________________________________。
(人教版)化学选修四思维导图:2-1化学反应速率(含答案)
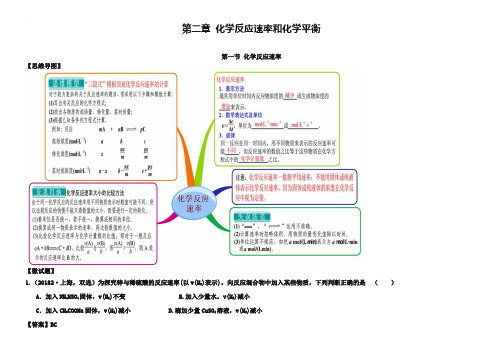
第二章化学反应速率和化学平衡第一节化学反应速率【思维导图】【微试题】1.(20182·上海,双选)为探究锌与稀硫酸的反应速率(以v(H2)表示)。
向反应混合物中加入某些物质,下列判断正确的是()A.加入NH4HSO4固体,v(H2)不变 B.加入少量水,v(H2)减小C.加入CH3COONa固体,v(H2)减小 D.滴加少量CuSO4溶液,v(H2)减小【答案】BC2.(2018海南,双选)对于可逆反应H2(g)+I2(g)2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是()A. H2(g)的消耗速率与HI(g)的生成速率之比为2:1B. 反应进行的净速率是正、逆反应速率之差C. 正、逆反应速率的比值是恒定的D. 达到平衡时,正、逆反应速率相等【答案】BD[:3.(2018·福建卷)一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。
下列判断正确的是( )[:A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等B.溶液酸性越强,R的降解速率越小C.R的起始浓度越小,降解速率越大D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1【答案】D4.臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是___________和_________。
(填分子式)(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如题表所示。
已知:O3的起始浓度为0.0216 mol/L。
①pH增大能加速O3分解,表明对O3分解起催化作用的是___________.②在30°C 、pH=4.0条件下,O 3的分解速率为__________ m ol/(L ·min)。
③据表中的递变规律,推测O 3在下列条件下分解速率依次增大的顺序为______.(填字母代号) a. 40°C 、pH=3.0 b. 10°C 、pH=4.0 c. 30°C 、pH=7.0【答案】(1)O 2 I 2 (2)①OH -; ②1.00×10-4 ; ③b 、a 、c 【解析】本题考察化学反应速率的概念、计算、外界条件对反应速率对影响。
人教版高中化学选修四课件1-1-1化学反应与能量的变化.pptx

化学键的断裂和形成
旧键断裂需要 吸收能量, 新键形成会 放出能量。
化学反应中能量变化的原因
旧键断裂 吸收能量 = 679kJ/mol 新键形成 放出能量 = 862 kJ/mol
反应H热== 679kJ/mol - 862kJ/mol = -183kJ/mol
反应物的键能总和 生成物的键能总和
对于 25℃ 101kPa时进行的反应可不注明。 普通化学方程式不需注明温度和压强。
二、热化学方程式
H242(1g.8)+kJ12/mO2o(lg)==H2O(g) △H=- H282(5g.8)+kJ12/mO2o(lg)==H2O(l) △H=-
3、热化学方程式需注明各物质的状态。 普通化学方程式不需注明物质的状态。
焓变与键能的关系式如何表达?
5、焓变与键能的关系
ΔH = 反应物的键能总和 – 生成物的键能总和
例 1:1 mol C与 1 mol H2O(g) 反应生成 l mol CO(g) 和1 mol H2(g),需要吸收131.5 kJ的热量,
该反应的反应热为△H = 131.5 kJ/mol。
例 2:拆开 1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ, 则1mol N2生成NH3的反应热为
高中化学课件
金戈铁骑整理敬请各位同仁批评指正共同进步
第一章 化学反应与能量
第一节 化学反应与能量的变化
第1课时 焓变 反应热 热化学方程式
E1:反应的活化能; E2:活化分子变成生成物分子放出的能量
E1
E2- E1:反应热
反应物
E2
人教化学选修4第一章第一节化学反应和能量的变化第1课时(共21张PPT)
恒压反应热:恒压条件下进行反应的反应热 恒容反应热:恒容条件下进行反应的反应热
焓变
生成物与反应物的焓值差
焓是物质所具有的能量,是与内能有关的物理 量,符号是H,单位是kJ/mol
ΔH
kJ/mol或kJ·mol-1
ΔH=H生成物 - H反应物
放热反应: ∆H < 0,∆H为“-” 吸热反应: ∆H > 0,∆H为“ + ”
B.A→B+C ΔH<0 C.A具有的焓高于B和C具有的焓的总和 D.A→B+C ΔH>0,则B+C→A ΔH<0
6.判断正误
√(1)化学反应旧化学键断裂时吸收能量,新化学键
形成时释放能量。
×(2)当反应放热时,Q>0。 ×(3)若形成新化学键释放的能量小于断裂旧化学键
所需要吸收的能量,则反应放热。
(微观):
Q1<Q2,
反应吸热 反应放热
2.从能量守恒的角度 反应物的总能量≠生成物的总能量
能
能
量 反应物
量
E1
E2
生成物
E2
生成物
E1 反应物
反应过程(I)
从物质总能 量守恒角度 (宏观):
反应过程 (II)
E1>E2,(Ⅰ) 反应放热
E1<E2,(Ⅱ) 反应吸热
新课学习
化学反应过程中所释放或吸收的能量,都可 以用热量(或转换成相应的热量)来表述,叫做 反应热。
书3—图1 化学反应中的能量变化的原因:
活化分子
活
E1 化
能
E2
E0
反应物 反应热
又称作为“焓变”
生成物 E
反应热=生成物的总能量-反应物的总能量
高中化学选修4《化学反应原理》 第1章 化学反应与能量转化 思维导图
普通高中化学
(山东科学技术出版社)
化学反应原理(第1章化学反应与能量转化)
思维导图
史学强
2014年10月18日
你是否发现笔记记得越多,思维也越混乱?你是否经常为琐事缠身而苦无分身之术?你是否总是感叹一天的时间太少?思维导图来了!它可以“解救”你!
思维导图是一种终极思维工具,由英国“记忆之父”东尼·博赞发明,并在全球得到广泛推广,已成为21世纪风靡全球思维工具,到目前已被世界上2.5亿人所使用。
思维导图注重开发人的左、右脑,运用线条、符号、词汇和图像,把一长串枯燥的信息变成彩色的、容易记忆的、有高度组织性的图,它绘制起来非常简单,而且十分有趣!它可以帮助人们改善思维,提高记忆力和办事效率。
关键词:高中化学化学反应原理电解池盖斯定律反应热原电池史学强
本资料利用思维导图整理高中化学《化学反应原理》第一章章中每一节基础知识,可以帮助大家增强记忆、改善思维、提高化学学习效率!
化学反应与能量转化
1-1化学反应的热效应
1-2电能转化为化学能——电解
1-3化学能转化为电能——电池。
(人教版)化学选修四思维导图1-3化学反应热的计算(含答案)
(人教版)化学选修四思维导图1-3化学反应热的计算(含答案)第一章化学反应与能量第三节化学反应热的计算①Sn(、白)+2HCl(aq)=SnCl2(aq)+H2(g);△H1②Sn(、灰)+2HCl(aq)=SnCl2(aq)+H2(g);△H2③Sn(、灰)Sn(、白);△H3=+2.1kJ/mol下列说法正确的是()A.△H1>△H2B.锡在常温下以灰锡状态存在【答案】D2.已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是()3.(13年高考江苏卷)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)H=+49.0kJ·mol-1②CH3OH(g)+21O2(g)=CO2(g)+2H2(g)H=-192.9kJ·mol-10反应过程反应物的总能量生成物的总能量CO2(g)+3H2(g)CH3OH(g)+H2(g)能量HC.CH3OH转变成H2的过程一定要吸收能量D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的H>-192.9kJ·mol-1【答案】D4.(2022年全国,节选)红磷P(S)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)根据上图回答下列问题(2)PCl5分解生成PCl3和Cl2的热化学方程式;(3)P和Cl2分两步反应生成1molPCl5的△H3=;P和Cl2一步反应生成1molPCl5的△H4△H1(填“大于”,“小于”或“等于”);【答案】(1)2P()+3Cl2(g)=2PCl3(g)△H=-612kJ/mol(2)PCl5(g)=PCl3(g)+Cl2(g)△H=+93kJ/mol(3)-399kJ/mol等于【解析】根据反应物的总能量、中间产物的总能量以及最终产物的总能量,结合化学方程式以及热化学方程式的书写方法解答,注意盖斯定律的应用.由图象可知,1molP与Cl2反应生成1molPCl3放出306lJ的能量,则反应的热化学方程式为P()+3/2Cl2(g)═PCl3(g);△H=-306kJmol-1,(2)由图象可知,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量,则反应的热化学方程式为PCl5(g)═PCl3(g)+Cl2(g);△H=+93kJmol-1,(3)由图象可知,P和Cl2分两步反应生成1molPCl5的△H3=-306kJ/mol-(+93kJ/mol)=-399kJ/mol,根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等,则P和Cl2一步反应生成1molPCl5的反应热等于P和Cl2分两步反应生成1molPCl5的反应热.。
化学思维导图
鱼类大量死亡
爱护水资源
水污染危害
人引用:中毒、致病、甚至死亡 工农业生产使用——降低产品质量
加强水质检测
防止水体污染
工业三废处理后排放 生活污水集中处理后排放
农业:合理使用农药、化肥
水的净化
自来水厂水的净化过程
沉降→过滤→吸附→投药消毒
原理:分离不溶于水的固体与液体的操作
过滤 仪器:铁架台、漏斗、烧杯、玻璃棒、滤纸
水这种物质 水由H、O元素组成 一个水分子
微观 一个水分子由2个氢原子和1个氧原子构成
水分子中H、O原子的个数比是2:1
书写 金属在前,非金属在后
读法 正写反读
单质化合价为0
根据化学式求化合价
化合物中各元素化合价代数和为0 H为+1,O为-2
金属正价,非金属负价
相对分子质量
化学式的计算 某元素的质量分数
反应原理
收集方法
排水法 向上排空气法
检验方法 将带火星的木条伸入集气瓶中,木条复燃
验满方法
将带火星的木条靠近集气瓶口,木条复燃则说明已收集满氧气
化学思维导图
物质构成的奥秘微观构成 宏观 Nhomakorabea成概念 分子是保持由分子构成的物质的化学性质的最小粒子
分子
质量、体积小 不断运动
性质 分子间有间隔
同种物质的分子性质相同,不同种物质的分子性质不同
化学思维导图:
化学思维导图
走进化学世界
物质的变化
物理变化(无物质生成) 化学变化(有新物质生成)
物质的性质
物理性质(不需要化学变化就表现出来) 化学性质(需要化学变化才表现出来)
对蜡烛及其燃烧的探究
点燃前(颜色、硬度、密度等) 点燃蜡烛(火焰分层、温度、生成物的检验) 熄灭蜡烛(白烟的检验)
