金属钾
金属钾跟金属钠的分离

金属钾跟金属钠的分离
金属钾和金属钠的分离可以通过以下步骤完成:
1. 溶解:将混合的金属钾和金属钠样品溶解在适量的无水醇中,如无水乙醇或无水丙酮。
2. 过滤:将溶解后的样品通过过滤操作,去除其中的固体杂质,如杂质金属颗粒或悬浮物。
3. 沉淀:将过滤后的溶液加入适量的有机溶剂(如酒精、乙醚等),引发金属钾和金属钠发生还原反应生成金属沉淀。
4. 分离:通过离心或过滤操作,将金属沉淀与溶液分离。
此时,金属钾将以沉淀的形式存在。
5. 洗涤:用无水有机溶剂洗涤金属钾沉淀,除去其中的杂质物质。
6. 干燥:将洗涤后的金属钾沉淀在低温下烘干,去除溶剂中的残余水分。
通过以上步骤,金属钾和金属钠就可以得到分离。
需要注意的是,在进行操作时要注意安全,避免金属钠和醇类溶剂的接触,以免引发剧烈反应。
表- 金属钾的理化性质和危险特性
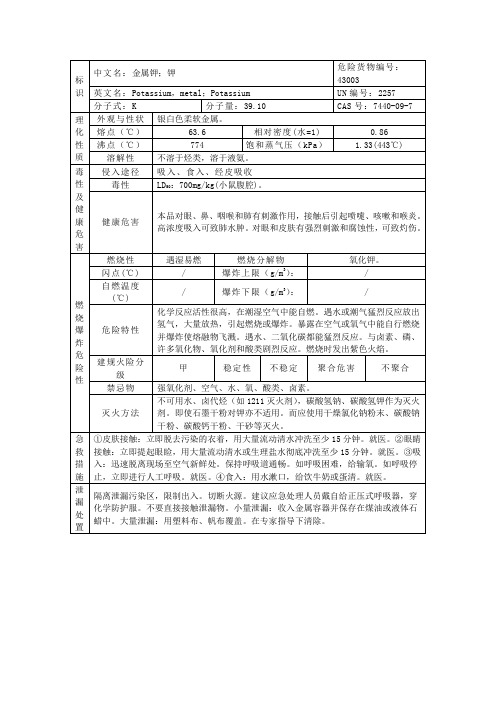
甲
稳定性
不稳定
聚合危害
不聚合
禁忌物
强氧化剂、空气、水、氧、酸类、卤素。
灭火方法
不可用水、卤代烃(如1211灭火剂),碳酸氢钠、碳酸氢钾作为灭火剂。即使石墨干粉对钾亦不适用。而应使用干燥氯化钠粉末、碳酸钠干粉、碳酸钙干粉、干砂等灭火。
急救措施
①皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗至少15分钟。就医。②眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。就医。③吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。④食入:用水漱口,给饮牛奶或蛋清。就医。
溶解性
不溶于烃类,溶于液氨。
毒性及健康危害
侵入途径
吸入、食入、经皮吸收
毒性
LD50:700mg/kg(小鼠腹腔)。
健康危害
本品对眼、鼻、咽喉和肺有刺激作用,接触后引起喷嚏、咳嗽和喉炎。高浓度吸入可致肺水肿。对眼和皮肤有强烈刺激和腐蚀性,可致灼伤。
燃烧炸危险性
燃烧性
遇湿易燃
燃烧分解物
氧化钾。
闪点(℃)
泄漏处置
隔离泄漏污染区,限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿化学防护服。不要直接接触泄漏物。小量泄漏:收入金属容器并保存在煤油或液体石蜡中。大量泄漏:用塑料布、帆布覆盖。在专家指导下清除。
储运注意事项
①储存注意事项:浸于煤油中。储存于阴凉、通风的库房。远离火种、热源。库温不超过25℃,相对湿度不超过75%。包装要求密封,不可与空气接触。应与氧化剂、酸类、卤素等分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有合适的材料收容泄漏物。
金属钾和二氧化氮

金属钾和二氧化氮1. 介绍金属钾是一种化学元素,化学符号为K,原子序数为19。
它是一种具有银白色的金属光泽的金属,在自然界中主要以氯化钾的形式存在。
钾是人体必需的元素之一,它在维持细胞的正常功能、水平衡和神经传导方面起着重要作用。
二氧化氮是一种具有刺激性气味的无色气体,化学式为NO2。
它是一种重要的大气污染物,主要由燃烧过程中的氮气和氧气反应产生。
二氧化氮对人体健康和环境都具有负面影响,因此需要采取措施来减少其排放和控制其浓度。
2. 金属钾的性质和用途金属钾具有以下性质:•密度较小:金属钾的密度为0.86克/立方厘米,比大多数金属都要轻。
•低熔点:金属钾的熔点为63.4摄氏度,较低的熔点使其在室温下就可以熔化。
•强烈的活性:金属钾是一种非常活泼的金属,它可以与水反应产生氢气和氢氧化钾。
•良好的导电性:金属钾是一种良好的电导体,因此被广泛应用于电池和其他电子器件中。
金属钾的主要用途包括:•作为钾肥的原料:金属钾可以制成氯化钾和硫酸钾等肥料,用于农业中提供植物所需的钾元素。
•用于合成化学反应:金属钾可以用于合成有机化合物,例如合成醇和醚等有机溶剂。
•用于制备合金:金属钾可以与其他金属形成合金,例如与锂形成钾锂合金,用于制备高能量密度的电池。
3. 二氧化氮的性质和影响二氧化氮具有以下性质:•有刺激性气味:二氧化氮具有刺激性气味,当浓度较高时,会引起眼睛和呼吸道不适。
•可溶于水:二氧化氮可以溶于水,形成硝酸和亚硝酸,这些物质对环境和生物体有害。
•与其他气体反应活泼:二氧化氮可以与其他气体反应,形成其他大气污染物,例如臭氧和酸雨。
二氧化氮对人体健康和环境都具有负面影响:•对人体健康的影响:长期暴露于高浓度的二氧化氮会导致呼吸系统疾病,例如哮喘和慢性阻塞性肺病。
•对环境的影响:二氧化氮是酸雨的主要成分之一,它会破坏植被、水体和土壤,对生态系统造成损害。
4. 金属钾和二氧化氮的反应金属钾和二氧化氮可以发生以下反应:2K + 4NO2 -> 2KNO3 + N2O4这个反应是一个氧化还原反应,金属钾被氧化为钾离子,二氧化氮被还原为一氧化氮和二氧化氮混合物。
金属钾的测定方法及原理

金属钾的测定方法及原理金属钾的测定方法及原理金属钾常用于化学实验室中,因其具有活泼的化学反应性和与许多物质发生反应的特性。
为了准确测定金属钾的含量,科学家们发展了一系列的分析方法。
下面将介绍几种常用的金属钾测定方法及其原理。
一、火焰原子吸收光谱法(FAAS)火焰原子吸收光谱法是最常用的金属钾测定方法之一。
其原理是利用物质在火焰中的蒸发和激发引起的特定谱线吸收的现象。
首先,将待测溶液或固体物质溶解于酸中,然后通过适当稀释和调节pH值,将其转化为钾离子。
随后,将钾溶液分别注入火焰中,利用钾原子在火焰中吸收特定波长的光线,测定吸收光谱的强度,从而计算钾的浓度。
二、原子荧光光谱法(AFS)原子荧光光谱法的原理与火焰原子吸收光谱法相似,但它使用的是荧光测量原理。
当钾原子在火焰中被激发时,外层电子吸收能量,然后返回到基态时释放出荧光。
荧光的强度与元素浓度成正比。
通过测量荧光光谱的强度,可以计算出钾的浓度。
三、电感耦合等离子体发射光谱法(ICP-OES)电感耦合等离子体发射光谱法是一种高灵敏度和多元素分析的方法。
该方法使用电感耦合等离子体产生高温等离子体,激发样品中的钾原子,使其发射特定的光谱线。
通过测量这些光谱线的强度并与标准样品进行比较,可以计算出钾的浓度。
四、钾电极法钾电极法是一种便捷且快速的金属钾测定方法。
它基于离子选择性电极的原理。
钾电极是一种特殊的传感器,具有高选择性地测定钾离子。
将待测溶液与含有已知浓度的标准钾溶液进行比较,通过测量溶液中钾离子浓度的差异,可以计算出样品中钾的浓度。
五、甲基橙滴定法甲基橙滴定法是一种常用的滴定方法,用于测定钾含量。
其原理是利用甲基橙指示剂对溶液中的钾离子和氢氧化钠进行滴定。
首先,用甲基橙作为指示剂添加到溶液中,钾离子与指示剂发生络合反应,在滴定过程中从红色变为黄色。
当溶液中的钾离子被完全滴定后,溶液颜色由黄色变为红色。
通过已知浓度的氢氧化钠的滴定量,计算出待测钾溶液中的钾离子浓度。
金属钾的熔沸点比铬低的原因

金属钾的熔沸点比铬低的原因
金属钾的熔沸点比金属铬低的原因是由于其原子半径比铬小和电子云膜松散。
在同种元素中,原子半径越小,其熔沸点越低。
这是因为原子半径越小,原子间的距离就越近,原子间的相互作用就越强,因此原子间的结合能也就越大,需要更多的能量才能使它们分离开来。
钾的原子半径比铬小,所以它的熔沸点比铬低。
此外,电子云膜松散也会使金属的熔沸点降低。
电子云膜松散指的是原子的电子云膜层较松散,即电子云膜层中的电子不太紧密地靠在一起。
电子云膜松散的原子电子之间的相互作用就会减弱,原子间的结合能也就会降低,因此它们的熔沸点也就会降低。
钾的电子云膜较松散,所以它的熔沸点比铬低。
金属钾的化学式

金属钾的化学式
金属钾的化学式是K,它是金属元素的一种,所属族为第一族,其原子序数为19。
金属钾是一种比较活跃的金属元素,它的颜色可以是银白色或淡紫红色,密度
为0.86 g/cm3。
它是一种熔点低的金属材料(63.4℃),大多数情况下可以利用
热量在室温下直接溶解。
金属钾的熔点和沸点相对其他金属材料很低,所以它的熔融性新颖有趣,大多数情况下可以利用热量在常温下直接溶解。
金属钾在日常生活中具有广泛的应用。
它被广泛应用于医学领域,作为一种可
以取代钠和钙的安全替代物,金属钾可以降低血压,促进新陈代谢,改善贫血症状,缓解肝硬化症状等。
它还可以应用于农业,因为它可以促进植物的生长,提高蔬菜的抗冻性,以及农作物的收成率,从而提高农作物的收获量和质量。
此外,金属钾也可用于工业生产,比如制作浮法熔炼成形,用于制造电子零部件,制造氧化钾的晶片用于燃烧汽油机等工程。
金属钾的化学式K,它既与人类福
祉有关,也与现代工业生产有着密切的联系。
钾

钾(1)化学品及企业标识化学品中文名钾;金属钾化学品英文名 potassium分子式 K 相对分子质量 39.098(2)成分/组成信息√纯品混合物有害物成分浓度 CAS NO.钾 7440-09-7(3)危险性概述危险性概述第4.3类遇湿易燃物品侵入途径吸入、食入健康危害钾在空气中能自燃生成氧化钾,后者与水反应生成氢氧化钾。
氧化钾和氢氧化钾均为强碱性物质,对眼和皮肤有强烈刺激和腐蚀性,可致灼伤。
环境危害对环境有害燃爆危险接触空气易自燃。
遇水剧烈反应,可引起燃烧或爆炸(4)急救措施皮肤接触立即脱去污染的衣着,用大量流动清水冲洗20~30min。
如有不适感,就医(5)消防措施危险特性化学反应活性很高,在潮湿空气中能自燃。
遇水或潮气发生猛烈反应放出氧气,大量放热,引起燃烧或爆炸。
暴露在空气或氧气中能自行燃烧并爆炸时熔融物飞溅。
遇水、二氧化碳都能发生猛烈反应。
与卤素、磷、许多氧化物、氧化剂和酸类发生剧烈反应。
燃烧时发出紫色火焰。
有害燃烧产物氧化钾灭火方法用干燥氯化钠粉末、碳酸钠干粉、碳酸钙干粉、干砂等灭火灭火注意事项及措施消防人员必须佩戴空气呼吸器、穿全身防火防毒服,在上风向灭火。
尽可能将容器从火场移至空旷处。
喷水保持火场容器冷却,直至灭火结束。
不可用水、卤代烃(如1211灭火剂)、碳酸氢钠、碳酸氢钾作为灭火剂。
即使石墨干粉对钾亦不适用。
(6)泄露应急处理应急行动严禁用水处理。
隔离泄露污染区,限值出入。
消除所有点火源。
建议应急处理人员戴正压自给式呼吸器,穿防静电、防腐蚀、防毒服。
禁止接触或跨越泄漏物。
尽可能切断泄漏源。
保持泄漏物干燥。
小量泄露:用干燥的砂土或其他不燃材料覆盖泄漏物,然后用塑料布覆盖,减少飞散、避免雨淋。
收入金属容器并保存在煤油或液体石蜡中。
粉末泄露:用塑料布或帆布覆盖泄漏物,减少飞散,保持干燥。
严禁设法扫除干的泄漏物。
在专家指导下清除。
(7)操作处置与储存操作注意事项密闭操作。
操作人员必须经过专门培训,严格遵守操作规程。
金属钾最高纯度

金属钾最高纯度全文共四篇示例,供读者参考第一篇示例:金属钾是一种化学元素,属于主族元素,原子序数为19,化学符号为K。
它是一种具有明亮的银白色外观和柔软质地的金属,在常温下是固体状态。
金属钾是一种非常活泼的金属,它能够与水反应产生氢气,并且能够在空气中自燃。
由于金属钾的化学性质十分活泼,所以在实验室中通常以一种合金形式存在,用以降低其活性,同时也更容易处理。
在纯度方面,金属钾最高纯度是非常重要的。
高纯度的金属钾在化学实验室和工业生产中起着至关重要的作用。
高纯度的金属钾可以确保实验的准确性和稳定性,同时也可以保证产品的质量和性能。
以下将介绍金属钾最高纯度的制备方法和应用场景。
一、金属钾最高纯度的制备方法1. 氧化钾法:氧化钾法是一种比较成熟的金属钾制备方法。
将氧化钾置于还原炉中,并加热至高温,然后通过电解还原的方法将氧化钾还原为金属钾。
在这一过程中,需要注意控制温度和压力,以确保制备的金属钾纯度达到要求。
2. 电解法:电解法是另一种常用的金属钾制备方法。
通过将含有化合物的金属钾溶液通入电解槽中,并施加电流,使金属钾在电流作用下析出。
通过控制电流强度和反应条件,可以获得高纯度的金属钾。
3. 溴化金属还原法:溴化金属还原法是一种较为新颖的金属钾制备方法。
首先将金属钾的溴化物与另一种金属还原剂反应,然后通过冶炼和精炼的方法得到高纯度的金属钾。
这种方法的优势在于制备过程简单,并且可以获得高纯度的金属钾。
二、金属钾最高纯度的应用场景1. 化学实验室:高纯度的金属钾在化学实验室中被广泛应用。
它可以作为还原剂、反应试剂和催化剂,用于有机合成反应、氢气生成反应等。
高纯度的金属钾可以确保实验结果的准确性和可靠性,为科学研究提供有力支持。
2. 电池生产:金属钾具有较高的电导率和热导率,因此在电池生产领域有着重要的应用。
高纯度的金属钾可以提高电池的性能和稳定性,延长电池的使用寿命,同时也有利于环境保护和资源节约。
3. 金属钾化合物的制备:金属钾与其他元素的化合物在冶金、材料科学等领域有着广泛应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、物质的理化常数
CA
国标编号: 43003
7440-09-7
S:
中文名称: 金属钾
英文名称: potassium
别名: 钾
分子
分子式: K
39.10
量:
熔点: 63.6℃ 沸点:774℃
密度: 相对密度(水=1)0.86
蒸汽压: 443℃
溶解性: 不溶于烃类,溶于液氨
稳定性: 不稳定
外观与性
银白色柔软金属
状:
危险标记: 10(遇湿易燃物品)
用途: 用于制过氧化钾、合金的热交换剂,也用作试剂
2.对环境的影响:
一、健康危害
侵入途径:吸入、食入。
健康危害:本口对眼、鼻、咽喉和肺有刺激作用,接触后引起喷嚏、咳嗽和喉炎。
高浓度吸入可致肺水肿。
对眼和皮肤有强烈刺激和腐蚀性,可致灼伤。
二、毒理学资料及环境行为
急性毒性:LD50700mg/kg(小鼠腑腔内)
危险特性:化学反应活性很高,在潮湿空气中能自燃。
遇水或潮气猛烈反应放出氢气,大量放热,引起燃烧或爆炸。
暴露在空气或氧气中能自行燃烧并爆炸使熔融物飞溅。
遇水、二氧化碳都能猛烈反应。
与卤素、磷、许多氧化物、氧化剂和酸类剧烈反应。
燃烧时发出紫色火焰。
燃烧(分解)产物:氧化钾。
3.现场应急监测方法:
4.实验室监测方法
火焰原子吸收法(GB11904-89,水质)
原子吸收法(GB13580.12-92,大气降水)
原子吸收法《固体废弃物试验分析评价手册》中国环境监测总站等译
5.环境标准:
6.应急处理处置方法:
一、泄漏应急处理
隔离泄漏污染区,限制出入。
切断火源。
建议应急处理人员戴自给式呼吸器,穿消防防护服。
不要直接接触泄漏物。
小量泄漏:避免扬尘,收集于干燥、洁净、有盖的容器中。
收入金属容器并保存在煤油或液体石蜡中。
大量泄漏:用塑料布、帆布覆盖,减少飞散。
在专家指导下清除。
二、防护措施
呼吸系统防护:一般不需要特殊防护,但建议特殊情况下,佩戴自吸过滤式防毒面具(半面罩)。
眼睛防护:戴安全防护面罩。
身体防护:穿化学防护服。
手防护:戴橡胶手套。
其它:工作现场严禁吸烟。
注意个人清洁卫生。
三、急救措施
皮肤接触:立即脱去被污染的衣着,用大量流动清水冲洗,至少15分钟。
就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。
就医。
吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
食入:误服者用水漱口,给饮牛奶或蛋清。
就医。
灭火方法:不可用水、卤代烃(如1211灭火剂)、碳酸氢钠、碳酸氢钾作为灭火剂。
即使用石墨干粉对钾亦不适用。
而应使用干燥氯化钠粉末、碳酸钠干粉、碳酸钙干粉、干砂等灭火。
CA
国标编号: 43003
7440-09-7
S:
中文名称: 金属钾
英文名称: potassium
别名: 钾
分子
39.10
分子式: K
量:
熔点: 63.6℃ 沸点:774℃
密度: 相对密度(水=1)0.86
蒸汽压: 443℃
溶解性: 不溶于烃类,溶于液氨
稳定性: 不稳定
外观与性
银白色柔软金属
状:
危险标记: 10(遇湿易燃物品)
用途: 用于制过氧化钾、合金的热交换剂,也用作试剂
2.对环境的影响:
一、健康危害
侵入途径:吸入、食入。
健康危害:本口对眼、鼻、咽喉和肺有刺激作用,接触后引起喷嚏、咳嗽和喉炎。
高浓度吸入可致肺水肿。
对眼和皮肤有强烈刺激和腐蚀性,可致灼伤。
二、毒理学资料及环境行为
急性毒性:LD50700mg/kg(小鼠腑腔内)
危险特性:化学反应活性很高,在潮湿空气中能自燃。
遇水或潮气猛烈反应放出氢气,大量放热,引起燃烧或爆炸。
暴露在空气或氧气中能自行燃烧并爆炸使熔融物飞溅。
遇水、二氧化碳都能猛烈反应。
与卤素、磷、许多氧化物、氧化剂和酸类剧烈反应。
燃烧时发出紫色火焰。
燃烧(分解)产物:氧化钾。
3.现场应急监测方法:
4.实验室监测方法
火焰原子吸收法(GB11904-89,水质)
原子吸收法(GB13580.12-92,大气降水)
原子吸收法《固体废弃物试验分析评价手册》中国环境监测总站等译
5.环境标准:
6.应急处理处置方法:
一、泄漏应急处理
隔离泄漏污染区,限制出入。
切断火源。
建议应急处理人员戴自给式呼吸器,穿消防防护服。
不要直接接触泄漏物。
小量泄漏:避免扬尘,收集于干燥、洁净、有盖的容器中。
收入金属容器并保存在煤油或液体石蜡中。
大量泄漏:用塑料布、帆布覆盖,减少飞散。
在专家指导下清除。
二、防护措施
呼吸系统防护:一般不需要特殊防护,但建议特殊情况下,佩戴自吸过滤式防毒面具(半面罩)。
眼睛防护:戴安全防护面罩。
身体防护:穿化学防护服。
手防护:戴橡胶手套。
其它:工作现场严禁吸烟。
注意个人清洁卫生。
三、急救措施
皮肤接触:立即脱去被污染的衣着,用大量流动清水冲洗,至少15分钟。
就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。
就医。
吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
食入:误服者用水漱口,给饮牛奶或蛋清。
就医。
灭火方法:不可用水、卤代烃(如1211灭火剂)、碳酸氢钠、碳酸氢钾作为灭火剂。
即使用石墨干粉对钾亦不适用。
而应使用干燥氯化钠粉末、碳酸钠干粉、碳酸钙干粉、干砂等灭火。
