第四节用途广泛的金属材料开发利用金属矿物课件
高考化学一轮总复习用途广泛的金属材料开发利用金属矿物课件

【解析】选D。A.合金的熔点比它的各成分金属的熔点低, 硬度大于其成分金属,故A正确;B.合金的性质与成分的含 量有关,所以改变原料的配比,可以制得性能不同的铝锂合 金,故B正确;C.铝锂合金具有金属材料的一些通性,有金属 光泽,可导电导热,故C正确;D.合金的熔点比它的各成分金 属的熔点低,硬度大于其成分金属,所以铝锂合金的性质与 各成分金属的性质不完全相同,故D错误。
第四节 用途广泛的金属材料
开发利用金属矿物
一、合金及常见的金属材料 1.合金 (1)概念:合金是指两种或两种以上的金属(或金属与 非金属)熔合而成的具有_金__属__特__性__的物质。
(2)性能: ①熔点:一般比它的各成分金属的低; ②硬度和强度:一般比它的各成分金属的大。
【微点拨】 (1)常温下,多数合金是固体,但钠钾合金是液体。 (2)合金的物理性质相比于成分金属有所改变,但合金 中各成分金属的化学性质仍然不变。 (3)并非所有的金属都能形成合金。当一种金属的熔 点高于另一种金属的沸点时,则这两种金属不能形成 合金。
1.(RJ必修1·P66改编)下列说法中正确的是 ( ) A.铁是人类在生产、生活中最早使用的金属材料 B.金、银、铜是应用最广泛的金属材料 C.钛被誉为“21世纪的金属”,应用前景很广阔 D.铜是导电性、导热性最好的有色金属
【解析】选C。铜是人类使用最早的金属材料,A错;铁、 铝及铝合金是应用最广泛的金属材料,B错;银的导电 性比铜好,D错。
3.(RJ必修2·P89改编)用铝热反应还原下列物质,制 得金属各1 mol 时,消耗铝最少的是 ( ) A.MnO2 B.Cr2O3 C.V2O5 D.Fe3O4
【解析】选D。制得Mn、Cr、V、Fe金属各1 mol 时, 分别转移电子4 mol、3 mol、5 mol、8 mol,根据得
高考化学一轮总复习 第3章 第四节 用途广泛的金属材料和开发金属矿物课件

实验 装置
①镁带剧烈燃烧,放出一定的热,并发出耀
实验 眼的白光,氧化铁和铝粉在较高温度下发生
现象 剧烈反应;
②纸漏斗的下部被烧穿,有熔融物落入沙中
原理 应用
①制取熔点较高、活泼性弱于 Al 的金属铬、 锰、钨等; ②金属焊接,如野外焊接钢轨等
第十五页,共三十七页。
铜及其化合物 (对应复习讲义第 35 页)
________(填“能”或“不能”)说明固体混合物
中无 Fe2O3,理由是______________________(用离
子方程式说明)。
第十一页,共三十七页。
[解析] 做铝热反应的实验时,需要 KClO3 作助燃剂,且用镁条引燃;即使固体混合物中有 Fe2O3,因发生反应 Fe2O3+6H+===2Fe3++3H2O 和 Fe+2Fe3+===3Fe2+,使 Fe3+转化为 Fe2+,KSCN 溶液也不会变红。
[答案] bd KClO3 作助燃剂,Mg 作引燃剂 不能 Fe2O3+6H+===2Fe3++3H2O、Fe+2Fe3+ ===3Fe2+(或只写 Fe+2Fe3+===3Fe2+)
第十二页,共三十七页。
4.(2019·成都模拟)金属材料在日常生活以及 生产中有着广泛的应用。下列说法不正确的是 (D )
第二十页,共三十七页。
②CuSO4 a.CuSO4· 5H2O 为_蓝___色晶体,俗称_胆_矾_(_dǎn fán) 或_蓝__矾_(l_án_fá。n) 受热或遇浓 H2SO4,蓝___色晶体变为_白__色粉 末。 b . 无 水 CuSO4 遇 水 变 _蓝__ 色 ( 生 成 CuSO4·5H2O),可作为水__或_水_蒸_气_____的检验试剂。 ③铜盐的毒性
金属矿物的开发利用资料课件

的过程。
适用条件
适用于埋藏较深的矿体,一般 要求矿体距地表深度大于600
米。
优点
对环境影响较小,可以保护地 表生态。
缺点
开采成本高,生产能力较小, 安全风险较高。
特殊开采技术
特殊开采技术
是指针对特殊地质条件和金属 矿物的开采技术,如高温高压 环境下的开采、海底矿产开采
生物浸出法
生物吸附法
利用微生物的代谢产物与矿物中的某些组 分发生化学反应,溶解后分离出有用组分 。
利用微生物对某些有用组分的吸附作用, 从溶液中分离出有用组分。
生物氧化还原法
生物堆积法
通过微生物的氧化还原作用,将矿物中的 某些组分转化为可溶性物质。
利用微生物的生长繁殖,使某些有用矿物 聚集在一起,便于分离。
电化学冶炼
涉及反应
电解反应,如铝的电解炼铝。
优缺点
电化学冶炼的优点在于能够提取高纯度的金属,但生产成本较高,且对能源的消耗较大。
直接冶炼
总结词
直接利用某种还原剂将金属矿物中的金属还原出来。
涉及反应
直接还原反应,如钒钛矿的直接还原炼钒。
详细描述
直接冶炼是一种较为特殊的金属冶炼技术,通过直接加入 还原剂将金属矿物中的金属还原出来。该方法适用于处理 某些特定的金属矿物,如钒、钛等。
锌
用于汽车电池等。
航空航天行业
01
02
03
高品质的铝和钛
用于制造飞机和火箭的结 构部件。
镍和钴
用于制造高温合金,用于 航空发动机。
钨和钼
用于制造航天器的热防护 系统。
电子产品行业
铜
01
课件:用途广泛的金属材料 开发利用金属矿物

一、常见的金属材料
1、合金
合金指多种金属(或金属与非金属)熔合而成具有金属特性 的金属材料。
合金特性:
⑴合金熔点一般比各成分金属熔点低。 ⑵合金硬度一般比各成分金属硬度大。
2、常见金属材料 金属材料包括纯金属和它们的合金。 可分为黑色金属材料和有色金属材料。 ⑴重要的黑色金属材料
练习4、合金相对于纯金属制成的金属材料的优点是 A ①合金的硬度一般比它的各成分金属的大;②一般地, 合金的熔点比它的各成分金属的更低;③改变原料的配 比、改变生成合金的条件,得到有不同性能的合金; ④合金比纯金属的导电性更强;⑤合金比纯金属的应用 范围更广泛。
A.①②③⑤ B.②③④ C.①②④ D.①②④⑤
练习2、金属的使用是人类拓展自身能力的标志之一。人
类利用几种常用金属的先后顺序依次为:金、铜、铁、
铝,之所以有先后,主要取决于 C A.金属在地壳中的含量多少 B.金属的熔、沸点高低
C.金属的活泼性强弱
D.金属的导电性强弱
练习3、下列制备金属单质的方法或原理正确的是 B A.在高温条件下,用H2还原MgO制备单质Mg B.在通电条件下,电解熔融Al2O3制备单质Al C.在通电条件下,电解饱和食盐水制备单质Na D.加强热,使CuO在高温条件下分解制备单质Cu
Mn+ + ne- = M
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
电解法
热还原法
(电解熔融盐或氧化物)
热分解法 物理提取法
★铝热反应
剧烈反应,发出强光,纸漏斗被烧 穿,沙子上落有黑色铁珠。
高温
2Al + Fe2O3 == 2Fe + Al2O3
第4讲用途广泛的金属材料及开发利用金属矿物
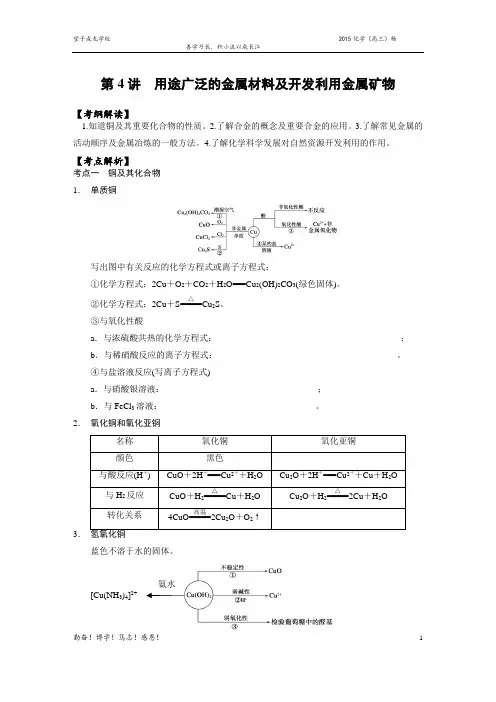
1第4讲 用途广泛的金属材料及开发利用金属矿物【考纲解读】1.知道铜及其重要化合物的性质。
2.了解合金的概念及重要合金的应用。
3.了解常见金属的活动顺序及金属冶炼的一般方法。
4.了解化学科学发展对自然资源开发利用的作用。
【考点解析】考点一 铜及其化合物 1. 单质铜写出图中有关反应的化学方程式或离子方程式:①化学方程式:2Cu +O 2+CO 2+H 2O===Cu 2(OH)2CO 3(绿色固体)。
②化学方程式:2Cu +S=====△Cu 2S 。
③与氧化性酸a .与浓硫酸共热的化学方程式:__________________________________________;b .与稀硝酸反应的离子方程式:_________________________________________。
④与盐溶液反应(写离子方程式)a .与硝酸银溶液:___________________________________;b .与FeCl 3溶液:___________________________________。
2. 氧化铜和氧化亚铜3.蓝色不溶于水的固体。
24. CuSO 4·5H 2OCuSO 4·5H 2O 为蓝色晶体,俗称蓝矾、胆矾。
无水CuSO 4为白色粉末,遇水变蓝色(生成CuSO 4·5H 2O),可作为水的检验依据。
【典例分析】铜有两种常见的氧化物CuO 和Cu 2O 。
某学习小组取0.98 g(用精密天平测量)Cu(OH)2固体,将其加热有铜的氧化物生成,其质量随温度变化的曲线如图1所示。
另外,某同学绘制了三条表示金属氧化物与其所含金属元素质量的关系曲线,如图2所示。
则下列分析正确的是( )A .图1中产物a 、b 的化学式分别为Cu 2O 和CuOB .图1整个过程中共生成0.26 g H 2OC .图2三条曲线中,表示CuO 和其中所含Cu 元素质量的关系曲线是曲线AD .图2中绘制错误的曲线共2条【典例分析】某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:方案Ⅰ:铜铝混合物――→足量溶液A充分反应测定生成气体的体积 方案Ⅱ:铜铝混合物――→足量溶液B 充分反应测定剩余固体的质量 下列有关判断中不正确的是( )A .溶液A 和B 均可以是盐酸或NaOH 溶液 B .溶液A 和B 均可以选用稀硝酸C .若溶液B 选用浓硝酸,则测得铜的质量分数偏小D .实验方案Ⅱ更便于实施 考点二 合金的概念及其重要应用 1. 熟记金属活动性顺序氨水[Cu(NH 3)4]2+(1)概念:合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
第三章第四讲用途广泛的金属材料及开发利用金属矿物
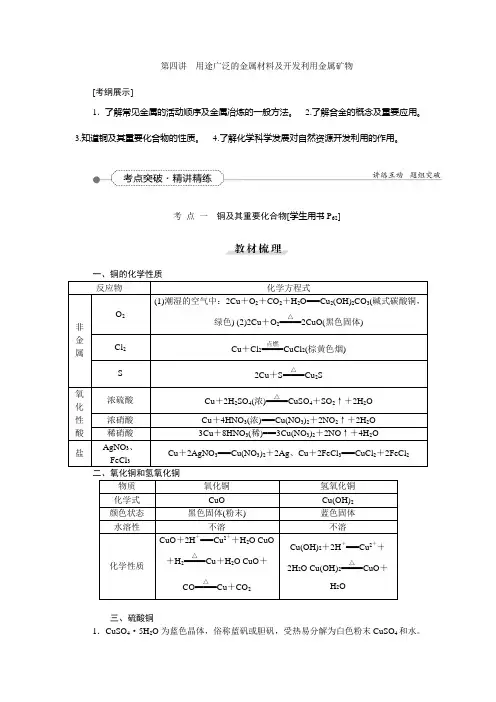
第四讲用途广泛的金属材料及开发利用金属矿物[考纲展示]1.了解常见金属的活动顺序及金属冶炼的一般方法。
2.了解合金的概念及重要应用。
3.知道铜及其重要化合物的性质。
4.了解化学科学发展对自然资源开发利用的作用。
考点一铜及其重要化合物[学生用书P62]二、氧化铜和氢氧化铜三、硫酸铜1.CuSO4·5H2O为蓝色晶体,俗称蓝矾或胆矾,受热易分解为白色粉末CuSO4和水。
2.无水CuSO4遇水变蓝色(生成CuSO4·5H2O),可作为水的检验试剂,但不适于作干燥剂。
(1)Cu在加热条件下与O2非常容易反应,利用这一性质,可把Cu作为O2的吸收剂。
若在实验题中看到加热的铜网或铜粉,应想到这一作用。
(2)无水CuSO4常用作水的检验试剂;由于其吸水效率不是太高,一般不作干燥剂使用。
(3)铜盐属于重金属盐,可使蛋白质变性,故铜盐有毒。
农业上常用石灰乳和CuSO4混合使用,是被称为“波尔多液”的农药。
(2015·最新调研)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。
其设计的实验过程为(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于________上(用以下所给仪器的编号填空,下同),取用坩埚应使用________,灼烧后的坩埚应放在________上,不能直接放在桌面上。
实验所用仪器:a.蒸发皿b.石棉网c.泥三角d.表面皿e.坩埚钳f.试管夹(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是________。
a.灼烧过程中部分氧化铜被还原b.灼烧不充分铜未被完全氧化c.氧化铜在加热过程中分解生成铜d.该条件下铜无法被氧气氧化(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、________、冷却结晶、________、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是①________________________________、②________________________________。
高考化学 用途广泛的金属材料 开发利用金属矿物 新人教版 PPT
②与酸的反应
a、与非氧化性酸:_不__反__应___。
b、与氧化性酸反应
与浓硫酸的反应:
_C_u_+_2_H_2_S_O_4_(_浓__)_=_=△_=_=_C_u_S_O_4_+_S_O_2_↑__+_2_H_2O__。
与浓硝酸的反应:
_C_u_+_4_H_N_O_3(_浓__)_=__=_=_=_C_u_(_N_O_3)_2_+_2_N_O_2_↑__+_2_H_2O__。
三、金属铜及其重要化合物的主要性质及应用 1、单质铜 (1)物理性质。 _紫__红__色、不能被磁体吸引。 (2)化学性质。
①与非金属的反应 a、与O2反应
加热:__2_C_u_+_O_2_=_=_△_=_=_2_C_u_O_。
常温下在潮湿的空气中:
2Cu+O2+H2O+CO2====Cu2(OH)2CO3。 b、与Cl2反应:_C_u_+_C_l_2_=_=△_=_=__C_u_C_l_2 _(_棕__黄__色烟)。
2、铜的化合物的主要性质 (1)氧化铜与氢氧化铜。
物质
氧化铜
氢氧化铜
化学式
CuO
状态 不溶于水的_黑__色固体(粉末)
Cu(OH)2 不溶于水的_蓝__色固
化学 性质
CuO+2H+====Cu2++H2O
CuO+H2
△
====
Cu+H2O
CuO+CO
△
====
Cu+CO2
Cu(OH)2+2H+====
与稀硝酸的反应: _3_C_u_+_8_H_N_O_3_(_稀__)_=_=_=_=_3_C_u_(_N_O_3_)_2+_2_N_O_↑__+_4_H_2_O__。
第四节 用途广泛的金属材料开发利用金属矿物 课件
电解
Fe2O3+3CO
2Fe+3CO2 ==== Cr2O3+2Al 高温 2Cr+Al2O3 ==== △ WO3+3H2 ==== W+3H2O
高温
△ 2HgO ==== 2Hg+O2↑ △ 4Ag+O ↑ 2Ag2O ==== 2
2019高考一轮总复习 • 化学
(5)铝热反应。 ①原理:Al作还原剂,另一种氧化物作氧化剂,用铝将 氧化物中的金属置换出来。
元素,缺钙会使骨质疏松,血红蛋白中含有铁元素,缺
铁会引起缺铁性贫血,D正确。
2019高考一轮总复习 • 化学
2.某同学设计了如下实验测量m g铜银合金样品中铜 的质量分数:
下列说法中不正确的是(
世纪金榜导学号79100040
)
2019高考一轮总复习 • 化学
A.合金的熔点比其成分金属低,通常比成分金属具有 更优良的金属特性 B.铜银都能与稀硝酸反应,收集到的V L气体可能全为
Cu2(OH)2CO3 。 ___________
2019高考一轮总复习 • 化学
写出下列化学方程式。
△ 2Cu+O 铜在空气中加热:_______________ 2==== 2CuO 。 △ Cu S 2Cu+S 铜丝在硫蒸气中反应:______________ ==== 2 。 △ CuCl Cu+Cl 铜丝在Cl2中反应:________________ 2 ==== 2。
1.铜:
(1)物理性质。 紫红 色固体,具有良好的延展性、导热性和导电性。 _____
2019高考一轮总复习 • 化学
(2)化学性质。
2019高考一轮总复习 • 化学
高考化学大一轮复习课件第三章第四节用途广泛的金属材料开发利用金属矿物ppt文档
解析:(1)A 是一种紫红色金属,则为铜,气体 D 能使品红溶液褪色,加 热 时 又 恢 复 原 色 , 说 明 为 二 氧 化 硫 , 所 以 是 铜 和 浓 硫 酸 的 反 应 : Cu + 2H2SO4(浓)==△===CuSO4+SO2↑+2H2O;SO2 被一种气体还原生成淡黄色固 体,所以是 2H2S+SO2===3S↓+2H2O。(2)如果 D 是最轻的气体,说明是氢 气,金属铝可以和 NaOH 溶液反应产生氢气,但生成的 NaAlO2 溶液无法一 步得到金属铝,即反应②无法进行,所以 B 不可能是 NaOH 溶液。(3)D 是一 种无色气体,遇到空气变为红棕色,说明是 NO 气体,液体 C 呈蓝色,说明 是含铜离子的溶液,应是铜与稀 HNO3 反应①:3Cu+8H++2NO- 3 ===3Cu2+ +2NO↑+4H2O,反应②可以是 Cu2++Fe===Fe2++Cu。
解析:无固体剩余,说明铜全部以 Cu2+形式存在,加入的铁粉完全 反应,溶液中一定含有 Fe2+,可能含有 Fe3+,A 错误;若有固体存在, 固体中一定有铜,可能有铁,溶液中一定含有 Fe2+,B 正确;若溶液中 有 Cu2+,加入的铁粉不足,可能只与 Fe3+反应,也可能与 Fe3+反应后, 剩余的部分与 Cu2+反应生成铜,所以可能有固体析出,C 错误;当加入 的铁粉较少时,只发生 Fe+2Fe3+===3Fe2+时,不会有铜析出,D 错误。
该气体 D 与另一种气体 H 混合后生成一种淡黄色固体 W,写出该反应的 化学方程式:_____________________________________。
金属矿物的开发利用(课件PPT)
问题3:金属冶炼常用到的三种方法分别适 用于什么样的金属?有什么规律?
K Ca Na Mg Al Zn Fe…Cu Hg Ag Pt Au
电解法
热还原法 热分解法 物理提纯
环节2:小试牛刀
孔雀石是一种常见的铜矿石, 资料卡片:
现以孔雀石为原料,其他试 孔雀石的主要成分为
铝在19世纪还是贵族享用的专 品,价格甚至高于黄金,近200 年,铝制品进入寻常百姓家
铝在地壳中的含量在金属中位 居第一,主要存在于铝土矿中
(成分主要为Al2O3)
1799年意大利物理学家伏打发明了将化学能转化 为电能的电池,为化学研究开辟了新天地。
1807年,英国化学家戴维 将白金导线通入熔融的氢氧 化钾中,接通电流。奇迹出 现了:电极上出现了水银似 的金属颗粒,通过电解法制 得到的第一种金属诞生了! 那就是金属钾。之后,戴维 用同样的方法电解得到了钠、 钙、镁等金属。但制铝失败.
节开发利用金属矿物和海水资源
司母戊大方鼎
鸟巢
金属餐具
“雪龙号”科考船
环节1
赤铁矿
Fe2O3
高炉
高炉出铁
高炉炼铁发生的主要化学反应是什么?
实验:
钢轨裂缝,怎么办?
温馨提示:镁条燃 烧,有耀眼白光, 请注意观察时不要 直视呦!
早在3000年前,人们已经学 用木炭还原铁矿石来炼铁, 人类进入“铁器时代”
一个过程
矿石
矿石
提纯 纯净物
金属
单质
物理提纯
化合物
单质
化学反应
金属的冶炼
不同的方法
一个转化
Al2O3
OH- AlO2- CO2
Al(OH)3
