高一化学-物质反应规律-叶长军
高考化学知识点复习学案8(专题:水溶液中的离子平衡_第五讲_《盐类的水解》的核心知识)

专题:水溶液中的离子平衡第五讲《盐类的水解》的核心知识北京四中:叶长军1.盐类的水解原理:(1)定义:在溶液中盐的离子跟水所电离出来的H+或OH-生成弱电解质的过程。
(2)实质:促进水的电离平衡的过程。
(3)规律:有弱才水解、都弱都水解、越弱越水解、谁强显谁性。
(4)特点:①水解反应和中和反应处于动态平衡,水解进行程度很小。
②水解反应为吸热反应。
基于以上特点,盐在水解时不会产生沉淀和气体,因此在书写水解离子方程式时不画“↓”“↑”,用可逆号“”连接。
③多元弱酸根离子分步水解,以第一步为主。
2、影响盐类水解的主要因素(1) 、盐本身的性质:越弱越水解。
(2) 、反应条件①温度:越热越水解。
②浓度:越稀越水解。
③溶液的酸、碱性:(3)完全互促水解Al 3+ + 3H 2O Al(OH)3+ 3H +3HCO 3—+ 3H 23H 2CO 3 + 3OH—3H 2O ①②总反应:3HCO 3-+Al 3+=Al(OH)3↓+3CO 2↑ 能够发生类似反应的还有:Al 3++HCO 3-CO 32-S 2-AlO 2-因此Al 3+和相应离子在水溶液中不能大量共存。
【思考题】(1)等pH 的①NH 4Cl ②H 2SO 4 ③HCl ④CH 3COOH 其物质的量浓度由大到小的顺序是: ①NH 4Cl ④CH 3COOH ③HCl ②H 2SO 4(2)pH=3的溶液中,由水电离出的C (H +)= 1.0×10-3mol/L 或1.0×10-11mol/L3、水解的应用(一)化学事实分析 判断盐溶液的酸碱性及强弱判断酸式盐的酸碱性:(不考虑阳离子的水解)①强酸的酸式盐只电离,不水解,显酸性。
如NaHSO4 。
②弱酸酸式盐存在两种趋势:HR- H++R2-(电离,显酸性),HR-+H2O H2R+OH-(水解,显碱性)。
电离占优势,则显酸性,如H2PO4―、HSO3―;水解占优势,则显碱性,如HCO3―、HS-、HPO42―等。
《离子反应》教学设计

44化学教学2006年,第3期Ni”xmol,N,(0.97一x)mol根据电中性:3xmol+2(o.97一X)mol:2×lmolx:o.06Ni2+为(o.97一x)mol=O.91mol。
离子数之比Nf+:Nf+=0.06:0.91=6:912.3围绕目标,针对训练,反馈矫正晶体结构内容抽象,应围绕复习目标,选择典型题目,做好针对性训练,对出现的问题及时矫正,帮助学生总结解题规律。
训练1.(1)二氧化碳晶体中与二氧化碳分子距离最近的二氧化碳分子有——个。
(2)金刚石结构中,一个碳原子与一个碳原子成键,则每个碳原予实际形成的化学键为——根;amol金刚石中,碳碳键数为mol。
训练2.C鲫分子是形如球状的多面体,该结构的建立是基于如下考虑①C∞分子中每个碳原子只跟相邻的3个碳原子形成化学键,②C∞分子只含有五边形和六边形。
C伯分子也可制得,它的分子模型可以与c∞同样考虑而推知。
通过计算确定C阳分子中五边形和六边形数。
(已知根据欧拉公式,多面体的顶点数、面数、棱边数之间的关系:顶点数+面数一棱边数=2)。
训练3.氯化钠是比较典型的离子晶体,中学化学课本上已给出氯化钠的晶体结构示意图。
假设氯化钠晶体中各离子都是互相接触的,试回答以下问题:(1)Na十与Cl一的半径比是多少?(2)已知Nacl摩尔质量为58.5咖ol,密度为2.29/cnf,阿佛加德罗常数为6.02×10。
Imol~,计算晶体中两个距离最近的Na+的核间距。
(答案:训练1.(1)12(2)4、2、2amol;训练2:12、25;{JII练3:(1)o.414(2)3.96×10—o)《离子反应》教学设计叶长军(北京市第五十中学化学组,北京100061)文章编号:1005—6629(2006)03一0042一02中图分类号:G633.8文献标识码:c教材:人教社高中化学必修第一册。
1设计思想在本课中设计了五个思维热点、讨论的焦点:(1)引入时,以含CuS04和NaCl稀溶液A与含CuCl2和Na2S04稀溶液B为相同溶液,加入相同的BaCl2溶液,为什么化学方程式不同?产生思维的矛盾,质疑化学方程式表达化学反应的缺陷,领悟反应实质。
发展学科核心素养的高考无机专题复习策略及教学案例分析

试测题II 19(1)
水平B
水平C
11、12、26(1)、27(1) 27(2)①
27(1)、28(3)①
27(2) 、28(1)、28(2)①
8、27(1)①②、28(2)、 10、26(1)、27(1)③、
28(2)②d
28(1)①、28(2)②b、
9、28(2)①i第一空、 28(2)②第一空、
BEA Confidential. | 7
写在前面3: 如何鉴别Na2S、K2SO4? 8类物质! 思维路径:
BEA Confidential. | 8
写在前面3:
如何鉴别Na2S、K2SO4 ? 思维路径:
1. 阳离子
2.沉淀:硫离子 3.沉淀:硫酸根 4.酸 5.pH、指示剂 6. 互促 7.氧化剂 8.电解
思维路径:
BEA Confidential. | 5
写在前面2:
某化合物W,它跟化合物U或CO2反应,都能 生成单质Y。
化合物W为______,单质Y是______。 思维路径:
CO2所有化学性质
BEA Confidential. | 6
CO2所有化学性质
1.类别 2.氧还 3.特性
思考:二氧化硫、氨气 预测:次磷酸 如何记忆物质的性质?
2016-28(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32。
已知:Cu+
Cu + Cu2+,Cu2+ I− CuI↓(白色)+ I2。
②通过下列实验证实,沉淀中含有Cu2+和SO32-。
a. 白色沉淀A是BaSO4,试剂1是____________。 b. 证实沉淀中含有Cu2+和SO32-的理由是___________。
高一化学与 有关的反应规律及应用学法指导

与22O Na 有关的反应规律及应用过氧化钠作为钠的一种重要化合物,其与水、二氧化碳的反应是各类考试的常考知识点。
考查角度是灵活多变,题型多样,如在解题中不注意巧思,往往会走弯路。
在学习时,灵活掌握知识间的内在联系,把握反应的实质,巧妙运用反应的关系,就能优化解题过程,提高解题效率。
一、O H O Na 222与、2CO 反应的特点1. 222O Na CO 与反应,其反应方程式为:232222O 21CO Na CO O Na +=+。
由反应方程式,可得出以下推论:推论1 每有1分子的22O Na 与2CO 充分反应时,固体质量的净增加量为1分子CO 的质量;减少的气体的质量为1个氧原子的质量。
推论2 22O Na 和2CO 完全反应时,减少的气体体积等于生成2O 的体积,等于参加反应的气体体积的21。
2. 222O Na O H 与反应,其反应方程式为:2222O 21NaOH 2O H O Na +=+。
由反应方程式,可得出以下推论:推论3 每有1分子的O H O Na 222与发生反应,固体质量的净增加量为参加反应的水中所含氢的质量,即1分子2H 的质量。
3. )g (O H 2和2CO 的混合气体通入过氧化钠中,发生的反应为:①232222O 21CO Na CO O Na +=+;②2222O 21NaOH 2O H O Na +=+。
反应前后,固体质量的增加量仍然满足上述推论1和推论3,解题时可灵活应用。
推论4 2CO 、)g (O H 2与足量22O Na 反应,混合气体减少的体积恰好为混合气体体积的21,与混合气体中2CO 与)g (O H 2所占的比例无关。
推论5 当CO 、2H 或它们的混合物与2O 充分燃烧后通过足量固体22O Na 时,固体质量的净增加量为CO 、2H 或它们混合物的质量。
二、应用例举例1. 200℃时,将一定量的2CO 和水蒸气的混合气体与一定量的22O Na 充分反应,固体质量增加了5.4g ,则原混合气体的平均相对分子质量为( )A. 10.8B. 24.2C. 48.4D. 16.2解析:该题看似比较难,实际上只要把握2CO 和水蒸气的混合气体,其平均相对分子质量必介于2CO 、O H 2之间,即数值在18~44范围内,结合题给选项就可轻松解答。
4总复习:等效平衡.doc
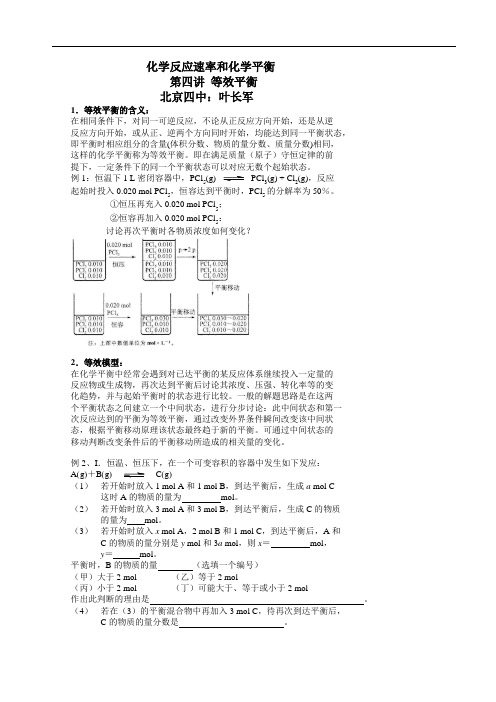
化学反应速率和化学平衡第四讲 等效平衡北京四中:叶长军1.等效平衡的含义:在相同条件下,对同一可逆反应,不论从正反应方向开始,还是从逆反应方向开始,或从正、逆两个方向同时开始,均能达到同一平衡状态, 即平衡时相应组分的含量(体积分数、物质的量分数、质量分数)相同, 这样的化学平衡称为等效平衡。
即在满足质量(原子)守恒定律的前提下,一定条件下的同一个平衡状态可以对应无数个起始状态。
例1:恒温下1 L 密闭容器中,PCl 5(g) PCl 3(g) + Cl 2(g),反应起始时投入0.020 mol PCl 5,恒容达到平衡时,PCl 5的分解率为50%。
①恒压再充入0.020 mol PCl 5;②恒容再加入0.020 mol PCl 5:讨论再次平衡时各物质浓度如何变化?2.等效模型:在化学平衡中经常会遇到对已达平衡的某反应体系继续投入一定量的反应物或生成物,再次达到平衡后讨论其浓度、压强、转化率等的变化趋势,并与起始平衡时的状态进行比较。
一般的解题思路是在这两个平衡状态之间建立一个中间状态,进行分步讨论:此中间状态和第一 次反应达到的平衡为等效平衡,通过改变外界条件瞬间改变该中间状态,根据平衡移动原理该状态最终趋于新的平衡。
可通过中间状态的移动判断改变条件后的平衡移动所造成的相关量的变化。
例2、I .恒温、恒压下,在一个可变容积的容器中发生如下发应:A (g )+B (g )C (g ) (1) 若开始时放入1 mol A 和1 mol B ,到达平衡后,生成a mol C这时A 的物质的量为 mol 。
(2) 若开始时放入3 mol A 和3 mol B ,到达平衡后,生成C 的物质的量为 mol 。
(3) 若开始时放入x mol A ,2 mol B 和1 mol C ,到达平衡后,A 和C 的物质的量分别是y mol 和3a mol ,则x = mol ,y = mol 。
平衡时,B 的物质的量 (选填一个编号)(甲)大于2 mol (乙)等于2 mol(丙)小于2 mol (丁)可能大于、等于或小于2 mol作出此判断的理由是 。
化学高考会考规范表达表达

该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料: a.Ag(NH3)2++2H2O Ag++2NH3· H 2O b.AgOH不稳定,极易分解为黑色Ag2O
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O。 ②产生Ag2O的原因是 。
②在NaOH存在下,加热促进NH3· H2O分解,逸出NH3, 促使Ag(NH3)2++2H2O Ag++2NH3· H2O平衡正向移动,c(Ag+)增大, Ag+与OH-反应立即转化为Ag2O:2OH-+2Ag+=Ag2O+H2O
(1)甲同学认为应补充一个实验:向同样的Mg(OH)2沉淀中加4 mL蒸 馏水,观察到沉淀不溶解。该实验的目的是 排除水使沉淀溶解的可能性 。 同学们猜测实验Ⅱ中沉淀溶解的原因有两种:一是NH4Cl溶液显 酸性,溶液中的H+可以结合OH- ,进而使沉淀溶解;二是NH4+结合OH使沉淀溶解。 (2)乙同学继续进行实验:向4 mL 2 mol· L-1 NH4Cl溶液中滴加2滴浓氨 水,得到pH约为8的混合溶液,向同样的Mg(OH)2沉淀中加入该混合溶 液,观察到沉淀溶解。乙同学这样配制混合溶液的理由是 。 溶液显碱性,c(H+)非常小,c(NH4+)较大,确定是NH4+结合OH-使沉淀溶解
总结:表达的一般思路:
例4、 (2009北京高考25)某学习小组探究浓、稀硝酸氧化性的相对 强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能 将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸 的氧化性强于稀硝酸。 可选药品:浓硝酸、3 mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液 及二氧化碳
高考化学知识点复习学案6(专题:水溶液中的离子平衡)

专题:水溶液中的离子平衡第三讲《水的电离平衡、pH计算》的核心知识北京四中:叶长军1.水的电离与水的离子积在纯水或水溶液中 H2O H++OH—△H>02H2O H3O++OH—△H>025℃ c(H+)=c(OH-) =1×10-7mol/L c(H+)∙c(OH-)=1×10-14=Kw 100℃ c(H+)=c(OH-) =1×10-6mol/L c(H+)∙c(OH-)=1×10-12=KwH2O H++OH—(正反应吸热)影响水的电离平衡的因素①酸抑制水的电离,Kw保持不变②碱③盐强酸弱碱盐促进水的电离,Kw保持不变强碱弱酸盐强酸强碱盐:不影响水的电离,Kw保持不变④温度:升高温度促进水的电离,Kw增大注意:Kw是一个温度函数,只随温度的升高而增大说明:(1)Kw只与温度有关,温度越高Kw越大。
因水的电离是吸热过程,升高温度Kw将增大,100℃时,c(H+)=c(OH-)=1×10-6mol/L,Kw =c(H+)∙c(OH-)=1×10-12。
(2)Kw不仅适用于纯水,也适用于酸,碱,盐的稀溶液。
2.溶液中酸碱性的判断(1)通过浓度和pH判断判断溶液的酸碱性一般有两种方法,例如:方法一25℃ 100℃中性溶液 c(H+)=c(OH-) pH=7 pH=6 酸性溶液 c(H+)>c(OH-) pH<7 pH<6 碱性溶液 c(H+)<c(OH-) pH>7 pH>6 (2)酸碱盐溶液中c(H+)、c(OH-)、c(H+)水、c(OH-)水(3)判断下列溶液等体积混合后的酸碱性3.溶液中pH值的测定方法测定溶液的pH值一般有三种方法:①利用酸碱指示剂,酸碱指示剂只能测出大概pH值范围不能测出具体的pH值;石蕊试液红色 5 紫色 8 蓝色酚酞试液无色 8.2 粉红 10 红色甲基橙红色 3.1 橙色 4.4 黄色②利用pH试纸,pH试纸测定的为溶液中c(H+)浓度,使用时不能润湿。
2024版新教材高中化学第2章化学键化学反应规律第3节化学反应的快慢和限度第1课时化学反应的快慢知识

第1课时化学反应的快慢知识点1 化学反应速率易错辨析一定温度下,固体和纯液体物质的浓度被视为常数,因此不能用固体和纯液体物质来表示化学反应速率。
知识点2 影响化学反应速率的因素1.内因:反应物本身的性质。
2.外因(1)反应物浓度实验操作实验现象0.5mol·L-1的盐酸与铁片反应产生气泡的速率较慢,3mol·L-1的盐酸与铁片反应产生气泡的速率较快实验结论其他条件相同时,增大反应物的浓度,化学反应速率________ 实验操作实验现象加热的试管中铁片表面产生气泡的速率较快,不加热的试管中铁片表面产生气泡的速率较慢实验结论其他条件相同时,升高温度,化学反应速率________ (3)催化剂实验操作实验现象不加二氧化锰粉末的试管内无明显现象,加二氧化锰粉末的试管内有大量气泡产生,产生的气体可使带火星的木条复燃实验结论二氧化锰是过氧化氢分解的催化剂,可明显________化学反应速率(4)接触面积实验操作实验现象加块状碳酸钙的试管内产生气泡的速率较慢,加碳酸钙粉末的试管内产生气泡的速率较快实验结论其他条件相同时,增大固体反应物表面积,化学反应速率______ (5)其他因素压强对于有气体参加的化学反应,在其他条件相同时,增大反应体系的压强(实质是增大气体反应物的浓度),化学反应速率加快,减小反应体系的压强(实质是减小气体反应物的浓度),化学反应速率减慢其他光波、超声波、激光、放射线、电磁波、溶剂等也能影响化学反应速率归纳提升(1)决定化学反应快慢的因素是物质的自身性质,外界条件只起次要作用。
(2)对于纯液体和固体物质,可认为其浓度为“常数”,它们的量的改变不会影响化学反应速率。
(3)压强的变化对固体、液体的体积影响很小,因而只有固体或液体参加的化学反应,可以认为改变压强对反应速率无影响。
(4)调控化学反应速率的意义第1课时 化学反应的快慢知识点1快慢 减少量(绝对值) 增加量 v =|Δc |Δtmol·L -1·s -1 2mol·L -1 min -1 知识点22.(1)加快 (2)加快 (3)加快 (4)加快。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
盐+水 酸
金 属
盐+碱
盐+酸
盐
盐+盐
盐
氧化还原反应的规律
化学反应的动力
一、复分解反应: 1、生成沉淀(溶解性表) 2、生成气体(常见的气体) 3、生成水(弱酸、弱碱) 二、氧化还原反应: 强氧化剂+强还原剂=====弱氧化剂+弱还原剂
思考: 1、物质的性质(与谁反应) 2、反应的动力(能生成谁)
4、与碳的反应
2Mg+CO2===2MgO+C 白+黑
启发:
特性
CO2
酸性氧化物 通性
氧化还原的性 质
CO2
SiO2
N2O5 SO2 P2O5 SO3
Na2O
MgO Al2O3 Fe2O3
扩展:
特性
物质
复分解性质 (九点图通性)
氧化还原的性质 (化合价、个数)
初中重点
高中重点
金属
非金属
盐
+ +
+ +
金属
非金属
盐
碱氧 盐
酸氧
盐
金
非
属 碱
盐+水 酸
金 属
盐+碱
盐+酸
盐
盐+盐
盐
碱有五条通性:
1、指示剂: 2、与非金属:
2NaOH+Cl2
NaCl+NaClO+H2O
3、与酸氧:如CO2
4、与酸:H3PO4 H2S
5、与盐:如AlCl3 NaH2PO4
水
+ +
金属
非金属
盐
碱氧 盐
酸氧
盐
金
非
属 碱
盐
碱氧 盐
酸氧
盐
金
非
属 碱
盐+水 酸
金 属
盐+碱
盐+酸
盐
盐+盐
盐
盐有五条通性: 1、与金属:
CuSO4+Fe==FeSO4+Cu 2、与非金属
2NaBr+Cl2===2NaCl+Br2 3、与碱:NaOH 4、与酸:H3PO4 HCl H2SO4 5、与盐:如AlCl3 NaH2PO4
水
+ +
金属
CO2
SiO2
N2O5 SO2 P2O5 SO3
Na2O
MgO Al2O3 Fe2O3
水
+ +
金属
非金属
盐
碱氧 盐
酸氧
盐
金
非
属 碱
盐+水 酸
金 属
盐+碱
盐+酸
盐
盐+盐
盐
这个表有什么应用呢?
练习一:
用尽可能多的方法制备NaCl?
水
+ +
金属
非金属
盐
碱氧 盐
酸氧
盐
金
非
属 碱
盐+水 酸
金 属
盐+碱
5、与盐:
2NaBr+Cl2=2NaCl+Br2 2KI+Cl2=2KCl+I2
C N2 O2
F2
Si P S
Cl2
Br2
I2
水
+ +
金属
非金属
盐
碱氧 盐
酸氧
盐
金
非
属 碱
盐+水 酸
金 属
盐+碱
盐+酸
盐
盐+盐
盐
金属具有五条性质:
1、与非金属:
4Na O2 缓慢氧化 2Na2O 2Na O2 燃 烧 Na2O2
2、与金属: 合金
3、与水:
2Na + 2H2O === 2NaOH + H2↑
4、与酸:
2Na+2HCl===2NaCl+H2
5、与盐:
先与水反应: 2Na+2H2O===2NaOH+H2 再与盐反应:CuSO4+2NaOH===Cu(OH)2 +Na2SO4
2Na 2H2O Cu2 Cu(OH )2 H2 2Na
非金属
盐
碱氧 盐
酸氧
盐
金
非
属 碱
盐+水 酸
金 属
盐+碱
盐+酸
盐
盐+盐
盐
水
+ +
金属
非金属
盐
碱氧 盐
酸氧
盐
金
非
属 碱
盐+水 酸
金 属
盐+碱
盐+酸
盐
盐+盐
盐
碱氧有三条通性: 1、与水: Na2O+H2O==2NaOH 2、与酸氧: Na2O+CO2===Na2CO3 3、与酸: Na2O+2HCl == 2NaCl+H2O
化学网络面授班课程
主讲教师:叶长军
化学网络面授班课程
各类物质间的反应规律
为什么要讲这一部分知识?
高中化方少说有300多个,多说有1000个左右。 如何去理解和记忆?
寻找规律
启迪: 请你说出你学过的CO2的所有化学
性质!
1、与 H2O 的反应 2、与 碱氧(如Na2O) 的反应 3、与碱(如NaOH)的反应
盐+酸
盐
盐+盐
盐
1、Na+Cl2
8、Na2SO4+BaCl2
2、Na+HCl
9、NaBr+Cl2
3、Na+MgCl2 (熔融) 10、Na2CO3+HCl
ห้องสมุดไป่ตู้
4、Na2O+HCl
5、NaOH+Cl2
6、NaOH+HCl
7、NaOH+AlCl3
指导功能
2、有下图所示的反应关系,A是中学常见的无机物, A、B、C中含有同一种元素R,不含R的产物已经略去。
盐
碱性 氧化物 盐
氢 气 酸性 氧化物
金
+H2O
属
碱
盐+水
酸
盐+碱
盐+酸
盐+盐
盐
盐
八点图
九 点 图 ( 对 称 )
水
金属
非金属
碱氧
酸氧
碱
酸
盐
盐
水
+ +
金属
非金属
盐
碱氧 盐
酸氧
盐
金
非
属 碱
盐+水 酸
金 属
盐+碱
盐+酸
盐
盐+盐
盐
本图蕴含着: 5个五(5种物质有五条通性) 2个三(2种物质有三条通性)
锂(Li) 钠(Na) 镁(Mg) 钾(K) 铷(Rb) 铯(Cs) 钫(Fr)
铝(Al) 铁(Fe) 铜(Cu)
水
+ +
金属
非金属
盐
碱氧 盐
酸氧
盐
金
非
属 碱
盐+水 酸
金 属
盐+碱
盐+酸
盐
盐+盐
盐
酸有五条通性:
1、指示剂:
2、与金属:2Na+2HCl===2NaCl+H2
3、与碱氧:如Na2O 4、与碱: 5、与盐:如AgNO3
水
+ +
金属
非金属
盐
碱氧 盐
酸氧
盐
金
非
属 碱
盐+水 酸
金 属
盐+碱
盐+酸
盐
盐+盐
盐
非金属具有五条通性:
点燃
1、与金属: 2Na + Cl2
点燃
2、与非金属: H2 + Cl2
2NaCl 2HCl
3、与水: H2O+Cl2
HCl+HClO
4、与碱: 2NaOH+Cl2
NaCl+NaClO+H2O
(1)A与NaOH溶液反应,既可只生成B,又可只生成C, 还可生成B+C。写出符合上述反应关系的A的三种不 同类物质的分子式________________; (2)若A与NaOH无论以何种比例反应,其产物必有B+C, 则A的分子式可能是____________________。 (高考科研题)
水
一切酸:
水
+ +
金属
非金属
盐
碱氧 盐
酸氧
盐
金
非
属 碱
盐+水 酸
金 属
盐+碱
盐+酸
盐
盐+盐
盐
碱有五条通性:
1、指示剂: 2、与非金属:
2NaOH+Cl2
NaCl+NaClO+H2O
3、与酸氧:如CO2
4、与酸:H3PO4 H2S
5、与盐:如AlCl3 NaH2PO4
一切碱:
水
+ +
金属
非金属
