物理化学知识点(全)
物理化学知识点(全)
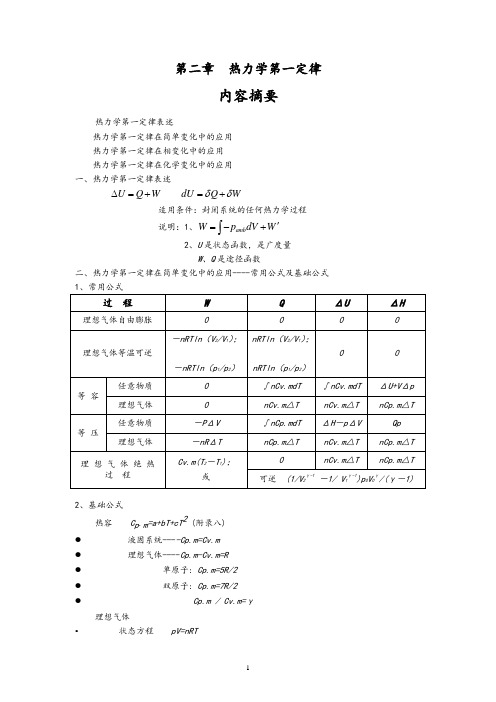
第二章热力学第一定律内容摘要热力学第一定律表述热力学第一定律在简单变化中的应用 热力学第一定律在相变化中的应用 热力学第一定律在化学变化中的应用 一、热力学第一定律表述U Q W ∆=+ dU Q W δδ=+适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+⎰2、U 是状态函数,是广度量W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式 过 程WQΔUΔH理想气体自由膨胀理想气体等温可逆-nRTln (V 2/V 1); -nRTln (p 1/p 2) nRTln (V 2/V 1);nRTln (p 1/p 2)0 0等 容任意物质0 ∫nCv.mdT ∫nCv.mdT ΔU+V Δp 理想气体 0 nCv.m △T nCv.m △T nCp.m △T 等 压任意物质-P ΔV ∫nCp.mdT ΔH -p ΔV Qp 理想气体-nR ΔT nCp.m △TnCv.m △T nCp.m △T 理 想 气 体 绝 热过 程 Cv.m(T 2-T 1);或nCv.m △TnCp.m △T可逆 (1/V 2γ-1-1/ V 1γ-1)p 0V 0γ/(γ-1)2、基础公式热容 C p .m =a+bT+cT 2 (附录八) ● 液固系统----Cp.m=Cv.m ● 理想气体----Cp.m-Cv.m=R ● 单原子: Cp.m=5R/2 ● 双原子: Cp.m=7R/2 ● Cp.m / Cv.m=γ理想气体• 状态方程 pV=nRT• 过程方程 恒温:1122p V p V = • 恒压: 1122//V T V T = • 恒容: 1122/ / p T p T =• 绝热可逆: 1122 p V p V γγ= 111122 T p T p γγγγ--=111122 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程1、 可逆相变化 Q p =n Δ相变H m W = -p ΔV无气体存在: W = 0有气体相,只需考虑气体,且视为理想气体ΔU = n Δ相变H m - p ΔV2、相变焓基础数据及相互关系 Δ冷凝H m (T) = -Δ蒸发H m (T)Δ凝固H m (T) = -Δ熔化H m (T) Δ凝华H m (T) = -Δ升华H m (T)(有关手册提供的通常为可逆相变焓)3、不可逆相变化 Δ相变H m (T 2) = Δ相变H m (T 1) +∫Σ(νB C p.m )dT 解题要点: 1.判断过程是否可逆;2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤;3.除可逆相变化,其余步骤均为简单变化计算.4.逐步计算后加和。
物理化学的知识点总结

物理化学的知识点总结一、热力学1. 热力学基本概念热力学是研究能量转化和传递规律的科学。
热力学的基本概念包括系统、环境、热、功、内能、焓、熵等。
2. 热力学第一定律热力学第一定律描述了能量守恒的原理,即能量可以从一个系统转移到另一个系统,但总能量量不变。
3. 热力学第二定律热力学第二定律描述了能量转化的方向性,熵的增加是自然界中不可逆过程的一个重要特征。
4. 热力学第三定律热力学第三定律表明在绝对零度下熵接近零。
此定律是热力学的一个基本原理,也说明了热力学的某些现象在低温下会呈现出独特的特性。
5. 热力学函数热力学函数是描述系统状态和性质的函数,包括内能、焓、自由能、吉布斯自由能等。
二、化学热力学1. 热力学平衡和热力学过程热力学平衡是指系统各个部分之间没有宏观可观察的能量传输,热力学过程是系统状态发生变化的过程。
2. 能量转化和热力学函数能量转化是热力学过程中的一个重要概念,热力学函数则是描述系统各种状态和性质的函数。
3. 热力学理想气体理想气体是热力学研究中的一个重要模型,它通过状态方程和理想气体定律来描述气体的性质和行为。
4. 热力学方程热力学方程是描述系统热力学性质和行为的方程,包括焓-熵图、温度-熵图、压力-体积图等。
5. 反应焓和反应熵反应焓和反应熵是化学热力学研究中的重要参数,可以用来描述化学反应的热力学过程。
三、物质平衡和相平衡1. 物质平衡物质平衡是研究物质在化学反应和物理过程中的转化和分配规律的一个重要概念。
2. 相平衡相平衡是研究不同相之间的平衡状态和转化规律的一个重要概念,包括固相、液相、气相以及其之间的平衡状态。
3. 物质平衡和相平衡的研究方法物质平衡和相平衡的研究方法包括热力学分析、相平衡曲线的绘制和分析、相平衡图的绘制等。
四、电化学1. 电解质和电解电解质是能在水溶液中发生电离的化合物,电解是将电能转化为化学能或反之的过程。
2. 电化学反应和电势电化学反应是在电化学过程中发生的化学反应,电势是描述电化学系统状态的一个重要参数。
物理化学复习知识点

物理化学复习知识点第⼀章热⼒学第⼀定律1.基本概念 1.1体系和环境系统(System )-被划定的研究对象称为系统。
环境(surroundings )-与系统密切相关、有相互作⽤或影响所能及的部分称为环境。
1.2状态函数*状态函数——由系统的状态确定的系统的各种热⼒学性质称为系统的状态函数。
*它具有以下特点:(1)状态函数是状态的单⼀函数。
(2)系统的状态发⽣变化,状态函数的变化值取决于系统始、终态。
与所经历的途径⽆关。
(3)状态函数的微⼩变化,在数学上是全微分。
(4)不同状态函数的集合(和、差、积、商)也是状态函数。
1.3体积功功(work )--系统与环境之间传递的除热以外的其它能量都称为功,⽤符号W 表⽰。
体积功就是体积膨胀或缩⼩所做的功。
系统对环境作功,W <0 环境对体系作功,W >0 1.4可逆过程(下)1.5各种热⼒学函数(U, H, Q,W)U 和H 是状态函数,Q 和W 不是状态函数。
1.6标准摩尔⽣成焓概念在标准压⼒下,反应温度时,由最稳定的单质合成标准状态下⼀摩尔物质的焓变,称为该物质的标准摩尔⽣成焓,⽤下述符号表⽰:(物质,相态,温度)2 体系和环境 2.1 体系(系统)*敞开系统(open system )系统与环境之间既有物质交换,⼜有能量交换。
*封闭系统(closed system )系统与环境之间⽆物质交换,但有能量交换。
*孤⽴系统(isolated system )系统与环境之间既⽆物质交换,⼜⽆能量交换。
热⼒学上有时把系统和环境加在⼀起的总体看成是孤⽴系统。
2.2状态函数体系的⼀些性质,其数值仅取决于体系所处的状态,⽽与体系的历史⽆关;它的变化值仅取决于体系的始态和终态,⽽与变化的途径⽆关。
具有这种特性的物理量称为状态函数。
对于循环过程:所有状态函数的改变值均为零 2.3可逆过程体系经过某⼀过程从状态(1)变到状态(2)之后,如果能使体系和环境都恢复到原来的状态⽽未留下任何永久性的变化,则该过程称为热⼒学可逆过程。
物理化学知识点

物理化学知识点物理化学是研究物质的物理性质与化学性质及其相互关系的学科,是化学和物理学的交叉领域。
在物理化学领域,有许多重要的知识点是我们必须要了解和掌握的。
本文将介绍一些物理化学的重要知识点,帮助读者更好地理解这一学科。
一、物态和相变物质存在的三种基本状态是固态、液态和气态。
固体的分子排列整齐,分子间的相互作用力较大;液体的分子排列比较有序,分子间的相互作用力较小;气体的分子排列比较松散,分子间的相互作用力很小。
相变是物质由一种状态转变为另一种状态的过程,如固液相变、液气相变等。
二、化学平衡在化学反应中,当反应物与生成物的浓度达到一定比例时,反应达到动态平衡。
平衡常数是描述平衡反应过程中生成物和反应物之间浓度关系的参数,反映了反应的进行方向及反应的速率。
平衡常数不同于反应速率常数,是稳态条件下的一个宏观参数。
三、溶液和溶解度溶液是由溶质和溶剂组成的混合物,其中溶质是被溶解的物质,溶剂是将溶质溶解的物质。
溶解度是溶质在一定温度下在单位溶剂中的最大溶解量,溶解度与温度密切相关,通常随温度升高而增大。
四、热力学热力学是研究能量转化和能量转移过程的学科,包括热力学系统、热力学第一定律、热力学第二定律等。
热力学定义了内能、焓、熵等物理量,描述了物质的热学性质和热平衡状态。
五、化学动力学化学动力学是研究化学反应速率、反应机理和反应过程的学科。
反应速率是描述反应物转变为生成物的速度,受温度、浓度、催化剂等因素影响。
动力学常数描述了反应速率与反应物浓度之间的关系。
六、量子化学量子化学是应用量子力学理论研究原子和分子的结构、性质和变化规律的学科。
量子化学描述了粒子在微观尺度的波粒二象性和不确定性原理,用于解释原子和分子的能级结构和化学键的形成。
以上是物理化学领域的一些重要知识点,涵盖了物态、相变、平衡、溶解度、热力学、动力学和量子化学等方面。
这些知识点是物理化学研究的基础,对于深入理解物质的结构和性质具有重要意义。
高三物理化学知识点总结

高三物理化学知识点总结一、物理知识点总结1. 力学(1) 牛顿运动定律:第一定律、第二定律、第三定律(2) 动量和冲量:动量定理、冲击力(3) 万有引力:万有引力定律、行星运动定律(4) 静力学:平衡条件、弹力、浮力2. 热学(1) 温度与热量:温度计、热力学第一定律、理想气体状态方程(2) 相变和热力学循环:相变概念、相变热、理想气体的等温过程、绝热过程3. 光学(1) 光的反射和折射:光的反射定律、光的折射定律、全反射(2) 光的波动性和粒子性:干涉、衍射、光的波长和频率、光电效应(3) 光的成像:薄透镜成像公式、眼睛的调节、光学仪器4. 电学(1) 静电学:电荷守恒定律、库仑定律、电场、电势、静电场与导电体(2) 电流和电阻:欧姆定律、电阻和电阻率、电功率、电路中的串并联、电流计和电压计的使用(3) 磁学:磁场、安培定律、负载线圈、电磁感应、电磁感应定律、自感和互感、变压器二、化学知识点总结1. 原子结构(1) 物质的组成:元素、化合物、混合物(2) 原子结构:原子的组成、元素的周期律、化学键2. 化学反应(1) 反应速率:速率常数、反应级数、活化能(2) 化学平衡:平衡常数、反应的移动方向、浓度对平衡的影响、温度与平衡(3) 酸碱中和:酸碱指示剂、中和滴定、pH值与酸碱度3. 化学能量(1) 反应热:焓变、焓变的计算、化学能量的利用(2) 化学能量与化学反应速率:活化能、催化剂4. 物质变化与电化学(1) 氧化还原反应:氧化还原电位、电解、电池、电解质溶液、农药与抗菌药5. 有机化学(1) 烃类:烷烃、烯烃、炔烃(2) 醇、醚和酚:醇的性质、酸碱性、脂肪醇、醚的制备(3) 醛和酮:醛酮的分类、性质、氧化还原、酮醇互变(4) 脂肪酸和脂类:酯的制备、皂化反应、脂肪酸的鉴别、脂类的性质结语高三物理化学知识点总结仅对常见的知识点进行了概述,通过系统学习和练习,可以更深入地理解和掌握这些知识点。
物理化学知识点

物理化学知识点物理化学知识点概述1. 热力学定律- 第零定律:如果两个系统分别与第三个系统处于热平衡状态,那么这两个系统之间也处于热平衡状态。
- 第一定律:能量守恒,系统内能量的变化等于热量与功的和。
- 第二定律:熵增原理,自然过程中熵总是倾向于增加。
- 第三定律:当温度趋近于绝对零度时,所有纯净物质的熵趋近于一个常数。
2. 状态方程- 理想气体状态方程:PV = nRT,其中P是压强,V是体积,n是摩尔数,R是理想气体常数,T是温度。
- 范德瓦尔斯方程:(P + a(n/V)^2)(V - nb) = nRT,修正了理想气体状态方程在高压和低温下的不足。
3. 相平衡与相图- 相律:描述不同相态之间平衡关系的数学表达。
- 相图:例如,水的相图展示了水在不同温度和压强下的固态、液态和气态的平衡关系。
4. 化学平衡- 反应速率:化学反应进行的速度,受温度、浓度、催化剂等因素影响。
- 化学平衡常数:在一定温度下,反应物和生成物浓度之比达到平衡时的常数值。
5. 电化学- 电解质:在溶液中能够产生带电粒子(离子)的物质。
- 电池:将化学能转换为电能的装置。
- 电化学系列:金属的还原性或氧化性排序。
6. 表面与胶体化学- 表面张力:液体表面分子间的相互吸引力。
- 胶体:粒子大小在1到1000纳米之间的混合物,具有特殊的表面性质。
7. 量子化学- 量子力学基础:描述微观粒子如原子、分子的行为。
- 分子轨道理论:通过分子轨道来描述分子的结构和性质。
- 电子能级:原子和分子中电子的能量状态。
8. 光谱学- 吸收光谱:分子吸收特定波长的光能,导致电子能级跃迁。
- 发射线谱:原子或分子在电子能级跃迁时发出特定波长的光。
- 核磁共振(NMR):利用核磁共振现象来研究分子结构。
9. 统计热力学- 微观状态与宏观状态:通过系统可能的微观状态数来解释宏观热力学性质。
- 玻尔兹曼分布:描述在给定温度下,粒子在不同能量状态上的分布。
物理化学知识点总结
第一章 热力学第一定律一、基本概念系统与环境,状态与状态函数,广度性质与强度性质,过程与途径,热与功,内能与焓。
二、基本定律热力学第一定律:ΔU =Q +W 。
焦耳实验:ΔU =f (T ) ; ΔH =f (T ) 三、基本关系式1、体积功的计算 δW = -p e d V恒外压过程:W = -p e ΔV可逆过程:1221ln ln p p nRT V V nRT W ==2、热效应、焓等容热:Q V =ΔU (封闭系统不作其他功) 等压热:Q p =ΔH (封闭系统不作其他功) 焓的定义:H =U +pV ; d H =d U +d(pV )焓与温度的关系:ΔH =⎰21d p T T T C3、等压热容与等容热容热容定义:V V )(T U C ∂∂=;p p )(T H C ∂∂=定压热容与定容热容的关系:nR C C =-V p 热容与温度的关系:C p =a +bT +c’T 2 四、第一定律的应用1、理想气体状态变化等温过程:ΔU =0 ; ΔH =0 ; W =-Q =⎰-p e d V 等容过程:W =0 ; Q =ΔU =⎰T C d V ; ΔH =⎰T C d p 等压过程:W =-p e ΔV ; Q =ΔH =⎰T C d p ; ΔU =⎰T C d V 可逆绝热过程:Q =0 ; 利用p 1V 1γ=p 2V 2γ求出T 2,W =ΔU =⎰T C d V ;ΔH =⎰T C d p不可逆绝热过程:Q =0 ; 利用C V (T 2-T 1)=-p e (V 2-V 1)求出T 2,W =ΔU =⎰T C d V ;ΔH =⎰T C d p2、相变化可逆相变化:ΔH =Q =n Δ_H ;W=-p (V 2-V 1)=-pV g =-nRT ; ΔU =Q +W3、热化学物质的标准态;热化学方程式;盖斯定律;标准摩尔生成焓。
摩尔反应热的求算:)298,()298(B H H m f B m r θθν∆=∆∑反应热与温度的关系—基尔霍夫定律:)(])([,p B C T H m p BB m r ∑=∂∆∂ν。
化学物理重要知识点总结
化学物理重要知识点总结一、热力学1. 热力学基本概念热力学是研究物质在各种物理过程中所表现出的热现象和热性质的一门学科。
它是研究物质状态和状态变化过程的基本规律的科学。
2. 热力学系统的基本概念热力学系统是指对物质进行热学研究时所根据需要确定的一定范围内的物质。
热力学系统包括封闭系统、开放系统和孤立系统。
3. 热力学过程热力学过程是指系统的状态随时间变化而发生的物理变化过程。
热力学过程包括绝热过程、等温过程、等容过程和等压过程。
4. 热力学定律热力学定律包括热力学第一定律和热力学第二定律。
热力学第一定律是指能量守恒定律,热力学第二定律是指所有系统在不受外力干扰的情况下都趋向于平衡状态。
5. 热力学函数热力学函数是热力学系统状态的特性参数。
常见的热力学函数包括内能、焓、自由能和吉布斯能。
6. 热力学平衡热力学平衡是指系统各个部分处在相同的温度、压力和化学势以及物理状态下的平衡状态。
7. 热力学系统的状态方程热力学系统的状态方程是系统物理状态的数学表达式。
常见的热力学系统状态方程包括理想气体状态方程、准压缩性气体状态方程和范德瓦尔斯气体状态方程。
8. 热力学过程中的工作热力学过程中的工作是指系统对外界的功。
常见的的工作包括体积功和非体积功。
9. 热力学熵热力学熵是系统内部无序程度的度量,是评价系统混乱程度的指标。
热力学熵具有增大趋势定律和熵最大原理。
10. 热力学的应用热力学在实际工程中有许多应用,例如燃烧、发动机、制冷技术、空气动力学和化学反应等方面的应用。
二、量子化学1. 基本概念量子化学是研究原子、分子等微观粒子的能级结构、性质和相互作用的一门学科。
它是研究原子分子电子结构和化学反应过程的基本理论。
2. 量子力学基本原理量子力学是描述微观粒子的运动和相互作用所遵循的规律的理论。
它包括波粒二象性、不确定关系、按我们知道的基本原理和狄拉克方程等内容。
3. 原子结构原子结构是指原子内部的构造和电子排布方式。
物理化学重要知识点总结及其考点说明
物理化学重要知识点总结及其考点说明
一、化学热力学
1、化学热力学的定义:化学热力学是研究化学反应中物质的热量及能量变化的学科。
2、热力学三定律:第一定律:能量守恒定律;第二定律:热力学第二定律确定有序
能可以被有度能转化;第三定律:热力学第三定律始终指出热力学反应的可能性和温度有关。
3、焓的概念:焓是衡量物质的热力学状态的量,它是物质的热力学特性连续变化的
测量,是物质拥有的热量能量,也可以视为物质拥有的有序能。
4、热力学平衡:热力学平衡是指在不变的温度、压力和其他条件下,恒定的化学反
应发生,直至反应物和生成物的物质形式和化学结构保持不变,热量吸积也变得稳定,这
种状态称为热力学平衡。
二、物理化学
1、物理化学的概念:物理化学是一门融合了物理学和化学的学科,通过应用物理方法,来研究化学性质的变化和分子间的作用及反应,其研究具有多学科的性质。
2、气体的特性:气体的物理性质有很多,如压强、体积、温度、熵、焓等。
质量和
体积的关系为:在一定温度下,气体的质量和体积都成正比。
3、溶质的溶解度:溶解度是衡量溶质溶解在溶剂中的性质,它是指在一定温度、压
力下,溶质在溶剂中的最高溶解量。
溶质的溶解度与温度,压强及溶剂特性有关。
4、化学均衡:化学均衡是指在特定温度和压强下,混合物中物质的各种浓度比例,
产物与原料之间的反应紊乱程度,变化状态的一种稳定平衡状态。
考研必备物理化学核心知识点
考研必备物理化学核心知识点关键信息姓名:____________________________考研年份:______________________1、热力学第一定律11 基本概念111 系统与环境112 热力学平衡态113 状态函数114 过程与途径12 热力学第一定律的表述121 内能的变化与热和功的关系122 热力学第一定律的数学表达式13 体积功的计算131 恒外压过程体积功132 可逆过程体积功14 热的计算141 定容热142 定压热143 绝热过程热的计算2、热力学第二定律21 热力学第二定律的表述211 克劳修斯表述212 开尔文表述22 熵的概念221 熵的定义222 熵的物理意义23 熵变的计算231 简单物理变化过程熵变的计算232 相变过程熵变的计算233 化学反应熵变的计算24 热力学第三定律241 热力学第三定律的表述242 规定熵和标准熵3、多组分系统热力学31 偏摩尔量311 偏摩尔量的定义312 偏摩尔量的集合公式32 化学势321 化学势的定义322 化学势的判据33 理想气体混合物331 道尔顿分压定律332 阿马格分体积定律34 稀溶液的两个经验定律341 拉乌尔定律342 亨利定律35 理想稀溶液351 溶剂的化学势352 溶质的化学势36 非理想溶液361 活度和活度系数362 超额函数4、化学平衡41 化学反应的等温方程411 标准摩尔反应吉布斯函数412 化学反应的等温方程的推导42 平衡常数的表达式421 气相反应平衡常数422 液相反应平衡常数43 平衡常数的测定和计算431 平衡组成的测定432 平衡常数的计算方法44 温度对平衡常数的影响441 范特霍夫方程442 平衡常数与温度的关系图45 其他因素对化学平衡的影响451 压力的影响452 惰性气体的影响453 反应物配比的影响5、相平衡51 相律511 相律的表达式512 相律的应用52 单组分系统相图521 水的相图522 二氧化碳的相图53 二组分系统相图531 气液平衡相图532 液固平衡相图533 生成稳定化合物的相图534 生成不稳定化合物的相图54 三组分系统相图541 等边三角形坐标表示法542 部分互溶三组分系统的相图6、电化学61 电解质溶液611 法拉第定律612 离子的电迁移613 电导、电导率和摩尔电导率614 离子独立运动定律和离子的摩尔电导率615 电导的测定及其应用62 可逆电池621 可逆电池的条件622 可逆电池的热力学623 常见的可逆电池63 不可逆电池631 不可逆电池的热力学632 电极极化633 电解时的电极反应7、表面现象71 表面张力和表面能711 表面张力的定义和单位712 表面能的概念72 弯曲液面的附加压力721 附加压力的产生原因722 拉普拉斯方程73 毛细现象731 毛细现象的原理732 毛细现象的应用74 吸附741 物理吸附和化学吸附742 吸附等温线743 朗缪尔吸附理论8、化学动力学81 化学反应速率的表示方法811 反应进度812 反应速率的定义82 浓度对反应速率的影响821 速率方程822 反应级数823 一级反应824 二级反应825 零级反应83 温度对反应速率的影响831 阿仑尼乌斯方程832 活化能84 催化剂对反应速率的影响841 催化剂的特点842 催化作用的原理9、胶体化学91 胶体的制备和净化911 分散法912 凝聚法913 胶体的净化方法92 胶体的性质921 丁达尔效应922 布朗运动923 电泳和电渗93 胶体的稳定性和聚沉931 胶体稳定性的原因932 胶体的聚沉方法933 电解质对胶体聚沉的影响以上内容涵盖了考研物理化学的核心知识点,您应根据自身实际情况有针对性地进行学习和掌握。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章 热力学第一定律内容摘要热力学第一定律表述热力学第一定律在简单变化中的应用 热力学第一定律在相变化中的应用 热力学第一定律在化学变化中的应用 一、热力学第一定律表述U Q W ∆=+ dU Q W δδ=+适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+⎰2、U 是状态函数,是广度量W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式 1、常用公式过 程WQΔUΔH理想气体自由膨胀理想气体等温可逆-nRTln (V 2/V 1);-nRTln (p 1/p 2)nRTln (V 2/V 1);nRTln (p 1/p 2)等 容任意物质0 ∫ ∫ ΔU+V Δp 理想气体 0△T △T △T等 压任意物质-P ΔV ∫ ΔH -p ΔVQp理想气体-nR ΔT△T△T △T 理 想 气 体 绝 热过 程 (T 2-T 1);或0 △T△T可逆 (1/V 2γ-1-1/ V 1γ-1)p 0V 0γ/(γ-1)2、基础公式热容 =a+bT+cT 2 (附录八) 液固系统=理想气体 单原子: =5R/2 双原子: =7R/2 / =γ 理想气体• 状态方程 pV=nRT• 过程方程 恒温:1122p V p V =• 恒压: 1122//V T V T = • 恒容: 1122/ / p T p T =• 绝热可逆: 1122 p V p V γγ=111122 T p T p γγγγ--=111122 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程 1、 可逆相变化 Q p =n Δ相变H m W = -p ΔV无气体存在: W = 0有气体相,只需考虑气体,且视为理想气体ΔU = n Δ相变H m - p ΔV2、相变焓基础数据及相互关系 Δ冷凝H m (T) = -Δ蒸发H m (T)Δ凝固H m (T) = -Δ熔化H m (T) Δ凝华H m (T) = -Δ升华H m (T)(有关手册提供的通常为可逆相变焓)3、不可逆相变化 Δ相变H m (T 2) = Δ相变H m (T 1) +∫Σ(νdT 解题要点: 1.判断过程是否可逆;2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤;3.除可逆相变化,其余步骤均为简单变化计算.4.逐步计算后加和。
四、热力学第一定律在化学变化中的应用 1、基础数据 标准摩尔生成焓 Δf H θm,B (T) (附录九)标准摩尔燃烧焓 Δc H θ(T)(附录十)2、基本公式反应进度 ξ=△ξ= △n B /νB = /νB由标准摩尔生成焓计算标准摩尔反应焓 Δr H θ(T)= ΣνB Δf H θ(T) 由标准摩尔燃烧焓计算标准摩尔反应焓 Δr H θ(T)=-ΣνB Δc H θ(T)(摩尔焓---- ξ=1时的相应焓值)恒容反应热与恒压反应热的关系Q p =Δr H Q v =Δr U Δr H =Δr U + RT ΣνB (g) Kirchhoff 公式 微分式 d Δr H θm (T) / dT=Δr积分式 Δr Hθm (T 2) =Δr H θm (T 1)+∫Σ(νdT本章课后作业:教材(3、4、10、11、16、17、38、20、23、24、28、30、33、34)第三章 热力学第二定律内容摘要1、导出三个新的状态函数——熵、亥姆霍兹函数、吉布斯函数2、过程方向和限度的判断依据——熵判据;亥氏函数判据;吉氏函数判据3、熵变、亥氏函数变、吉氏函数变计算——简单变化、相变化、化学变化4、热力学函数归纳——热力学基本方程一、卡诺循环(热功转换的理论模型)1、 卡诺循环的组成1、恒温可逆膨胀 Q 1 = —W 1= nRT 1 ln (V 2/V 1)2、绝热可逆膨胀 Q ’=0 W ’=(T 2—T 1)3、恒温可逆压缩 Q 2 = —W 2 = nRT 2 ln (V 4/V 3)4、绝热可逆压缩 Q ’’ = 0 W ’’ = (T 1—T 2)∵ △U = 0 (V 2/V 1) = —(V 4/V 3)∴ -W = Q = Q 1 + Q 22、热机效率 通式 1211= -=+W Q Q Q Q η 可逆热机 122111= -==1-Q Q T W Q Q T η+ 讨论:1、可逆热机效率只取决于高、低温热源的温度 2、低温热源和高温热源温度之比越小,热机效率越高 3、温度越高,热的品质越高 结论:1、卡诺热机效率最大2、卡诺循环的热温商之和等于零 ∑(Q/T )=03、卡诺定理“在高低温两个热源间工作的所有热机中,以可逆热机的热机效率为最大。
” 由卡诺定理 ir r η≤η 得出2211Q T Q T ≤- 整理后可得: <0 不可逆循环{Q ()0Tδ≤∑=0 可逆循环上式适用与任何工质和任何变化的循环过程。
4、卡诺定理推论在高温、低温两个热源间工作的所有可逆热机,其热机效率必然相等,与工质及其变化的类型无关。
二、热力学第二定律1、自发过程及其特点一个自发过程发生之后,不可能使体系和环境都恢复到原来状态而不留下任何影响。
2、自发过程的共同特征1、自发过程具有作功能力,是热力学的不可逆过程的。
2、任何体系都是自发地倾向平衡的。
3、反自发过程的进行,必须借助外力。
3、热力学第二定律文字表述1、 克劳修斯说法:不可能把热从低温物体传给高温物体而不产生其它影响。
2、 开尔文说法:不可能从单一热源吸取热量使之完全转变为功而不产生其它影响。
(即:第二类永动机不可能实现)4、克劳修斯不等式(热力学第二定律数学表达式)> 过程不可逆 = 过程可逆5、熵增原理及熵判据熵增原理——隔离系统发生不可逆过程时熵值增大;发生可逆过程时,熵值不变;隔离系统不可能发生熵值减小的过程。
熵判据: > 不可逆,自发= 可逆,平衡(注意与克劳修斯不等式的区别)三、熵变计算{{dS dS dS =≥系统环境隔离+0S S S ∆=∆∆≥系统环境隔离+0dS Q δ≥计算依据——熵(S )的定义式:rQ dS Tδ=r Q δ——可逆过程热T ——系统温度熵是系统的状态函数,是广度量。
单位——1J K -g 。
对应的量有: 规定熵()B S T ——11J mol K --g g 标准摩尔熵()m S T θ——11J mol K --g g 熵是系统混乱程度的度量。
混乱程度越大,熵值越大。
1、单纯PVT 变化熵变的计算① 恒温过程 Qr WS T T-∆==理想气体恒温过程:2112ln ln V P S nR nR V P ∆== ② 恒压过程 2,1ln p m T S nC T ∆= 或 ()2dT S n a bT cT T ∆=++⎰③ 恒容过程 2,1lnv m T S nC T ∆= ④ 理想气体绝热过程: 22,11lnln v m T V S nC nR T V ∆=+ 或:21,12ln ln p m T pS nC nR T p ∆=+ 或:22,,11lnln p m v m V p S nC nC V p ∆=+2、相变过程的熵变计算①可逆相变:mn H S T∆∆=相变 ②不可逆相变:分解过程并分别计算 简单变化过程可逆相变过程3、化学反应熵变计算①热力学第三定律:(),00m S K *=完美晶体 ②热力学标准状态下:()r m B m BS S B θθν∆=∑③任意温度时:设计过程,使其包含 简单变化过程298K 时的化学反应过程{{{{(可逆相变过程)四、 Helmholtz 函数和 Gibbs 函数 1、函数定义式:Helmholtz 函数 —— A=U –TS Gibbs 函数 —— G=H-TS2、 判据: 亥氏函数判据 ,0T V A ∆≤ <——不可逆,自发吉氏函数判据 ,0T p G ∆≤ =——可逆,平衡3、 ΔA 和ΔG 的计算简单变化可逆相变 恒温过程 化学反应五、Clapeyron 方程(表明了纯物质二相平衡时温度与压力之间的关系。
)温度随压力的变化率(Clapeyron 方程) m m H dpdT T V βαβα∆=∆ (推导中用到的热力学基本方程——dG=-SdT+Vdp )Clapeyron 方程的应用——1、固垐垎?噲垐?平衡液、固垐垎?噲垐?平衡固:fus m fus mV dTdP T H ∆=∆;trs m trs m V dT dP T H ∆=∆ 积分后得到 ()2211ln fus m fus mV T p p T H ∆=-∆ (假设Δfus H=常数)()2211ln trs m trs mV Tp p T H ∆=-∆ (假设Δtrs H=常数)2、液垐垎?噲垐?平衡气、固垐垎?噲垐?平衡气: vap m vap m H dP dT T V ∆=∆ ; vap m vap mH dP dT T V ∆=∆ 积分后得到 212111ln vap m H p p R T T ∆⎛⎫=-- ⎪⎝⎭或 212111ln sub m H pp R T T ⎛⎫∆=-- ⎪⎝⎭1ln vap m H p C R T ∆=-+或 1ln sub m H p C R T∆=-+六、热力学基本方程一共8个状态函数,其中3个是辅助函数(){A=U-T S G=H-T S∆∆∆∆∆∆}{vap m sub m H H ∆=∆=气体为理想气体常数常数{}dG SdT Vdp=-+相互之间关系如下: H =U +pVA =U -TSG =H -TS dU TdS pdV =-热力学基本方程是热力学中重要的公式,有着广泛的应用,应掌握公式的应用条件及用法(对函数进行积分计算)。
热力学第二定律学习主线热力学函数的归纳 p TG G S V T p ⎛⎫∂∂⎛⎫=-= ⎪ ⎪∂∂⎝⎭⎝⎭本章课后作业:教材(3、4、9、15、19、21、23、24、31、36、38、47、48)第四章 多组分系统热力学内 容 摘 要一、偏摩尔量1、定义式 ,,CB B T p n X X n ⎛⎫∂= ⎪∂⎝⎭(下角标为具备的条件;X 为状态函数的广度量) 2、常见的偏摩尔量偏摩尔体积 偏摩尔热力学能 偏摩尔焓偏摩尔熵 偏摩尔亥姆霍兹函数 偏摩尔吉布斯函数3、偏摩尔量的集合公式 B B BX n X =∑上式表明:在一定的温度、压力下,某混合物系统的任一广度量等于形成该混合物系统的各组分在该组成下的偏摩尔量与其物质的量的乘积之和。
4、偏摩尔量之间的关系与热力学函数之间的关系及热力学基本方程完全相同。
二、化学势1、化学势——偏摩尔吉布斯函数,定义为2、多组分单相系统热力学公式3、化学势判据多组分单相系统 <——不可逆,自发 =——可逆,平衡 (适用条件:dT=0、dp=0、δW ’=0)三、稀溶液的基本定律1、拉乌尔定律 *A A A p p x = *A p :同温度下液体纯A 的饱和蒸汽压。
