高血压性视网膜病变Ⅳ级
高血压分级分组
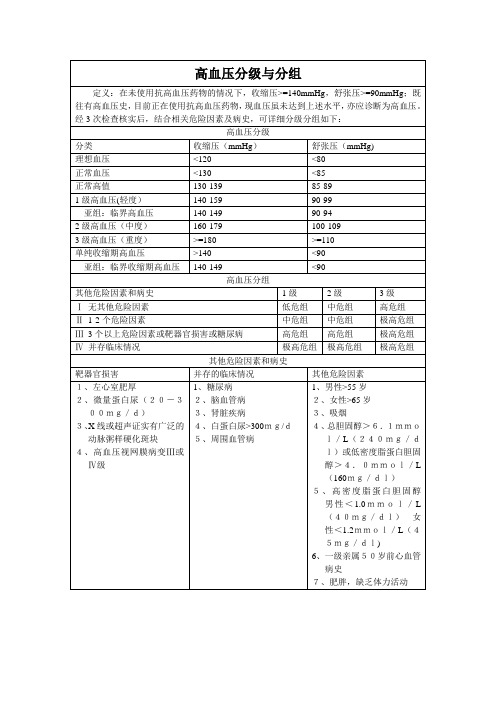
7、肥胖,缺乏体力活动
<90
高血压分组
其他危险因素和病史
1级
2级
3级
Ⅰ无其他
中危组
中危组
极高危组
Ⅲ3个以上危险因素或靶器官损害或糖尿病
高危组
高危组
极高危组
Ⅳ并存临床情况
极高危组
极高危组
极高危组
其他危险因素和病史
靶器官损害
并存的临床情况
其他危险因素
1、左心室肥厚
2、微量蛋白尿(20-300mg/d)
高血压分级与分组
定义:在未使用抗高血压药物的情况下,收缩压>=140mmHg,舒张压>=90mmHg;既往有高血压史,目前正在使用抗高血压药物,现血压虽未达到上述水平,亦应诊断为高血压。经3次检查核实后,结合相关危险因素及病史,可详细分级分组如下:
高血压分级
分类
收缩压(mmHg)
舒张压(mmHg)
理想血压
<120
<80
正常血压
<130
<85
正常高值
130-139
85-89
1级高血压(轻度)
140-159
90-99
亚组:临界高血压
140-149
90-94
2级高血压(中度)
160-179
100-109
3级高血压(重度)
>=180
>=110
单纯收缩期高血压
>140
<90
亚组:临界收缩期高血压
140-149
3、X线或超声证实有广泛的动脉粥样硬化斑块
4、高血压视网膜病变Ⅲ或Ⅳ级
1、糖尿病
高血压病视网膜病变护理业务学习PPT课件

同时也要关注患者的心理健康和生活质量。Fra bibliotek总结与展望
呼吁行动
呼吁社会各界关注高血压病视网膜病变,提供更 多支持。
通过教育与宣传,提高公众意识,促进健康管理 。
谢谢观看
必要时进行激光治疗或其他干预。
高血压病视网膜病变的预防
高血压病视网膜病变的预防 饮食管理
控制盐摄入,增加水果和蔬菜的摄入量。
健康饮食有助于降低血压,保护视网膜健康。
高血压病视网膜病变的预防 生活方式改变
保持适度运动,减轻体重,减少压力。
这些因素有助于控制血压,降低疾病风险。
高血压病视网膜病变的预防 定期检查
高血压病视网膜病变的护理方法 如何进行日常护理
患者应定期监测血压,保持健康的生活方式 。
包括均衡饮食、适量运动和戒烟限酒。
高血压病视网膜病变的护理方法 如何识别症状
关注视力模糊、视物变形等症状,及时就医 。
这些可能是病变加重的信号。
高血压病视网膜病变的护理方法 如何配合医生治疗
遵循医嘱,定期复查,按时服用药物。
参与支持小组也有助于心理康复。
高血压病视网膜病变的心理支持 专业心理咨询
必要时,建议患者寻求专业心理咨询。
专业人士可以帮助患者处理情绪和压力。
总结与展望
总结与展望
重要性总结
高血压病视网膜病变的护理至关重要,影响患者 整体健康。
通过有效的护理和预防,可以显著降低并发症发 生率。
总结与展望
未来研究方向
此病变可导致视力下降,甚至失明。
高血压病视网膜病变的概述 为什么关注此病变
高血压病视网膜病变是高血压患者常见并发症, 影响患者生活质量。
高血压视网膜病变的研究进展

高血压视网膜病变的研究进展焦 雷1,张红灵2摘要 高血压视网膜病变是长期高血压引起的视网膜血管损害,是高血压靶器官损害的一部分㊂由于眼底检测方法的局限性及高血压视网膜病变症状的隐匿性,高血压视网膜病变未得到足够重视㊂近年来,随着影像学技术的快速发展,特别是光学相干断层扫描及光学相干断层扫描血流成像的广泛应用,高血压视网膜病变的诊断有了较大发展㊂随着新型成像技术的发展,高血压视网膜病变预测高血压其他靶器官损害方面的研究较多,为高血压管理和心血管风险分层提供了新思路㊂综述高血压视网膜病变的发病机制㊁分期㊁分级和诊断方式的最新研究进展及高血压性视网膜病变领域的研究进展和方向㊂关键词 高血压;高血压视网膜病变;靶器官损害;综述d o i :10.12102/j.i s s n .1672-1349.2023.12.017 高血压是全球范围内患病率最高的慢性代谢性疾病之一,我国高血压患病率总体呈上升趋势[1]㊂高血压常引起心㊁脑㊁肾㊁眼㊁主动脉和外周动脉等不同器官的损害,2020年世界高血压学会指南将其定义为高血压介导的靶器官损害(target organ damage ,TOD )[2]㊂高血压视网膜病变是高血压引起的全身性血管病变在眼部的表现,是高血压常见的靶器官损害之一,70%以上的原发性高血压病人存在不同程度的视网膜病变[3],与年龄㊁病程长短㊁血压升高的程度有关㊂由于视网膜在胚胎发育㊁解剖结构及生理功能等方面与心㊁脑㊁肾等器官具有高度的相似性,因此,视网膜形态及功能的变化与其他器官疾病相互印证[4]㊂因此,高血压视网膜病变可作为判断高血压预后简单㊁实用的指标,对评估靶器官损害有重要的临床意义㊂现就高血压视网膜病变的发病机制㊁诊断与其他器官损害的关系及高血压视网膜病变领域的研究进展和方向进行综述㊂1 高血压视网膜病变血管系统视网膜分为色素上皮层和神经上皮层两部分㊂神经上皮层自外向内又分为视细胞层㊁外界膜㊁外核层㊁外丛状层㊁中界膜㊁内核层㊁内丛状层㊁神经节细胞层㊁神经纤维层㊁内界膜(见图1)[5]㊂图中,posteriorcortical vitreous 为后皮质玻璃;pre -retinal space 为前视网膜间隙;nerve fiber layer (NFL )为神经纤维层;ganglion cell layer (GCL )为神经节细胞层;inner作者单位 1.山西医科大学(太原030001);2.山西医科大学第一医院(太原030001)通讯作者 张红灵,E -mail :*****************引用信息 焦雷,张红灵.高血压视网膜病变的研究进展[J ].中西医结合心脑血管病杂志,2023,21(12):2212-2217.plexiform layer (IPL )为内丛状;inner nuclear layer (INL )为内核层;outer plexiform layer (OPL )为外丛状层;outer nuclear layer (ONL )为外核层;Henle 'snerve fiber 为Henle 纤维层;external limiting membrane 为外界膜;myoid zone 为肌样体区;ellipsoid zone 为椭圆体区;outer segments of the photoreceptors 为光感受器外节;interdigitation zone 为交叉区;RPE/Bruch 's membrane 为视网膜色素上皮/Bruch 膜复合体;choriocapillaris 为脉络膜毛细血管;Sattler 's layer 为脉络膜Sattler 层;Haller 's layer 为脉络膜Haller 层;choroid sclera junction 为脉络膜巩膜连接视网膜血液供应完全依赖视网膜中央动脉系统㊂视网膜中央动脉是眼动脉的分支,常起于眼动脉的视神经骨管孔附近,穿过视神经干鞘膜后进入视神经,分出视网膜中央动脉侧支后其主干通过筛板进入眼底㊂主干在视乳头中央略偏鼻侧处首先分为颞上㊁颞下动脉和鼻上㊁鼻下动脉㊂各支不断分出各级更小分支,最终形成毛细血管前微动脉,移行于毛细血管小叶,再汇入毛细血管小叶后微静脉,经静脉小分支㊁二级及一级分支,于视乳头中央穿过巩膜筛板进入视网膜中央静脉总干,血液汇入眼上静脉或海绵窦㊂视网膜中央动脉㊁静脉较大的分支,位于视网膜神经纤维层靠近内界膜一侧㊂视网膜毛细血管前动脉及位于神经纤维中的浅表血管丛(superficial vascular plexus ,SVP )和位于内核层更深处的深层血管丛(deep vascular plexus ,DVP )等深浅两组毛细血管网,遍布于视网膜神经上皮层的内层,是神经上皮层内层营养的唯一来源[6]㊂视网膜血管系统(包括视神经的血管在内)具有自主调节功能,对来自眼动脉血流灌注均有一定程度的调节作用㊂图1OCT下视网膜层次解剖位置(资料来源:Staurenghi G,Sadda S,Chakravarthy U,et al.Ophthalmology,2014,121(8):1572-1578)2高血压视网膜病变的发病机制高血压视网膜病变的发生涉及氧化应激㊁肾素-血管紧张素-醛固酮系统(RAAS)激活㊁免疫系统与炎症反应等多种机制[7],高血压引起的不同血管反应导致眼底改变㊂2.1氧化应激反应氧化应激反应在视网膜血管损害过程中发挥着重要作用,参与氧化还原信号的主要分子是活性氧,如超氧化物㊁过氧化氢㊁羟基自由基㊁一氧化氮和过氧亚硝酸盐㊂内皮细胞㊁血管平滑肌细胞,外膜细胞及巨噬细胞等血管成分均可产生活性氧㊂活性氧在血管收缩和舒张㊁血管细胞的生长㊁死亡和迁移及细胞外基质修饰相关的信号转导中发挥着关键的作用㊂活性氧对免疫细胞分化和功能有影响,导致CD8+和CD4+T淋巴细胞的活化㊂淋巴细胞引起细胞因子分泌,从而增加氧化应激水平㊂大量免疫细胞浸润到血管壁,引起血管结构和功能损害[8]㊂视网膜中还原型辅酶Ⅱ(NADPH)氧化酶衍生的氧化应激和炎症反应的增加导致局部血压升高,活性氧过度产生引起眼部小胶质细胞活化,表明氧化应激㊁炎症和高血压眼病之间存在着相互作用[9]㊂2.2免疫系统与炎症反应免疫系统在高血压血管损害中发挥着重要作用,T细胞㊁B细胞㊁肥大细胞㊁巨噬细胞和树突状细胞产生相关细胞因子,通过免疫级联反应,介导组织损伤,阻碍血管舒张,增强钠的重吸收,引起血压升高,进而造成血管损害㊂单核细胞和巨噬细胞可增强血管收缩和钠潴留,树突状细胞和B淋巴细胞等抗原提呈细胞可能通过调节T细胞功能刺激血压升高㊂树突状细胞可产生白细胞介素(IL)-1β和IL-6等介质,可独立于T细胞调节血压[10]㊂在血管系统中,免疫细胞通过产生各种分子(如细胞因子㊁趋化因子㊁基质金属蛋白酶㊁活性氧)积聚在血管周围脂肪中,这些分子通过不同反应导致血压升高㊁血管扩张㊁刺激胶原合成㊁降解弹力纤维及增加血管僵硬度,最终引起血管功能障碍[11]㊂2.3RAAS通过血管紧张素-1受体(AT-1R)和血管紧张素-2受体(AT-2R)上的受体信号介导视网膜血管病变㊂A T-1R介导炎症㊁细胞死亡㊁氧化应激和血管收缩;A T-2R可降低促炎细胞因子水平,减轻氧化应激,提高细胞存活率㊂血管紧张素(Ang)Ⅱ通过AT-1R途径刺激促炎分子和活性氧的产生,激活免疫细胞,引起免疫细胞积聚,血管内皮功能障碍,从而导致局部血压升高[12]㊂AngⅡ引起视网膜周细胞迁移㊁视网膜动脉收缩和细胞外基质沉积,并发挥一系列致病性作用,导致视网膜病变,包括炎症㊁新生血管形成㊁血管渗漏和水肿形成[13]㊂3高血压视网膜病变分期高血压视网膜病变分为血管收缩期㊁硬化期和渗出期3个阶段㊂在血管收缩期,血压升高引起视网膜动脉生理性痉挛收缩,临床表现为全身性视网膜小动脉变窄㊂在硬化期,随着血压持续升高,视网膜小动脉内膜增厚㊁中膜壁增生及透明变性,临床观察到小动脉对光反射的改变,称为 铜线征 ㊂狭窄和硬化的小动脉僵硬并压缩相邻的视网膜小静脉,从而导致动静脉交叉征(AVN)㊂随着时间的推移,长期持续的血压升高导致组织缺血和血-视网膜屏障破坏[14]㊂在渗出期,出现血液-视网膜屏障破裂㊁血管内皮细胞和血管内皮细胞坏死㊁血液和脂质渗出㊁视网膜神经纤维层缺血等病理变化,临床表现为微动脉瘤㊁出血㊁硬性渗出物和棉绒斑㊂高血压性视网膜病变的3个阶段并非按顺序发生,高血压引起视网膜病变一方面取决于高血压的严重程度,另一方面取决于血压升高的时间和年龄㊂部分急性血压升高的病人常观察到视网膜出血或硬性渗出等渗出期改变,而无AVN等硬化期改变[15]㊂4高血压视网膜病变分级目前,临床常用的分级标准是Keith-Wagener-Baker分级[16]和Mitchell-Wong[17]分级,具体内容详见表1㊂在长期临床应用中,较难区分Keith-Wagener-Baker分级中的Ⅰ级和Ⅱ级病变㊂表1高血压视网膜病变分级标准Keith-Wagener-Baker分级Mitchell-Wong分级临床表现Ⅰ级轻度视网膜动脉痉挛狭窄或合并轻度硬化Ⅱ级中度中度至显著小动脉狭窄㊁局部和/或全身小动脉狭窄㊁光反射过度(铜线征)㊁动静脉交叉改变或切口Ⅲ级重度视网膜小动脉狭窄和局灶性收缩,伴有视网膜水肿㊁微血管瘤㊁出血㊁硬性渗出㊁棉绒斑等Ⅳ级除Ⅲ级改变外,伴有视盘水肿等5高血压视网膜病变的诊断2020年国际高血压学会全球高血压实践指南建议对所有2级及以上高血压[收缩压ȡ160mmHg (1mmHg=0.133kPa)和/或舒张压ȡ100mmHg]病人进行视网膜检查[2]㊂近年来,随着眼底影像学及图像处理技术的不断发展及广泛应用,临床对眼底的观察及评价方法有了显著进步㊂5.1彩色眼底照相目前,直接检眼镜等传统眼底检查方式由于主观性较强㊁检查范围较小㊁随访困难等缺点已被逐渐淘汰,而眼底照相以其操作简便㊁便于筛查等优势,已成为眼底检查的主流方式㊂高血压引起多种眼底改变,多表现为视网膜小动脉变细(如动脉变窄㊁铜丝样改变及管径大小不均等)㊁动静脉交叉征等,伴有视网膜内出血㊁水肿㊁硬性渗出等表现以及视网膜动静脉阻塞㊁动脉瘤等病变[18]㊂5.2眼底荧光血管造影(fundus fluorescein angiography, FFA)FFA是将荧光素钠注入静脉,荧光素钠随着全身血液循环到达眼底,应用特殊的眼底照相机拍摄记录其在视网膜血管动态循环时发出的荧光㊂荧光素钠在眼底循环情况反映了视网膜血管及色素上皮层的生理病理改变,为眼底病的诊断及鉴别诊断提供了重要依据㊂高血压病人FFA常表现为出血㊁脂质渗出㊁荧光素渗漏等,严重者发生视乳头水肿㊂急进型高血压病人易出现血-视网膜屏障破裂,由于血压骤然升高㊁血管内皮调节失控及炎性因子的作用,血浆㊁脂肪及血液其他成分由血管进入视网膜,FFA可观察到出血㊁脂肪渗出㊁荧光素渗漏㊁水肿㊁微血管瘤和新生血管形成[19]㊂5.3光学相干断层扫描(optical coherence tomography, OCT)OCT是近年来发展迅速的一项无创眼底检查技术,其是基于弱相干光干涉仪的基本原理,测定生物组织不同深度层面的反射或散射信号,从而得到高分辨率的图像,可对视网膜进行3D成像㊂有研究表明,高血压病人中心凹下脉络膜厚度(subfoveal choroidal thickness,SFCT)㊁中央黄斑厚度(central macular thickness,CMT)㊁内丛-神经节细胞复合体(inner plexiform-ganglion cell complex,IP-GCC)和视网膜乳头周围神经纤维层(retinal nerve fiber layer,RNFL)均低于对照组[20]㊂有靶器官损害的全身性高血压病人SFCT㊁CMT㊁IP-GCC和RNFL均降低,且随着靶器官数目的增加,SFCT显著降低,提示SCFT可作为预测终末器官损害负荷的指标㊂随着血压持续升高,血-视网膜屏障可能被破坏,并发生RNFL缺血㊂中度㊁重度高血压视网膜病变病人多预后不良㊂有研究显示, TOD和SFCT之间的关系,靶器官受累数目越多, SFCT越低,而CMT㊁IP-GCC和RNFL厚度随着TOD 数目增加而无明显下降[21]㊂5.4光学相干断层扫描血流成像(optical coherence tomography angiography,OCTA)OCTA是一种新型快速的㊁非侵入性的成像手段,可对病人视网膜和脉络膜层内的血管结构及功能进行分析,并在活体上分层观察视网膜的各层血流及脉络膜毛细血管血流情况㊂临床通过OCTA进行多次筛查,及时发现病人视网膜㊁脉络膜血管的异常改变㊂与传统的FFA相比,OCTA可提供更高分辨率的三维视网膜血管成像,精确描绘中心凹无血管区(foveal avascular zone,FAZ),并生成浅㊁深血管丛的深度分辨率图像,测量视网膜SVP与DVP的血管密度㊁灌注密度㊁FAZ面积和周长㊂与眼底照相比较,OCTA可观察到眼底照相无法识别的微血管异常,如FAZ侵蚀,浅层视网膜和深层视网膜中存在非灌注区域和微动脉瘤,血管襻和毛细血管迂曲等㊂由此可见,OCTA可精确显示视网膜血管系统的内部结构并进行定量分析,发现早期视网膜改变,这是传统眼底检查或照相难以发现的[22]㊂有研究表明,OCTA可观察到高血压视网膜病变的5种主要病理变化,包括局灶性毛细血管稀疏㊁散在性微血管瘤㊁局灶性黄斑拱环缺损㊁局灶性毛细血管障碍和局灶性毛细血管无灌注[23]㊂随着高血压视网膜病变逐步恶化,病变数量随之增加,深部血管密度可能是预测高血压性视网膜病变风险的最佳指标㊂6高血压性视网膜病变的治疗高血压视网膜病变的治疗主要是根据相关高血压管理指南降低血压㊂降低血压可减轻高血压视网膜病变进展的风险,改善小动脉结构和稀疏,并增加小动脉密度[24]㊂及早发现并控制血压,早期高血压视网膜病变表现通常是可逆的㊂有研究显示,当高血压视网膜病变作为治疗指征时,需使用降压药物治疗的高血压病人比例从3%上升到14%[25]㊂目前,高血压相关指南未对高血压视网膜病变的治疗提供具体指导,但建议将高血压病人的治疗目标定为血压<140/90 mmHg,理想情况下血压ɤ130/80mmHg,同时建议高血压病人改变生活方式,包括控制体重㊁坚持体育锻炼㊁遵循健康饮食㊁减少盐及酒精摄入量㊂若病人在改变生活方式后血压仍未得到控制或存在较高的心血管风险,需要及时使用降压药物治疗,包括肾素-血管紧张素抑制剂㊁血管紧张素受体拮抗剂㊁β受体阻滞剂㊁利尿剂或钙通道阻滞剂等,通常需在医生指导下用药[2]㊂7高血压视网膜病变与靶器官损害的关系7.1高血压视网膜病变与脑损害的关系由于眼和脑的胚胎同源性,二者具有相似的解剖学㊁生理学特征,视网膜的某些特征可在脑小血管病变的诊断和随访中代替或补充影像学检查[26]㊂相关研究表明,视网膜小动脉狭窄与腔隙性脑梗死有关[27],而视网膜动脉瘤与脑出血有关[28]㊂与对照组比较,脑小血管病变病人深层毛细血管层和浅层毛细血管层的血流密度降低,FAZ区域扩大,这些表现与基于MRI的脑小血管病变疾病评分相关[29-30]㊂有研究显示,痴呆和阿尔茨海默病病人出现视网膜神经纤维层(retinal nerve fiber layer,RNFL)变薄和微血管异常等,随着认知功能下降,RNFL与脉络膜变薄[31]㊂有研究发现,基线时较低的RNFL厚度与认知能力下降和痴呆的风险增加有关[32]㊂7.2高血压视网膜病变与心血管损害的关系心血管疾病在全球范围内具有极高的发病率和死亡率,高血压是心血管疾病的主要死亡风险因素,视网膜微血管病变可在一定程度反映其他潜在的高血压靶器官损害,在预测心血管疾病风险和死亡率方面发挥着重要作用[33]㊂在OCTA中,高血压对视网膜的影响主要表现在DVP㊁SVP的血管密度降低与FAZ面积扩大[34-35]㊂有研究发现,中央凹和中央凹旁区域DVP的血管密度与高血压视网膜病变严重程度有关,无高血压病史DVP 血管密度较高,近期新诊断为高血压的病人(未接受治疗的病人)血管密度较低,高血压未控制的病人血管密度值最低[27]㊂Pascual-Prieto等[36]研究发现,与低心血管风险病人相比,心血管风险高的高血压病人DVP 和SVP的血管密度较低㊂根据病人血压进行分层时,血压控制良好的病人较血压控制不佳病人DVP的血管密度更高[37]㊂根据高血压病程分层时,高血压病程较长(>5年)的病人黄斑区SVP的血管密度低于健康人和高血压病程ɤ5年病人[38]㊂Wang等[39]使用OCTA观察了158例冠心病病人的视网膜和脉络膜血流,并将其与数量相似的健康受试者进行了比较,结果显示,除中心凹外,视网膜其他区域的SVP和DVP的血管密度降低,随着研究的深入,将眼底微血管的变化(由血管密度和血流面积反映)与各冠状动脉分支的Gensini评分(狭窄范围)进行分析,结果显示,左主干(LM)㊁左回旋支(LCX)近端和右冠状动脉(RCA)的狭窄程度与SVP和DVP(中心凹区域除外)的血管密度变化呈负相关㊂7.3高血压视网膜病变与肾损害的关系眼睛与肾脏在结构㊁发育和组织方面有一定相似之处,脉络膜毛细血管内皮㊁Bruch's膜和视网膜色素上皮的排列反映了肾小球内皮㊁GBM和足细胞的排列,在Ⅱ型膜增殖性肾小球肾炎中,GBM和Bruch's膜上均出现了电子致密沉积物,该发现验证了这种观点[40]㊂慢性肾病病人视网膜微血管改变可能在视觉症状出现的早期发生㊂不同视网膜层的微血管可能对系统性合并症有不同的反应㊂慢性肾病病人存在明显的视网膜微血管异常㊂定量变化包括SVP和DVP的毛细血管变细㊁血管密度降低和FAZ的非圆形指数增加㊂血管密度降低可能是由于毛细血管的局部或弥漫性稀疏,FAZ的非圆形指数增加可能是由于中央凹旁毛细血管网络的破坏引起的[41]㊂一项研究通过对比60例慢性肾病的高血压病人与对照组的OCTA资料,结果显示,慢性肾病病人的SVP和DVP血管密度较低[35]㊂7.4高血压视网膜损害与颈动脉狭窄(carotid artery stenosis,CAS)的关系在CAS的病人中,同侧颈动脉重度狭窄病人视网膜中央动脉当量(CRAE)和动静脉比值(AVR)较小,重度CAS病人的平均视网膜敏感度降低㊂视网膜敏感度和CRAE呈正相关[42]㊂与健康对照组相比,病人视网膜血流密度降低[43]㊂Lee 等[44]研究CAS术前后视网膜微循环的变化,结果显示,双眼黄斑深部毛细血管层和浅毛细血管层的血管密度增加㊂8小结与展望高血压视网膜病变发病机制复杂,其损伤过程与全身微血管损伤密切相关,在诊疗过程中,临床医生并未对高血压视网膜病变的诊治给予足够重视,且常规眼底检查对早期微血管系统的发现不敏感㊂随着科学技术的进一步发展,OCT及OCTA等技术广泛应用,临床医生可早期发现和评估高血压视网膜病变㊂由于视网膜血管的可视性及其与心㊁脑㊁肾等各器官的内在联系,常将其作为判断其他器官损害的标志,可用于高血压管理和心血管风险的分层,也为临床医师早期发现并干预高血压靶器官损害提供借鉴和指导㊂参考文献:[1]王增武,王文.中国高血压防治指南(2018年修订版)解读[J].中国心血管病研究,2019(3):193-197.[2]UNGER T,BORGHI C,CHARCHAR F,et al.2020InternationalSociety of Hypertension global hypertension practice guidelines[J].Journal of Hypertension,2020,38(6):982-1004.[3]边波,万征,李永乐,等.高血压患者视网膜病变调查及其临床价值评价[J].中国慢性病预防与控制,2011,19(2):170-171. [4]VADALÀM,CASTELLUCCI M,GUARRASI G,et al.Retinal andchoroidal vasculature changes associated with chronic kidneydisease[J].Graefe's Archive for Clinical and ExperimentalOphthalmology,2019,257(8):1687-1698.[5]STAURENGHI G,SADDA S,CHAKRAVARTHY U,et al.Proposedlexicon for anatomic landmarks in normal posterior segmentspectral-domain optical coherence tomography:the IN㊃OCTconsensus[J].Ophthalmology,2014,121(8):1572-1578. [6]CAMPBELL J P,ZHANG M,HWANG T S,et al.Detailed vascularanatomy of the human retina by projection-resolved opticalcoherence tomography angiography[J].Scientific Reports,2017,7:42201.[7]FERREIRA N S,TOSTES R C,PARADIS P,et al.Aldosterone,inflammation,immune system,and hypertension[J].AmericanJournal of Hypertension,2021,34(1):15-27.[8]LEE M Y,GRIENDLING K K.Redox signaling,vascular function,and hypertension[J].Antioxidants&Redox Signaling,2008,10(6):1045-1059.[9]SANT ANA-GARRIDOÁ,REYES-GOYA C,FERNÁNDEZ-BOBADILLA C,et al.NADPH oxidase-induced oxidative stress in the eyes ofhypertensive rats[J].Molecular Vision,2021,27:161-178. [10]WEN Y,CROWLEY S D.Renal effects of cytokines inhypertension[J].Advances in Experimental Medicine andBiology,2019,1165:443-454.[11]RAI A,NARISAWA M,LI P,et al.Adaptive immune disorders inhypertension and heart failure:focusing on T-cell subsetactivation and clinical implications[J].Journal of Hypertension,2020,38(10):1878-1889.[12]GAO X,YAMAZAKI Y,TEZUKA Y,et al.Pathology of aldosteronebiosynthesis and its action[J].The Tohoku Journal ofExperimental Medicine,2021,254(1):1-15.[13]CHEN H,ZHAO X Y,CHEN Y X,et al.AngiotensinⅡis a crucialfactor in retinal aneurysm formation[J].Experimental EyeResearch,2021,213:108810.[14]MARK O M,TSO M D.Pathophysiology of hypertensiveretinopathy[J].Ophthalmology,1982,89(10):1132-1145. [15]GÖBEL W,MATLACH J.Hypertone veränderungen des fundus[J].Der Ophthalmologe,2013,110(10):995-1007.[16]KEITH N M,WAGENER H P,BARKER N W.Some different typesof essential hypertension:their course and prognosis[J].TheAmerican Journal of the Medical Sciences,1974,268(6):336-345.[17]WONG T Y,MITCHELL P.Hypertensive retinopathy[J].NewEngland Journal of Medicine,2004,351(22):2310-2317. [18]TAPP R J,OWEN C G,BARMAN S A,et al.Associations of retinalmicrovascular diameters and tortuosity with blood pressure andarterial stiffness:United Kingdom biobank[J].Hypertension(Dallas,Tex:1979),2019,74(6):1383-1390.[19]张真,王彤,徐强,等.高血压视网膜病变的研究进展[J].中国慢性病预防与控制,2016,24(7):541-543.[20]WEI W B,XU L,JONAS J B,et al.Subfoveal choroidal thickness:the Beijing eye study[J].Ophthalmology,2013,120(1):175-180.[21]SIMSEK E E,KANAR H S,KANAR B G,et al.Can ocular OCTfindings be as a predictor for end-organ damage in systemichypertension?[J].Clinical and Experimental Hypertension(NewYork,N Y:1993),2020,42(8):733-737.[22]YANG J Y,WANG Q,YAN Y N,et al.Microvascular retinalchanges in pre-clinical diabetic retinopathy as detected byoptical coherence tomographic angiography[J].Graefe's Archivefor Clinical and Experimental Ophthalmology,2020,258(3):513-520.[23]LIU Y H,LI J S,PAN J,et al.Morphological changes in andquantitative analysis of macular retinal microvasculature byoptical coherence tomography angiography in hypertensiveretinopathy[J].Hypertension Research,2021,44(3):325-336.[24]JUMAR A,HARAZNY J M,OTT C,et al.Improvement in retinalcapillary rarefaction after valsartan treatment in hypertensivepatients[J].The Journal of Clinical Hypertension,2016,18(11):1112-1118.[25]KOLMAN S A M,VAN SIJL A M,VAN DER SLUIJS F A,et al.Consideration of hypertensive retinopathy as an important end-organ damage in patients with hypertension[J].Journal ofHuman Hypertension,2017,31(2):121-125.[26]BIFFI E,TURPLE Z,CHUNG J,et al.Retinal biomarkers ofcerebral small vessel disease:a systematic review[J].PLoS One,2022,17(4):e0266974.[27]YATSUYA H,FOLSOM A R,WONG T Y,et al.Retinalmicrovascular abnormalities and risk of lacunar stroke:atherosclerosis risk in communities study[J].Stroke,2010,41(7):1349-1355.[28]BAKER M L,HAND P J,LIEW G,et al.Retinal microvascular signsmay provide clues to the underlying vasculopathy in patients withdeep intracerebral hemorrhage[J].Stroke,2010,41(4):618-623.[29]GEERLING C F,TERHEYDEN J H,LANGNER S M,et al.Changes of the retinal and choroidal vasculature in cerebralsmall vessel disease[J].Scientific Reports,2022,12(1):3660. [30]WANG X J,WEI Q,WU X Q,et al.The vessel density of thesuperficial retinal capillary plexus as a new biomarker in cerebralsmall vessel disease:an optical coherence tomographyangiography study[J].Neurological Sciences,2021,42(9):3615-3624.[31]CARAZO-BARRIOS L,ARCHIDONA-ARRANZ A,CLAROS-RUIZ A,et al.Correlation between retinal nerve fibre layer thickness andwhite matter lesions in Alzheimer's disease[J].InternationalJournal of Geriatric Psychiatry,2021,36(6):935-942. [32]MUTLU U,COLIJN J M,IKRAM M A,et al.Association of retinalneurodegeneration on optical coherence tomography withdementia:a population-based study[J].JAMA Neurology,2018,75(10):1256-1263.[33]LEE W H,PARK J H,WON Y,et al.Retinal microvascular changein hypertension as measured by optical coherence tomographyangiography[J].Scientific Reports,2019,9:156.[34]DONATI S,MARESCA A M,CATTANEO J,et al.Opticalcoherence tomography angiography and arterial hypertension:arole in identifying subclinical microvascular damage?[J].European Journal of Ophthalmology,2021,31(1):158-165.[35]CHUA J,CHIN C W L,HONG J,et al.Impact of hypertension onretinal capillary microvasculature using optical coherencetomographic angiography[J].Journal of Hypertension,2019,37(3):572-580.[36]PASCUAL-PRIETO J,BURGOS-BLASCO B,ÁVILA SÁNCHEZ-TORIJA M,et al.Utility of optical coherence tomography angiography indetecting vascular retinal damage caused by arterialhypertension[J].European Journal of Ophthalmology,2020,30(3):579-585.[37]CHUA J,CHIN C W L,TAN B Y,et al.Impact of systemic vascularrisk factors on the choriocapillaris using optical coherencetomography angiography in patients with systemic hypertension[J].Scientific Reports,2019,9(1):5819.[38]LIM H B,LEE M W,PARK J H,et al.Changes in ganglion cell-inner plexiform layer thickness and retinal microvasculature inhypertension:an optical coherence tomography angiographystudy[J].American Journal of Ophthalmology,2019,199:167-176.[39]WANG J,JIANG J,ZHANG Y,et al.Retinal and choroidal vascularchanges in coronary heart disease:an optical coherencetomography angiography study[J].Biomedical Optics Express,2019,10(4):1532-1544.[40]MCAVOY C E SILVESTRI G.Retinal changes associated withtype2glomerulonephritis[J].Eye(London,England),2005,19(9):985-989.[41]YEUNG L,WU I W,SUN C C,et al.Early retinal microvascularabnormalities in patients with chronic kidney disease[J].Microcirculation(New York,N Y:1994),2019,26(7):e12555. [42]WU D H,WU L T,WANG Y L,et al.Changes of retinal structureand function in patients with internal carotid artery stenosis[J].BMC Ophthalmology,2022,22(1):123.[43]LAHME L,MARCHIORI E,PANUCCIO G,et al.Changes in retinalflow density measured by optical coherence tomographyangiography in patients with carotid artery stenosis after carotidendarterectomy[J].Scientific Reports,2018,8(1):17161. [44]LEE C W,CHENG H C,CHANG F C,et al.Optical coherencetomography angiography evaluation of retinal microvasculaturebefore and after carotid angioplasty and stenting[J].ScientificReports,2019,9:14755.(收稿日期:2022-08-06)(本文编辑薛妮)。
高血压病眼底疾病

高血压眼底疾病分期【高血压病Ⅰ期】初期全身小动脉多正常或有轻度功能性收缩,无器质性损害,眼底多正常。
当血压持续性升高或一时性的急剧升高时,出现反应性的局部管腔狭窄,反光增强变窄,称为动脉痉挛。
此时为暂时性的,当血压正常后即可恢复正常。
【高血压病Ⅱ期】已有器官损害,但功能可以代偿。
眼底可出现高血压视网膜动脉硬化(hypertensive arteriolosclerosis)表现:(1)动脉变细反光增强加宽,血柱颜色变浅。
由于动脉硬化收缩视网膜动静脉管径之比由正常的2:3,可减少为1:2,甚至更细。
由于管壁屈光指数增加,透明度降低,使得动脉反光增强加宽,呈黄红色,形成铜丝状外观(copper wire)。
当发展到管壁不透明时,不能看到血柱,仅见一白线,则呈银丝状外观(silver wire)。
(2)动静脉交叉部位可出现特有的交叉压迫征。
正常情况下,此处的动静脉共为一外膜,当动脉硬化及血管周围胶质增生时,产生对静脉的压力并使其管腔缩小,其表现为静脉隐匿、削尖、肿胀、移位或偏向,以及静脉拱桥等。
静脉隐匿是交叉部位的静脉受硬化动脉管壁压迫下陷,遮挡动脉两侧的静脉血柱,似被隔断样。
动脉硬化时,交叉部位的静脉壁也增厚且不透明,因而显示血柱变窄呈削尖样。
交叉部位静脉受压使其血流回流受阻,静脉远端扩张,加上硬化动脉的牵引关系使局部静脉偏向或移位。
当静脉隐匿并有受压出现回流障碍时称为Gunn征。
若静脉隐匿合并有偏向或移位时称salus征。
桥拱现象则是交叉部位的静脉位于动脉表面时,静脉骑跨形成驼峰状隆起,这是硬化的动脉增粗撑顶的体现。
【高血压病Ⅲ期】合并有器官损害,且功能已失代偿,眼底即形成高血压性视网膜病变(hypeaensive retinopathy)。
慢性高血压病晚期或急进性高血压舒张压超过130mmHg以上时,由于视网膜内屏障破坏失代偿,视网膜出现大面积的灰白色水肿,并有散在的或多发性片状出血灶,深层有黄白色斑点状硬性渗出,浅层有团状或棉絮状软性渗出斑。
特殊慢性病鉴定病种诊断标准

特殊慢性病鉴定病种诊断标准一、高血压病合并症(一)诊断标准高血压3级以上病史(收缩压≥180mmhg或舒张压≥110mmhg),并有下列并发症之一:1、心脏疾病。
既往心绞痛、心肌梗死病史,并伴有心脏扩大及心功能不全3级以上。
2、脑血管疾病。
既往脑梗死或脑出血病史,并伴有肢瘫(肌力3级及以下),头部CT或磁共振示责任病灶≥2.0cm(脑干、内囊处可<2.0cm)。
3、肾脏疾病。
血肌酐≥177μmol/L或2.0mg/dl。
4、主动脉夹层。
须有既往磁共振或CTA证据。
5、重度高血压性视网膜病变(出血或渗出),或伴有视神经乳头水肿。
(二)相关检查检验项目1、心电图。
2、超声心动图。
3、尿分析。
4、肾功(尿素氮、肌酐)。
5、眼底检查。
6、头部CT或既往头核磁共振。
二、糖尿病合并症(一)诊断标准有明确的糖尿病诊断,并有下列并发症之一:1、四肢动脉病变。
超声多普勒或动脉造影示动脉狭窄程度≥50%,或局部足、趾坏疽(干性、湿性、溃疡)、截趾、截肢。
2、肾病Ⅳ期以上(含Ⅳ期)。
血肌酐≥177μmol/L或2.0mg/dl 或肾小球滤过率<60ml/min,或伴有尿蛋白定性阳性(两次以上超过300mg/L或0.5g/24h)、高血压、浮肿、低蛋白血症、贫血、管型尿等。
3、视网膜病变。
糖尿病眼底视网膜病变3期(含3期)以上。
4、心功能不全。
心功能不全3级以上。
(二)相关检查检验项目1、血糖。
2、尿分析。
3、肾功(尿素氮、肌酐)。
4、眼底检查。
5、周围动脉血管彩超。
6、超声心动图。
7、既往肾小球滤过率检查。
三、脑血管意外(外伤性脑出血除外)(一)诊断标准既往有脑梗死或脑出血病史,并同时符合以下二项:1、肢瘫(肌力3级及以下)。
2、头部CT或磁共振示责任病灶(梗死灶或出血灶),梗死病灶应≥2.0cm(脑干、内囊处可<2.0cm)。
(二)相关检查检验项目头部CT或既往头核磁共振。
四、冠心病(心功能不全3级以上)(一)诊断标准既往有冠心病病史,并伴有心绞痛或心肌梗死发作病史。
高血压眼底病变分级

“三”是指每天要步行三千米以上,且确保 30分钟,并坚持做到有恒、有度,过分剧 烈旳运动对身体不利。
健康就是幸福,健康就是力量,健康是建 功立业旳基础,切勿等闲视之。加强自我 保健,注意预防,保持主动,人人有机会, 关键在自己。预防保健重在了解,贵在坚 持,麻痹大意,后患无穷。
在临床上发觉:脑血栓、脑溢血、心脏猝 死等常发生在夜间。二十四小时动态心电 图监测显示,许多病人旳心脏跳动一天都 很平稳,唯独夜里有几次大旳波动,且大 多数在病人夜间起床上厕所时。
“三个半小时”是:早上走半小时; 中午睡半小时;晚上散步半小时。
世界卫生组织曾在国际睡眠会议上强 调了午睡旳好处,但午睡时间不能超出半 小时。世界卫生组织以为:最佳旳运动是 步行,尤其提醒心脑血管病人;步行运动 要注意“三五七”。
高血压眼底病变分级
高血压旳眼底变化可分为4种程度不等旳情 况,医学上称为4级:
第1级:视网膜动脉功能性狭窄或伴有 轻度硬化,主要发生于第2分支及下列旳分 支。
第2级:视网膜动脉硬化程度比第1级 明显,动脉管径狭窄不均,并出现动静脉 交叉压迹现象。
第3级:除视网膜动脉狭窄与硬化外, 还有视网膜水肿、棉絮状斑、硬性白斑、 出血斑等视网膜病变。
第4级:除第3级变化外,还有视盘水 肿。
眼底病变级别越高,高血压病情越重, “靶器官”受害旳程度也越厉害。
高血压眼底病变分级
眼底病变是毛细血管破裂,压了神经, 还有就是和长久吃药有关系,这期间不要 给鱼油 血管破裂还是因为血液不流通,血 脂稠,胆固醇高,再加上心情不好 劳累过 分 就很危险了。
严格防治高血压病及其并发旳心脑血管病 如心绞痛、心梗和中风等,对高血压病人 旳健康长寿格外主要。教授提出旳健康处 方“三个三”,就是“三个半分钟”、 “三个半小时”和“三杯水”。
高血压视网膜病变的分级和治疗原则

高血压视网膜病变的治疗方案
1.明确病因,尽快去除 2.原发性高血压患者,如果血压突然急剧升高,最好使舒张
压缓慢稳定下降,急剧降低血压可造成器官缺血。因为长 期高血压患者小动脉已部分或完全纤维化,血管壁对血压 有很高的耐力,且丧失了一定的弹性和收缩力,只有在一 定高度的收缩压下,才能维持器官的末梢循环。如果血压 突然降得太多,反而出现末梢血液供血不足,而使器官血 管出现闭塞现象
高血压视网膜病变的分级和治 疗原则
邓婷
高血压视网膜病变分级标准:
目前关于高血压视网膜病变的分期临床上 还多沿用keith-wagener的四级分类法:
Ⅰ级为视网膜动脉功能性狭窄有轻度硬化表现 Ⅱ级为视网膜动级标准:
Ⅲ级为视网膜动脉明显硬化狭窄收缩,并有出 血,渗出等高血压视网膜病变
Ⅳ级为视网膜病变加重,合并有视乳头水肿。 此分类法与临床高血压分期比较吻合,眼底检 查可协助高血压的诊断,并对预后提出较为客 观的意见
临床分级标准:
Ⅰ级 视网膜动脉轻度硬化 视网膜动脉功能性狭窄 Ⅱ级 动静脉交叉征阳性 视网膜动脉有肯定的局部狭窄
临床分级标准:
Ⅲ级 视网膜出血,渗出等表现 视网膜动脉明显硬化狭窄收缩 Ⅳ级 视网膜病变加重 合并有视乳头水肿
高血压视网膜病变的治疗方案
3.注意饮食,限制食盐摄入 4.眼部采取对症治疗,如活血化瘀以促进渗出和
出血的吸收,口服维生素C、E 和芦丁等
谢 谢!
复方血栓通胶囊治疗高血压性视网膜病变的疗效观察

复方血栓通胶囊治疗高血压性视网膜病变的疗效观察
朱越峰
【期刊名称】《全科医学临床与教育》
【年(卷),期】2012(010)002
【摘要】@@ 高血压性视网膜病变是高血压病重要的病理变化,可引起视网膜渗出、出血.复方血栓通胶囊为纯中药制剂,国内外尚未有报道将其用于治疗高血压性视网
膜病变Ⅲ、Ⅳ级.本次研究对48例高血压性视网膜病变Ⅲ、Ⅳ级患者应用复方血栓通胶囊治疗,取得满意效果.
【总页数】2页(P205-206)
【作者】朱越峰
【作者单位】312000,浙江绍兴,绍兴文理学院附属医院眼科
【正文语种】中文
【相关文献】
1.复方血栓通胶囊治疗中心性浆液性脉络膜视网膜病变的临床疗效观察 [J], 陈瑞
中
2.复方血栓通胶囊联合阿司匹林治疗高血压性视网膜病变的疗效分析 [J], 吕洁文; 谢凤华; 袁小玉
3.复方血栓通胶囊联合抗VEGF药物玻璃体腔治疗中心性渗出性脉络膜视网膜病变疗效观察 [J], 闫俊惠
4.复方血栓通胶囊联合弱剂量光动力治疗中心性浆液性脉络膜视网膜病变疗效观察[J], 彭志华;金小琴;吴岚
5.复方血栓通胶囊治疗中心性浆液性脉络膜视网膜病变的疗效观察 [J], 吴晓阳;吴克虎
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
治疗上宜积极控制血压至正常水平。可配合中药治疗。 肝阳上亢证,宜平肝潜阳,用天麻钩藤饮 阴虚火旺证,宜滋阴降火,用知柏地黄丸 痰浊阻络证,宜祛痰化浊,用半夏白术天麻汤 肝肾亏虚证,宜滋补肝肾,用左归饮
此外,要注意劳逸结合,保持乐观愉快情绪,避免过度 劳累和情绪激动。服用降压药后,患者从坐位和卧位起立时 动作应缓慢,特别是夜间起床时更应注意,防止突然昏厥而 发生意外。宜进低盐、低胆固醇、低动物脂肪食物;多食水 果蔬菜及豆类食物,食用豆油、菜油等植物油。禁烟慎酒, 切忌暴饮暴食,保持大便通畅。
第一节 高血压性视网膜病变
有高血压病史。多伴有头痛眩晕,视物模糊。眼底可出现视网 膜动脉血管狭窄,动静脉交叉处有压迹,或不同程度的动脉硬 化,或伴有视网膜出血斑、棉絮状渗出斑,严重者出现视盘水 肿。急进型患者,视网膜水肿,以视盘附近明显。变细的动脉 和纡曲的静脉起伏于水肿的视网膜之中,可有大小不等的火焰 状出血斑;后极部沿四支主干血管分布区域,有位于神经纤维 层数量不等、大小不一,呈放射状排列的灰白色棉絮状斑;晚 期可出现细小白色或淡黄色小点的硬性渗出,若位于视盘颞侧 ,呈放射状排列,若位于黄班则呈扇形或星状排列。
高血压性视网膜病变Ⅰ级
高血压性视网膜病变Ⅱ级
高血压性视网膜病变Ⅲ级
高血压性视网膜病变Ⅳ级
高血压性视网膜病变Ⅳ级
高血压性视网膜病变(急性型)
高血压性视网膜病变(急性型)
第二节 糖尿病视网膜病变
确诊为糖尿病。眼底检查见视网膜微动脉瘤、出血、渗出 、水肿、新生血管形成,或发生增殖性视网膜病变。
高血压性视网膜病变的分级: Ⅰ级:视网膜小动脉轻度普遍变窄.但管径均匀。小 分支动脉反光带增宽,静脉隐匿。 Ⅱ级:动脉硬化,弥漫性狭窄,反光增强,呈铜丝状 或银丝状,动静脉交叉处静脉偏移,远端膨胀或被压呈梭型 ,或呈直角偏离。 Ⅲ级:弥漫小动脉明显狭窄及管径不规则,合并视网 膜出血、硬性渗出、棉絮状斑和视网膜水肿。 Ⅳ级:在Ⅲ级基础上出现上视盘水肿。
糖尿病视网膜病变Ⅰ期
糖尿病视网膜病变Ⅱ期
糖尿病视网膜病变Ⅲ期
糖尿病视网膜病变Ⅲ期
糖尿病视网膜病变Ⅳ期
糖尿病视网膜病变Ⅴ期
糖尿病视网膜病变Ⅴ期術後
糖尿病视网膜病变Ⅵ期
糖尿病视神经视网膜病变
糖尿病视神经视网膜病变
糖尿病视神经视网膜病变
糖尿病视神经视网膜病变Fra bibliotek荧光素眼底血管造影:可出现多种异常荧光状态。如微动 脉瘤样高荧光,黄斑部毛细血管拱环结构异常,毛细血管扩张 ,渗漏,窗样缺损与色素上皮功能失代偿等。荧光素眼底血管 造影对毛细血管闭塞即无灌注区的位置与范围可做出定量估计 ;可对黄斑部病变(水肿、囊样变性、缺血等)的性质、范围 、程度作出诊断;对新生血管的部位、活动程度进行估计。所 有这些都对本病的诊断、治疗、疗效评估提供了根据。
可根据糖尿病视网膜病变的程度选择激光光凝治疗,若 有增生性玻璃体视网膜病变手术适应症者,宜及时手术治疗 。严格控制血糖、血压、血脂是防治糖尿病视网膜病变发生 发展的基础。定期进行眼科检查是预防糖尿病视网膜病变造 成失明的重要措施;早期采取针对性治疗是保护糖尿病视网 膜病变患者视功能的必要手段。在日常生活中要慎起居,调 情志,戒烟酒,节饮食,勤运动,注意避免过度劳累。
视网膜电图振荡电位:视网膜电图振荡电位异常。 B形超声检查:有助于了解视网膜玻璃体增殖程度及有无 牵引性视网膜脱离。
用中医、中西医结合的方法治疗。若属阴虚燥热证,宜 滋阴降火,润燥化瘀,用玉泉丸(《卫生部药品标准·中成 药制剂分册》)加减。气阴两虚证,宜益气养阴,利水化瘀 ,用六味地黄丸(《小儿药证直诀》)加减。脾肾两虚证, 宜温阳益气,利水消肿,用加减驻景丸(《眼科简易方》) 加减。瘀血内阻证,宜化瘀通络。用血府逐瘀汤(《医林改 错》)加减。痰瘀阻滞证,宜健脾燥湿、化痰祛瘀,用温胆 汤(《千金要方》)加减。
