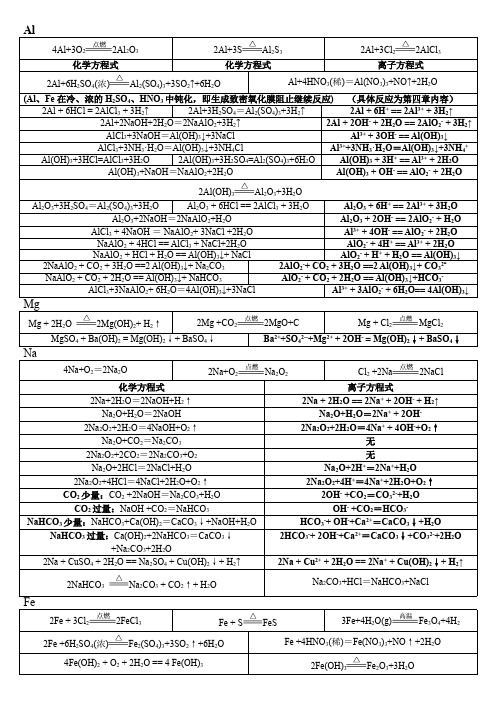
铝镁及其化合物的化学方程式和离子方程式
铝及其化合物的化学方程式和离子方程式

铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H+2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2OAl+6H++3NO3-Al3++3NO2↑+3H2O 8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO 4Al 2(SO 4)3 +3H 2O Al 2O 3+6H +2Al 3++3H 2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH2NaAlO 2+H 2O Al 2O 3+2OH -2AlO 2-+H 2O3、电解氧化铝的熔融液:2Al 2O 34Al +3O 2 ↑ 三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOH NaAlO 2+2H 2O Al(OH)3 +OH -AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O四、硫酸铝1、硫酸铝的水溶液呈酸性:Al 2(SO 4)3+6H 2O2Al(OH)3 +3H 2SO 4 Al 3++3H 2OAl(OH)3 +3H +2、硫酸铝溶液中加入少量的氢氧化钠溶液:Al 2(SO 4)3 +6NaOH 3Na 2SO 4+2Al(OH)3 ↓Al 3++3OH -Al(OH)3 ↓3、向硫酸铝溶液中加足量的氢氧化钠溶液: Al 2(SO 4)3 +8NaOH 2NaAlO 2+3Na 2SO 4+4H 2OAl 3++4OH -AlO 2-+2H 2O4、向硫酸铝溶液中加入少量的氢氧化钡溶液:冰晶石电解Al2(SO4)3+3Ba(OH)22Al(OH)3↓+3BaSO4↓2Al3++3SO42-+3Ba2++6OH-2Al(OH)3↓+3BaSO4↓5、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-2AlO2-+3BaSO4↓+4H2O 6、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+7、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑8、向硫酸铝溶液中加入碳酸氢钠溶液(灭火器原理):Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑9、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓六、明矾1、明矾净水:Al3++3H2O Al(OH)3(胶体)+3H+2、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO4 3Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓3、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O。
高一上四大基本金属元素钠镁铝铁单质及其化合物化学和对应离子方程式总结
NO3- + 2+
Fe3+ + 3H2O
Fe(OH)3(胶体) + 3H+
Cl2 少量: 6FeBr2 + 3Cl2 == 2FeCl3 +4FeBr3 Cl2 过量:2FeBr2+ 3Cl2 == 2FeCl3 + 2Br2
2Fe2+ + Cl2 == 2Fe3+ + 2Cl2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 2Br2 + 6Cl-
Al2O3+3H2SO4=Al2(SO4)3+3H2O Al2O3 + 6HCl == 2AlCl3 + 3H2O Al2O3 + 6H+ == 2Al3+ + 3H2O Al2O3+2NaOH=2NaAlO2+H2O Al2O3 + 2OH- == 2AlO2- + H2O AlCl3 + 4NaOH = NaAlO2+ 3NaCl +2H2O Al3+ + 4OH- == AlO2- + 2H2O NaAlO2 + 4HCl == AlCl3 + NaCl+2H2O AlO2- + 4H+ == Al3+ + 2H2O NaAlO2 + HCl + H2O == Al(OH)3↓+ NaCl AlO2- + H+ + H2O == Al(OH)3↓ 2NaAlO2 + CO2 + 3H2O ==2 Al(OH)3↓+ Na2CO3 2AlO2-+ CO2 + 3H2O ==2 Al(OH)3↓+ CO32NaAlO2 + CO2 + 2H2O == Al(OH)3↓+ NaHCO3 AlO2- + CO2 + 2H2O == Al(OH)3↓+HCO3AlCl3+3NaAlO2+ 6H2O=4Al(OH)3↓+3NaCl Al3+ + 3AlO2- + 6H2O== 4Al(OH)3↓
铝及其化合物及化学方程式和离子方程式

铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H+2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2OAl+6H++3NO3-Al3++3NO2↑+3H2O8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO4Al 2(SO 4)3 +3H 2O Al 2O 3+6H+2Al 3++3H 2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH2NaAlO 2+H 2O Al 2O 3+2OH-2AlO 2-+H 2O3、电解氧化铝的熔融液:2Al 2O34Al +3O 2↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOH NaAlO 2+2H 2OAl(OH)3 +OH-AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH)3Al 2O 3+3H 2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al 2(SO 4)3 +3BaCl 22AlCl 3+3BaSO 4↓SO 42-+Ba 2+BaSO 4↓2、硫酸铝的水溶液呈酸性:Al 2(SO 4)3+6H 2O 2Al(OH)3 +3H 2SO 4 Al 3++3H 2O Al(OH)3 +3H +3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al 2(SO 4)3 +6NaOH 3Na 2SO 4+2Al(OH)3↓Al 3++3OH-Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液: Al 2(SO 4)3 +8NaOH 2NaAlO 2+3Na 2SO 4+4H 2OAl 3++4OH-AlO 2-+2H 2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液: Al 2(SO 4)3 +3Ba(OH)22Al(OH)3↓+3BaSO 4↓2Al 3++3SO 42-+3Ba 2++6OH-2Al(OH)3↓+3BaSO 4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:冰晶石电解Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-2AlO2-+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO43Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO 2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓。
高三化学一轮复习【镁、铝及其化合物】

在空气中都能跟氧气反应,表面覆盖一层致密而坚硬的氧化物薄膜,都具有自我抗腐蚀能力铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等易错点:(1)常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是二者能使铝发生“钝化”,而不是铝与浓硫酸、浓硝酸不反应。
(2)铝不但能与酸(H +)反应,还能够与碱溶液反应,表现为特殊性。
2Al +2OH -+2H 2O===2AlO -2+3H 2↑。
其反应机理应为:铝先与强碱溶液中的水反应生成H 2和Al(OH)3,然后Al(OH)3再与NaOH 反应生成H 2O 和NaAlO 2,反应中铝作还原剂,水作氧化剂,NaOH 无电子得失。
(3)铝热反应是在高温干态下进行的置换反应,铝只能与排在金属活动性顺序其后的金属氧化物反应。
铝不能与MgO 反应,铝热反应不能用来冶炼大量的金属铁、铜等(要考虑冶炼成本)。
(4)Mg 在CO 2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器和泡沫灭火器灭火。
同时镁与氮气反应生成Mg 3N 2。
二、铝的重要化合物1.氧化铝(1)物理性质 色态: ;硬度: ;熔点: 。
(2)化学性质①属于两性氧化物,写出有关反应的离子方程式:,②电解 化学方程式为 2Al 2O 3(熔融)=====电解4Al +3O 2↑。
(3)用途熔点很高,是一种较好的耐火材料,天然产刚玉的成分是Al 2O 3,还可制作各种宝石。
2.氢氧化铝 (1)物理性质Al(OH)3是一种难溶于水的白色胶状物质,具有较强的吸附能力。
(2)化学性质 ①两性Al(OH)3的电离方程式为Al(OH)3既能溶于强酸又能溶于强碱,且都生成盐和水。
与强酸反应: , 与强碱溶液反应: 。
②不稳定性Al(OH)3受热分解: 。
(3)制备①向铝盐中加入氨水,离子方程式为 。
②NaAlO 2溶液中通入足量CO 2,离子方程式为 。
③NaAlO 2溶液与AlCl 3溶液混合:离子方程式为 。
化学方程式和离子方程式整理(离子检验、卤素、钠、镁、铝)

化学方程式和离子方程式整理(离子检验、卤素、钠、镁、铝) 1.铵根的鉴定(浓氢氧化钠溶液、加热)__________________________________________2.硫酸根的鉴定(稀盐酸、氯化钡)__________________________________________3.氯气的实验室制备(用浓盐酸、加热、一半HCl被氧化)________________________________________,___________________________________ 4.氯气的工业制备(电解氯化钠溶液)________________________________________,____________________________________ 5.铁在氯气中燃.(棕褐色烟)________________________________________6.铜在氯气中燃烧(棕黄色烟)_________________________________________7.工业制氯化氢(苍白色火焰)________________________________________8.氯气和水的反应(注意可逆)________________________________________,____________________________________ 9.氯气溶于氢氧化钠溶液(尾气吸收)________________________________________,_____________________________________ 10.工业制漂白粉(漂白粉有效成分为次氯酸钙)________________________________________11.漂白粉在空气中易变质(同时也是漂白粉的利用方式之一)_________________________________________12.次氯酸的不稳定性(见光分解)__________________________________________13.氯气通入溴化钾溶液中(工业制溴单质的原理)__________________________________________,____________________________________ 14.氯气通往碘化钾溶液中(工业制碘单质的原理)__________________________________________,___________________________________ 15.溴水滴入碘化钾溶液中__________________________________________,____________________________________ 16.氯、溴、碘离子的鉴定___________________________,__________________________,_______________________ 17.氯化银、溴化银、碘化银见光分解___________________________,__________________________,______________________ 18.钠在空气中缓慢氧化(生成白色固体)_____________________________________19.钠在空气中燃烧(生成淡黄色固体)____________________________________20.钠与水反应(红、嘶、浮、游、熔)______________________________________,______________________________________ 21.钠与硫酸铜溶液反应(先水后盐)______________________________________,_____________________________________ 22.工业制备钠(电解熔融氯化钠)______________________________________23.过氧化钠与水反应_________________________________________24.过氧化钠与二氧化碳反应(可用于呼吸面具)__________________________________________25.碳酸钠溶液与氯化钙溶液反应________________________________________,____________________________________ 26.碳酸钠溶液与氢氧化钙溶液反应(工业制烧碱时,用石灰乳)_______________________________________,_____________________________________ 27.碳酸钠溶液中缓慢滴入少量盐酸并不断搅拌(无二氧化碳产生)_____________________________________,_____________________________________ 28.碳酸钠溶液中加入过量盐酸(有二氧化碳产生)______________________________________,___________________________________ 29.碳酸钠溶液中通入二氧化碳气体(转化为碳酸氢钠)_______________________________________,__________________________________ 30.碳酸氢钠固体受热分解(不稳定)________________________________________31.碳酸氢钠溶液与盐酸反应(比碳酸钠更快产生气体)________________________________________,__________________________________ 32.碳酸氢钠溶液与氢氧化钠溶液反应________________________________________,__________________________________ 33.碳酸氢钠溶液与少量氢氧化钙溶液反应(2:1反应)_______________________________________,____________________________________ 34.碳酸氢钠溶液与过量氢氧化钙溶液反应(1:1反应)______________________________________,_____________________________________ 35.侯氏制碱法原理(第一步生成小苏打,第二步灼烧小苏打得纯碱)_______________________________________,____________________________________ 36.硫酸氢钠溶液与少量氢氧化钡溶液反应(2:1反应)______________________________________,_____________________________________ 37.硫酸氢钠溶液与过量氢氧化钡溶液反应(1:1反应)______________________________________,______________________________________ 38.从海水中提取镁(按书上,分六步)________________________________________,_________________________________________________________________________,_________________________________________________________________________,_________________________________ 39.镁在空气中点燃生成氧化镁(还生成少量的氮化镁)________________________________________40.镁在氮气中燃烧_______________________________________41.镁在二氧化碳气体中燃烧(生成两种固体)________________________________________42.加热分解氢氧化镁或碳酸镁制氧化镁(作耐火材料)________________________________________,_____________________________________ 43.从铝土矿提取铝(涉及四个反应)_______________________________________,_____________________________________,_______________________________________,_____________________________________ 44.氧化铝的两性(可溶于盐酸、氢氧化钠溶液)____________________________________,__________________________________________________________________________,_______________________________________ 45.氢氧化铝的两性(可溶于盐酸、氢氧化钠溶液)____________________________________,__________________________________________________________________________,_______________________________________ 46.氯化铝溶液中加入过量的氨水(实验室制氢氧化铝)_____________________________________,_____________________________________ 47.偏铝酸钠溶液中通入过量的二氧化碳气体(若二氧化碳少量,则生成碳酸钠)_____________________________________,___________________________________________________________________________,______________________________________ 48.氯化铝溶液中逐滴加入氢氧化钠溶液(先有沉淀,后又溶解)_____________________________________,____________________________________________________________________________,______________________________________ 49.氯化铝溶液与过量氢氧化钠溶液反应______________________________________,_______________________________________ 50.氯化铝溶液与偏铝酸钠溶液的反应(铝离子与偏铝酸根不能大量共存)______________________________________,________________________________________ 51.偏铝酸钠溶液中逐滴加入盐酸(先有沉淀,后又溶解)_______________________________________,_______________________________________ _______________________________________,_______________________________________ 52.偏铝酸钠溶液与过量盐酸反应_______________________________________,________________________________________ 53.铝溶于盐酸_______________________________________,_______________________________________ 54.铝溶于氢氧化钠溶液_______________________________________,_____________________________________ 55.铝粉与氧化铁粉在高温下发生铝热反应(用于焊接钢轨,也可冶炼难熔金属)___________________________________________。
化学方程式及离子方程式(总结)

点燃 △电解 四.学测考试化学方程式和离子方程式(学测必备材料4)一、钠及其化合物1、钠与氧气(常温): 4Na+O 2=2Na 2O2、钠与氧气(燃烧): 2Na+O 2 Na 2O 23、钠与水反应: 2Na+2H 2O =2NaOH+H 2↑ 2Na + 2H 2O = 2Na + +2OH - + H 2↑4、氧化钠与水反应: Na 2O+H 2O==2NaOH5、碳酸氢钠与氢氧化钠溶液: NaHCO 3 + NaOH== Na 2CO 3+ H 2OHCO 3- + OH - == CO 32- + H 2O6、碳酸氢钠与盐酸: HCl +NaHCO 3=NaCl+H 2O+CO 2↑HCO 3- + H + == CO 2↑ + H 2O7、碳酸氢钠固体加热: 2NaHCO 3 Na 2CO 3 + CO 2↑+ H 2O8、碳酸钠溶液通入二氧化碳: Na 2CO 3+CO 2+H 2O==2NaHCO 3 CO 32- + CO 2+H 2O==2HCO 3-9、大理石与与盐酸反应: CaCO 3+2HCl =CaCl 2+H 2O+CO 2↑CaCO 3 + 2H + == Ca 2+ + CO 2↑+ H 2O二、镁及其化合物 10、镁在氧气中燃烧: 2Mg+O 2 2MgO11、氯化镁溶液与石灰水: MgCl 2 + Ca(OH)2 = CaCl 2+ Mg(OH)2↓ Mg 2+ + 2OH - = Mg(OH)2↓12、氢氧化镁与盐酸反应: Mg(OH)2 + 2HCl = MgCl 2 +2H 2OMg(OH)2 + 2H + = Mg 2+ + 2H 2O 13、电解熔融氯化镁: MgCl 2 Mg + Cl 2↑14、碳酸镁与盐酸: MgCO 3 +2HCl = MgCl 2 + CO 2↑+ H 2OMgCO 3 + 2H + == Mg 2+ + CO 2↑+ H 2O三、铝及其化合物 (Al 2O 3是两性氧化物Al(OH)3是两性氢氧化物15、铝热反应: Fe 2O 3 + 2Al Al 2O 3+2Fe16、铝与盐酸: 2Al + 6HCl = 2AlCl 3 + 3H 2↑2Al + 6H + == 2Al 3+ + 3H 2↑17、铝与氢氧化钠溶液: 2Al+2NaOH+2H 2O =2NaAlO 2+3H 2↑ 2Al + 2OH - + 2H 2O =2AlO 2- + 3H 2↑18、氧化铝与盐酸: Al 2O 3+6HCl=2AlCl 3+3H 2O Al 2O 3 + 6H + = 2Al 3+ + 3H 2O19、氧化铝与氢氧化钠溶液: Al 2O 3+2NaOH =2NaAlO 2+H 2OAl 2O 3 + 2OH - =2AlO 2- + H 2O20、氢氧化铝与盐酸: Al(OH)3+3HCl=AlCl 3+3H 2OAl(OH)3 + 3H + =Al 3+ + 3H 2O21、氢氧化铝与氢氧化钠溶液: Al(OH)3+NaOH =NaAlO 2+2H 2OAl(OH)3 + OH - =AlO 2- + 2H 2O22、加热氢氧化铝: 2Al(OH)3 Al 2O 3+3H 2O 23、电解熔融氧化铝: 2Al 2O 3 4Al+3O 2↑ 点燃 △ 电解24、二氧化碳通入偏铝酸钠溶液中: NaAlO 2+CO 2+2H 2O =Al(OH)3↓+NaHCO 3CO 2 + AlO 2- + 2H 2O == Al(OH)3↓+ HCO 3-25、氯化铝与少量氢氧化钠溶液: AlCl 3+3NaOH =Al(OH)3↓+3NaClAl 3+ + 3OH - == Al(OH)3↓26、氯化铝与过量氢氧化钠溶液反应:AlCl 3 + 4NaOH = NaAlO 2+ 3NaCl + 2H 2OAl 3+ + 4OH - == AlO 2- + 2H 2O27、氯化铝与氨水: AlCl 3+3NH 3·H 2O =Al(OH)3↓+3NH 4Cl Al 3+ + 3NH 3.H 2O == Al(OH)3↓+ 3NH 4+28.明矾净水原理: Al 3++3 H 2O Al(OH)3(胶体) + 3H +四、铁及其化合物29、铁在与氯气中燃烧: 2Fe + 3Cl 2 2FeCl 330、铁在氧气中燃烧: 3Fe + 2O 2 点燃Fe 3O 431、铁与盐酸反应: Fe+2HCl =FeCl 2+H 2↑Fe + 2H + = Fe 2+ + H 2↑32、铁与氯化铁溶液: 2FeCl 3+Fe =3FeCl 2Fe + 2Fe 3+ == 3Fe 2+33、铜与氯化铁溶液: 2FeCl 3+Cu =2FeCl 2+CuCl 2Cu + 2Fe 3+ == 2Fe 2+ + Cu 2+34、氯化铁溶液与氢氧化钠溶液: FeCl 3+3NaOH == Fe(OH)3↓+ 3NaCl Fe 3+ + 3OH - == Fe(OH)3↓35、氯化铁溶液与硫氰化钾溶液: FeCl 3 + 3KSCN == Fe(SCN)3 + 3KClFe 3+ + 3SCN - == Fe(SCN)3(血红色)36、氯水(或氯气)与氯化亚铁溶液: Cl 2 +2FeCl 2 =2FeCl 3Cl 2 + 2Fe 2+ == 2Fe 3+ + 2Cl - 37、氧化铁与一氧化碳: Fe 2O 3 + 3CO △2Fe+3CO 238、氢氧化亚铁与氧气反应: 4Fe(OH)2 + O 2 + 2H 2O == 4 Fe(OH)339、氢氧化铁固体加热: 2F e(OH)3△Fe 2O 3 + 3H 2O (Al 、Fe 在冷、浓的H 2SO 4、HNO 3中钝化)五、铜及其化合物40、铜与氧气反应: 2Cu +O 2△2CuO 41、氢氧化铜固体加热: Cu(OH)2 △ CuO + H 2O42、氢氧化铜与硫酸反应: Cu(OH)2+H 2SO 4=CuSO 4+2H 2OCu(OH)2+ 2H + == Cu 2+ +2 H 2O六、硅及其化合物43、二氧化硅与氢氧化钠溶液: SiO 2+2NaOH =Na 2SiO 3+H 2O SiO 2 + 2OH - = SiO 32-+ H 2O44、二氧化硅与氢氟酸: 4HF+SiO 2=SiF 4↑+2H 2O45、工业上生产普通玻璃的反应: SiO 2+Na 2CO 3 高温Na 2SiO 3+CO 2↑点燃七、硫及其化合物46、硫与氧气:S+O2点燃SO247、二氧化硫被氧气氧化:2SO2+O2△2SO348、二氧化硫与水:SO2+H2O H2SO349、稀硫酸与氢氧化钡溶液:Ba(OH)2+ H2SO4= BaSO4↓ + 2H2OBa2+ + 2OH- + 2H+ + SO42- == BaSO4↓+ 2H2O50、浓硫酸与碳共热:2H2SO4(浓)+C △CO2↑+2SO2↑+2H2O(浓H2SO4只作氧化剂)51、浓硫酸与铜共热:Cu+2H2SO4(浓)△CuSO4+SO2↑+2H2O(H2SO4既表现氧化性又表现酸性)52、工业上接触法制硫酸(1)、以黄铁矿为原料:4FeS2+11O2催化剂△2Fe2O3+8SO22SO2+O2催化剂高温高压2SO3SO3+H2O==H2SO4八、氮气及其化合物53、工业氮气与氢气合成氨气:N2+3H2催化剂高温高压2NH354、氮气与氧气在放电条件下反应:N2+O22NO55、一氧化氮与氧气:2NO+O2=2NO256、二氧化氮与水:3NO2+H2O=2HNO3+NO57、实验室制NH3:2NH4Cl(固)+Ca(OH)2(固)△CaCl2+2NH3↑+2H2O58、氨与氯化氢:NH3+HCl=NH4Cl(白烟)59、氨气与水反应:NH3 + H2O NH3·H2O一水合氨电离NH3·H2O NH4+ + OH-(氨水呈碱性)或:NH3 + H2O NH3·H2O NH4+ + OH60、硝酸的见光、受热分解:4HNO3△4NO2↑+O2↑+2H2O61、稀硝酸与铜:3Cu+ 8HNO3=3Cu (NO3)2+2NO↑+4H2O3Cu +2NO3- + 8H+ == 3Cu2++ 2NO↑+ 4H2O 62、浓硝酸与铜:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2OCu +2NO3- + 4H+ == Cu2+ + 2NO2↑+ 2H2O63、浓硝酸与碳共热: 4HNO3(浓)+C △CO2↑+4NO2↑+2H2O64、工业氨的催化氧化制硝酸:(1). 4NH3+5O24NO +6H2O(2)2NO+O2==2NO2(3) 3NO2+H2O=2HNO3+NO九、氯、溴、碘及其化合物65、二氧化锰与浓盐酸共热(实验室制取氯气):4HCl(浓)+MnO 2△MnCl2+Cl2+2H2OMnO2 + 4H++ 2Cl-△Mn2+ + Cl2↑+ 2H2O66、氢气在氯气中燃烧:Cl2 +H22HCl (光照或点燃)67、氯气溶于水:Cl2+H2O HCl +HClOCl2+H2O H++Cl—+HClO68、氯水与碘化钾溶液反应:Cl2 +2KI= 2 KCl+ I2Cl2 + 2I- == 2Cl- + I269、氯气与氢氧化钠溶液反应:Cl2+2NaOH=NaCl+NaClO+H2OCl2 + 2OH- == Cl- + ClO- + H2O70、氯气与石灰乳反应(工业制取漂白粉):2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O71、漂白粉的漂白原理:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO十、原电池和电解池72、由铜、锌、稀硫酸构成的铜锌原电池(写出两极现象)电极反应式:正极:2H+ + 2e- == H2↑(有气泡放出)负极:Zn - 2e- == Zn2+(锌片溶解)电池总反应的化学方程式:Zn +H2SO4=ZnSO4+H2↑离子方程式:Zn + 2H+ == Zn2+ + H 2↑73、钢铁在潮湿的空气中发生电化学腐蚀电极材料:正极:碳,负极:铁正极:O2 + 2H2O + 4e - == 4OH-负极:2Fe - 4e- == 2Fe2+总反应式:2Fe + O2 + 2H2O == 2Fe(OH)2十一、烃74、甲烷与氯气混合光照:(取代反应)CH4 + Cl 2CH3Cl + HCl 等75、乙烯通入溴的四氯化碳溶液中:(加成反应)CH2=CH2 + Br2 CH2BrCH2Br(褪色)76、乙烯与氯化氢在催化剂作用下反应(加成反应):CH2=CH2 +HCl CH3CH2Cl77、乙烯与水在催化剂作用下反应生成乙醇(加成反应):CH2=CH2 + H2O CH3CH2OH78、乙烯在催化剂作用下生成聚乙烯(加聚反应):n CH2=CH279、苯与浓硝酸和浓硫酸的混酸共热(取代反应):+HO-NO2+ H2O十三、食品中的有机化合物80、乙醇的催化氧化(氧化反应):2CH3CH2OH+O2 2CH3COOH+2H2O81、乙醛的催化氧化:2CH3CHO + O 22CH3COOH82、.乙酸与乙醇发生酯化反应:CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O83、淀粉的水解:(C6H10O5)n (淀粉) + nH2O n C6H12O6(葡萄糖)Cu。
2024届高考一轮复习化学课件(人教版):金属及其化合物-铝、镁及其化合物

_M__g_(_O_H__)2_+__C_a_2_+_;
HCl
(3)制备MgCl2:___M__g_(O__H_)_2_+__2_H_C_l_=_=_=_M__g_C_l_2_+__2_H_2_O__、__M_g_C__l2_·_6_H_2_O_=_=_△=_=_=__M_g_C__l2__
_+__6_H__2O__; (4)电解MgCl2:__M_g_C__l2_(_熔__融__)=_电=_=_解=_=__M_g_+__C__l2_↑__。
4. 在 Mg(HCO3)2 溶 液 中 加 入 足 量 的 Ca(OH)2 溶 液 , 最 终 得 到 的 沉 淀 是 MgCO3 和
CaCO3( × )
关键能力
化工流程中的“镁”
1.以混有SiO2的MgCO3为原料制备氧化镁的实验流程如图: 下列说法错误的是
√A.酸浸的离子方程式为 CO23-+
返回
<
>
镁 海水提镁
必备知识
1.从海水中提取镁的流程
主要化学反应为 (1)制石灰乳:_C_a_C_O__3=_高_=_=温_=_=_C__a_O__
_+__C_O_2_↑__、C__a_O_+__H_2_O__=_=_=_C_a_(_O_H__)2;
(2)沉淀Mg2+:M__g_2_+_+__C_a_(_O_H__)2_=_=_=_
2.从海水中提取镁的工艺流程如图所示:
回答下列问题:
(1)海水通过结晶、过滤得到的固体物质主要是__N__a_C_l__。
(2)怎样使MgCl2·6H2O失去结晶水得到MgCl2? 答案 将晶体置于HCl气体氛围中脱水。
(3)上述工艺流程涉及到的基本反应类型有__化__合__反__应__、__分__解__反__应__、__复__分__解__反__应___。
镁铝及其重要化合物的化学方程式(或离子方程式)总结

9.铝在氧气中燃烧
10.铝热反应
11.铝与盐酸的反应:
离子方程式:
12.铝与氢氧化钠的反应
离子方程式:
13.工业制铝:
14.三氧化二铝与盐酸的反应
离子方程式:
15.三氧化二铝与氢氧化钠的反应:
离子方程式:
16.氢氧化铝与盐酸的反应:
离子方程式:
17.氢氧化铝与氢氧化钠的反应:
离子方程式:
18.氢氧化铝受热分解:
19.向硫酸铝中加过量氨水:
离子方程式:
20.向偏铝酸钠溶液中通入少量二氧化碳:
离子方程式:
21.向偏铝酸钠溶液中通入过量二氧化碳:
离子方程式:
22.氯化铝溶液与偏铝酸钠溶液混合:
离子方程式:
23.向氯化铝中加入少量氢氧化钠:
离子方程式:
24.向氯化铝中加入足量氢氧化钠:
离子方程式:
向硫酸氢钠溶液中滴加氢氧化钡至硫酸根恰好沉淀完全化学方程式
镁铝及其重要化合物的化学方程式(或离子方程式)总结
1.镁在氮气中燃烧:
2.镁在二氧化碳中燃烧:
3.镁与沸水反应:
4.氮化镁与水的反应:
5.镁与盐酸的反应:
离子方程式:
6.镁和氯化铵溶液的反应
离子方程式:
7.工业制镁:
8.向碳酸氢镁中加足量氢氧化钙溶液:
25.向偏铝酸钠溶液中加少量稀盐酸:
离子方程式:
26.向偏铝酸钠溶液中加足量稀盐酸:
离子方程式:
27.氢氧化铝的电离:
28.向明矾溶液中加入少量氢氧化钡溶液:
离子方程式:
29.向明矾溶液中加入足量氢氧化钡溶液:
离子方程式:
30.向硫酸氢钠溶液中滴加氢氧化钡至硫酸根恰好沉淀完全
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铝及其化合物的化学方程式和离子方程式
一、铝
1、铝在氧气中燃烧:
2、铝在氯气中燃烧:
3、铝和硫共热:
4、铝与稀硫酸反应:
5、铝和氢氧化钠溶液反应:
6、铝和浓硫酸共热:
7、铝和浓硝酸共热:
8、铝和稀硝酸反应:
8、铝和硝酸银溶液反应:
9、铝与硫酸铜溶液反应:
10、铝和氧化铁高温下反应:
11、铝和四氧化三铁高温共热:
12、铝和氧化铜高温共热:
13、铝和二氧化锰高温共热:
二、氧化铝
1、氧化铝与稀硫酸反应:
2、氧化铝与氢氧化钠溶液反应:
3、电解氧化铝的熔融液:
三、氢氧化铝
1、氢氧化铝与稀硫酸反应:
2、氢氧化铝与氢氧化钠溶液反应:
3、加热氢氧化铝:
四、硫酸铝
1、硫酸铝溶液与氯化钡溶液混合:
2、硫酸铝的水溶液呈酸性:
3、硫酸铝溶液中加入少量的氢氧化钠溶液:
4、向硫酸铝溶液中加足量的氢氧化钠溶液:
5、向硫酸铝溶液中加入少量的氢氧化钡溶液:
6、向硫酸铝溶液中加入足量的氢氧化钡溶液:
7、向明矾溶液中加入少量的氢氧化钡溶液:
8、向明矾溶液中加入足量的氢氧化钡溶液:
9、向硫酸铝溶液中加入氨水:
10、向硫酸铝溶液中加入碳酸钠溶液:
11、向硫酸铝溶液中加入碳酸氢钠溶液:
12、向硫酸铝溶液中加入硫化钠溶液:
13、向硫酸铝溶液中加入硫氢化钠溶液:
14、向硫酸铝溶液中加入硅酸钠溶液:
15、向硫酸铝溶液中加入偏铝酸钠溶液:
五、偏铝酸钠
1、偏铝酸钠溶液呈碱性:
2、偏铝酸钠溶液滴入少量盐酸:
3、向偏铝酸钠溶液加入足量盐酸:
4、向偏铝酸钠溶液通入少量二氧化碳气体:
5、向偏铝酸钠溶液通入足量二氧化碳气体:
6、向偏铝酸钠溶液中加入硫酸铝溶液:
7、向偏铝酸钠溶液中加入氯化铵溶液:
8、向偏铝酸钠溶液中加入氯化铁溶液:
铝及其化合物的化学方程式和离子方程式
一、铝
1、铝在氧气中燃烧:4Al+3O22Al2O3
2、铝在氯气中燃烧:2Al+3Cl22AlCl3
3、铝和硫共热:2Al+3S Al2S3
4、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑
2Al+6H+2Al3++3H2↑
5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑
2Al+2OH-+2H2O2AlO2-+3H2↑
6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O
7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2O
Al+6H++3NO3-Al3++3NO2↑+3H2O
8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2O
Al+4H++NO3-Al3++NO ↑+2H2O
8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3Ag
Al+3Ag+Al3++3Ag
9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu
2Al+3Cu2+2Al3++3Cu
10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe
11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe
12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu
13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn
二、氧化铝
1、氧化铝与稀硫酸反应:Al2O3+3H2SO4Al2(SO4)3+3H2O Al2O3+6H+2Al3++3H2O
2、氧化铝与氢氧化钠溶液反应:Al O+2NaOH2NaAlO+H O
3、电解氧化铝的熔融液:2Al 2O
34Al +3O 2 ↑
三、氢氧化铝
1、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4
Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +
Al 3++3H 2O
2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOH NaAlO 2+2H 2O Al(OH)3 +OH -
AlO 2-
+2H 2O
3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O
四、硫酸铝
1、硫酸铝溶液与氯化钡溶液混合:Al 2(SO 4)3 +3BaCl 2
2AlCl 3+3BaSO 4 ↓
SO 42-
+Ba 2
+BaSO 4 ↓
2、硫酸铝的水溶液呈酸性:Al 2(SO 4)3+6H 2O 2Al(OH)3 +3H 2SO 4 Al 3++3H 2O Al(OH)3 +3H +
3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al 2(SO 4)3 +6NaOH
3Na 2SO 4+2Al(OH)3 ↓
Al 3+
+3OH
-
Al(OH)3 ↓
4、向硫酸铝溶液中加足量的氢氧化钠溶液: Al 2(SO 4)3 +8NaOH 2NaAlO 2+3Na 2SO 4+4H 2O
Al 3+
+4OH
-
AlO 2-
+2H 2O
5、向硫酸铝溶液中加入少量的氢氧化钡溶液: Al 2(SO 4)3 +3Ba(OH)2
2Al(OH)3 ↓+3BaSO 4 ↓
2Al 3+
+3SO 42-
+3Ba 2+
+6OH
-
2Al(OH)3 ↓+3BaSO 4 ↓
6、向硫酸铝溶液中加入足量的氢氧化钡溶液: Al 2(SO 4)3 +4Ba(OH)2
Ba(AlO 2)2 +3BaSO 4 ↓+4H 2O
2Al 3+
+3SO 42-
+3Ba 2+
+8OH
-
2AlO 2-
+3BaSO 4 ↓+4H 2O
7、向明矾溶液中加入少量的氢氧化钡溶液:
3Ba(OH)2 +2KAl(SO 4)2
2Al(OH)3 ↓+3BaSO 4 ↓+K 2SO 4
3Ba 2+
+6OH -
+2Al 3+
+3SO 42
-
3BaSO 4 ↓+2Al(OH)3 ↓
8、向明矾溶液中加入足量的氢氧化钡溶液: KAl(SO ) +2Ba(OH)
KAlO +2BaSO ↓+2H O
冰晶石
电解
9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4
Al3++3NH3·H2O Al(OH)3↓+3NH4+
10、向硫酸铝溶液中加入碳酸钠溶液:
Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑
2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑
11、向硫酸铝溶液中加入碳酸氢钠溶液:
Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑
Al3++3HCO3-Al(OH)3↓+3CO2↑
12、向硫酸铝溶液中加入硫化钠溶液:
Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑
2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑
13、向硫酸铝溶液中加入硫氢化钠溶液:
Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑
Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑
14、向硫酸铝溶液中加入硅酸钠溶液:
Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓
2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓
15、向硫酸铝溶液中加入偏铝酸钠溶液:
Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓
Al3++AlO2-+6H2O4Al(OH)3↓
五、偏铝酸钠
1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOH
AlO2-+2H2O Al(OH)3+OH-
2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaCl
AlO2-+H++H2O Al(OH)3↓
3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2O
AlO2-+4H+Al3++2H2O
4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO+CO+3H O2Al(OH)↓+Na CO
5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3
AlO2-+CO2+2H2O Al(OH)3+HCO3-
6、向偏铝酸钠溶液中加入硫酸铝溶液:
Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓
Al3++AlO2-+6H2O4Al(OH)3↓
7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑
AlO2-+NH4++H2O Al(OH)3↓+NH3↑
8、向偏铝酸钠溶液中加入氯化铁溶液:
3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl
3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓。
