高考化学利用曲线判断溶液中离子浓度大小专题训练
高中化学离子浓度大小比较练习题(附答案)
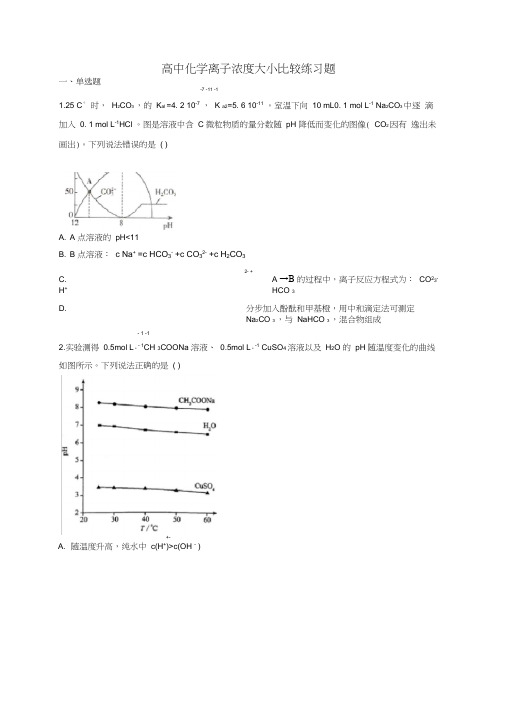
高中化学离子浓度大小比较练习题一、单选题-7 -11 -11.25 C° 时,H2CO3 ,的K al =4. 2 10-7,K a2=5. 6 10-11。
室温下向10 mL0. 1 mol L-1 Na2CO3 中逐滴加入0. 1 mol L-1HCl 。
图是溶液中含 C 微粒物质的量分数随pH 降低而变化的图像( CO2 因有逸出未画出)。
下列说法错误的是( )A. A 点溶液的pH<11B. B 点溶液:c Na+=c HCO3-+c CO32-+c H2CO32- +C. A →B 的过程中,离子反应方程式为:CO23-H+HCO 3D. 分步加入酚酞和甲基橙,用中和滴定法可测定Na2CO 3 ,与NaHCO 3 ,混合物组成- 1 -12.实验测得0.5mol L·- 1CH 3COONa 溶液、0.5mol L·-1 CuSO4 溶液以及H2O 的pH 随温度变化的曲线如图所示。
下列说法正确的是( )+-A. 随温度升高,纯水中c(H+)>c(OH - )c R( COOH )c(RCOOH)+c(RCOO -)CH 3CH 2COOH)溶液中 δRCOOH 与 pH 的关系如图所示。
下列说法正确的是 ( )A. 图中 M 、N 两点对应溶液中的 c(OH )比较:前者 >后者B. 丙酸的电离常数 K= 10 4.88C. 等浓度的 HCOONa 和CH 3CH 2 COONa 两种榕液的 pH 比较:前者 > 后者D. 将 0. 1 mol/L 的 HCOOH 溶液与 0. 1 mol/L 的 HCOO-Na 溶 液 等 体 积 混 合 , 所 得 溶 液中 :c Na >c H COOH >c H - COOH - >cc HO +4. 常温下 ,Ksp(CaF 2)=4×10-9,Ksp (CaSO 4)=9.1×10-6。
2021年高考化学专题练习:水溶液中离子浓度比较

2021年高考化学专题练习:水溶液中离子浓度比较 1.室温下,用0.1 mol·L-1的盐酸分别滴定50 mL的三种碱(AOH、BOH和DOH)溶液,滴定曲线如图所示,下列判断错误的是( )
A.从反应开始至恰好完全反应,水电离出的c(H+)始终增大 B.滴定至P点时,溶液中:c(B+)>c(Cl-)>c(BOH)>c(OH-)>c(H+) C.pH=7时,三种溶液中c(A+)=c(B+)=c(D+) D.当盐酸体积为50 mL时,将三种溶液混合后:c(H+)=c(AOH)+c(BOH)+c(DOH)+c(OH-)
2.在常温下,向10 mL浓度均为0.1 mol·L-1的NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1的盐酸,溶液pH随盐酸加入体积的变化如图所示。下列说法正确的是( )
A.在a点的溶液中:c(Na+)>c(CO2-3)>c(OH-)>c(Cl-)>c(H+) B.在b点的溶液中:2n(CO2-3)+n(HCO-3)<0.001 mol C.在c点的溶液pH<7,是因为此时HCO-3的电离能力大于其水解能力 D.若将0.1 mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:c(Na+)=c(CH3COO-)
3.(2019·大庆第二次质检)25 ℃时,有c(HA)+c(A-)=0.1 mol·L-1的一组HA、KA混合溶液,溶液中c(HA)、c(A-)与pH的关系如图所示。下列叙述不正确的是( )
A.pH=5.75的溶液中:c(K+)>c(A-)>c(HA)>c(H+)>c(OH-) B.欲得W点所示溶液,起始所加溶液应符合c(HA)+c(A-)=0.1 mol·L-1且c(KA)>c(HA)
C.pH=3.75的溶液中:c(K+)+c(H+)-c(OH-)+c(HA)=0.1 mol·L-1 D.若A-的水解平衡常数为Kh,则lg Kh=-9.25
4.(2019·凉山模拟)常温下向25 mL 0.1 mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1的一元酸HX溶液,pH的变化曲线如图所示(溶液混合时体积的变化忽略不计)。下列说法正确的是( ) A.在b点,离子浓度大小为c(OH-)>c(H+)>c(Na+)>c(X-) B.d点的溶液中2c(H+)+c(HX)=c(X-)+2c(OH-) C.HX是弱酸,常温下其电离常数Ka=2.5×10-6 D.d点的溶液中有c(HX)-2c(H+)=2c(OH-)+c(X-)
高二化学盐溶液中离子浓度大小比较练习题(附答案)

高二化学盐溶液中离子浓度大小比较练习题一、单选题1.下列说法正确的是( )A.常温下,pH=3的HX(一元酸)溶液与pH=11的YOH(一元碱)溶液等体积混合,所得溶液的pH一定等于7B.在相同温度下,浓度均为0.1mol·L-1的(NH4)2Fe(SO4)2和(NH4)2SO4溶液中,c(NH4+)相同C.在pH<7的CH3COOH和CH3COONa的混合液中,c(Na+)>c(CH3COO-)>c(H+)>c(OH-)D.将CH3COOH和NaOH混合后,离子浓度有可能为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)2.今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份溶液进行如下实验:(1)第一份加入AgNO3溶液有沉淀产生(2)第二份加足量NaOH溶液加热后,收集到无色刺激性气味气体(3)第三份加足量BaCl2溶液后,得白色沉淀,经足量盐酸洗涤后,沉淀部分溶解。
根据上述实验,以下推测正确的是( )A.K+一定存在B.CO32-一定存在C.Cl-一定存在D.Ba2+一定不存在,Mg2+可能存在3.水的电离平衡曲线如图所示,下列说法正确的是( )A.图中五点K W间的关系:B=C=A=D=EB.若从A点到D点,可采用:温度不变在水中加入少量的酸C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体D.若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显酸性4.下列叙述正确的是( )A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色D.向0.1 mol/L的氨水中加入少量硫酸铵固体,溶液PH值增大5.已知0.1mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )A.加少量烧碱溶液B.降低温度C.加少量冰醋酸D.加水6.已知①氢硫酸是具有较强还原性的二元弱酸,②CuSO4+H2S=CuS↓+H2SO4。
高中化学【常考“离子浓度与曲线关系图”分类集训】

常考“离子浓度与曲线关系图”分类集训每小题有一个或两个选项符合题意。
1. 298 K 时,将0.1 mol·L-1的两种钠盐NaX 、NaY 溶液加水稀释,溶液的pH 与稀释倍数的对数lg VV 0的关系如图所示。
下列说法不正确的是( )A .酸性:HY >HXB .298 K 时,K (HX )K (HY )=1100C .lg V V 0=2时,[HX ]+[X -]=[HY ]+[Y -]D .相同浓度时,NaX 和NaY 两溶液中离子总浓度相等 答案 D解析 由图像可知,同浓度的NaX 和NaY 的pH NaX 大,说明X -在水溶液中的水解能力强于Y -,则酸性:HY>HX ,故A 正确;由图像可知,同浓度的NaX 和NaY 的pH 相差1,可知K (HX )K (HY )=1100,故B 正确;根据物料守恒可知,lg V V 0=2时,[HX ]+[X -]=[HY ]+[Y -],故C 正确;根据电荷守恒可知,浓度相等的两溶液中,阴、阳离子总浓度=2[Na +]+2[H +],由于水解程度:NaX>NaY ,则两溶液中[H +]不同,故两溶液中离子总浓度不相等,故D 错误。
2.常温下10 mL 浓度均为0.1 mol·L-1的HX 和HY 两种一元酸溶液加水稀释过程中的pH 随溶液体积变化曲线如图所示。
则下列说法不正确的是( )A.电离常数:K(HX)<K(HY)B.浓度均为0.1 mol·L-1的HX和HY的混合溶液中:[X-]+[HX]=[Y-]+[HY]C.浓度均为0.1 mol·L-1的NaX和NaY的混合溶液中:[Na+]>[Y-]>[X-]>[OH-]>[H+] D.a点水的电离度大于b点水的电离度答案 D解析浓度均为0.1 mol·L-1的HX和HY两种一元酸溶液,HY溶液的pH=2,HX溶液的pH=3,说明HY溶液中氢离子浓度大于HX溶液中的氢离子浓度,则HY的酸性强于HX,故电离常数:K(HX)<K(HY),A正确;根据物料守恒可知浓度均为0.1 mol·L-1的HX和HY 的混合溶液中:[X-]+[HX]=[Y-]+[HY],B正确;由于HY的酸性强于HX,则NaX的水解程度大,所以溶液中[Y-]>[X-],则溶液中离子浓度大小关系为:[Na+]>[Y-]>[X-]>[OH-]>[H+],C正确;a、b两点溶液中氢离子浓度相同,对水电离的抑制作用相同,故两点水的电离程度相同,D错误。
高考化学选择题专项训练---离子浓度大小比较和三大守恒式(含答案和解析)
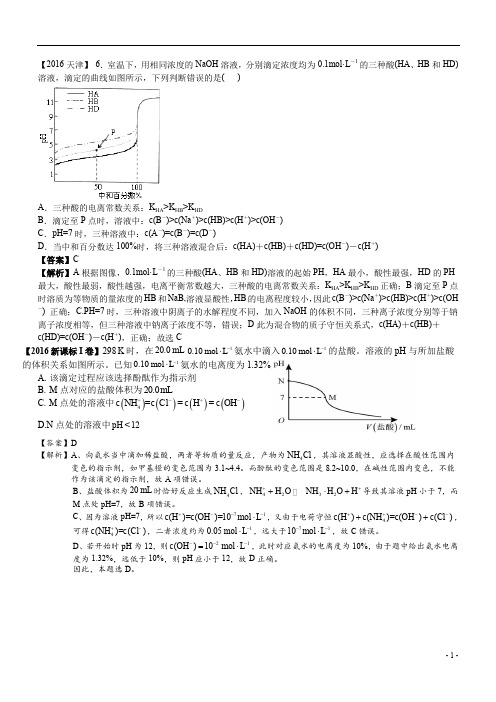
【2016天津】 6.室温下,用相同浓度的NaOH 溶液,分别滴定浓度均为0.1mol·L -1的三种酸(HA 、HB 和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )A .三种酸的电离常数关系:K HA >K HB >K HDB .滴定至P 点时,溶液中:c(B -)>c(Na +)>c(HB)>c(H +)>c(OH -)C .pH=7时,三种溶液中:c(A -)=c(B -)=c(D -)D .当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH -)-c(H +) 【答案】C【解析】A 根据图像,0.1mol·L -1的三种酸(HA 、HB 和HD)溶液的起始PH ,HA 最小,酸性最强,HD 的PH 最大,酸性最弱,酸性越强,电离平衡常数越大,三种酸的电离常数关系:K HA >K HB >K HD 正确;B 滴定至P 点时溶质为等物质的量浓度的HB 和NaB,溶液显酸性,HB 的电离程度较小,因此c(B -)>c(Na +)>c(HB)>c(H +)>c(OH-) 正确;C.PH=7时,三种溶液中阴离子的水解程度不同,加入NaOH 的体积不同,三种离子浓度分别等于钠离子浓度相等,但三种溶液中钠离子浓度不等,错误;D 此为混合物的质子守恒关系式,c(HA)+c(HB)+c(HD)=c(OH -)-c(H +),正确;故选C【2016新课标I 卷】298K 时,在20.0mL 10.10mol L -⋅氨水中滴入10.10mol L -⋅的盐酸。
溶液的pH 与所加盐酸的体积关系如图所示。
已知10.10mol L -⋅氨水的电离度为1.32%,下列有关叙述正确的是A. 该滴定过程应该选择酚酞作为指示剂B. M 点对应的盐酸体积为20.0mLC. M 点处的溶液中()()()()++4NH Cl =H =OH c =c c c --D.N 点处的溶液中pH <12【答案】D【解析】A 、向氨水当中滴加稀盐酸,两者等物质的量反应,产物为4NH Cl ,其溶液显酸性,应选择在酸性范围内变色的指示剂,如甲基橙的变色范围为3.1~4.4。
高中化学高考总复习 8.29 溶液中“粒子”浓度关系

题组强化训练·形成关键能力 题组一 单一溶液中的粒子浓度关系 1.HA为酸性略强于醋酸的一元弱酸,在0.1 mol·L-1NaA溶液中, 离子浓度关系正确的是( ) A.c(Na+)>c(A-)>c(H+)>c(OH-) B.c(Na+)>c(OH-)>c(A-)>c(H+) C.c(Na+)+c(OH-)=c(A-)+c(H+) D.c(Na+)+c(H+)=c(A-)+c(OH-)
答案:A
答案:D
题组三 “多曲线”图像中微粒浓度的分析与比较 5.25 ℃时,用0.25 mol·L-1 NaOH溶液分别滴定同浓度的三种稀酸 溶液,滴定曲线如图所示。下列判断不正确的是( ) A.同浓度的稀酸中:c(A-)>c(B-)>c(D-) B.滴定至P点时,溶液中:c(B-)>c(HB) C.pH=7时,三种溶液中:c(A-)>c(B-)>c(D-) D.当中和百分数达到100%时,将三种溶液混合后:c(HA)+c(HB) +c(HD)=c(OH-)-2c(H+)
答案:A
解析:由电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),因c(CH3COO -)>c(Na+),则c(H+)>c(OH-);由元素质量守恒:c(CH3COOH)+c(CH3COO-)= 0.2 mol·L - 1 , 因 c(CH3COO - ) > c(Na + ) = 0.1 mol·L - 1 , 则 c(CH3COO - ) > c(CH3COOH)。
4.室温下,取20 mL 0.1 mol·L-1某二元酸H2A,滴加0.2 mol·L-1 NaOH溶液。已知:H2A===H++HA-,HA-⇌H++A2-。
下列说法不正确的是( ) A.0.1 mol·L-1 H2A溶液中有c(H+)-c(OH-)-c(A2-)=0.1 mol·L-1 B.当滴加至中性时 ,溶液中c(Na+)=c(HA-)+2c(A2-),用去 NaOH溶液的体积小于10 mL C.当用去NaOH溶液体积10 mL时,溶液的pH<7,此时溶液中有 c(A2-)=c(H+)-c(OH-) D.当用去NaOH溶液体积20 mL时,此时溶液中有c(Na+)=2c(HA-) +2c(A2-)
2019届高考化学专题17离子浓度大小比较

专题17离子浓度大小比较2017年高考题1. 【2017高考全国卷Ⅰ卷13题】常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。
下列叙述错误的是( )A.K a2(H2X)的数量级为10-6B.曲线N表示pH与lg的变化关系C.NaHX溶液中c(H+)>c(OH-)D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)【答案】D【解析】本题考查弱酸电离平衡和溶液中离子浓度大小比较等。
(1)图象纵轴表示pH,横轴表示溶液中两种粒子浓度比的对数;(2)酸性越强,c()越大,pH越小;(3)横坐标为0.0时两种粒子浓度之比为1,而电离平衡常数只与温度有关,与浓度无关。
选择该点计算电离常数。
H2X的电离方程式为H2X+H,H+。
当==1时,即横坐标为0.0时,K a1=c(),K a2=c'(),因为K a1>K a2,故c(H+)>c'(H+),即pH<pH',结合图象知,曲线N代表第一步电离,曲线M代表第二步电离。
K a2≈10-5.4,A项正确;由上述分析知,B项正确;选择曲线M分析,当NaHX、Na2X浓度相等时,溶液pH约为 5.4,溶液呈酸性,所以,NaHX溶液中c(H+)>c(OH-),C项正确;电荷守恒式为c(N)+c()=c(O )+c(H)+2c(),中性溶液中存在c()=c(O),故有c(N)=c(H)+2c(),假设c(HX-)=c(X2-)或c(HX-)>c(X2-)(见C项分析),则溶液一定呈酸性,故中性溶液中c(HX-)<c(X2-),D项错误。
【名师点晴】本题受二元弱酸电离,以第一步为主,第二步电离常数小于第一步等思维定势的影响,误认为c(H)>c(),会认为D项正确,导致错选,其错选本质原因是忽视了“混合溶液呈中性”条件的限制。
高三年级下学期化学 题型分析3:离子浓度大小判断图像及高考真题(滴定曲线)课程设计

水溶液中的离子平衡:离子浓度大小判断图像及高考真题(滴定曲线)学习导航1.掌握离子浓度大小判断图像规律。
2.突破滴定曲线类图像的解题思路和方法教学过程【导入】同学们,咱们先来找找有关溶液中离子浓度滴定曲线图像的规律?【典例】【答案】C【详解】C.【点晴】本题考查了酸碱混合时的定性判断、弱电解质的电离平衡、离子浓度大小比较等。
在判断溶液中微粒浓度大小的比较时,要重点从三个守恒关系出发,分析思考。
(1)两个理论依据:①弱电解质电离理论:电离微粒的浓度大于电离生成微粒的浓度。
例如,H2CO3溶液中:c(H2CO3)>c(HCO3-)①c(CO32-)(多元弱酸第一步电离程度远远大于第二步电离)。
①水解理论:水解离子的浓度大于水解生成微粒的浓度。
例如,Na2CO3溶液中:c(CO32-)>c(HCO3-)①c(H2CO3)(多元弱酸根离子的水解以第一步为主)。
(2)三个守恒关系:①电荷守恒:电荷守恒是指溶液必须保持电中性,即溶液中所有阳离子的电荷总浓度等于所有阴离子的电荷总浓度。
例如,NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)。
①物料守恒:物料守恒也就是原子守恒,变化前后某种元素的原子个数守恒。
例如,0.1 mol·L-1NaHCO3溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol·L-1。
①质子守恒:由水电离出的c(H+)等于由水电离出的c(OH-),在碱性盐溶液中OH-守恒,在酸性盐溶液中H+守恒。
例如,纯碱溶液中c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)。
质子守恒的关系式也可以由电荷守恒式与物料守恒式推导得到。
解答本题时,能够从图像的起始点得出三种酸的相对强弱是解题的关键。
【答案】C【详解】分析:本题应该从题目所给的图入手,寻找特定数据判断题目中的沉淀滴定的具体过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
利用曲线判断溶液中离子浓度大小
题组一浙江卷试题集训
1.(2018·浙江11月选考,23)常温下,分别取浓度不同、体积均为20.00 mL的3种HCl溶液,分别滴入浓度为1.000 mol·L-1、0.100 0 mol·L-1和0.010 00 mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00 mL前后pH出现突跃。
下列说法不正确的是()
A.3种HCl溶液的c(HCl):最大的是最小的100倍
B.曲线a、b、c对应的c(NaOH):a>b>c
C.当V(NaOH)=20.00 mL时,3个体系中均满足:c(Na+)=c(Cl-)
D.当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
2.(2018·浙江4月选考,23)在常温下,向10 mL浓度均为0.1 mol·L-1的NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1盐酸,溶液pH随盐酸加入体积的变化如图所示。
下列说法正确的是()
A.在a点的溶液中:c(Na+)>c(CO2-3)>c(Cl-)>c(OH-)>c(H+)
B.在b点的溶液中:2n(CO2-3)+n(HCO-3)<0.001 mol
C.在c点的溶液pH<7,是因为此时HCO-3的电离能力大于其水解能力
D.若将0.1 mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:c(Na+) =c(CH3COO-)
3.(2017·浙江11月选考,23)25 ℃时,在“H2A—HA-—A2-”的水溶液体系中,H2A、HA-和A2-三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。
下列说法正确的是()
A.在含H2A、HA-和A2-的溶液中,加入少量NaOH固体,α(HA-)一定增大
B.将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-) C.NaHA溶液中,HA-的水解能力小于HA-的电离能力
D.在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)和α(HA-)一定相等
4.(2017·浙江4月选考,23)25 ℃时,在含CH3COOH和CH3COO-的溶液中,CH3COOH、CH3COO-二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。
下列说法不正确的是()
A.在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH)
B.在pH=7的溶液中,α(CH3COOH)=0,α(CH3COO-)=1.0
C.在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+)
D.在pH=4.76的溶液中加盐酸,α(CH3COOH)与α(CH3COO-)之和保持不变
题组二 新课标卷试题集训
5.(2017·全国卷Ⅰ,13)常温下将NaOH 溶液滴加到己二酸(H 2X)溶液中,混合溶液的pH 与离子浓度变化的关系如图所示。
下列叙述错误的是( )
A .K a2(H 2X)的数量级为10-
6
B .曲线N 表示pH 与lg c (HX -)
c (H 2X )的变化关系
C .NaHX 溶液中c (H +
)>c (OH -)
D .当混合溶液呈中性时,c (Na +
)>c (HX -
)>c (X 2-
)>c (OH -
)=c (H +
) 6.(2017·全国卷Ⅱ,12)改变0.1 mol·L
-1
二元弱酸H 2A 溶液的pH ,溶液中的H 2A 、HA -
、
A 2-
的物质的量分数δ(X)随pH 的变化如图所示[已知δ(X)=c (X )c (H 2A )+c (HA -)+c (A 2-)
]。
下列叙述错误的是( ) A .pH =1.2时,c (H 2A)=c (HA -
) B .lg[K 2(H 2A)]=-4.2
C .pH =2.7时,c (HA -
)>c (H 2A)=c (A 2-
) D .pH =4.2时,c (HA -
)=c (A 2-
)=c (H +
) 题组三 浙江模拟预测
7.(2019·浙江省名校新高考研究联盟联考)常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 某未知浓度的CH3COOH溶液,滴定曲线如图所示。
已知在点③处恰好中和。
下列说法不正确的是()
A.点①②③三处溶液中水的电离程度依次增大
B.该温度时CH3COOH的电离平衡常数约为1.8×10-5
C.点①③处溶液中均有c(H+)=c(CH3COOH)+c(OH-)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
8.(2019·浙江省稽阳高三联考)常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成两者溶液的体积之和),下列说法正确的是()
A.点②所示溶液中:c(K+)+c(H+)=c(HC2O-4)+c(C2O2-4)+c(OH-)
B.点③所示溶液中:c(K+)>c(HC2O-4)>c(H2C2O4)>c(C2O2-4)
C.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O-4)+c(C2O2-4)=0.10 mol·L-1
D.点⑤所示溶液中:c(OH-)=c(H+)+c(HC2O-4)+c(C2O2-4)
9.(2019·浙江省学军中学高三4月选考模拟冲刺)常温下,向20 mL 0.2 mol·L-1H2A 溶液中滴加0.2 mol·L-1NaOH 溶液,滴加过程中有关微粒的物质的量变化绘制在下图中。
下列说法正确的是()
A.当V(NaOH)=10 mL 时,溶液中粒子浓度大小关系为:c(Na+)>c(H2A)>c(HA-)>c(H+)>c(OH-)
B.当V(NaOH)=20 mL 时,溶液中粒子浓度大小关系为:c(Na+)>c(H+)>c(HA-)>c(A2-)>c(H2A)
C.当V(NaOH)=30 mL 时,溶液中存在以下关系:c(A2-)+2c(OH-)=c(HA-)+c(H+)+3c(H2A)
D.当V(NaOH)=40 mL 时,溶液中存在以下关系:c(Na+)=2[c(A2-)+c(HA-)+c(H2A)]
10.(2019·宁波市北仑中学高三模拟训练)在常温下,在一组c(H2A)+c(HA-)+c(A2-)=0.10 mol·L-1的H2A和NaOH混合溶液中,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。
下列说法正确的是()
A.c(Na+)=0.10 mol·L-1的溶液中:c(H+)-c(A2-)=c(OH-)-c(H2A)
B.NaHA溶液中,水的电离程度比纯水大
C.c(HA-)=c(A2-)的溶液是由等物质的量的NaHA和Na2A混合而成
D.pH=2.5的溶液中:c(H2A)+c(A2-)>c(HA-)。
