药 品 不 良 反 应 事 件 报 告 表
PSUR报告(药品定期安全性报告)模板

某中药注射液定期安全性报告(PSUR模板)一、药品不良反应报告总体概况1、报告总数2009年到2011年我公司收到我省药品不良反应监测中心转发国家药品不良反应监测中心收集、记录的“某中药注射液个例药品不良反应病例”1458例,依此整理形成《药品不良反应/事件报告表》1458份。
2、每年报告数图1-1 2009-2011 年某中药注射液药品不良反应/事件报告数3、报告表类型2009-2011年根据我省药品不良反应监测中心转发国家药品不良反应监测中心收集、记录的“某中药注射液个例药品不良反应病例”,我省药品不良反应监测中心收到关于我公司某中药注射液不良反应/事件报告中,没有群体不良反应报告及死亡报告,一般药品不良反应报告979份,占67.1%;新的一般不良反应报告403份,占27.6%;严重药品不良反应41份,占 2.8% ;新的严重不良反应报告35份,占2.4%。
图1-2 2009-2012年某中药注射液 药品不良反应/事件报告类型统计二、涉及患者信息1、年龄分布2009-2011年不良反应/事件某中药注射液报告中,小于1岁的案例为0,1-4岁的5例,占0.3%; 5-14岁的11例,占 0.8%;15-30 岁的 119 例,占 0.8%; 31-45 岁的 305 例,占 21% 46-60岁的453例,占31% 61岁以上的555例,占38% 从分 布情况看,45-60岁及61岁以上的中老年人比例很高,提示中 老年人更易出现严重药品不良反应/事件。
3.5%■—般扭寺 ■严重银告 ■新的一般禾告图2-1 2009-2012年细某中药注射液药品不良反应/事件患者年龄分布2、性别2009-2011年某中药注射液不良反应/事件报告中,具体分布如下:某中药注射液男性783例,占53.7%;女性675例,占46.3%;男女比是1.16。
图2-2 2009-2011 年某中药注射液药品不良反应/事件患者性别分布3、体重依据2009-2011年不良反应/事件报告,我公司某中药注射液给药方式均是按说明书用量给药,并非是按体表面积差异给药,其中个别个体给药量比说明书要求量多,这些个体年龄分布无规律,仅属于医生根据实际情况进行判断的。
我院2011年药品不良反应报告分析

发生 明显大 于男性 。年龄构成 比显示 , 不 同年龄段都有发生不 良反应的可能 , 其 中
≤1 9岁 的 未 成 年 人 及 1 >6 0岁 的 老 年 人 药
6 5 4 3 0 0云南建水县 中医院药剂科
的老年人 明显 高 于其 他 人 群 , A D R患 者
d o i : 1 0 . 3 9 6 9 / j . i s s n .1 0 0 7 —6 1 4 x 2 0 1 3 .
cH t NE sE c OM M UNt T Y D0cToRS
社 用药指导
我院 2 0 1 1 年药 品不 良反应报告分析
杜 林 波
A D R报 告 中, 女 3 3例 ( 6 6 %) , 男 1 7例 ( 3 4 %) , 男女 之 比 1 : 1 . 9 4 ; 患者 年龄 3~ 8 5岁 , 其中 ≤1 9岁 的未成 年人及 > t6 0岁
良反 应 报 告 进 行 统 计 分 析 , 为临床合理 用
药提供 可 靠依 据。方 法 : 对2 0 1 1年 收 集
5 O例 AD R报 告 进 行 统 计 分 析 。 结 果 : 5 0 例A D R报 告 中 , 女性 患者明显 高于男性 , 男女 之 比 1 : 1 . 9 4; ≤1 9 岁 的 未成 年 人 及
生物类 药物 , 加 强 中 药注射 剂 的 质 量监 控, 积 极 开 展 药 品 不 良反 应 的 监 测 上 报 工
作, 避 免 减 少 临 床 药 品 不 良反 应 的发 生 。 关 键 词 药 品 不 良反 应 统计 分 析
药 品不 良反应 是 指合格 药 品在 正常 用法用量下 , 在预 防 、 诊断 、 治疗疾 病时所 出现的 、 与用药 目的无关 的或 意外的有 害 反应 。药 品不 良反应监 测是 加强 药 品管
医疗(安全)不良事件登记表

XX县人民医院医疗(安全)不良事件登记表7.事件发生场所:急诊门诊病区医技部门行政后勤部门其它: C.不良事件类别一般事件重大事件病人辨识事件:诊疗过程中的病人或身体部位错误(不包括手术病人或部位错误)。
检验病理放射等技术诊查中,丢失或弄错标本,拍错部位,配错血;漏报、错报、迟报结果等引起的不良事件手术事件:手术治疗中开错部位、摘错器官、遗留异物在病员体内的事件。
麻醉事件:麻醉方式、部位、药品剂量错误,麻醉过程中不认真观察病情变化。
医疗处置事件:诊断、治疗、技术操作不当等引起的不良事件。
烧烫伤事件:治疗或手术后发生烧烫伤。
呼吸机事件:呼吸机使用相关不良事件。
管路事件:如管路滑脱、自拔事件。
输血事件:医嘱开立、备血、传送及输血不当引起的相关不良事件。
针扎事件:包括针刺、锐器刺伤等不良事件;药物事件:医嘱、处方、调剂、给药、药物不良反应、药物过敏等相关的不良事件。
报告人:医师技师护士其他报告人签名:联系地址: 联系电话:1、医疗不良事件(medical adverse event)是指因诊疗活动而非疾病本身造成的损害。
包括诊断治疗的失误及其相关的设施、设备引起的损害等。
不良事件包括可预防的和不可预防的两种。
2、潜在不良事件(potential adverse event)是指由于不经意或是及时的介入行为,而使其原本可能导致的不良事件或情况并未真正发生在病人身上。
3、无伤害:事件发生在病人身上,但是没有造成任何的伤害。
4、轻度伤害:事件虽然造成伤害,但不需或仅需稍微的处理或观察;如捏伤、擦伤、皮肤小撕裂伤。
5、中度伤害:需额外的探视、评估或观察,但仅需要简单的处理;如缝合、夹板固定、冰敷、抽血检查、包扎或止血治疗。
6、重度伤害:除需要额外的探视、评估或观察外,还需住院、延长住院时间或会诊等特别处理。
药品器械化妆品不 良 反 应 事 件 报 告 表参考

附件2:
可疑医疗器械不良事件报告表
报告日期:年月日编码:
报告来源:生产企业经营企业使用单位单位名称:
联系地址:邮编:联系电话:
A.患者资料
1.姓名:
2.年龄:
3.性别男女
4.预期治疗疾病或作用:
B.不良事件情况
5.事件主要表现:
6.事件发生日期:年月日
7.发现或者知悉时间:年月日
8.医疗器械实际使用场所:
关联性评价
报告人评价: 肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告单位评价: 肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告人信息
联系电话:
职业:医生□药师□护士□其他□
电子邮箱:
签名:
报告单位信息
单位名称:
联系人:
电话:
报告日期:年 月 日
生产企业请
填写信息来源
医疗机构□经营企业□个人□文献报道□上市后研究□其他□
2020年9月20日
不良反应
发生日期:
2020年9月25日
停用日期:
2020年9月27日
不良反应/事件过程描述(包括症状体征等)及处理情况:(可多选)
过程描述:
1潜伏期(可疑化妆品□开始□停止使用时间~出现临床表现的时间差):7天(□小时天□月)
2自觉症状:瘙痒灼热感□疼痛□干燥□紧绷感其他
3皮损部位:面部(□额部□颊部□眼周□鼻部□口唇□口周□颏部)□头皮□外耳廓□颈部□全身□胸部□腹部□背部□腋窝□腹股沟□上肢□下肢□手部□甲周□甲板□无 □其他
相关重要信息:吸烟史□饮酒史□妊娠期□肝病史□肾病史□过敏史□其他□
药品
批准文号
商品名称
我院2010年第三季度药品不良反应报告及分析

的药 品种 类 、 药途 径 、 ቤተ መጻሕፍቲ ባይዱR涉及 器 官或 系 统及 临床 表现 等 给 A 方 面 进行 统计 、 析 。 分
2 结 果 21A . DR 患 者 的 性 别 与 年 龄 分 布
1 4巾 国医 药导 报 3 CHIA ME C E L N DIALH RA D
2 1 3月 第 8卷 第 7期 01 年
・
调查 研 究 ・
26合 并 用 药 情 况 与 既 往 A . . DR 史 只 有 1例 患 者 是 合 并 用 药 ,8例 患 者 是 单 独 用 药 。 既 9
剂见 表 3 。
表2 引发 AD 的 抗 感 染 药物 种 类殛 构 成 比 R
21 0 0年 7 9月来 源 于我 院 临床 医师 、 士 、 - 护 药师 上报 的 9 9例
AD R报 告 进 行 总 结 与 分 析 。
1资 料 与 方 法
资 料来 源 于 我 院 临 床 药 剂 科 收 集 的 2 1 0 0第 三 季 度 的
药 品不 良反 应 ( DR) 指合 格 的药 品 存 预 防 、 断 、 A 是 诊 治 疗疾 病 的 过程 中 , 在正 常 用 法 、 用量 情 况 下 出 现 的与 用药 目 的无 关 的有 害反应 。 为 了解 我院 AD R发 生 的特点 及 规 律 , 进 A R监 测工 促 D 作 的 深 入 开 展 ,同 时 为 临 床安 全 、合 理 用 药 提 供 参 考 , 对
在 9 9例 AD R报 告 中 , 4 男 1例 , 5 女 8例。年龄 最小者 为
我院2010年药品不良反应报告回顾性分析
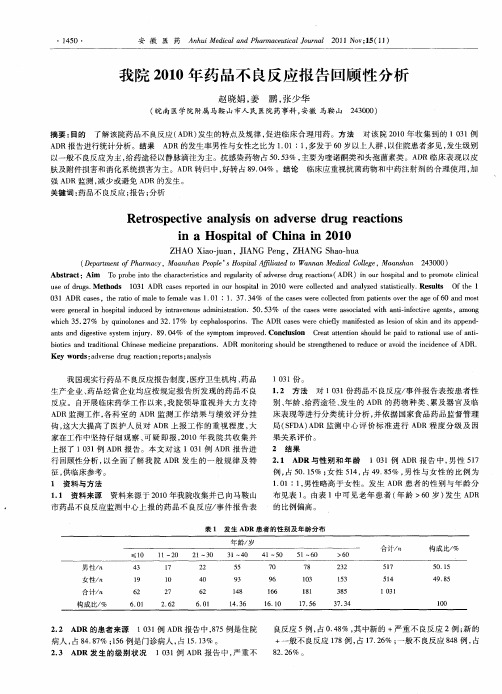
2 结 果
2 1 AD1例 A R 报 告 中 , 性 5 7 3 D 男 1
例 , 5 .5 ; 性 5 4 占 4 . 5 , 性 与女 性的 比例 为 占 0 1% 女 1 , 98% 男 10 1 男性略高于 女性 。发 生 A R患 者 的性别 与年龄 分 .1: , D 布见表 1 。由表 1中可 见老 年患 者 ( 年龄 >6 0岁 ) 生 A R 发 D 的比例偏高 。
i o p t lo i a i 0 0 n a H s ia f Ch n n 2 1
Z O X a— a 。 I N eg Z A G S a—u HA i j n JA G P n . H N h oh a ou
( eat etfP am c , asa epe s o i l f l t a n nMei l o ee Manhn 2 30 ) Dp r n o h r ay Ma nh nP ol’ H s t f i e t W n a dc lg , asa 4 0 0 m p aA a d O i aC l A src: m T rb t te hr trt sadrgl i f des rgratn ( D )i o r opt n rm t ci cl bta t Ai o oei o h aa e sc n ua t o vre u co s A R n u sil dt po o l ia p n c cii e ry a d e i h aa o e n
b o isa d ta i o a C i e e me i i ep e a ai n .AD mo i rn h u d b te gh n d t e u e o v i h n i e c f it n d t n l h n s d cn r p rt s c r i o R n ti g s o l e sr n t e e or d c ra o d t e ic d n e o o ADR.
《药品不良反应事件报告表》填写要求

一、《药品不良反应/事件报告表》填写要求《药品不良反应报告和监测管理办法》第十三条明确规定:药品生产、经营企业和医疗卫生机构必须指定专(兼)职人员负责本单位生产、经营、使用药品的不良反应报告和监测工作,发现可能与用药有关的不良反应应详细记录、调查、分析、评价、处理,并填写《药品不良反应/事件报告表》,每季度集中向所在地的省、自治区、直辖市药品不良反应监测中心报告,其中新的或严重的药品不良反应应于发现之日起15日内报告,死亡病例须及时报告。
(一)填写注意事项:1.《办法》第十四条规定:《药品不良反应/事件报告表》的填报内容应真实、完整、准确。
2.《药品不良反应/事件报告表》是药品安全性监测工作的重要档案资料,手工报表需要长期保存,因此需用钢笔、签字笔书写,填写内容、签署意见(包括有关人员的签字)字迹要清楚,不得用报告表中未规定的符号、代号、不通用的缩写形式和花体式签名。
其中选择项画“√”,叙述项应准确、完整、简明,不得有缺漏项。
3.每一个病人填写一张报告表。
4.个人报告建议由专业人员填写,可以是诊治医务人员、药品生产、经营企业专(兼)职人员及专业监测机构人员。
5.尽可能详细地填写报告表中所要求的项目。
有些内容无法获得时,填写“不详。
6.对于报告表中的描述性内容,如果报告表提供的空间不够,可另附A4纸说明。
在纸的顶部注明“附件”,所有的附件应按顺序标明页码,附件中必须指出描述项目的名称。
7.补充报告:如需作补充报告时,请注意与原报表编号保持一致,并在报告左上方注明“补充报告”,与原报表重复的部分可不必再填写。
补充报告也可不填写报告表,只需附纸说明补充内容即可,但须注明原报表编号、单位名称、补充报告时间、报告人。
(二)填写详细要求1.新的、严重、一般:新的ADR:是指药品说明书中未载明的ADR。
严重ADR:是指因服用药品引起以下损害情形之一的反应:⑴引起死亡;⑵致癌、致畸、致出生缺陷;⑶对生命有危险并能够导致人体永久的或显著的伤残;⑷对器官功能产生永久损伤;⑸导致住院或住院时间延长。
某医院药品不良反应报告分析
•药事服务・某医院药品不良反应报告分析李德华药品不良反应(adverse drug reaction,ADR)是指在严格按照药品的限定剂量[规用药过程中,产生的无益且期望之外的有害反应,与相关药品的使用有因果关系。
其对人体导致的不良反应主要表现为毒副作用、过敏反应、三致作用(致畸性、致、致癌)性应[2]o对药品的不良反应、计析,对降低不良反应的生率,维护患者健有极为重要的。
对院出现的药品不良反应析,。
1资料与方法1.1:以2017—2019年在本院收集的药品不良反应病例为研究对象,共70例。
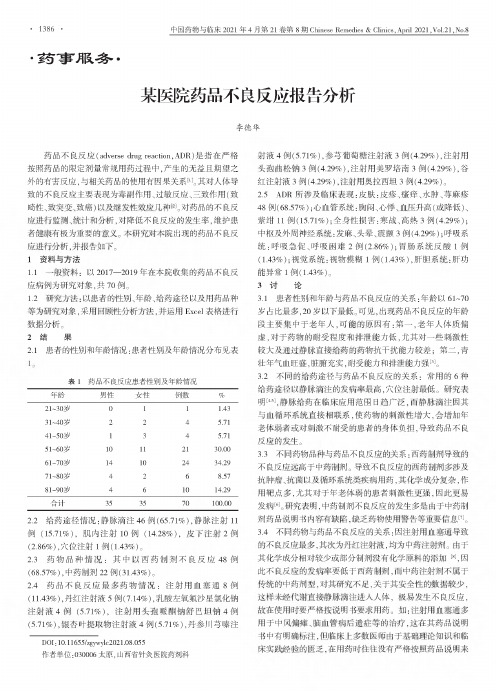
1.2:患者的性别、年龄、给药途径以及用药品种为对象,采用 性析,用Excel表格数据分析。
2结果2.1患者的性别和年龄情况:患者性别及年龄情况分布见表表1药品不良反应患者性别及年龄情况年龄男性女性例数%21〜30岁011 1.4331~40岁224 5.7141〜50岁134 5.7151〜60岁10112130.0061〜70岁14102434.2971〜80岁4268.5781〜90岁461014.29合计353570100.002.2给药途径情况:静脉滴注46例(65.71%),静脉注射11例(15.71%),肌内注射10例(14.28%),2例(2.86%),穴位注射1例(1.43%)。
2.3药物品种情:其中西药制剂不良反应48例(68.57%),中药制剂22例(31.43%)。
2.4药品不良反应药物情:注射用血塞通8例(11.43%),丹红注射液5例(7.14%),乳酸左氧氟沙星氯化钠4(5.71%),用4例(5.71%),物注射液4例(5.71%),丹参川莒嗪注D0I:10.11655/zgywylc2021.08.055作者单位:030006太原,山西省针灸医院药剂科射液4例(5.71%),参莒葡萄糖注射液3例(4.29%),注射用3例(4.29%),注射用美罗培南3例(4.29%),谷红注射液3例(4.29%),用奥拉西坦3例(4.29%)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附表1
药品不良反应/ 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
