物理化学11小结例题和作业
物理化学中国石油大学课后习题答案第11章

π
d
2 AB
L2
8RT πμ
[A][B]
( ) = 3.14× 2.93×10−10 2
( ) × 6.022×1023 2 ×
8×8.314× 300 3.14×1.897 ×10−3
× 31.25× 49.60m−3 ⋅ s−1
= 2.77 ×1035 m−3 ⋅ s−1
2.某双原子分子分解反应的阙能为 83.68kJ ⋅ mol-1 ,试分别计算 300K 及 500K 时,具有足
[A] = WA MA
V
=
⎛ ⎜ ⎝
1.0 ×10−3 32.00×10−3 ×1×10−3
⎞ ⎟
mol
⋅
m-3
⎠
= 31.25mol ⋅ m-3
[B] = WB MB
V
=
⎛ ⎜ ⎝
0.1×10−3 2.016 ×10−3 ×1×10−3
⎞ ⎟
mol
⋅
m-3
⎠
=
49.60mol ⋅ m-3
Z AB
=
物理化学习题解答
第十一章 化学动力学基础(二)
1.将1.0g 氧气和 0.1g 氢气于 300K 时在1dm3 的容器内混合,试计算每秒钟、每单位体
积内分子的碰撞总数为若干?设 O2 和 H2 为硬球分子,其直径为 0.339 和 0.247nm 。
解:设 O2 和 H2 分别为 A 和 B ,则
dAB
=
dA
+ dB 2
=
⎡(0.339 + 0.247)×10−9
⎢ ⎣
2
⎤ ⎥m ⎦
=
2.93×10−10 m
μ = MAMB MA + MB
物理化学习题解答(十一)..

8 0.326
12 0.222
16 0.151
试计算:
(1) 该分解反应的级数;
(2) 求反应的速率常数 k 和半衰期 t1/2; (3) 若抗菌素在血液中质量浓度不低于 0.37mg/(100cm3)才有效,求注射第二针的 时间。
解:
(1) 设为一级反应, ln( a–x)= –kt + lna,则 ln( a–x)~t 作图应为一直线:
(2) r
d[ A] k[ A][ B ]
dt
dx ( a x ) 2 kdt
k[ A] 2
d ( a x ) 1 kdt
x
t
d (a x) 1 k dt
0
0
( a x ) 1 a 1 k ( t 0)
( 0.25 a) 1 a 1 k (1 0)
k 3a 1
( a x) 1 a 1 3a 1 (2 0)
2n 1 1
中 k 为速率常数 ): t 1 2
( n 1) a n 1k
解:
a,证明其半衰期表示式为 (式
dx (a x ) n kdt
d ( a x )1 n ( n 1) kdt
x
d (a
x)1 n
t
(n 1) k dt
0
0
( a x )1 n a 1 n ( n 1) kt
当 x= 1/2a,t=t1/2 (a 1/ 2a)1 n a1 n
2.2
2.0
1.8
) 1.6
(lnα-αt∞
1.4 1.2 1.0
0.8
0.6
0.4
斜率 = -0.0053
0
50 100 150 200 250 300
物理化学经典习题11

物理化学经典习题一、填空题1.硫酸与水可形成三种水合盐:H 2SO 4·H 2O 、H 2SO 4·2H 2O 、H 2SO 4 ·4H 2O 。
常压下将一定量的H 2SO 4溶于水中,当达三相平衡时,能与冰、 H 2SO 4水溶液平衡共存的硫酸水合盐的分子中含水分子的数目是 。
2.Na +、H +的还原电极电势分别为 –2.71V 和 –0.83V ,但用Hg 作阴极电解 NaCl 溶液时,阴极产物是Na –Hg 齐,而不是H 2,这个现象的解释是 。
3.在稀亚砷酸溶液中通入过量的硫化氢制备硫化砷溶液。
其胶团结构式为 。
注明紧密层、扩散层、胶核、胶粒、胶团。
4.在两个具有0.001mAgNO 3溶液的容器之间是一个AgCl 多孔塞,在多孔塞两端放两个电极,接通直流电源后,溶液将向 极方向流动。
5. 反应 A −→−1k B (Ⅰ) ; A −→−2k D (Ⅱ)。
已知反应(Ⅰ)的活化能大于反应(Ⅱ)的活化能,加入适当催化剂 改变获得B 和D 的比例。
6.等温等压(298K 及p ø)条件下,某一化学反应在不做非体积功条件下进行,放热40.0 kJ·mol -1,若该反应通过可逆电池来完成,吸热 4.00 kJ·mol -1,则该化学反应的熵变为 。
7.若稀溶液表面张力γ 与溶质浓度c 的关系为 γ0 – γ = A + B ln c (γ0为纯溶剂表面张力, A 、B 为常数), 则溶质在溶液表面的吸附量Γ 与浓度c 的关系为 。
8.298.2K 、101.325kPa 下,反应 H 2(g) + 21O 2(g) ═ H 2O(l) 的 (∆r G m – ∆r F m )/ J·mol -1为 。
二、问答题1.为什么热和功的转化是不可逆的? 2.在绝热钢筒中进行一化学反应:H 2(g) +21O 2(g) ═ H 2O(g),在反应自发进行。
天津大学物理化学教研室《物理化学》(第6版)笔记和课后习题(含考研真题)详解-第十一章至第十二章【圣

1.转化速率
用单位时间内反应发生的进度来定义。对于非依时计量学反应,反应进度ξ定义为:dξ
▪
▪
≝ (1/vB)dnB,所以转化速率ξ为ξ≝ dξ/dt=(1/vB)(dnB/dt),转化速率的单位为 mol·s
-1。
注意:
▪
(1)反应的转化速率ξ是广度量,依赖于反应系统的大小;
(2)对于非依时计量反应,转化速率的数值与用来表示速率的物质 B 的选择无关;
(2)分级数与组分的计量系数无关;
(3)分级数一般为零、整数或半整数(正或负);
(4)对于速率方程不符合
v
kcAnA
cnB B
的反应,不能应用级数的概念。
在每个反应组分的分级数都是一级的二级反应中,若维持其中一组分的浓度远远大于另
一组分的浓度,反应过程中其浓度变化可以忽略不计,从而使此反应表现为一级反应,这种
(3)与化学计量式的写法有关,应用上述定义式时必须指明化学反应方程式。
2.反应速率
单位体积的转化速率,定义式为
def
vξ
V (
1
)( dnB )
νBV dt
1 / 134
圣才电子书 十万种考研考证电子书、题库视频学习平台
反应速率 v 为强度量,其单位为 mol·m-3·s-1,与用来表示速率的物质 B 的选择无关, 与化学计量式的写法有关。
2.半衰期法
ln t1
2
ln
2n1 1 (n 1)k
(1
n) ln cA,0
如上,反应的半衰期的对数和初始浓度成直线关系,直线的斜率为(1-n)。只要获得
两个不同浓度下对应的半衰期的数值,就可以求得反应的级数 n(运用此关系式时,n≠1)。
物理化学题库及详解答案

物理化学题库及详解答案物理化学是一门结合物理学和化学的学科,它通过物理原理来解释化学现象,是化学领域中一个重要的分支。
以下是一些物理化学的题目以及相应的详解答案。
题目一:理想气体状态方程的应用题目内容:某理想气体在标准状态下的体积为22.4L,压力为1atm,求该气体在3atm压力下,体积变为多少?详解答案:根据理想气体状态方程 PV = nRT,其中P是压力,V是体积,n是摩尔数,R是理想气体常数,T是温度。
在标准状态下,P1 = 1atm,V1 = 22.4L,T1 = 273.15K。
假设气体摩尔数n和温度T不变,仅压力变化到P2 = 3atm。
将已知条件代入理想气体状态方程,得到:\[ P1V1 = nRT1 \]\[ P2V2 = nRT2 \]由于n和R是常数,且T1 = T2(温度不变),我们可以简化方程为:\[ \frac{P1}{P2} = \frac{V2}{V1} \]代入已知数值:\[ \frac{1}{3} = \frac{V2}{22.4} \]\[ V2 = \frac{1}{3} \times 22.4 = 7.46667L \]所以,在3atm的压力下,该气体的体积约为7.47L。
题目二:热力学第一定律的应用题目内容:1摩尔的单原子理想气体在等压过程中吸收了100J的热量,如果该过程的效率为40%,求该过程中气体对外做的功。
详解答案:热力学第一定律表明能量守恒,即ΔU = Q - W,其中ΔU是内能的变化,Q是吸收的热量,W是对外做的功。
对于单原子理想气体,内能仅与温度有关,且ΔU = nCvΔT,其中Cv 是摩尔定容热容,对于单原子理想气体,Cv = 3R/2(R是理想气体常数)。
由于效率η = W/Q,我们有:\[ W = ηQ \]\[ W = 0.4 \times 100J = 40J \]现在我们需要找到内能的变化。
由于过程是等压的,我们可以利用盖-吕萨克定律(Gay-Lussac's law)PV = nRT,由于n和R是常数,我们可以简化为PΔV = ΔT。
南京大学《物理化学》练习第十一章化学动力学基础_二_

南京⼤学《物理化学》练习第⼗⼀章化学动⼒学基础_⼆_第⼗⼀章化学动⼒学基础(⼆)返回上⼀页1. 将1.0 g氧⽓和0.1 g氢⽓于300 K时在1 dm3的容器内混合,试计算每秒钟内单位体积内分⼦的碰撞数为若⼲?设O2和H2为硬球分⼦,其直径分别为0.339和0.247 nm.2. 某双原⼦分⼦分解反应的阈能为83.68 kJ/mol,试分别计算300 K及500 K时,具有⾜够能量可能分解的分⼦占分⼦总数的分数为多少?3. 某⽓相双分⼦反应, 2A(g) ---> B(g)+C(g),能发⽣反应的临界能为100 kJ/mol.已知A的相对分⼦量为60,分⼦直径为0.35 nm,试计算在300 K 时,该分解作⽤的速率常数k 值.4. 松节油萜(液体)的消旋作⽤上⼀级反应,在457.6 K和510.1 K时的速率常数分别为2.2×和3.07×min-1,试求反应的实验活化能E a,在平均温度时的活化焓和活化熵.5. 在298 K时某化学反应,如加了催化剂后使其活化熵和活化焓⽐不加催化剂是时分别下降了10 J/(mol·K)和10 kJ/mol,试求不加催化剂与加了催化剂的两个速率常数的⽐值.6. 在298 K时有两个级数相同的基元反应A和B,其活化焓相同,但速率常数k A=10k B,求两个反应的活化熵相差多少?7. 某顺式偶氮烷烃在⼄醇溶液中不稳定,通过计量其分解放出的N2⽓来计算其分解的速率常数k值,⼀系列不同温度下测定的k值如下所⽰:T/ k 248 252 256 260 264k×/s-1 1.22 2.31 4.39 8.50 14.3试计算该反应在298K时的实验活化能,活化焓,活化熵和活化吉布斯⾃由能.8. 对下述⼏个反应,若增加溶液中的离⼦强度,则其反应速率常数是增⼤,减⼩还是不变?(1) NH4+ +CNO- --->CO(NH2)2(2) 酯的皂化作⽤.(3) S2O82- + I- --->P9. 在298 K时,反应N2O4(g)2NO2(g)的速率常数k1=4.80×s-1,已知NO2和N2O4的⽣成吉布斯⾃由能分别为51.3和97.8 kJ/mol,试求(1)298 K时, N2O4的起始压⼒为101.325 kPa时, NO2(g)的平衡分压?(2)该反应的弛豫时间?10. ⽤温度跳跃技术测量⽔的离解反应: H2O H+ + OH-,在298 K时的弛豫时间τ=37×s,试求该反应正向和逆向反应的速率常数k1和k-2.11. 在光的影响下,蒽聚合为⼆蒽.由于⼆蒽的热分解作⽤⽽达到光化平衡.光化反应的温度系数(即温度每增加10K反应速率所增加的倍数)是1.1,热分解的温度系数是2.8,当达到光化平衡时,温度每升⾼10K.⼆蒽产量是原来的多少倍?12. ⽤波长为313nm的单⾊光照射⽓态丙酮,发⽣下列分解反应:(CH3)2CO +hv---> C2H6 + CO ,若反应池的容量是0.059 dm3,丙酮吸收⼊射光的分数为0.915,在反应过程中,得到下列数据:反应温度:840 K 照射时间t=7 h起始压⼒:102.16 kPa ⼊射能48.1×J/s,终了压⼒:104.42 kPa计算此反应的量⼦效率.13. 有⼀酸催化反应A+B C+D,已知该反应的速率公式为d[C]/dt=k[H+][A][B] ,当[A]0=[B]0=0.01 mol·dm-3时,在pH=2的条件下,在298 K时的反应的半衰期为1 h,若其他条件不变,在288 K时t1/2为2 h,试计算(1)在298 K时反应的速率常数k值。
《物理化学(第五版)》第十一章复习题答案
复习题11
对于复杂反应,如果有一步放出很多热, 大于决速步的活化能,或激发态分子发生 反应,生成处于基态的生成物,表观上活 化能是负值,所以有负温度系数效应,反 应温度升高,速率反而下降。这种反应不 多,一般与NO氧化反应有关。
复习题12
12.某温度时,有一气相一级反应 A(g)→2B(g)+C(g),在恒温、恒容条件下进 行。设反应开始时,各物质的浓度分别为 a,b,c,气体总压力为p0,经t时间及当A完全 分解时的总压力分别为pt和p∞,试推证该分 解反应的速率常数为
t3 4
a
3 4
a
1 2
a12
k 2 1
3 ka
复习题5
t1 2
a
1 2
a
13
a13
k 3 1
3 2ka 2
t3 4
a
3 4
a
13
a13
k 3 1
15 2ka 2
所以,对a=b的二级反应,t3/4 =3 t1/2。同 理,对a=b=c的三级反应t3/4 =5t1/2。
复习题6
零级反应不可能是基元反应,因为没有零分 子反应。一般是由于总反应机理中的决速步 与反应物的浓度无关,所以对反应物呈现零 级反应的特点。零级反应一般出现在表面催 化反应中,决速步是被吸附分子在表面上发 生反应,与反应物的浓度无关,反应物通常 总是过量的。
复习题2
基元反应一定具有简单反应级数,但具有 简单级数的反应不一定是基元反应,如 H复2杂(g)反+I应2(g。)=2HI(g)是二级反应,但是一个
1 2
d
P
dt
k2
A
B
2
r2
1 2
d A
物理化学学习总结

物理化学学习总结(经典版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的经典范文,如总结报告、合同协议、条据文书、策划方案、规章制度、心得体会、名人名言、教学资料、作文大全、其他范文等等,想了解不同范文格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!Moreover, our store provides various types of classic sample essays, such as summary reports, contract agreements, doctrinal documents, planning plans, rules and regulations, personal experiences, famous quotes, teaching materials, complete essays, and other sample essays. If you want to learn about different formats and writing methods of sample essays, please stay tuned!物理化学学习总结物理化学学习总结总结在一个时期、一个年度、一个阶段对学习和工作生活等情况加以回顾和分析的一种书面材料,他能够提升我们的书面表达能力,因此我们需要回头归纳,写一份总结了。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
c.各组分的初浓度比例于计量系数 cA0 cB0 cP0
则反应进行到任何时刻
cA cB cP abp
a
b
p
A = d d A c tk A c A c B c p k A c A a b c A a p c A k 'c A
b.积分式
cA
cA0
半衰期与 k A 和 c A0 的乘积成反比。
1 t1/ 2 kAcA0
4.n级反应: aAbBpP
a.微分式
A
dcA dt
kAcA n
可表示为上述形式的情况有:
a. 反应速率只与一种反应物浓度有关
b.除一种组分外,其余均大量过剩.
A = d d A c tk A c A c B c p (k A c B c p )c A k 'c A
t1 / 2
c A0 2kA
cA
d. 线性关系
cA—t 图为直线
t
反应的特征:
cA0cAkAt
以反应物浓度 c A对时间t作图是一条直线,表 明速率与浓度无关,直线的斜率的负值即为 k A
k A 具有[浓度 时 / 2
c A0 2kA
2.一级反应:
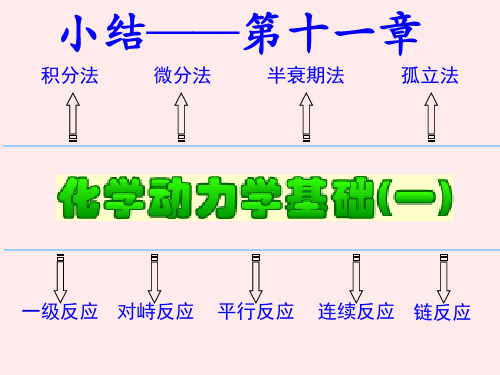
第十一章 小 结
一、主要研究内容:
1 研究各种因素(浓度、压力、温度、催化剂、溶 剂、光照射等)对化学反应速率的影响。
2 研究宏观反应是经过那些具体步骤实现的— 即反应机理。
3 研究机理中每一步反应如何实现—即反应速 率理论。
本章主要讨论:反应速率方程、反应速 率与反应机理的关系、反应速率理论、 溶液中反应、光化学、催化作用等
dcA t
cAn
0
kAdt
n11cA n11 cA n101kAt
n≠1
c.半衰期:
t1/2 (n2n1)1kAc1A n01
d. 线性关系
以 1 对t 作图应为直线 cn1
A
反应的特征:
1
对 t 作图是一条直线
c
n-1 A
k A 具有浓度n1·时间1的量纲,
半衰期与 k A 和 c A0 的n-1次方乘积成反比。
上页 下页
二、化学反应的反应速率及速率方程
1. 反应速率的定义
恒容条件下:
•
defξ υ
1
•
ξ
def
ddξtνdBndBt
dnB 1 dcB
V νBVdt νB dt
对于反应: A A B B Y Y Z Z
反应物的消耗速率
A
dcA dt
产物 的生成速率
Z
dcZ dt
上页 下页
——与物质选择无关
测定反应系统的某些物理性质随时间 变化的数据。电导、旋光度、吸光度、折 光率、粘度、气体的压力和体积……
由实验测定的c—t数据确定反应级数的方法如下:
1.微分法
A d cA/d tkA cA n l g A n l c g A l k g A
l g A n 1 l c g A 1 l k g A nlgA1 A2
上页 下页
解: (1) 一级反应
k
9622
lns1
24.00 T/
K
(2)
k ln
Ea
C
[k] RT
Ea 9622K R
Ea=9622×8.3145J ·mol-1 =80.002kJ ·mol-1
上页 下页
A产物
a.微分式
A
dcA dt
kcA
1 cA c cA0 A
dcA
t 0
kdt
b.积分式
k 1 ln cA0 t cA
ln cA { } k tln cA {}0
kA
1 ln cA0 t cA
若 令 xA为A的 转 化 ,则c率 A cA0(1xA) 代 入 积:分 式
k1lncA01ln cA0 1ln 1 t cA t cA0(1xA) t 1xA
cA0kAt
c.半衰期:
11 2 1 1 cAcA0 cA0 cA0 cA0 kA t1/2
d. 线性关系
1 t1/ 2 kAcA0
1
1/cA—t 图应为直线 c A
t
反应的特征:
1 cA
1 cA0
kAt
1
c A 对 t 作图是一条直线,斜率即 k A 。
k A 具有[浓度]1·[时间]1的量纲。
y
Z
k k A
k B
k y
k z
ν ν
νν
A
B
y
z
上页 下页
3 用气体组分的分压表示速率方程
dcA dt
kc,AcnA
dp A dt
kp,A pnA
kp,A kc,A RT 1n
上页 下页
4. 基元反应与质量作用定律
基元反应:由反应物一步生成产物的反应,没有可 由宏观实验方法探测到的中间产物。
aA 产物
a.微分式
A
dcA dt
kAcA 2
b.积分式
ccAA0c1A 2 dcA
t
0kAdt
11 cA cA0 kAt
将 cAcA 0(1xA )代入积分式
cA(1 01 xA )c1 A 0c1 A 01 1 xA1 c1 A 01 xA xA kA t
xA 1 xA
kA1 tln p p A A 01 tln 3 (2 p p pt)0.06m 4 1 9 in
ln2 0.693
t1/2
k
1.0 6m 8 in
0.0649
(2) pApA0ektp 3ekt0.24k4P 2a
pt= 3 pA0 -2 pA=p∞- 2 pA=35.484kPa
3.二级反应:
A Z ——与物质选择有关
A Z A Z
0N23H 22N3H
1d1d n N 21d n H 21d n N3H
Vd t Vd t 3 Vd t 2 Vd t
N2
H2
3
NH 3
2
2.速率方程的一般形式
=dcA kccc
A
dt
AAB p
υ υ A
υ B
υ y
υ z
ν ν
νν
A
B
反应的特征:
k1lncA01ln cA0 t cA t cA0x
ln{cA }对t 作图是一条直线,斜率的负值即 k
k 具有[时间1]的量纲。一级反应速率常数的
值与浓度单位无关。
半衰期与 k成反比,与 无c A0关。
ln 2 t1/2 kA
叔丁基溴在丙酮和水的混合溶剂(含水10%) 中水解生成叔丁醇的动力学实验结果
l g A 2 n l c g A 2 l k g A
lgcA1 cA2
一次法
初速率法(可排除产物对反应速率的干扰)
lg ddcAt t0 对 lgcA 图
2.积分法(尝试法) 实验数据 t1c1,t2c2,t3c3
代入各级速率方程的积分形式
考察直线关系,求得 n, k
例如: H 2+I2
反应机理
反应分子数
2H I
I2 2I I+H2 HI+H H+I2 HI+I
---基元反应中实际参加反应的反应物的分子数目
质量作用定律——基元反应的反应速 率与该反应的反应物浓度幂乘积成正比。
单分子反应 双分子反应
三分子反应
AP
2A P AB P
=kcA
= kcA2 =kcAcB
过氧化氢催化分解:
ln ( V V t) k tln V
乙酸乙酯皀化:
k 1 G0 Gt tcA,0 Gt G
上页 下页
四、速率方程的确定
需要由动力学实验提供的c—t 数据确定反应级数
n 或、及速率常数 k.
测定不同反应时刻,反应物或产物浓度的方法分为:
化学法:需要终止反应,不够方便。 物理法: 不需要终止反应
(1)反应的速率常数kA及半衰期t1/2 (2)反应进行1小时A的分压及系统的总压。
解2:
cA0 Y Y0 cA Y Yt
k A 1 tln c c A A 0 1 tln p p p p 0 t 1 tln 3 (2 p p p t)
物理化学实验:
蔗糖水解: l( n α t α ) k lt( n α 0 α )
k3=1.67 ×10-3s-1
一级反应:
1
ln 1
xA
k3t
1
ln
1.67
1 xA
xA=0.812=81.2%
上页 下页
例3:恒容气相反应A(g)→D(g)的速率常数k与 温度T具有如下关系式:
k
9622
lns1
24.00 T/
K
(1)确定此反应的级数; (2)计算此反应的活化能; (3)欲使A(g)在10min内转化率达到90%,则 反应温度应控制在多少度.
2AB P =kcA 2cB
A B +C P=kcAcBcC
三、速率方程的积分形式 1.零级反应: A产物
a.微分式
A
dcA dt
kA
b.积分式
dc cA
cA0 A
k
t 0
dt
cA0cAkAt
c.半衰期:
反应物消耗掉一半所需要的时间
11 cA 0cAcA 02cA 02cA 0kA t1/2
解:
lnk2 k1
Ea R
T12
T11
ln 1 5 ..0 4 8 8 1 1 0 4 4 4 0 0 8 .3 E a1 24 1 .1 85 5 3 31 .1 3 m 5 3J o 1 l
