【全程复习方略】中考化学 第3章 物质构成的奥秘 第2节 物质的组成及表示精练精析 沪教版
初三化学上册第3章知识点:物质构成的奥秘

初三化学上册第3章知识点:物质构成的奥秘化学知识点是同窗们化学学习中的重要局部,大家一定要仔细掌握,查字典化学网为大家整理了初三化学上册第3章知识点:物质构成的微妙让我们一同窗习,一同提高吧! 第一节用微粒的观念看物质知识导学水是由少量的这样的水的微粒聚集而成的。
异样的,其他的物质也是由自身的微粒聚集而成的。
在生活中,我们可以感知微粒的存在,例如,当你走近花园时会闻到花的香味,是由于构成花香的微粒运动到我们鼻孔中去了;湿衣服晾干,是一个个的水微粒不时地从湿衣服上分散到空气中去了,所以衣服干了;在家里倒一杯开水,你细心观察会发现水面上的水花在不时地运动,这是许许多多的水的微粒相互运动的结果。
一切上述现象都表达了微粒都是在不停地运动着。
水和酒精的混合一定要留意,应先向量筒参与水,再参与酒精,由于水的密度比酒精大,假设先加酒精后参与水,很容易混合比拟充沛,就不会出现体积变小的现象或现象不清楚。
对普通的物质来说,固体、液体的微粒间的距离小,不易被紧缩;气体微粒间的距离比拟大,容易被紧缩。
第二节构成物质的基本微粒知识导学要知道哪些罕见的物质是由分子构成的,如氢气、氧气、水、二氧化碳等物质是由分子构成的。
分子很小,体积很小,质量也很小,我们肉眼看不见,也摸不着。
一个分子是不能表达物质的密度、熔点、沸点、形状等物理性质的,物质的物理性质是该物质少量分子的聚团体共同表现出来的。
一个水分子可以表达水的化学性质,在表达水的化学性质时是不可再分的,再分就不是水的分子了,也就不能表达水的化学性质了。
要知道哪些罕见的物质是由原子构成的,如金属(铁、铜、铝等)、稀有气体和金刚石等物质是由原子构成的。
从电解水的进程中,可以看出水分子在这个化学变化中是可再分的,而氢原子和氧原子没有再分。
可以表达出原子是化学变化中的最小粒子;分子与原子的基本区别在于在化学变化中,分子可以再分而原子不能再分。
就目前的实验手腕来说,很美观到原子的外部结构。
中考化学教材考点梳理 第三单元 物质构成的奥秘(含答案)新人教版

2019-2020年中考化学教材考点梳理第三单元物质构成的奥秘(含答案)新人教版考点1分子和原子考点2原子的结构1.原子结构⎪⎩⎪⎨⎧⎩⎨⎧负电荷)(每个电子带一个单位(不带电)正电荷)(每个质子带一个单位(带正电)原子________________________(1)在原子中,核电荷数=________=__________。
(2)构成原子的粒子有__________、________和__________等,但并不是所有的原子中都有这三种粒子,例如氢原子核内无中子,原子核中质子数不一定等于中子数。
2.相对原子质量(1)以一种____原子质量的1/12为标准,其他原子的质量跟它相比较所得到的_____就是这种原子的相对原子质量。
(2)相对原子质量(Ar)=一个待求原子的实际质量/(一个碳12原子的质量×1/12)相对原子质量=__________+____________3.核外电子的排布(1)核外电子排布的初步知识①通常用电子层表明运动着的电子离核远近的不同。
②元素原子核外电子最少的有1层,最多的有7层,最外层电子最多不超过___个(只有第1层的不超过2个)。
(2)原子结构示意图①原子结构示意图的含义说明:圆圈表示原子核,里面的数字表示核电荷数;弧线表示电子层,上面的数字表示每一个电子层上的电子数②原子结构与元素性质的关系元素种类最外层电子数元素的性质结论金属元素_____个原子易__电子___________决定了元素化学性质非金属元素_____个原子易__电子稀有气体元素_____个(氦2个)不易得、失电子,稳定1.带电的______________叫做离子,带正电荷的离子叫做____________,带负电荷的离子叫做________________。
2.离子符号表示的意义联系考点4元素1.元素是具有相同_______(即________)的一类原子的总称。
2.性质:①元素是宏观概念,它只能组成物质,而不能构成分子或原子;②元素只讲______,不讲______;③化学变化中,元素的______和________保持不变。
人教版初三化学第三章物质构成的奥秘知识点总结

第三单元物质构成的奥秘课题1 分子和原子一、构成物质的微粒:分子、原子、离子1、由分子构成的物质:例如水、二氧化碳、氢气、氧气等物质2、由原子构成的物质:金属、稀有气体、金刚石、石墨等物质3、有离子构成的物质:氯化钠NaCl 硫酸锌ZnSO4(显著特征:含有SO4 CO3 NO3 OH NH4POCl等原子团)44、物质构成的描述:物质由××分子(或原子、离子)构成。
例如:铁由铁原子构成;氧气由氧分子构成。
氯化钠由氯离子和钠离子构成二、分子1、基本性质:⑴质量、体积都很小;⑵在不停地运动(与温度有关)。
温度越高,运动速率越快例:水的挥发、品红的扩散、闻到气味等;⑶分子间存在间隔。
同一物质气态时分子间隔最大,固体时分子间隔最小;物体的热胀冷缩现象就是分子间的间隔受热时增大,遇冷时变小的缘故。
⑷同种物质间分子的性质相同,不同物质间分子的性质不同。
分子相同物质相同,分子不同物质不同2、分子的构成:分子由原子构成。
分子构成的描述:①××分子由××原子和××原子构成。
例如:水分子由氢原子和氧原子构成②一个××分子由几个××原子和几个××原子构成。
例如:一个水分子由一个氧原子和二个氢原子构成3、含义:分子是保持物质化学性质的最小微粒。
例:氢分子是保持氢气化学性质的最小粒子,水分子是保持水的化学性质的最小粒子。
4、从分子和原子角度来区别下列几组概念⑴物理变化与化学变化由分子构成的物质,发生物理变化时,分子种类不变。
发生化学变化时,分子种类发生了改变。
(学会从分子和原子的角度描述物理变化和化学变化)⑵纯净物与混合物由分子构成的物质,纯净物由同种分子构成;混合物由不同种分子构成。
⑶单质与化合物单质的分子由同种原子构成;化合物的分子由不同种原子构成。
三、原子1、含义:原子是化学变化中最小的微粒。
中考化学总复习第三单元物质构成的奥秘

12/9/2021
第十四页,共二十一页。
一二三四五六
答案:C
12/9/2021
第十五页,共二十一页。
一二
三
四
五
六
归类示例四 物质的元素组成
【例 4】 碳元素与氧元素的本质区别是( ) A.质子数不同 B.电子数不同 C.中子数不同 D.最外层电子数不同
解析:元素是具有相同核电荷数(即质子数)的一类原子的总称,因此,同
第十九页,共二十一页。
一
二
三
四
五六
答案:A
12/9/2021
第二十页,共二十一页。
内容(nèiróng)总结
第三单元 物质(wùzhì)构成的奥秘
No Image
12/9/2021
第二十一页,共二十一页。
答案:B
12/9/2021
第十八页,共二十一页。
一
二
三
四五
六
归类示例六 化学符号表示的意义
【例 6】 (广西南宁中考)下列有关化学用语中数字“2”的意义的说法中错 误的是( )
+2
①SO2 ②Mg2+ ③CO2 ④CuSO4 ⑤O带电荷数的是②⑤ C.表示化合价数值的是④ D.表示一个分子中含有某种原子个数的是①③⑥ 解析:以上五个化学用语中都有“2”,其含义分别是:①中,右下角的 2 表示
12/9/2021
第二页,共二十一页。
一二
一、物质的构成
1.分子 (1)概念。 分子是保持物质化学性质的最小粒子。 (2)分子的基本性质。 ①质量和体积都很小。②分子在不停地运动。温度越高,分子运动越 快。③分子之间有间隔。④同种物质的分子化学性质相同,不同种物质的 分子化学性质不同。 (3)相对分子质量。 化学式中各原子的相对原子质量的总和。 (4)分子观点的应用。 ①运用分子观点解释生活中常见的现象:我们可用分子来解释物质的 扩散、溶解、蒸发、挥发等现象;用分子间的间隙解释物质的“三态”变化 等。
中考化学复习考点梳理:第三单元 物质构成的奥秘(21张)
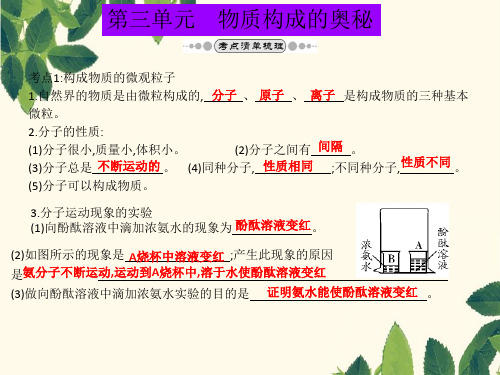
3.分子运动现象的实验 (1)向酚酞溶液中滴加浓氨水的现象为 酚酞溶液变红。
(2)如图所示的现象是 A烧杯中溶液变红 ;产生此现象的原因 是氨分子不断运动,运动到A烧杯中,溶于水使酚酞溶液变红
(3)做向酚酞溶液中滴加浓氨水实验的目的是 证明氨水能使酚酞溶液变红 。
【注意】(1)分子、原子都能直接构成物质,因此它们都能保持所构成物质的化学 性质,如:水分子可以保持水的化学性质,铁原子可以保持铁的化学性质。(2)原子在 化学变化中不能再分,但在其他的条件下可以再分。(3)由分子构成的物质,如果只 含一种分子则是纯净物,含有多种分子则为混合物。若纯净物中的分子由同种原 子构成,则它是单质;若分子由不同种原子构成,则它是化合物。(4)由分子构成的物 质,在发生物理变化时,分子本身没有变化,只是分子间的间隔发生了改变;而在化学 变化中,分子本身发生改变,变成新物质的分子。不过,原子是化学变化中最小的粒 子,因此在化学变化前后,分子的种类改变,而原子的数量和种类不变。 6.离子 (1)离子符号 在元素符号的 右上角 写上一个离子所带的电荷数和电性符号。先写__数__字__ 后写 __正__负__号___,当数字为1时,应省略不写。
(1)在原子中,核电荷数= 质子数 = 核外电子数 。 (2)构成原子的粒子有 质子 、 中子 和 电子 等,但并不是 所有的原子中都有这三种粒子,例如 氢 原子核内无中子,原 子核中质子数不一定等于 中子数 。 2.原子核外电子的排布 (1)核外电子排布的初步认识 ①通常用 电子层 表明运动着的电子离核远近的不同。 ②元素原子核外电子最少的有 1 层,最多的有 7 层,最外 层电子数最多不超过 8 个。(只有1层的不超过 2 个)
考点3:元素和元素周期表
1.元素 (1)元素是具有相同 核电荷数 (即 质子数 )的一类原子的总称。 (2)元素与原子的区别与联系
中考化学复习第三单元物质构成的奥秘

4.(2015凉山州)我的家乡四季如春,美景如画,素有“小春城”的美誉。
下列现象说明分子在永不停息运动的是 ( )
D
A.初春的滨河路柳絮飞扬
B.盛夏的瀛洲园百花斗艳、蜂飞蝶舞
C.深秋的龙肘山万亩杜鹃黄叶飘落(piāo luò)
D.寒冬的绿地广场梅园腊梅绽放、花香四溢
第二十页,共三十四页。
命题点3 微粒(wēilì)结构示意图 1.(2016乐山)下列粒子(lìzǐ)结构示意图中,属于阴离子是( B)
第二十四页,共三十四页。
命题(mìng tí)点4 元素及元素符号
1.(2017攀枝花)银针(yín zhēn)是中医针灸的常用器械。银的元素符号是( B )
A. Au
B. Ag
C. Mg
D. Hg
2.(2015乐山(lè shān))地壳中含量最多的元素是 ( A )
A.氧
B.硅
C.铝
D.铁
3.(2017自贡)每100 g黑木耳中含0.185 g铁,是常见天然食品中含铁量最高
【方法指导】在利用微观粒子的性质解释常见的生活现象时,应注意分子性质与物理现象 之间的对应关系,常见现象的关键词与微粒之间的对应关系如下:
(1)蒸发、扩散、挥发→微观粒子在不停地运动;
(2)体积变化、三态变化→分子间有间隔;
(3)很小体积的物质由多个微观粒子构成(gòuchéng)→微观粒子的质量和体积都很小。
第九页,共三十四页。
类型(lèixíng)3 元素及元素符号
【例3】下列关于(guānyú)元素的叙述中正确的是( A )
A.同种原子的统称为元素
B.同种元素的原子结构和质量完全相同
C.元素的种类取决于该元素的核外电子数
中考化学复习第3单元 构成物质的奥秘

练习(2)
请指出原子结构示意图各符号或数字的含义
元素符号
Na
+11 2 2 8 8 1 1
各层内电子数
电子层 原子核 核内质子数
练习(3)
某元素的原子结构示意图为 12 , 该原子的质子数为_____ 12 个电子, 核外共有____ 分为____ 3 个电子层, 第二层上有____ 8 个电子, 2 个电子。 最外电子层上有____
最外层≥4个电子是非金属元素,在化学变化中易得电子,显负价。
辨析下列粒子各自不同的含义
氢元素 H 一个氢原子 2H 两个氢原子 H+ 一个氢离子 H2
氢气这种物质 一个氢分子 一个氢分子由两 个氢原子构成 -2 水这种物质
H2O
一个水分子 水由氢元素和氧元素组成 一个水分子由两个氢原子和一个 氧原子构成
学一学怎样做这种题
某元素是人体中的常量元素,它在人体内99%存在于 骨骼和牙齿中。该元素的原子结构示意图为: 则该元素的质子数为 20 ,该原子核外 有 4 个电子层,该元素属于 金属
。
(填“金属”或“非金属”)元素,该元素在化合物中的 常见化合价为 。 +2
元素的化学性质决定于最外层电子数, 最外层<4个电子是金属元素,在化学变化中易失电子,显正价。
1 12 16 23 56
铁
26
30
练习(4)
铁原子的相对原子质量是( B )
B 、56
A 、56克
C、 9.288X10-26 Kg
D 、1/56
练习(5)
铝原子的相对原子质量为27,核电荷数为13, 则铝原子由( 13 )个质子和( 14 )个中子构成一个 原子核,核外有( 13 )个电子作高速运动而构成。
中考化学九年级复习九年级第三章物质构成的奥妙--核心知识点总结(word版)

第三章物质构成的奥妙--核心知识点总结1、微粒的基本性质(1)微粒很小,肉眼看不到(2)微粒是在不停地运动的(3)微粒之间有空隙2、构成物质的微粒有原子、分子、离子。
3、不同的物质具有不同的性质,这是由于构成的微粒不同。
构成微粒相同,则物质的性质相同;构成微粒不同,则物质的性质不同。
4、分子概念:分子是构成物质的一种微粒,,大多数物质是由分子构成的。
由分子构成的物 质,分子是保持其化学性质的最小微粒。
5、分子的性质:①分子很小,肉眼看不到 ②分子是在不停地运动的 ③分子之间有空隙④同种物质的分子化学性质相同,不同种物质的分子化学性质不同6、原子概念:原子是化学变化中的最小微粒7、原子的性质:①原子的质量和体积都很小 ②原子是在不停地运动的 ③原子之间有空隙 8、原子的构成(1)原子结构示意图的认识核内质子数正原子核+122 8 2最外层上有 2 个电子原子原子核(带电)第一电子层电子(带 负电)(2)在原子中核电荷数=质子数=核外电子数(3)原子的质量主要集中在原子核上(4)相对原子质量≈质子数+中子数决定元素种类质子数(核电荷数)(5)三决定最外层电子数决定原子的质量原子核说明:最外层电子数相同其化学性质不一定都相同(Mg,He 最外层电子数为 2)最外层电子数不同其化学性质有可能相似(He,Ne 均为稳定结构)9、相对原子质量1(1)概念:以一种碳原子(原子核中含有6 个质子和6 个中子)质量的12它原子的质量与这一基准的比,称为这种原子的相对原子质量。
作为基准,其(2)公式:某种原子的相对原子质量=一个该原子的实际质量(Kg)一个碳-12原子的实际质量(Kg)*112(3)单位:相对原子质量是一个比值,单位为“1”,一般不写出。
(4)相对原子质量≈质子数+中子数10、离子:原子或原子团得失电子后形成的带电荷的微粒叫做离子。
(带电的原子或原子团)11、(1)离子表示方法及意义:如Fe3+ :一个铁离子带3 个单位正电荷(2)离子结构示意图的认识注意:与原子示意图的区别:质子数=电子数则为原子结构示意图*原子数≠电子数为离子结构示意图质子数>电子数:则为阳离子,如Al3+质子数<电子数:则为阴离子,O2--12、离子与原子的区别与联系离子粒子的种类原子阳离子阴离子粒子结构质子数=电子数质子数>电子数质子数<电子数区粒子电性不显电性显正电性显负电性别符号用元素符号表示用阳离子符号表示用阴离子符号表示13、元素(1)定义:具有相同核电荷数(质子数)的同一类原子的总称(2)表示方法——元素符号——拉丁文名称的第一个字母大写,第二个小写a、书写方法:b、意义注意:如O:氧元素一个氧原子*有些元素符号还可表示一种单质如Fe、He 、C 、Si*在元素符号前加上数字后只能有微观意义,没有宏观意义,如3O:只表示3 个氧原子c、有关元素周期表*发现:门捷列夫*7 横行(718 纵行(16 族*注:原子序数=质子数d金属元素:如Mg、Al,最外层电子数特点:<4非金属元素:如N、C,最外层电子数特点:≥4稀有气体元素:如He、Ne。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第2节物质的组成及表示综合检测·知能升级一、选择题1.(2012·淄博中考)下列化学用语,通常只具有微观意义,而不具有宏观意义的是( )A.N2B.2HC.AlD.MgCl22.(2012·湛江中考)雷州半岛因雷多而闻名,在闪电打雷时,空气中的氮气和氧气反应生成NO,下列说法正确的是( )A.氮气的化学性质活泼B.NO是单质C.NO是氧化物D.NO是混合物3.(2012·泰安中考)化学用语是最简明、信息丰富、国际通用的语言。
下列对化学用语解释不正确的是( )A.2H—2个氢元素B.N2—氮气C.2H2O—2个水分子D.Mg2+—镁离子4.含有氯元素的酸有多种,高氯酸是其中的一种。
已知高氯酸中氯元素的化合价为+7,则高氯酸的化学式是( )A.HClB.HClOC.HClO3D.HClO45.下列关于H2和H2SO4的叙述,正确的是( )A.都含有氢元素B.都含有氢分子C.都含有氢离子D.都是化合物6.根据右图提供的信息判断,下列说法正确的是( )A.钠原子的结构示意图中,x=10B.钠原子的质子数为11C.在化学反应中,氯原子易失去电子D.氯元素为金属元素7.(2012·怀化中考)2011年9月12日,中国科学家屠呦呦荣获拉克斯——狄蓓吉临床医学研究奖,以表彰她发现了一种药物——青蒿素,它是治疗疟疾的特效药,化学式是C15H22O5。
下列有关青蒿素的说法正确的是( )A.“青蒿素”是混合物B.“青蒿素”含42个原子C.“青蒿素”中碳元素的质量分数是6.38%D.“青蒿素”中碳、氢、氧三种元素的质量比是90∶11∶408.(2011·怀化中考)已知某硫的氧化物中硫元素和氧元素的质量比为2∶3,则该硫的氧化物的相对分子质量是( )A.28B.30C.64D.80二、填空与简答题9.(2012·天津中考)构建知识网络是一种重要的学习方法。
(1)将“分子”“原子”“元素”填入下图序号所对应的横线上。
(2)蔗糖是贮藏在某些植物(如甘蔗、甜菜等)中的糖,其化学式为C12H22O11,它由_________种元素组成,每个蔗糖分子由_________个原子构成。
10.(2012·宜宾中考)用化学用语填空:(1)银_________;(2)4个二氧化硫分子_________;(3)2个铝离子_________;(4)高锰酸钾_________;(5)+5价的氮元素_________;(6)由Ca2+和H2PO4-构成的磷酸二氢钙_________。
11.形象的微观示意图有助于我们认识化学物质和理解化学反应。
(1)若用●表示氢原子,用表示氧原子,则表示_________(填化学式,下同),表示__________。
(2)ClO2是新一代饮用水的消毒剂,我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:上述四种物质中,属于氧化物的是__________,氯元素的化合价为+3价的物质是_________。
12.(2012·重庆中考)国家新版《生活饮用水卫生标准》从今年7月1日起强制实施,其中饮用水消毒剂除了目前采用的液氯以外,补充了一氯胺(NH2Cl)、臭氧(O3)等。
(1)O3中氧元素的化合价是__________。
(2)NH2Cl由__________(填数字)种元素组成,其中氮元素与氢元素的质量比是__________。
(3)用NH2Cl消毒时,发生反应NH2Cl+X====NH3+HClO,其中X的化学式为_______。
三、计算题13.(2011·烟台中考)低钠盐适合患有高血压、肾病、心脏病的患者服用,苹果酸钠盐(C4H5O5Na)是低钠盐的一种。
请回答:(1)苹果酸钠盐的相对分子质量是________________。
(2)苹果酸钠盐中各元素的质量比为m(C)∶m(H)∶m(O)∶m(Na)=__________。
(3)若某病人每天食用5.85 g苹果酸钠盐,比食用相同质量的食盐(NaCl)少摄入钠元素多少克?(计算结果保留一位小数)答案解析1.【解析】选B。
本题主要考查化学用语的意义。
A化学式既有宏观意义,也有微观意义,故错;B项中只有微观意义即2个氢原子,故正确;C项中既有元素符号的意义,也有化学式的意义,既有宏观意义,也有微观意义,故错;D项中化学式既有宏观意义,也有微观意义,故错。
2.【解析】选C。
本题考查考生对物质分类的理解,解题的关键是理解单质、氧化物、混合物的基本概念。
氮气是一种化学性质不活泼的气体,常温下不能与其他物质发生反应,常用作保护气,A错误;单质是由同种元素组成的纯净物,NO是由N和O两种元素组成,属于化合物,B错误;氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素,NO是由两种元素组成的且有一种是氧元素的化合物,属于氧化物,C正确;混合物从组成上由两种或两种以上物质组成,而纯净物只由一种物质组成,D错误。
3.【解析】选A。
本题考查学生对化学符号意义的掌握。
2H表示2个氢原子。
4.【解析】选D。
根据化合物中正负化合价代数和为零的原则,可分别求出各选项中氯元素的化合价,只有D项符合题意。
5.【解析】选A。
从宏观上讲,物质都是由元素组成的,H2和H2SO4中都含有氢元素,故A对。
从微观上讲,物质有的是由分子构成的,有的是由原子构成的,有的是由离子构成的,H2是由氢分子构成的,H2SO4是由硫酸分子构成的,H2中含有氢分子,H2SO4中不含氢分子,1个硫酸分子中含有2个氢原子、1个硫原子和4个氧原子,B、C均错;由同种元素组成的纯净物是单质,由不同种元素组成的纯净物是化合物,H2是单质,H2SO4是化合物,D错。
6.【解析】选B。
由原子结构示意图,根据原子结构示意图中圆圈内数字表示核内质子数,故B正确,由核内质子数=核外电子数可知,11=2+x+1,所以x=8,故A错误。
在化学反应中,氯原子易得到电子,故C 错误;氯元素为非金属元素,故D错误。
7.【解析】选D。
本题主要考查物质的分类及化学式的计算。
混合物指的是由多种物质混合而成的物质。
青蒿素有固定的组成,属于纯净物;1个青蒿素分子含有42个原子,而这种物质中有大量的分子,也就有大量的原子;碳元素的质量分数=(12×15)/282×100%=63.8%;碳、氢、氧元素的质量比为(12×15)∶22∶(16×5)=90∶11∶40。
8.【解析】选D。
设该氧化物的化学式为S x O y,则有32x∶16y=2∶3,解得x∶y=1∶3,所以其化学式为SO3,相对分子质量为32+16×3=80。
9.【解析】本题以物质与化学式为主题,主要考查学生物质的组成与构成、化学式的知识点。
第(1)题物质是由元素组成的,是由分子、原子和离子构成的;分子是由原子构成的。
第(2)题由蔗糖的化学式可以看出,该物质是由碳、氢、氧三种元素组成,每个分子是由12+22+11=45个原子构成。
答案:(1)元素原子分子 (2)三 4510.【解析】本题以常见物质为载体,考查化学用语的意义及书写。
解题时要明确物质的构成和题目的要求,关键是理解化学式、离子符号以及化合价符号书写的不同。
由离子形成的物质的化学式,要确保化学式中正负离子数目相等,能反映物质不显电性的事实。
答案:(1)Ag (2)4SO2 (3)2Al3+ (4)KMnO4(5)5N(6)Ca(H2PO4)211.【解析】(1)根据分子中原子的种类和个数书写两种物质的化学式;(2)该反应微观过程示意图中从左到右四种物质的化学式分别为Cl2、NaClO2、ClO2和NaCl,由于氧化物中含有两种元素,且其中有一种是氧元素,可知只有ClO2属于氧化物;根据化合物中各元素正负化合价的代数和为零的原则,以及单质中元素的化合价为零,可计算出氯元素在四种物质中的化合价依次为0、+3、+4和-1。
答案:(1)O2 H2O (2)ClO2 NaClO212.【解析】本题综合性较强,考查化合价的判断、物质的元素组成及质量守恒定律的应用。
单质中元素的化合价为0;NH2Cl是由氮、氢和氯三种元素组成的,其中氮元素与氢元素的质量比为14∶(1×2)=7∶1;根据化学反应前后各种元素的原子个数相等,可推知X中含2个氢原子和1个氧原子,故X的化学式为H2O。
答案:(1)0 (2)三 7∶1 (3)H2O13.【解析】(1)苹果酸钠盐的相对分子质量=12×4+1×5+16×5+23=156。
(2)苹果酸钠盐中碳、氢、氧、钠四种元素的质量比为=(12×4)∶(1×5)∶(16×5)∶23=48∶5∶80∶23。
(3)可先求出5.85 g NaCl中钠元素的质量,再求出5.85 g 苹果酸钠盐中钠元素的质量,最后求其差值即可。
答案:(1)156 (2)48∶5∶80∶23(3)5.85 g NaCl中钠元素的质量为:5.85 g×(23/58.5)×100%=2.3 g5.85 g C4H5O5Na中钠元素的质量为:5.85 g×(23/156)×100%≈0.86 g5.85 g NaCl比等质量的C4H5O5Na多的钠元素的质量为:2.3 g-0.86 g=1.44 g≈1.4 g答:该病人每天食用5.85 g苹果酸钠盐比食用相同质量的NaCl少摄入钠元素1.4 g。
