晶体结构,配合物结构知识点与习题
章习题及答案

8. 试从离子极化观点解释,HgCl 为白色,溶解度较大,HgI 为黄色或红色,溶解度较小。
答:Hg 为 18e 构型的,极化力较强,变形性也比较强,而 Cl 与 I 相比,I 离子半径更大,变形性更强,
所以 Hg 与 I 间附加极化作用很强,其结果使晶体中共价成分增大,而难溶于水和颜色加深。
9. 试比较下列两组化合物中正离子极化能力的大小。<1>. ZnCl、CaCl、FeCl、KCl
10. 下列化合物熔点最高的是( B )
A. MgCl
Hale Waihona Puke B. NaCl C. ZnCl D. AlCl
11. 下列化合物在水中溶解度最大的是( A )
A. AgF
B. AgCl
C. AgBr
D. AgI
12. 下列化合物哪个熔沸点最低( D )
A. KCl
B. CaCl
C. AlCl D. GeCl
13. 下列氧化物属于离子型的是( D )
3. 石墨晶体是( D ) A. 原子晶体 B. 金属晶体 C. 分子晶体 D. 前三种晶体的混合型
4. 关于离子晶体的性质,以下说法中不正确的是( A ) A. 所有高熔点的物质都是离子型的物质; B. 离子型物质的饱和水溶液是导电性很好的溶液;
C. 熔融的碱金属氯化物中,导电性最好的是 CsCl;
9. 填下表:
物质 晶格结点上质点 质点内作用力 晶体类型 预测熔点高低
CaO 离子.Ca .O
离子键
离子晶体 高
SiC
Si.C
共价键
原子晶体 很高
HF
极性分子.HF
分子间力.氢键 分子晶体 低
10. 离子的极化力是某种离子使异号离子被极化而变形的能力,极化力与离子电荷,离子半径 ,以及
晶体结构与性质 晶体结构与性质知识点

晶体结构与性质晶体结构与性质知识点第34讲晶体结构与性质(一)(考纲要求)1、理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。
2、了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
3、理解金属键的含义,能用金属键理论解释金属的一些物理性质。
4、了解化学键和分子间作用力的区别。
5、了解氢键的存在对物质性质的影响,能列举含有氢键的物质。
6、了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。
7、了解简单配合物的成键情况。
(课前预习区)一、认识晶体1、晶体的定义:微观粒子在空间按一定规律做周期性重复排列构成的固体物质2、晶体的特性:(1)有规则的几何外形(自范性:在适宜的条件下,晶体能够自发的呈现封闭的、规则的多面体外形。
)(2)有确定的熔点(3)各向异性:在不同的方向上表现不同的性质(4)具有特定的对称性3、晶体是由晶胞堆积得到的,故晶胞就能反映整个晶体的组成。
利用晶胞可以求化学式——均摊法。
均摊法是指每个晶胞平均拥有的粒子数目。
若某个粒子为N 个晶胞所共有,则该粒子有1/N属于此晶胞。
以正方体晶胞为例,晶胞中不同位置的粒子对晶胞的贡献为:顶点原子_______属于此晶胞棱上原子_______属于此晶胞面上原子_______属于此晶胞体内原子完全属于此晶胞若晶胞为六棱柱,则顶点原子有________属于此晶胞,棱上有________属于此晶胞。
练习、硼镁化合物刷新了金属化合物超导温度的最高记录。
该化合物晶体结构中的重复结构单元如图所示。
十二个镁原子间形成正六棱柱,两个镁原子分别在棱柱上底、下底的中心;六个硼原子位于棱柱内。
则该化合物的化学式可表示为A 、Mg 14B 6 B 、MgB 2 ()● ○ Mg BC 、Mg 5B 12D 、Mg 3B 2二、晶体结构1、金属晶体(1)金属键:_____________________________________________________________成键微粒:________________________特征:影响金属键强弱因素及对金属性质的影响:(2)金属晶体:(3)金属晶体物理性质的解释2、离子晶体(1)离子键:____________________________________________________________成键微粒:_________________ 特征:____________________________影响离子键强弱因素:(2)离子晶体定义:(3)晶格能:①影响因素②与离子晶体性质的关系:晶格能越大,形成的离子晶体越,且熔点越,硬度越。
无机化学 第十一章配合物结构

② 先阴离子配体,后阳离子和中性配体;
K[PtCl3NH3] 三氯· 氨合铂(Ⅱ)酸钾 配体数目(一、二、三等) →配体名称→合→中心 离子名称(氧化态Ⅰ、Ⅱ、Ⅲ等)
③ 同类配体,按配位原子元素符号的字母顺序排列:
[Co(NH3)5H2O]Cl3
三氯化五氨· 水合钴(Ⅲ)
④ 同类配体而且配位原子相同时,则将含较少原子数
(2)[ 内界 ] 命名顺序:
配体数目(一、二、三等) →配体名称→合→中心 离子名称(氧化态Ⅰ、Ⅱ、Ⅲ等)
[Co(NH3)6]Cl3 [Cu(en)2]SO4 H2[SiF6] [Cu(H2O)4]2+
三氯化六氨合钴(Ⅲ) 硫酸二乙二胺合铜(Ⅱ) 六氟合硅(Ⅵ) 酸 四水合铜(Ⅱ)配离子
(3) 多种配体共存时排列顺序 ① 先无机配体,后有机配体; [PtCl2(Ph3P)2] 二氯· 二(三苯基膦)合铂(Ⅱ)
一般若分子无“对称面”或“反演中心”,则 有对映异构体。 ①Mabcd四面体分子有对映体; ②平面正方形配合物某配体中含有手性C、N、P,As 则有对映体; ③八面体没有σ或i,则有对映体。
m C A A B CC AA AA MM BB CB BC A A M B C M C M B C A A
轨道,可以和CN-离子充满电子的pz轨道重叠,而形
成离域∏98键,增强了[Ni(CN)4]2-配离子的稳定性。
Ni 2 +
CN
N C Ni C N C C
N
2Ni(CN)4
N
价键理论的应用和局限性 价键理论可用来: 1、解释许多配合物的配位数和几何构型。 2、可以说明含有离城键的配合物特别稳定。 3、可以解释配离子的某些性质,如[Fe(CN)6]4-(低 自旋型配离子)配离子为什么比[FeF6]3-(高自旋型配离 子)配离子稳定。 价键理论的局限性: 1、价键理论在目前的阶段还是一个定性的理论, 不能定量地或半定量地说明配合物的性质。 2、不能解释每个配合物为何都具有自己的特征光 谱,也无法解释过渡金属配离子为何有不同的颜色。 3、不能解释过渡金属离子的配合物的稳定性随中 心离子的d电子数的变化而变化。
结构化学知识点汇总

结构化学知识点汇总关键信息项:1、原子结构原子轨道电子排布原子光谱2、分子结构化学键类型分子几何构型分子的极性3、晶体结构晶体类型晶格结构晶体的性质11 原子结构111 原子轨道原子轨道是描述原子中电子运动状态的数学函数。
主要包括s 轨道、p 轨道、d 轨道和 f 轨道。
s 轨道呈球形对称,p 轨道呈哑铃形,d 轨道和 f 轨道形状更为复杂。
112 电子排布遵循泡利不相容原理、能量最低原理和洪特规则。
电子按照一定的顺序填充在不同的原子轨道上,形成原子的电子构型。
113 原子光谱原子在不同能级间跃迁时吸收或发射的光子所形成的光谱。
包括发射光谱和吸收光谱,可用于分析原子的结构和成分。
12 分子结构121 化学键类型共价键:通过共用电子对形成,分为σ键和π键。
离子键:由正负离子之间的静电引力形成。
金属键:存在于金属晶体中,由自由电子和金属离子之间的相互作用形成。
氢键:一种特殊的分子间作用力,比一般的范德华力强。
122 分子几何构型通过价层电子对互斥理论(VSEPR)和杂化轨道理论来解释和预测。
常见的分子构型有直线型、平面三角形、四面体型、三角双锥型和八面体型等。
123 分子的极性取决于分子中正负电荷中心是否重合。
极性分子具有偶极矩,非极性分子则没有。
13 晶体结构131 晶体类型离子晶体:由离子键结合而成,具有较高的熔点和硬度。
原子晶体:通过共价键形成,硬度大、熔点高。
分子晶体:分子间以范德华力或氢键结合,熔点和硬度较低。
金属晶体:由金属键维系,具有良好的导电性和导热性。
132 晶格结构晶体中原子、离子或分子的排列方式。
常见的晶格有简单立方、体心立方、面心立方等。
133 晶体的性质各向异性:晶体在不同方向上的物理性质不同。
自范性:能够自发地呈现出多面体外形。
固定的熔点:在一定压力下,晶体具有固定的熔点。
21 量子力学基础211 薛定谔方程是描述微观粒子运动状态的基本方程,通过求解该方程可以得到粒子的能量和波函数。
晶体结构,配合物结构知识点与习题1-1
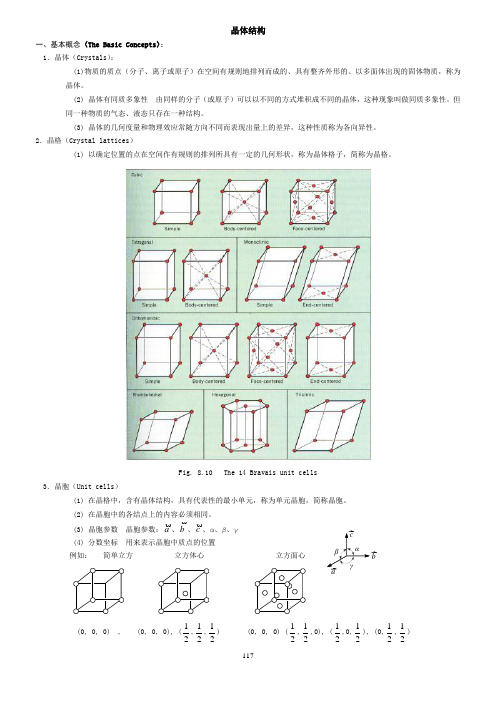
117晶体结构一、基本概念(The Basic Concepts ): 1.晶体(Crystals ):(1)物质的质点(分子、离子或原子)在空间有规则地排列而成的、具有整齐外形的、以多面体出现的固体物质,称为晶体。
(2) 晶体有同质多象性 由同样的分子(或原子)可以以不同的方式堆积成不同的晶体,这种现象叫做同质多象性。
但同一种物质的气态、液态只存在一种结构。
(3) 晶体的几何度量和物理效应常随方向不同而表现出量上的差异,这种性质称为各向异性。
2.晶格(Crystal lattices )(1) 以确定位置的点在空间作有规则的排列所具有一定的几何形状,称为晶体格子,简称为晶格。
Fig. 8.10 The 14 Bravais unit cells3.晶胞(Unit cells )(1) 在晶格中,含有晶体结构,具有代表性的最小单元,称为单元晶胞,简称晶胞。
(2) 在晶胞中的各结点上的内容必须相同。
(3) 晶胞参数 晶胞参数:a、b、c、α、β、γ (4) 分数坐标 用来表示晶胞中质点的位置例如: 简单立方 立方体心 立方面心(0, 0, 0) , (0, 0, 0), (21,21,21) (0, 0, 0) (21,21,0), (21,0,21), (0,21,21) αβγbc a118在分数坐标中,绝对不能出现1,因为1即0。
这说明晶胞是可以前后、左右、上下平移的。
等价点只需要一个坐标来表示即可,上述三个晶胞中所含的质点分别为1、2、4,所以分数坐标分别为1组、2组和4组。
(5) 晶面指数 晶面在三维空间坐标上的截距的倒数(h 、k 、l )来表示晶体中的晶面,称为晶面指数,如立方晶系中(100),(110),(111)面分别为(100) (110)(111)lFig. 8.12 Selected planes and their Miller indices for cubic system用X-ray 的衍射可以测量晶体中的面间距,2d ·sin θ = n ·λ。
人教版高中化学选择性必修二第3章晶体结构与性质第4节配合物与超分子课件

C.[Cr(H2O)4]Cl2·2H2O
D.[Cr(H2O)3]Cl3·3H2O
答案:B
解析:[Cr(H2O)6]Cl3含有3个Cl-,与过量硝酸银溶液反应时
CrCl3·6H2O和AgCl的物质的量之比是1∶3,不是1∶2,故A项
错误;[Cr(H2O)5Cl]Cl2·H2O含有2个Cl-,与过量硝酸银溶液反
3.(1)Zn的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,1
mol该配合物中含有σ键的数目为
(设NA为阿伏加德
罗常数的值)。
(2)下列关于配合物[Zn(NH3)4]Cl2的说法正确的是
。
A.配位数为6
B.配体为NH3和ClC.Zn2+和NH3以配位键结合
D.[Zn(NH3)4]Cl2属于离子化合物
[Cu(NH3)4]2+的球棍模型图可知,配离子内N原子排列成为平
面正方形,可见Cu2+是dsp2杂化,故B项错误;由配离子
[Cu(NH3)4]2+的球棍模型图可知,配体是NH3,NH3中N原子价
层电子对数为4,有1个孤电子对,空间结构为三角锥形,故C项
正确;N的电负性小于O的电负性,O原子给出电子的能力比N
第四节
配合物与超分子
目标素养
1.知道配位键的特点,认识简单的配合物的成键特征,了解配
位化合物的存在与应用。发展宏观辨识与微观探析的化学学
科核心素养。
2.了解人类探索物质结构的过程,了解从原子、分子、超分子
等不同尺度认识物质结构的意义。发展科学探究与创新意识
的化学学科核心素养。
知识概览
一、配合物
(5)配合物中的配体可以是分子,也可以是阴离子。( √ )
晶体结构配合物结构知识点与习题

配合物结构一、配位化合物的定义由提供孤电子对(NH3、H2O、X「)或n电子(H2C= CH2、| 、)的物种与提供适当空轨道的物种(金属原子或金属离子)组成的化合物称为配位化合物,简称为配合物。
二、配位化合物的组成1 .配合物由内界(inner)和外界(outer)组成。
外界为简单离子,配合物可以无外界,但不可以无内界。
例如:Fe(CO)5 Pt(NH3)2Cl22 .内界由中心体(center)和配位体(ligand)组成。
(1) 中心体:提供适当的空轨道的原子或离子,绝大部分是d区或ds区元素。
用M表示。
(2) 配位体(L)(简称配体):提供孤对电子对或n电子的离子,离子团或中性分子。
三、配位化合物的分类 (Classification )1. Classical complexes :配体提供孤电子对,占有中心体的空轨道而形成的配合物。
例如:Ag(NH 3)2 , Cu(CN) 42. n -complexes :配体提供n电子,占有中心体的空轨道而形成的配合物。
例如:Fe(C5H5)2, K[PtCl 3(C2H4)](第一个n配合物,Zeise's salt)出匚CH2 IMM配体提供:2个n电子4个n电子6个n电子四、配位体(L) Ligand1.根据配体中配位原子的不同,配体可分类成:(1) 单基(齿)配体(unidentate ligand ):配体中只含有一个配位原子;例如:NH3、H2。
、X「、(py)N(2) 多基(齿)配体(multidentate ligand ):配体中含有两个或两个以上的配位原子。
由单齿配体组成的配合物,称为简单配合物;由多齿配体组成的配合物,称为螯合物(chelate)。
2 .一些常见的配体:(1) 单基配体:X : F (fluoro)、Cl (chloro)、Br (bromo)、I (iodo)、H2O (aquo)、CO (carbonyl)、NO (nitrosyl)、C5H5N (py)、OH (hydroxo)(2) 双基配体:en (乙二胺)H2NCH2CH2NH2 (ethylenediamine)(oxalate ion^N Ci giy C (氨基乙酸根)O(2,2 -d ipyridyl )(3) 多基配体:EDTA (乙二胺四乙酸)(六齿) (H4Y)HOOCH2C CH2COOHNCH 2CH2N、(ethyle nediami netetracetato)HOOCH2C CH2COOH五、配位数(Coordination Number1.中心原子(或离子)所接受的配位原子的数目,称为配位数2 .若单基配体,则配位数=配体数;若多基配体,则配位数=配体数配位原子数/每个配体3 .确定配位数的经验规则一EAN规则(Effective atomic number rule )或十八电子(九轨道)规则(1) 含义:a. EAN规则:中心体的电子数加上配体提供给中心体的电子数等于某一稀有气体的电子构型( 36, 54,86)+配体提供的电子数=18, (n 1)d10nEnp6b.十八电子规则:中心体的价电子数c .九轨道规则:五个 (n 1)d 轨道(或者五个nd 轨道),1个ns 轨道和3个np 轨道(9个价轨道)都充满电子。
无机化学——配合物结构习题解答②

无机化学——配合物结构习题解答②第10章习题解答②一、是非题1. 价键理论认为,配合物具有不同的空间构型是由于中心离子(或原子)采用不同杂化轨道与配体成键的结果。
.()解:对2. 价键理论能够较好地说明配合物的配位数、空间构型、磁性和稳定性,也能解释配合物的颜色。
()解:错3. 价键理论认为,在配合物形成时由配体提供孤对电子进入中心离子(或原子)的空的价电子轨道而形成配位键。
.()解:对4. 同一元素带有不同电荷的离子作为中心离子,与相同配体形成配合物时,中心离子的电荷越多,其配位数一般也越大。
.()解:对5. 在多数配位化合物中,内界的中心原子与配体之间的结合力总是比内界与外界之间的结合力强。
因此配合物溶于水时较容易解离为内界和外界,而较难解离为中心离子(或原子)和配体。
.()解:对6. 由磁矩测出在[Fe(CN)6]3-中,中心离子的d 轨道上有1个未成对电子,则这个未成对电子应排布在分裂后的dr (e g )轨道上。
()解:错7. 在强场配体形成的配合物中,分裂能大于电子成对能,形成低自旋配合物。
.()解:对8. 在高自旋配合物中,分裂能小于电子成对能,相应的配体称为弱场配体。
()解:对9. 按照晶体场理论,对给定的任一中心离子而言,强场配体造成d 轨道的分裂能大。
()。
解:对10. 按照晶体场理论可知,强场配体易形成高自旋配合物。
()。
解:错11. 晶体场理论认为配合物的中心离子与配体之间的作用力是静电引力。
()解:对12. 具有d 0、d 10结构的配离子都没颜色,因为不能产生d -d 跃迁。
.()解:错13. 按照晶体场理论,在八面体场中,中心离子d 轨道分裂后组成d ε(t 2g )轨道的是d x y 22-和d z2。
()解:错14. 按照晶体场理论,在八面体场中,中心离子分裂后组成dr (eg )轨道的是d xy 、d yz 、d xz 。
()解:错15. 按照晶体场理论,中心离子的电荷数越高,半径越大,分裂能就越小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
配合物结构一、配位化合物的定义由提供孤电子对(NH 3、H 2O 、X -)或π电子(H 2C =CH 2、 )的物种与提供适当空轨道的物种(金属原子或金属离子)组成的化合物称为配位化合物,简称为配合物。
二、配位化合物的组成1.配合物由内界(inner )和外界(outer )组成。
外界为简单离子,配合物可以无外界,但不可以无内界。
例如:Fe(CO)5 Pt(NH 3)2Cl 22.内界由中心体(center )和配位体(ligand )组成。
(1) 中心体:提供适当的空轨道的原子或离子,绝大部分是d 区或ds 区元素。
用M 表示。
(2) 配位体 (L)(简称配体):提供孤对电子对或π电子的离子,离子团或中性分子。
三、配位化合物的分类(Classification )1.Classical complexes :配体提供孤电子对,占有中心体的空轨道而形成的配合物。
例如:+23)Ag(NH ,-34Cu(CN)2.π-complexes :配体提供π电子,占有中心体的空轨道而形成的配合物。
例如:255)H Fe(C ,)]H C (K[PtCl 423(第一个π配合物,Zeise ’s salt )M H 2CCH 2M配体提供:2个π电子 4个π电子 6个π电子四、配位体(L )Ligand1.根据配体中配位原子的不同,配体可分类成:(1) 单基(齿)配体(unidentate ligand ):配体中只含有一个配位原子; 例如:NH 3、H 2O 、X -、 (py)(2) 多基(齿)配体(multidentate ligand ):配体中含有两个或两个以上的配位原子。
由单齿配体组成的配合物,称为简单配合物;由多齿配体组成的配合物,称为螯合物(chelate )。
2.一些常见的配体:(1) 单基配体:X -:F -(fluoro)、Cl -(chloro)、Br -(bromo)、I -(iodo)、H 2O (aquo)、CO (carbonyl)、NO (nitrosyl)、C 5H 5N (py)、OH -(hydroxo)(2) 双基配体:en (乙二胺) H 2NCH 2CH 2NH 2(ethylenediamine )ox 2-(草酸根) (oxalate ion ) gly - (氨基乙酸根)bipy (联吡啶) (2,2’-dipyridyl )(3) 多基配体:EDTA (乙二胺四乙酸)(六齿)(H 4Y)(ethylenediaminetetracetato )五、配位数(Coordination Number )1.中心原子(或离子)所接受的配位原子的数目,称为配位数2.若单基配体,则配位数 = 配体数;若多基配体,则配位数 = 配体数 ⨯ 配位原子数 / 每个配体 3.确定配位数的经验规则—EAN 规则(Effective atomic number rule )或十八电子(九轨道)规则(1) 含义:a .EAN 规则:中心体的电子数加上配体提供给中心体的电子数等于某一稀有气体的电子构型(36,54,86)b .十八电子规则:中心体的价电子数 + 配体提供的电子数 =18,(n - 1)d 10n s 2n p 6NO C O COO H 2NCH 2C O O N N HOOCH 2CNCH 2CH 2N HOOCH 2C CH 2COOH CH 2COOHc .九轨道规则:五个 (n - 1)d 轨道(或者五个n d 轨道),1个n s 轨道和3个n p 轨道(9个价轨道)都充满电子。
(2) 应用a .确定配位数:Fe(CO)x (NO)y 8 + 2x + 3y = 18∴x = 5,y = 0 或 x = 2,y = 2b .判断配合物是否稳定:4HCo(CO) -4Co(CO) 4Co(CO) 18e (stable) 18e (stable) 17e (unstable)c .可以判断中性羰基配合物是否双聚Mn(CO)5 17e ,2Mn(CO)5 → Mn 2(CO)10,Co(CO)4,2Co(CO)4 → Co 2(CO)8 d .判断双核配合物中金属原子之间是否存在金属键(式中数字为配体提供的电子数以及中心体的价电子数)18216421=++++⨯+x 1811725=+++++x∴ x = 0 无金属键 ∴ x = 2 有金属键 e .正确书写配合物的结构式:455)H Fe(C -21033]CO)(Re H [f .正确书写反应方程式: Re 2O 7 + 17CO Re 2(CO)10 + 7CO 2+ Fe(CO)2 + 2COCr(CO)6 + 4NOCr(CO)4 + 6CO六、配位化合物的命名(The Nomenclature of Coordination Compounds )1.从总体上命名(1) 某化某:外界是简单阴离子,[Cr(H 2O)4Cl 2]Cl ,氯化二氯·四氨合铬(Ⅲ) (2) 某酸某:a .外界是含酸根离子:[Co(NH 3)5Br]SO 4:硫酸溴·五氨合钴(Ⅲ)b .内界是配阴离子:K 3[Fe(CN)6]:六氰合铁(Ⅲ)酸钾 2.内界的命名(1) 内界的命名顺序:配体名称 + 合 + 中心体名称 + (用罗马数字表示的中心体氧化数)例如:[PtCl 2(NH 3)(C 2H 4)]:二氯·氨·(乙烯)合铂(Ⅱ)(2) 配体的命名顺序:a .先无机配体后有机配体,有机配体名称一般加括号,以避免混淆;b .先命名阴离子配体,再命名中性分子配体;c .对于都是中性分子(或阴离子),先命名配体中配位原子排在英文字母顺序前面的配体,例如NH 3和H 2O ,应先命名NH 3;d .若配位原子数相同,则先命名原子数少的配体。
例如:NH 3、NH 2OH ,先命名NH 3。
(3) 配体的名称a .英文的数字前缀mono(一) di(二) tri(三) tetra(四) penta(五)Cl(OC)4W 4Cl (C 5H 5)(OC)MnMn(CO)(C 5H 5)O OCCx Re H CORe Re COCO COH HOC OCOCOCCOCOFe(CO)3hexa(六) hepta(七) octa(八) nona(九) deca(十) b .M ←SCN 硫氰酸根 (-SCN) thiocyano M ←NCS 异硫氰酸根 (-NCS) isothiocyanoM ←NO 2 硝基 (-NO 2) nitro来自HO -NO 2 M ←ONO 亚硝酸根 (-ONO) nitrito 来自H - ONONO 亚硝酰基 nitrosylCO 羰基 carbonylM ←CN 氰根 cyano M ←NC 异氰根isocyano3.多核配合物的命名在桥基配体名称前面加上希腊字母μ ,例如:3323Fe(CO)CO)Fe((OC)-μ 三( μ-羰基)·二[三羰基合铁(0 )]二( μ- 氯)·二[二氯合铁(Ⅲ)]氯化μ – 羟·二[五氨合铬(Ⅲ)]七 几种常见配位数的配合物的几何异构现象 a .四配位:(i) 正四面体:不存在几何异构体, AA, A-cis -t r a n s +]Cl )[Co(NH 243 ]O)(H RuCl [323-c i s -t r a n s -fac -mer(4) 确定几何异构体的方法 −− 直接图示法a .只有单齿配体的配合物 以Ma 2cdef 为例 (9种): 第一步,先确定相同单齿配体的位置Cl Fe Cl Cl Cl Fe ClCl [(NH 3)Cr O H Cr(NH 3)5]Cl 5NH 3CoNH 3H 3N Cl H 3N Cl CoCl H 3N NH 33H 3Cl RuOH 2H 2O Cl H 2O OH 2RuOH 2Cl ClOH 2M aa M aa① ②第二步,再确定其他配体的位置 ① (6种):② (3种):b .既有单齿配体,又有双齿配体的配合物 以M(AB)2ef 为例 (6种)第一步,先固定双齿的位置① ②第二步,确定双齿配体中配位原子的位置. ①②第三步,最后确定单齿配体的位置.八 配合物的化学键理论⑴价键理论1.价键理论的基本内容:(1) 配合物的中心体M 与配体L 之间的结合,一般是靠配体单方面提供孤对电子对与M 共用,形成配键M ←∶L ,这种键的本质是共价性质的,称为σ配键。
(2) 形成配位键的必要条件是:配体L 至少含有一对孤对电子对,而中心体M 必须有空的价轨道。
(3) 在形成配合物(或配离子)时,中心体所提供的空轨道(s 、p ,d 、s 、p 或s 、p 、d)必须首先进行杂化,形成能量相同的与配位原子数目相等的新的杂化轨道。
2.讨论:(1) 配合物中的中心体可以使用两种杂化形式来形成共价键:一种杂化形式为(n 1)d 、n s 、n p 杂化,称为内轨型杂化。
这种杂化方式形成的配合物称为内轨型配合物(inner complexes );M a f a c M d a c e M a d a c M a c a de M a c a d M a c a e M d c a a M e c a a Md c aa M M M B A A BMB A M B B AA MB A M A B M B A A B e MB A B ef M B B A A M B AM B A M A B另一种杂化形式为n s 、n p 、n d 杂化,称为外轨型杂化,这种杂化方式形成的配合物称为外轨型配合物(outer complexes );(2) 对于四配位:a .正四面体配合物:中心体一定采取sp 3杂化,一定是外轨型配合物,对于(n - 1)d 10电子构型的四配位配合物,一定为四面体。
b .平面四方配合物:中心体可以采取dsp 2杂化,也可以采取sp 2d 杂化,但sp 2d 杂化类型的配合物非常罕见。
舍去低能n p 价轨道而用高能n d 价轨道的杂化是不合理的。
☆ 对于(n - 1)d 8电子构型四配位的配合物(或配离子):+243)Ni(NH 、-24Ni(CN),前者为正四面体,后者为平面四方,即前者的Ni 2+采取sp 3杂化,后者的Ni 2+采取dsp 2杂化。
而Pd 2+、Pt 2+为中心体的四配位配合物一般为平面四方,因为它们都采取dsp 2杂化。
Ni 2+的sp 3杂化:3d83d4s4pNi 2+的dsp 2杂化3d4s4pdsp 2杂化(3) 对于六配位:中心体既能采取sp 3d 2杂化,也能采取d 2sp 3杂化。
