必修1 第一单元 丰富多彩的化学物质 知识点总结
苏教版高中化学必修1复习提纲

苏教版高中化学必修1复习提纲专题一化学家眼中的物质世界第一单元丰富多彩的化学世界一、物质的分类及转化物质的分类(可按组成、状态、性能等来分类物质混合物非均匀混合物均匀混合物纯净物单质非金属单质金属单质化合物有机化合物无机化合物氧化物金属氧化物非金属氧化物…酸碱盐…物质的转化(反应类型四种基本反应类型:化合反应,分解反应,置换反应,复分解反应化学反应本质氧化还原反应化学反应离子反应非氧化还原反应非离子反应氧化还原反应1.氧化还原反应:有电子转移的反应2.氧化还原反应实质:电子发生转移判断依据:元素化合价发生变化3.氧化还原反应中电子转移的表示方法1.双线桥法表示电子转移的方向和数目注意:a.“e-”表示电子。
b.双线桥法表示时箭头从反应物指向生成物,箭头起止为同一种元素,应标出“得”与“失”及得失电子的总数。
c.失去电子的反应物是还原剂,得到电子的反应物是氧化剂d.被氧化得到的产物是氧化产物,被还原得到的产物是还原产物2.单线桥法(从失→得还原剂氧化剂氧化还原反应和四种基本反应类型的关系氧化还原反应中:化合价升高总数=化合价降低总数元素失电子总数=元素得电子总数离子反应(有离子参加的化学反应离子方程式的书写:1.写2.拆:(可简单认为强酸、强碱、可溶性盐拆3.删4.查(遵循:电荷守恒、质量守恒二、物质的量1、物质的量是一个物理量,符号为n,单位为摩尔(mol2、1 mol粒子的数目是0.012 kg 12C中所含的碳原子数目,约为6.02×1023个。
3、1 mol粒子的数目又叫阿伏加德罗常数,符号为NA,单位mol-1。
4、使用摩尔时,必须指明粒子的种类,可以是分子、原子、离子、电子等。
5.、三、摩尔质量1、定义:1mol任何物质的质量,称为该物质的摩尔质量。
用符号:M表示,常用单位为g•mol -12、数学表达式:四、物质的聚集状态1、物质的聚集状态:气态、液态和固态2、气体摩尔体积单位物质的量的气体所占的体积。
高一上化学知识点第一章

高一上化学知识点第一章化学是自然科学的重要分支,它研究物质的组成、性质、结构和变化规律。
高中化学作为基础课程之一,涵盖了丰富的知识点。
本文将介绍高一上学期化学知识点的第一章内容,包括物质的结构、性质与分类,以及元素的周期律等。
一、物质的结构物质是构成一切事物的基本单位。
根据物质的结构,我们可以将其分为单质和化合物两大类。
单质是由同种元素构成的纯净物质,如氧气、水银等。
化合物则是由不同元素以一定比例结合而成的物质,如水、二氧化碳等。
在化合物中,原子通过化学键结合在一起,形成分子或离子。
分子是由非金属元素通过共价键结合而成的,如氧气分子O2、水分子H2O等。
离子是由金属元素和非金属元素通过离子键结合而成的,如氯化钠NaCl、氢氧化钠NaOH等。
二、物质的性质与分类物质的性质是指物质表现出来的各种特征和行为。
根据物质的性质,我们可以将其分为物理性质和化学性质。
物理性质是在不改变物质组成的情况下可以观察到的性质,如颜色、形状、密度等。
化学性质则是物质与其他物质发生反应时表现出来的性质,如燃烧、腐蚀等。
物质还可以按照其在化学反应中的参与方式进行分类。
反应物是指参与反应并被消耗的物质,生成物则是反应过程中生成的物质。
根据反应物和生成物的不同,我们可以将物质分为单质反应和化合物反应两大类。
三、元素的周期律元素是组成物质的基本单位,目前已知的元素共有118种。
元素的周期律是指元素按照一定规律排列的系统。
按照元素的周期律,我们可以将元素分为周期表中的不同区域,如周期、主族、过渡元素等。
元素周期表是将元素按照原子序数递增的顺序排列而成的表格。
每个元素都有自己独特的原子序数、原子符号和原子质量。
周期表中的横行被称为周期,共有7个周期。
周期表中的竖列被称为族,共有18个主族和10个过渡族。
元素周期表的主要特征是周期性规律。
原子序数递增的元素,其物理性质和化学性质都表现出周期性变化。
例如,同一周期内的元素,原子半径逐渐减小,电子亲和能逐渐增大;同一族的元素,具有相似的化学性质,如钠、铜等都属于1A族元素,具有较强的金属性质。
化学必修一第一章知识点总结

化学必修一第一章知识点总结哇塞!化学必修一第一章,那可真是个神奇的知识世界!首先咱们来说说化学实验安全。
这就好比我们出门玩耍,得先知道哪里有危险,才能好好玩不是?在实验室里,可不能随便乱碰那些化学药品,不然就像不小心碰到了老虎的尾巴,后果不堪设想!比如强酸强碱,那可厉害啦,要是不小心沾到手上,哎哟喂,皮肤不得“哭鼻子”呀!还有那些容易燃烧、容易爆炸的东西,可得小心存放,不然就像点燃了炸药包,“砰”的一下,那可不得了!再说说物质的分类。
这就好像给咱们的小伙伴分分类一样。
混合物就像是一群性格各异的小伙伴凑在一起,啥样的都有;纯净物呢,就像是一个班级里都是志同道合的好朋友。
而单质和化合物,就好比男生和女生,各有各的特点。
单质是那种“独来独往”的家伙,化合物则是几个小伙伴手拉手组成的小团队。
然后是离子反应。
这离子啊,就像一群调皮的小精灵,在溶液里跑来跑去。
当它们碰到一起,发生反应的时候,就像是小伙伴们一起做游戏,有的组合在一起,有的又分开了。
比如说盐酸和氢氧化钠反应,氢离子和氢氧根离子一见面,就变成了水,这多有趣呀!还有氧化还原反应。
这可有点复杂啦,不过别怕!就好像一场战斗,有得电子的胜利者,也有失电子的失败者。
氧化剂就像是英勇的战士,夺取了电子;还原剂呢,则是无奈的失败者,失去了电子。
比如说铜和硝酸的反应,铜失去电子变成铜离子,硝酸得到电子变成一氧化氮,这不是一场激烈的“战斗”吗?哎呀,总结起来,化学必修一第一章的知识真是丰富多彩,就像一个装满宝贝的大箱子,每打开一个小格子都有惊喜!难道你不觉得这些知识超级有趣吗?难道你不想更深入地去探索化学的世界吗?我觉得呀,只要我们用心去学,化学一定能成为我们的好伙伴!。
高中化学苏教版必修1知识点全面总结
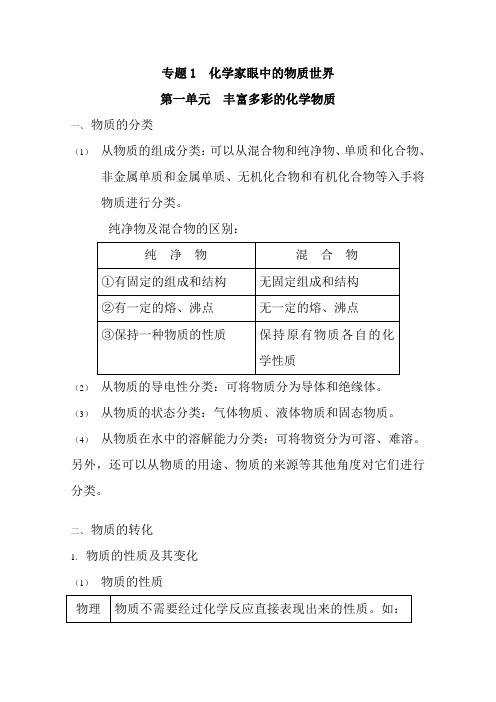
专题1 化学家眼中的物质世界第一单元丰富多彩的化学物质一、物质的分类(1)从物质的组成分类:可以从混合物和纯净物、单质和化合物、非金属单质和金属单质、无机化合物和有机化合物等入手将物质进行分类。
纯净物及混合物的区别:(2)从物质的导电性分类:可将物质分为导体和绝缘体。
(3)从物质的状态分类:气体物质、液体物质和固态物质。
(4)从物质在水中的溶解能力分类:可将物资分为可溶、难溶。
另外,还可以从物质的用途、物质的来源等其他角度对它们进行分类。
二、物质的转化1.物质的性质及其变化(1)物质的性质性质颜色、状态、气味、熔点、沸点、密度、硬度等化学性质物质在发生化学反应时表现出来的性质。
如:酸性、碱性、氧化性、还原性、可燃性、稳定性等(2)物质的变化物理变化定义物质发生状态或外形的改变,而没有生成新物质的变化。
如:水结成冰,蔗糖的溶解,酒精的挥发,金属通电,活性炭的吸附漂白等化学变化定义物质发生变化时生成了其他物质的变化。
在化学变化中常伴随有发光、热效应、变色、气体放出、沉淀生成等现象。
如:金属的腐蚀、物质的燃烧、食品的腐败变质、铵盐受热分解等类型按反应形式可分为:分解、化合、置换、复分解按反应的本质可分为:氧化还原反应、非氧化还原反应按参及反应的离子可分为:离子反应、分子反应按反应进行的程度可分为:可逆反应、不可逆反应2.无机化学反应一般规律(1)金属+非金属→无氧酸盐 Mg+Cl2MgCl2(2)碱性氧化物+酸性氧化物→含氧酸盐 CaO+CO2=CaCO3(3)酸+碱→盐+水 2HCl+Ba(OH)2=BaCl2+H2O(4)盐+盐→两种新盐 AgNO3+NaCl=AgCl↓+NaNO3一般参加反应的两种盐可溶,反应向生成更难溶物质的方向进行。
(5)金属+氧气→碱性氧化物 2Cu+O2 2CuO(6)碱性氧化物+水→碱 CaO+ H2O=Ca(OH)2一般生成的是可溶性的强碱,如CuO、Fe2O3等不能及H2O反应生成相应的氢氧化物(碱)。
1650936专题1 第一单元 丰富多彩的化学物质

专题1 第一单元丰富多彩的化学物质第1课时物质的分类与转化一、物质的分类1.物质的分类依据为了更好地认识和研究物质,人们常根据物质的________、________、________等对物质进行分类。
根据物质的存在状态,将物质分为__________、__________和__________;根据物质的导电性,将物质分为________、__________和__________;根据物质在水中的溶解性,将物质分为____________、________________和______________。
2.物质分类方法(1)按组成结构分类(2)根据物质的性质分类如氧化物的分类①酸性氧化物a.概念:能够与碱反应生成________的氧化物。
b.举例:写出CO2和NaOH溶液反应的化学方程式:___________。
②碱性氧化物a.概念:能够与酸反应生成________的氧化物。
b.举例:写出CaO和盐酸反应的化学方程式:____________________________。
二、物质的转化12.钙及其化合物之间的转化写出上述反应的化学方程式:①________________________________________________________________________ ②________________________________________________________________________ ③________________________________________________________________________ ④________________________________________________________________________ ⑤________________________________________________________________________ 三、化学反应的几种类型1.以反应物和生成物的类别、反应前后物质的种类为分类依据,化学反应可分为:____________、____________、__________和____________。
苏教版高中化学必修一知识点(全)
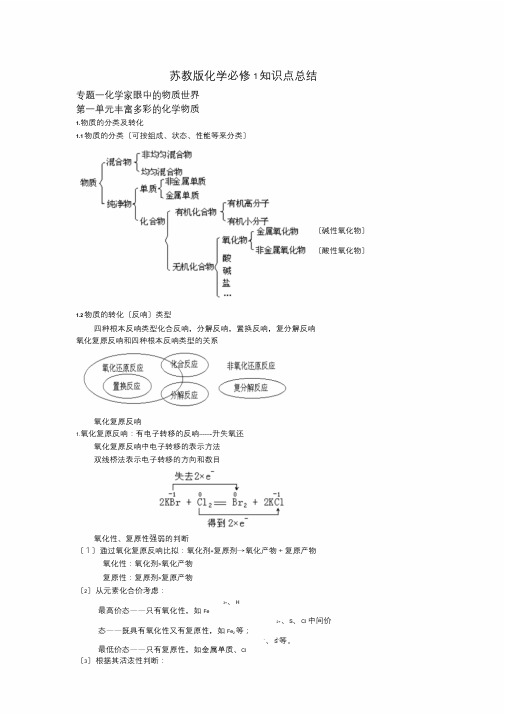
苏教版化学必修1知识点总结专题一化学家眼中的物质世界第一单元丰富多彩的化学物质1.物质的分类及转化1.1物质的分类〔可按组成、状态、性能等来分类〕〔碱性氧化物〕〔酸性氧化物〕1.2物质的转化〔反响〕类型四种根本反响类型化合反响,分解反响,置换反响,复分解反响氧化复原反响和四种根本反响类型的关系氧化复原反响1.氧化复原反响:有电子转移的反响-------升失氧还氧化复原反响中电子转移的表示方法双线桥法表示电子转移的方向和数目氧化性、复原性强弱的判断〔1〕通过氧化复原反响比拟:氧化剂+复原剂→氧化产物+复原产物氧化性:氧化剂>氧化产物复原性:复原剂>复原产物〔2〕从元素化合价考虑:3+、H最高价态——只有氧化性,如Fe2+、S、Cl 中间价态——既具有氧化性又有复原性,如Fe2等;-、S2-等。
最低价态——只有复原性,如金属单质、Cl〔3〕根据其活泼性判断:①根据金属活泼性:对应单质的复原性逐渐减弱KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu对应的阳离子氧化性逐渐增强②根据非金属活泼性:对应单质的氧化性逐渐减弱Cl2Br2I2S对应的阴离子复原性逐渐增强(4)根据反响条件进展判断:不同氧化剂氧化同一复原剂,所需反响条件越低,说明氧化剂的氧化剂越强;不同复原剂复原同一氧化剂,所需反响条件越低,说明复原剂的复原性越强。
如:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O△MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O前者常温下反响,后者微热条件下反响,故物质氧化性:KMnO4>MnO2(5)通过与同一物质反响的产物比拟:如:2Fe+3C2l=2FeC3l Fe+S=FeS可得氧化性Cl2>S离子反响〔1〕电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。
酸、碱、盐都是电解质。
在水溶液中或熔化状态下都不能导电的化合物,叫非电解质。
物质的分类与转化

(3) 根 据分类 角 度 不同 , 同 一物 质 可 以属 于 不 同的 类 别 ,如 Na2CO3 可以属于纯净物、化合物或钠盐,也属于固体,也属于 可溶性物质,因此在分类时要明确分类的依据。
于谦的《石灰吟》赞颂了石灰石 (碳酸钙)“粉身碎骨浑不怕,要 留清白在人间”的品格。其中 碳酸钙属于 A.单质 C.酸 ( )
由金属阳离子和酸根组成属于盐
B.氧化物 D.盐
从对化合物的分类方法出发,指出下列各组物质中与其他类型不同的 一种物质。 SO2 (1)Na2O、CaO、SO2、CuO________________ 。 NaClO3 (2)NaCl、KCl、NaClO3、CaCl2______________ 。 HCl (3)HClO3、KClO3、HCl、NaClO3____________ 。
1
2
3
4
5
2. ClO2 是生产饮用水的新一代消毒剂。 从物质分类来看, ClO2 属于 A.氧化物 C.碱 B.酸 D.
5
3.实验室中的药品常按物质的性 质、类别等不同而有规律地放 置。在做“酸的性质”实验时, 实验桌上部分药品的摆放如图 所示。 某同学取用 KOH 溶液后 应把试剂瓶放回的位置是
物质的分类与物质的性质。
一 物质的分类 1.物质的分类方法 (1)根据物质存在的状态: 分为固态物质、液态物质和气态物质。 (2)根据物质的导电性: 分为导体、半导体、绝缘体。 (3)根据物质在水中的溶解性:
分为可溶性物质、微溶性物质、难溶性物质。
第一单元---丰富多彩的化学物质课件

根据物质的组成分:
稀有气体分在哪一类?
物质
混合物
均匀混合物: 非均匀混合物:
金属单质
溶液、胶体分散系、合金 悬浊液、乳浊液
单质
非金属单质
包括稀有气体
纯净物 化合物
无机化合物
酸、碱、盐、氧化物、氢化 物、配合物……
有机化合物
问题解决:完成教材P3问题解决
物质
混合物
均匀混合物: 非均匀混合物:
金属单质
思考:为什么摩尔质量以g .mol-1为单位时,数值上等于其相对式量?
回顾
▪ 初中学习的相对分子质量、相对原子质量的标准是什么? ▪ 你能结合通过初中相对原子质量的定义 ▪ 式推导某元素X的摩尔质量么?
填空
(1)氯分子的摩尔质量是 (2) 氢氧化钠的摩尔质量是 (3) 镁原子的摩尔质量是 (4)Cl-离子的摩尔质量是 (5)K+ 离子的摩尔质量是
2、填空: 1molH2所含氢气分子的个数
。2mol氢分子含
原子。0.5molClO3-含
个氯酸根离子。
个氢分子,含 个氢
填空
(1)1 mol 碳原子约含有
个6.0碳2原×子1023
(2)0.3 mol 硫酸分子约含有
0个.3硫×酸6.0分2×子1023
(3)10 mol 钠离子约含有
1个0×钠6离.0子2×1023
[例 2] 2. 5 mol 铜原子的质量是多少克
解: 铜的原子量是 63. 5 , 铜的摩尔质量是 63.5 g/mol 。
m (Cu) =
63.5g/mol ×
2.5 mol
答:2.5mol 铜原子的质量等于 158.8g 。
= 158.8g
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一单元丰富多彩的化学物质
一、物质的分类方法
①根据存在状态分:气态,固态和液态
②根据导电性能分:导体,半导体和绝缘体
③根据眼的溶解性分:可溶性的盐,难溶性的盐和不溶性的盐
④根据物质的组成分:混合物和纯净物
稳定的混合物:溶液,空气等
混合物(多种物质构成) 不稳定的混合物:泥土,矿石等
金属单质:Na、Fe、Cu等
物质单质
一种元素非金属单质:Cl2、H2、、O2、O3、C60等
纯净物酸:HCl、H2CO3等
(一种物质)无机化合物碱:NaOH、Ba(OH)2、NH3·H2O等
化合物盐:Na2CO3、NaHSO4、Cu(OH)2(CO3)2
两个或氧化物:CO、CO2、CuO等
两个以上元素有机化合物:CH3COOH、CH4、C2H6、CH3CH2OH等
二、物质的转化
意义:一定条件下,不同类别的物质是可以转化的。
研究物质的转化,不仅可以探索自然界已经存在的物质,更重要的是利用物质的转化可以进一步制造人类需要的新物质
(1)不同类别物质间的转化:一定条件下,不同类别的物质间可以转化
(1)按反应类型研究物质的转化
①四大基本反应类型的化学反应
反应类型实例
A+B====AB Ca+Cl2=====CaCl2化合反应
AB==== A+B 分解反应
AB+C====A+CB Ca+H2O====Ca(OH)2+H2↑置换反应
AB+CD====AD+CB CaO+2HCl====CaCl2+H2O 复分解反应
②两类反应发生的条件:
A.在水溶液中,发生复分解反应需具备下列条件之一:生成沉淀(包括微溶性物质),生成气体,生成水(严格讲是生成难电离的物质)
B.在水溶液中,一种金属与另一种可溶性的金属盐溶液发生置换反应应具备的条件是:活动性强的金属置换
活动性弱的金属(除K 、Ca 、Na 外)
(2)按照反应前后元素的化合价是否变化研究物质的转化 反应类型 反应前后元素化合价是否
变化
实例
氧化还原反应 升(被氧化),降(被还原) Ca+Cl 2=====CaCl 2 非氧化还原反应
没有变化
CaO+2HCl====CaCl 2+H 2O
氧化还原反应与四大反应之间的关系如下图所示
三、物质的量
1.物质的量
① 物质的量是七个基本物理量之一(长度l 质量m 时间s 物质的量n ),
② 意义:表示含有一定量数目的粒子的集体,适用范围:肉眼看不到的微粒,如原子,分子,离子等。
③ 符号为:n ,单位为:摩尔(mol )。
④ 物质的量的基准(N A ):以0.012kg 12
C 所含的碳原子数即阿伏加德罗常数作为物质的量的基准。
阿伏加德罗 常数可以表示为N A ,其近似值为6.02×1023 mol -1 ⑤ 1mol 任何微粒所含有的数目为6.02×1023
mol -1
⑥ 关系式:n =A
N N
2.摩尔质量(M )
① 定义:1mol 任何物质的质量的质量(以克为单位),称为该物质的摩尔质量 ② 符号:M 单位:g/mol
③ 摩尔质量与相对分子质量、相对原子质量的联系和区别
联系:摩尔质量以g/mol 作为单位时,在数值上等于该物质的式量(相对分子式量,相对原子质量或原子
团、离子式量)
区别:两者意义不同,摩尔质量的单位是g/mol ,相对分子质量、相对原子质量的单位时“1”。
④ 关系式:n =
M
m
四、物质的聚集状态
(1)物质的聚集状态 物质的聚集状态
微观结构
微粒运动方式
宏观性质
固态 微粒排列紧密,微粒间的空隙很小 在固定的位置上振动 有固定形状,几乎不能被压缩
液态 微粒排列的较紧密,微粒间空隙较小
可以自由移动 没有固定形状,不易被压缩 气态
微粒间的距离较大
可以自由移动
没有固定形状,容易被压缩
固体可以分为:晶体和非晶体 (2)晶体和非晶体物质的区别 区别 固体 晶体
非晶体
外观
有规则几何外形
一般不具有规则几何外形
氧化还原
非氧化
置换
分解
复分解
化合
性质 有固定熔、沸点
无固定熔、沸点 类型
盐、酸、盐、水、CO 2的固态
玻璃、石蜡
非晶体也能制成具有几何外形的固体,因此,不能简单地从外观上区别晶体和非晶体
五、气体摩尔体积
(1)1mol 不同物质的体积
相同条件下,1mol 固体和液体的体积一般不同
相同条件下,1mol 任何气体的体积相同,在标准状况下(0℃和101kPa )约为22.4 L (2)影响物质体积大小的因素
物质的体积大小取决于构成物质的粒子数目、粒子的大小和粒子之间距离
1mol 任何物质中的粒子数目相同,即约为6.02×1023。
因此1mol 物质的体积大小主要取决于构成物质 的粒子大小和粒子之间的距离
(3)气体摩尔体积
1.定义:单位物质的量的气体所占的体积,叫做气体摩尔体积。
2.表示符号:Vm
3.单位:L/mol (或L·mol -1)
4.标准状况下,气体摩尔体积约为22.4L/mol
5.数学表达式:气体的摩尔体积=气体的物质的量
气体所占的体积
, 即n
V
V m
6. 气体摩尔体积的一个特例就是标准状况下的气体摩尔体积(V 0)。
在标准状况下,1mol 任何气体的体积
都约等于22.4 L 。
在理解标准状况下的气体摩尔体积时,不能简单地认为“22.4 L 就是气体摩尔体积”,因为这个22.4 L 是有特定条件的。
这些条件就是:
①标准状况,即0℃和101.325 kPa ,气体的物质的量为1 mol ,只有符合这些条件的气体的体积才约是
22.4 L 。
因此,22.4 L 是1 mol 任何气体在标准状况下的体积。
②这里所说的标准状况指的是气体本身所处的状况,而不指其他外界条件的状况。
例如,“1 mol H 2O(g)
在标准状况下的体积为22.4 L”是不正确的,因为在标准状况下,我们是无法得到气态水的。
③1mol 任何气体的体积若为22.4 L ,它所处的状况不一定就是标准状况。
根据温度、压强对气体分子间
平均距离的影响规律知,温度升高一倍或压强降低一半,分子间距将增大一倍;温度降低一半或压强增大一倍,分子间距将减小一半。
由此可知,1 mol 任何气体在0℃ 、101 kPa 条件下的体积与273℃ 、202kPa 条件下的体积应相等,都约为22.4L 。
六、阿伏伽德罗定律及其推论
七、物质的分散系
(1)分散系
分散系:一种(或多种)物质分散到另一种(或多种)物质中形成的混合物
分散质:被分散的物质
分散剂:分散其他物质的物质
(2)溶液、胶体、浊液比较
分散系溶液胶体浊液
分散质粒子的直径<1nm 1nm-100nm >100nm
分散质粒子组成分子或离子许多分子集合体或高分子巨大数目分子集合体外观均一、透明均一、透明不均一、不透明
稳定性稳定较稳定不稳定
能否透过滤纸(过滤)能能不能
能否透过半透膜渗析能不能不能
是否有丁达尔现象无有无
分类饱和溶液、不饱和溶液固体胶、液溶胶、气溶胶悬浊液、乳浊液
实例食盐水、蔗糖水Fe(OH)3胶体、淀粉溶液淀粉溶液、蛋白
质溶液烟、云、雾、有色玻璃、烟水晶
石灰乳、油水、泥水
(3)胶体的性质:
①丁达尔现象:当一束强光透过胶体时,可以看到一条光亮的通路。
(用来区别溶液和胶体)
②胶体有较强的吸附能力
③电泳现象,胶体的聚沉(要使胶体发生聚沉现象:加入电解质,加入胶粒带相反电荷的胶体,加热胶体
即即加热)
八、电解质和非电解质
(1)电解质与非电解质的区别
电解质非电解质
概念在水溶液或熔融状态下能导电的化
合物在水溶液中或熔融状态下都不能导电的化合物
溶于水或熔融时能否直接电离能电离不能电离
溶于水或熔融时通电的现象能导电不能导电
在水溶液中(或熔融时)的存在形
式
离子或离子和分子只有分子形式
举例HCl、NaCl、酒精、CO
2 /SO
2
注意事项:①电解质必须是化合物,单质、混合物既不是电解质也不是非电解质,如金属等
②电解质必须是自身能电离出自由移动离子化合物,某些物质的水溶液能导电,是由于它跟水作
用生成了能电离的物质,而非自己发生了电离
(2)电离:电解质溶于水或受热熔化时,离解成自由移动的离子的过程。
电离方程式:用离子符号和化学式来表示电解质电离的式子。
如NaOH=Na+ + OH-
注意事项:电离是电解质溶液能导电的前提条件。
电解质必须在水溶液或熔融状态下才能导电。
