景峰医药:关于子公司药品获得美国ANDA批准文号的公告
药品不良反应报告表(范例)

药品不良反应/ 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重■一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
13
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1)导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应.说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告.
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系.根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等.在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
14。
美国FDA给予药企的警告信(含中文翻译)

WARNING LETTERCMS 535005December 19, 2017VIA UPS NEXT DAY AIRPaul F. Devine, CEO/PresidentC.O. Truxton, Inc.136 Harding AvenueBellmawr, NJ 08031Dear Mr. Devine:The U.S. Food and Drug Administration (FDA) inspected your drug manufacturing facility, C.O. Truxton, Inc. (“Truxton”), at 136 Harding Avenue, Bellmawr, New Jersey (FEI 2220338), from April 17 to June 1, 2017.This warning letter summarizes significant violations of current good manufacturing practices (CGMP) regulations for finished pharmaceuticals. See 21 CFR, parts 210 and 211.Because your methods, facilities or controls for manufacturing, processing, packing, or holding do not conform to CGMP, your drug products are adulterated within the meaning of section 501(a)(2)(B) of the Federal Food, Drug, and Cosmetic Act (FD&C Act), 21 U.S.C. 351(a)(2)(B).In addition, your firm mislabeled drug products, causing them to be misbranded under section 502(b)(2) and 502 (e)(1)(A)(ii) of the FD&C Act, 21 U.S.C. 352(b)(2) and 21 U.S.C. 352(e)(1)(A)(ii). By introducing adulterated and misbranded drugs into interstate commerce you are in violation of section 301(a) of the FD&C Act, 21 U.S.C. 331(a).We reviewed your June 14, 2017, response in detail.During our inspection, our investigator observed specific violations including, but not limited to, the following.CGMP Violations1. Your firm failed to establish a quality control unit with the responsibility and authority to approve or reject all components, drug product containers, closures, in-process materials, packaging materials, labeling, and drug products (21 CFR 211.22(a)).Your firm failed to establish a quality control unit for your drug repackaging operation and you lacked written procedures for production or quality unit responsibilities.You did not address this observation in your response. You stated that “some items were not addressed, as they should not have been done and will not be done by C.O. Truxton Inc., in the future.” We are unclear as to what specific items you referred to in your response.In your response to this letter, provide your procedure detailing the responsibilities of the quality control unit, and outline your repackaging operations with their corresponding procedures. In addition, specify which operations your firm has ceased to perform and the dates on which such operations were halted.2. Your firm failed to establish and follow written procedures to assure that correct labels and packaging materials are used for drug products (21 CFR 211.130).Your firm performs repackaging and labeling operations but did not have written procedures governing the application of packaging and labeling materials to your drug products. You incorrectly labeled a container filled with Phenobarbital tablets 30 mg as Phenobarbital tablets, USP 15 mg (schedule IV) lot 70952A. In the affidavit collected during the inspection, you stated, “I have no records to show the repackaging operation.”You did not address this observation in your response. In your response to this letter, provide your plan, including written procedures, to ensure compliance with CGMP for all drug repackaging activities in which you engage.3. Your firm failed to establish and follow adequate written procedures describing the handling of all written and oral complaints regarding a drug product (21 CFR 211.198(a).Your firm lacked an adequate procedure for handling complaints. You received a complaint regarding a bottle labeled as Phenobarbital Tablets USP (15 mg, 1000 count), lot 70952A. The product received was actually Phenobarbital Tablets USP (30 mg, 1000 count.) You sold this drug product to both human and animal clinics. Your firm did not maintain a record of the complaint or investigate it to determine the cause of the labeling mix-up.In response to our inspection, you drafted and submitted a complaint handling procedure. However, this procedure is inadequate because it lacks adequate provisions to investigate the complaints you receive.In your response to this letter, provide your complaint handling procedure, including cataloguing, tracking, and investigating complaints.4. Your firm failed to establish a written distribution procedure to includea system by which each lot of drug product can be readily determined to facilitate its recall if necessary (21 CFR 211.150(b)).Your firm lacked any procedures describing your drug distribution system. Your distribution system was deficient in that it could not differentiate between the lot number your firm assigns and the lot number assigned by the manufacturer, and therefore there is no product traceability if a recall is required. Our investigator observed that neither your receiving or shipping records included the lot numbers of products you received and shipped.In your response, you stated that, moving forward, only Phendimetrazine manufactured and packaged by (b)(4)will bear the Truxton label. Your response was inadequate because you did not address your firm’s lack of traceability for your repackaged drug products.In your response to this letter, provide your drug distribution and tracking procedures for your repackaged drug products.5. Your firm failed to establish and follow a written testing program designed to assess the stability characteristics of drug products and to use results of such stability testing to determine appropriate storage conditions and expiration dates (21 CFR 211.166(a)).You had no data to support the expiration date of Phenobarbital tablets, USP 15 mg (schedule IV) lot 70952A repackaged from original container-closure system(500-count bottle size) to a new container- closure system (1000-count bottle size). You had not performed stability testing of the drug product in the newcontainer-closure system and you did not have any supporting stability data to support the use of the new container-closure system. In addition, you were unable to provide documentation to show that the container-closure system used to repackage drug products was identical or equivalent to their original container-closure systems.You did not address this observation in your response. In your response to this letter, provide your evaluation of any other drug products that may have been repackaged into a different container-closure system, and the procedures and controls you have in place to assess stability of the drug products in their new container-closure systems. Include your corrective action plan if you find drug products that are unstable in the new container-closure system.Misbranding ViolationsYour phenobarbital tablets were labeled as containing 15 mg of Phenobarbital but in fact the tablets contained 30 mg of Phenobarbital. Further, as labeled, the Phenobarbital 15 mg tablets are misbranded drugs within the meaning of section 502(b)(2) of the FD&C Act, 21 U.S.C. 352(b)(2), in that the labels for these packaged drug products did not bear an accurate statement of the quantity or the contents in terms of weight, measure, or numerical count. Also, your Phenobarbital 15 mg tablets are misbranded within the meaning of section 502(e)(1)(A)(ii) of the FD&C Act, 21 U.S.C. 352(e)(1)(A)(ii), in that the drug product is labeled as Phenobarbital15 mg, and the proportion of the active ingredient in each phenobarbital tablet is 30 mg of Phenobarbital (as identified by tablet markings)In addition to the CGMP violations, your firm repackaged mislabeled drugs in violation of the FD&C Act at your facility. Based on the information collected during the inspection, you mislabeled the following prescription drug, including, but not limited to: Phenobarbital Tablets 30 mg mislabeled as Phenobarbital Tablets 15 mg.As labeled, the Phenobarbital Tablets are misbranded drugs within the meaning of section 502(a) of the FD&C Act, 21 U.S.C. 352(a), in that the labels are false.ConclusionViolations cited in this letter are not intended as an all-inclusive list. You are responsible for investigating these violations, for determining the causes, for preventing their recurrence, and for preventing other violations.If you are considering an action that is likely to lead to a disruption in the supply of drugs produced at your facility, FDA requests that you contact CDER’s Drug Shortages Staff immediately, at*********************.gov,so that FDA can work with you on the most effective way to bring your operations into compliance with the law. Contacting the Drug Shortages Staff also allows you to meet any obligations you may have to report discontinuances or interruptions in your drug manufacture under 21 U.S.C. 356C(b) and allows FDA to consider, as soon as possible, what actions, if any, may be needed to avoid shortages and protect the health of patients who depend on your products.Correct the violations cited in this letter promptly. Failure to promptly correct these violations may result in legal action without further notice, including, without limitation, seizure and injunction.Unresolved violations in this warning letter may also prevent other federal agencies from awarding contracts.Until these violations are corrected, we may withhold approval of pending drug applications listing your facility, or remove your current misbranded drugs listing information from public databases such as the online NDC Directory. We may re-inspect to verify that you have completed your corrective actions.We may also refuse your requests for export certificates.After you receive this letter, respond to this office in writing within 15 working days. Specify what you have done since our inspection to correct your violations and to prevent their recurrence. If you cannot complete corrective actions within 15 working days, state your reasons for delay and your schedule for completion.Send your firm’s response to the U.S. Food and Drug Administration, 10 Waterview Boulevard, 3rdFloor, Parsippany, New Jersey 07054. Refer to CMS case 535005 whenreplying. If you have any questions about this letter, please contact CDR Liatte Krueger, Compliance Officer, at (973) 331-4933.Sincerely,/S/Diana Amador-ToroDivision Director/OPQ Division 1New Jersey District Office警告信CMS 5350052017年12月19日首席执行官兼总裁Paul F. DevineC.O. 如织,Inc.136 哈丁大道贝尔玛尔,NJ 08031尊敬的Devine先生:美国食品和药物管理局(FDA)于2017年4月17日至6月1日在新泽西贝尔玛尔市哈丁大街136号(FEI 2220338)检查了你的药物生产设施C.O. Truxton,Inc.。
仿制药参比制剂目录(第七批)
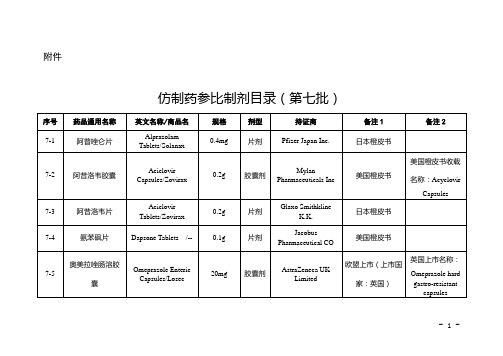
片剂(肠溶片)
AstraZeneca K.K.
日本橙皮书
7-8
奥美拉唑肠溶片
Omeprazole Enteric-coated Tablets/Omepral
10mg
片剂(肠溶片)
AstraZeneca K.K.
日本橙皮书
7-9
苯巴比妥片
Phenobarbital Tablets/
Luminaletten
7-20
茶碱缓释片
Theophylline Sustained-release Tablets/THEOPHYLLINE
0.1g(按C7H8N4O2计)
片剂(缓释片)
PLIVA INC
美国橙皮书
美国橙皮书收载名称:Theophylline Extended-release Tablets
7-21
地红霉素肠溶片
0.1g
片剂
DESITIN Arzneimittel GmbH
欧盟上市(上市国家:德国;产地:德国)
7-12
苯妥英钠片
Phenytoin Sodium Tablets
50mg
片剂
Aurobindo Pharma - Milpharm Ltd.
欧盟上市(上市国家:英国;产地:英国)
7-13
苯妥英钠片
Phenytoin Sodium Tablets
0.5mg
片剂
HOFFMANN LA ROCHE INC
美国橙皮书
7-47
马来酸氯苯那敏片
Chlorphenamine Maleate Tablets/Chlor-Tripolon
4mg
片剂
BAYER INC CONSUMER CARE
商务部关于同意变更ZEMIC美国有限公司股权比例的批复

商务部关于同意变更ZEMIC美国有限公司股权比例的
批复
文章属性
•【制定机关】商务部
•【公布日期】2006.11.29
•【文号】商合批[2006]930号
•【施行日期】2006.11.29
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】商务综合规定
正文
商务部关于同意变更ZEMIC美国有限公司股权比例的批复
(商合批〔2006〕930号)
中国航空工业第二集团公司:
《关于中航电测(美国)有限公司部分股权变更的请示》(航空计〔2006〕783号)悉。
经研究,现批复如下:
一、同意中航电测仪器股份有限公司减持在“ZEMIC美国有限公司”的股权。
减持后,中航电测仪器股份有限公司在该境外企业中的投资额为26.6万美元,持股比例从51%变更为38%;美国Promiseland公司在境外企业中的投资额为43.4万美元,持股比例从49%变更为62%。
其他事项不变。
二、接此批文后,请通知主办单位到我部(合作司)换领《中国企业境外投资批准证书》。
凭批准证书于1年内办理有关手续。
三、请督促主办单位自领取批准证书起60天内,到外汇管理部门办理有关登记手续。
四、请要求境外企业的中方负责人持批准证书(复印件)向我驻洛杉矶总领
馆经商室重新登记,并加入美国中国总商会,中方派出人员须接受我使领馆的领导。
境外企业要对安全、质量、知识产权、社会责任等方面给予高度重视。
五、企业在境外变更注册后,请督促其将注册文件报你公司备案,并按照《境外投资联合年检暂行办法》的规定,参加境外企业的年检工作。
中华人民共和国商务部
二〇〇六年十一月二十九日。
XX新药开发股份有限公司2024年H股奖励信托计划(草案)(2024年)

证券简称:XX新药证券代码:6XXXX新药开发股份有限公司2024年H股奖励信托计划(草案)目录1.定义和解释.2.本计划概览与目的3.条件4.计划存续期限5.管理6.选定参与者的选择7.奖励函和奖励授予通知8.计划受托人购买H股股票9.奖励归属10.选定参与者的情况变化11.奖励股份的转让及其他权利12.信托资产权益13.限制性条款14.收购、配股、公开发售、股票分红计划等15.计划上限16.退还股票17.解释18.计划变更19.取消奖励20.计划终止21.其他条款22.争议解决23.适用法律24.文本1.定义和解释1.1在本计划中,除非文中另有所指,释义如下:「实际售价」指根据本计划在奖励归属的情形下奖励股份的实际出售价格(扣除经纪费、印花税、任何税费、联交所交易费、香港证监会交易征费及任何其他适用费用后),或在根据计划规则第14.1条规定在本公司控制权或私有化发生变化导致归属情形时,相关计划或要约下的应收对价「采纳日期」指公司股东大会审议通过本计划之日「章程」指经不时修订的公司章程「奖励」指董事会对选定参与者的奖励,由董事会根据本计划条款约定通过奖励股份或奖励股份对应的实际售价形式实现归属「奖励函」指定义参见计划规则第7.3条「奖励期限」指从采纳日期起至采纳日期10周年前一个营业日止的期间「奖励股份」指对选定参与者奖励时向其授予的H股「董事会」指本公司不时的董事会(另请参阅计划规则第1.2⑴条)「营业日」指联交所开市进行证券买卖业务的日子「股份回购守则」指香港证监会发布的公司股份回购守则「公司」或!■本公司」指XX新药开发股份有限公司「关连人士」指具有《上市规则》所载之涵义「关连选定参与者」指为根据股东大会授权,由董事会或其授权人士根据本计划第7条确定的关连人士之选定参与者。
在实际发生授予之前,受限于可能的调整,截至本计划披露日,关连选定参与者为XX「授权人士」指经董事会授权的执行委员会「董事」指本公司董事「适格员工」指在本集团任何成员公司全职任职的中国或非中国雇员,包括董事、监事、高层(高级)管理人员、中层管理人员、基层管理人员、科学骨干人员及其他技术人员;除非该员工所在地的法律和法规规定不允许该员工参与本计划奖励的授予、接受或归属;或者董事会或其授权人士认为,出于遵守该员工所在地的适用法律和法规,必须或适当排除该员工参与计划,因而不符合适格员工的范畴「雇员」指已与本集团相关成员公司签订正式雇佣合同的雇员「执行委员会」指本公司执行委员会,经董事会授权管理本计划「授予日」指向选定参与者授予奖励日「集团」或!■本集团」指XX新药开发股份有限公司及其附属公司,集团成员公司一词应作相应解释「H股」指本公司股本中每股面值人民币1.oO元的境外上市外资股,已于联交所上市「港元」指港元,香港法定货币「香港」指中华人民共和国香港特别行政区「香港证监会」指香港证券及期货事务监察委员会「上市」指H股于202X年X月X日在联交所主板上市「《上市规则》」指《香港联合交易所有限公司证券上市规则》「市场内交易」指根据《上市规则》和任何其他适用的法律法规,通过联交所的交易机制达成一项或多项交易购买本公司的H股「中国」指中华人民共和国「薪酬与考核委员会」指董事会薪酬与考核委员会「退还股票」指根据本计划条款未归属及/或被取消的奖励股份,或根据本计划规则视为退还股票的H股「计划」或!"本计划」指在采纳日期公司根据本计划规则采纳的H股奖励信托计划「计划上限」指定义参见计划规则第15.1条「计划规则」指本文所载的经不时修订的与计划有关的规则「选定参与者」指符合计划规则第6条获批参与本计划并授予奖励的适格员工Γ《证券及期货条例》」指香港法例第571章《证券及期货条例》「股东」指本公司股东「联交所」指香港联合交易所有限公司「附属公司」指本公司的任何附属公司(定义参见《上市规则》)「税」指定义参见计划规则第9.11条的规定「信托」指服务于本计划,根据信托契约设立的信托「信托契约」指公司与计划受托人之间签订的信托契约(可不时重述、补充和修订)「计划受托人」指为信托目的由公司委任的受托人,最初为香港中央证券信托有限公司,为一家于香港注册成立的公司,注册地址为香港X大道东X号X中心X层「归属日」指董事会或其授权人士不时根据计划规则第7」条确定的奖励(或部分奖励)归属于相关奖励函所载选定参与者的日期,除非根据计划规则第10.6条或14.1条视为发生不同的归属日「归属通知」指定义参见计划规则第9.7条「归属期」指定义参见计划规则第9.2条1.2在本计划规则中,除非上下文另有释义:(八)凡提述规则之处,均指计划规则的规则;(b)时间均指香港时间;(c)如果明确一个时间段自某一天起,或从某一行为或事件发生之日起,则该段时间的计算应不包括该日;(d)「港币」或「港元」指香港现行法定货币;(e)对法规、法定条文或《上市规则》的明示或默示引用,应解释为对分别经修订或重述的法规、条文或规则的引用,或其适用不时被其他条文(无论是在本协议日期之前或之后)修改,并应包括任何法规,重新制定(无论是否修改)的规定或规则,应包括相关法规、规定或规则下的任何命令、法规、文书、附属法规、其他附属法规或实践说明;⑴除非另有说明,董事会可自行决定;如果董事会将其管理本计划的权力授权给其授权人士,该授权人士应享有董事会同样完整的决定权力;(g)提及「包括」应被视为「包括但不限于」;(三)表示单数的词包括复数,反之亦然,表示性别的词包括所有性别;(i)标题仅为方便起见而列入计划规则,并不影响其解释;及(j)凡提及任何法定团体,均须包括该法定团体的继任者及为取代该法定团体或承担该法定团体的职能而成立的任何团体。
在华外资药企名单

北美生产商英文名生产商中文名1 A&Z Pharmaceutical Inc 美国安士制药有限公司2 Abbott Laboratories Ltd 美国雅培制药有限公司3 Alcon Ophthalmology Products Co Ltd 爱尔康眼科产品有限公司4 Allergan Pharmaceutical Co Ltd 美国眼力健制药有限公司5 AMT Labs INC, USA 美国矿维公司6 Apotex Inc Canada 加拿大奥贝泰克制药有限公司7 Bristol Myers Squibb 美国百时美施贵宝公司8 Chiron S.p.A. 美国凯龙疫苗公司9 Eli Lilly Inc 美国礼来公司10 Ivax Pharmaceutical Co Ltd 美国安维世制药有限公司11 Merck 美国默克公司12 Mission Pharmacal 美国美信药业公司13 Pfizer Pharmaceuticals Ltd 美国辉瑞制药有限公司14 Schering-Plough Ltd 美国先灵葆雅公司15 SciClone Pharmaceuticals 美国赛生药品股份国际有限公司16 Dermik Pharmaceutical Co Ltd 美国德美克制药有限公司(安万特公司的子公司)17 Johnson & Johnson Pharmaceuticals Ltd 美国强生制药有限公司18 Bristol-Myers Squibb 美国百时美施贵宝公司19 Wyeth Ltd 美国惠氏公司20 Parke-Davis 美国派德药厂欧洲生产商英文名生产商中文名1 Almirall Prodesfarma 西班牙艾美罗医用药物有限公司2 AstraZeneca Pharmaceutical Co Ltd 阿斯利康制药有限公司3 Aventis Behring 安万特贝林4 B Braun Medical (H.K.) Ltd 德国贝朗医疗有限公司5 Bayer 拜耳医药保健有限公司6 Beaufour Ipsen Pharmaceutical Co Ltd 博福-益普生制药有限公司7 Berlin-Chemie AG (Menarini Group) 柏林化学股份公司(美纳里尼集团)8 Biomedica Foscama Chemical Pharmaceutical Industry 意大利福斯卡玛生化制药公司9 Mundipharma Pharmaceutical Co Ltd 英国萌蒂制药有限公司10 Boehringer Ingelheim 德国勃林格殷格翰制药公司11 Chiesi Farmaceutici SpA 意大利凯西制药公司12 Codal Synto Ltd 塞浦路斯高特制药有限公司13 Ferring Pharmaceuticals Ltd 荷兰辉凌制药有限公司14 Laboratoires Fournier 法国利博福尼制药有限公司15 Fresenius Kabi Pharmaceutical Co Ltd 德国费森尤斯卡比医药有限公司16 Laboratoires Galderma S.A. 法国高德美制药公司17 GlaxoSmithKline 葛兰素史克公司18 Grunenthal Co Ltd 德国格兰泰19 Leo Pharmaceutical Products 丹麦利奥制药有限公司20 Organon Pharmaceutical Co Ltd 荷兰欧加农制药有限公司21 Norgine Ltd 英国诺金有限公司22 Novartis Pharma Ltd 瑞士诺华制药有限公司23 Novo Nordisk Biotechnology Co Ltd 丹麦诺和诺德生物技术有限公司24 Nutricia 荷兰纽迪希亚制药有限公司25 OM Pharmaceuticals 瑞士欧姆制药有限公司26 Pharmacia 法玛西亚公司27 Pharmaton SA 瑞士富马有限公司(勃林格殷格翰集团)28 Laboratories Pierre Fabre 法国皮尔·法伯药物研制公司29 Pliva Pharmaceutical Industry Incorporated 克罗地亚普利瓦医药工业股份有限公司30 ratiopharm International GmbH/Merckle GmbH 德国通益国际制药有限责任公司/德国麦克乐药厂31 Recordati 意大利利康化工及制药有限公司32 Sanofi-Synthelabo 法国赛诺菲圣德拉堡33 Schaper & Brummer GmbH & Co KG 德国夏菩天然药物制药公司34 Schering Pharmaceutical Ltd 德国先灵公司35 Schwarz Pharma Co Ltd 德国许瓦兹制药有限公司36 Servier International 法国施维雅国际公司37 Ethypharm Pharmaceutical Co Ltd 法国爱的发制药有限公司38 Roche Pharmaceutical Ltd 瑞士罗氏制药有限公司39 Teva Pharmaceutical Industries Ltd 以色列梯瓦制药工业有限公司40 Laboratoires Besins International 法国法杏大药厂41 Laboratoires Biocodex 法国百科达药厂42 Bruschettini S.r.I. 意大利贝斯迪大药厂43 Byk Gulden 德国百克顿药厂44 Dr. Falk Pharma GMBH 德国福克大药厂45 Gedeon Richter Ltd 匈牙利吉瑞大药厂46 Laboratoires Jacques Logeais 法国洛斯大药厂47 Laphal Laboratories 法国纳化制药厂48 Lek Pharmaceutical Co 斯洛文尼亚力奇制药和化学工厂49 Laboratoires Leurquin Mediolanum SA 法国乐康美的澜制药厂50 Italy Lisapharma S.p.A 意大利利沙大药厂51 Lundbeck 丹麦灵北药厂52 Heinrich Mack Nachf. GmbH & Co. KG 德国马赫大药厂53 Madaus AG 德国马博士大药厂54 Medochemie Ltd 塞浦路斯麦道甘美大药厂55 Mepha 瑞士美化药厂56 Pohl-Boskamp GmbH & Co 德国保时佳大药厂57 Promedica France-Part of Chiesi Group 法国康密迪加大药厂(隶属于凯西制药集团)58 Rotta Research Laboratorium S.p.A. 意大利罗达药厂59 Sangstat 法国赛达药厂60 Laboratoires UPSA France 法国玉莎大药厂亚洲及澳洲生产商英文名生产商中文名1 Atlantic Laboratories Corp Ltd 泰国大西洋制药厂有限公司2 Otsuka Pharmaceutical Co Ltd 日本大冢制药有限公司3 Daiichi Pharmaceutical Co Ltd 日本第一制药株式会社4 Eisai Co Ltd 日本卫材制药有限公司5 Faulding Pharmaceuticals Ltd 澳大利亚科鼎制药有限公司6 Fujisawa 日本藤泽药品工业株式会社7 Kirin Kunpeng Bio-Pharmaceutical Co Ltd 麒麟鲲鹏生物药业有限公司8 Ranbaxy Laboratories Ltd 印度兰伯西制药有限公司9 Sankyo Pharmaceuticals Co Ltd 日本三共株式会社10 Takeda Pharmaceutical Co Ltd 日本武田药品株式会社11 Tanabe Seiyaku Co Ltd 日本田边制药有限公司12 Yamanouchi Pharmaceutical Co Ltd 日本山之内集团公司13 Asahi Kasei Corporation 日本旭化成株式会社14 Chugai Pharmaceutical Co Ltd 日本中外制药株式会社15 Daiichi Pharmaceutical Co Ltd 日本第一制药株式会社16 Fujisawa Pharmaceutical Co Ltd 日本藤泽药品工业株式会社17 Hanlim Pharmaceutical Co Ltd 韩国韩林制药株式会社18 Kyowa Hakko Kogyo Co Ltd 日本协和发酵工业株式会社19 Meiji Seika Kaisha Ltd 日本明治制果株式会社20 Miyarisan Pharmaceutical Co Ltd 日本米雅利桑制药株式会社21 Nippon Kayaku Co Ltd 日本化药株式会社22 Nippon Shinyaku Co Ltd 日本新药株式会社23 Nippon Zoki Pharmaceutical Co Ltd 日本脏器制药株式会社24 Seiko Eiyo Yakuhin Co Ltd 日本生晃荣养药品株式会社25 Senju Pharmaceutical Ltd 日本千寿制药株式会社26 Shionogi & Co Ltd 日本盐野义制药株式会社27 Sumitomo Pharmaceuticals Co Ltd 日本住友制药株式会社28 Teijin Limited 日本帝人株式会社29 Toyama Chemical Co Ltd 日本富山化学株式会社。
中美史克ppa事件的危机处理

案例启示
• 1,任何组织都有可能遇到危机和风险,但只有那些真正具有雄厚实 力和管理水平的组织才能处变不惊,通过自己的努力化险为夷;相反, 那些根基不牢固,自身工作存在较多问题的组织则必然一蹶不振,陷 入灭顶之灾。 • 2,成功的组织在面临突发事件时,总能以极强的应变能力,在第一 时间做出积极反应,勇于承担责任,并立即制定有效的对策,团结, 稳定内部公众,调动组织的各资源,以高水平的危机公关,迅速控制 局面。 • 3·他们能以对公众高度负责的精神,坦陈地面对问题和来自各方面的 批评,既借助媒体和权威机构的帮助,利用充分的信息传播,与公众 形成有效的沟通,争取公众的理解;同时,更注重用自己的行动表明 态度,减少公众的损失,换得公众的好感。 • 4·它们还具有存在危机过后,迅速修复自身形象,稳定甚至扩大市场 的能力,并取得预期的效果。所以,不仅突发事件造成的影响和损失, 可以在短时期内加以拟补,而且能够使组织及其员工由此得到锻炼。 增强抵御风险的能力,为此后的发展注入新的活力.
·现场执行 在现场执行期间我们特别注意了以下问题: ——外地记者由专人接待,大报小报、年轻与资深记者一视同仁。 ——对未被邀请而来的记者单独登记,并做到及时沟通,态度热情、诚恳。 ——与会记者纷纷就康泰克是否已经停产、中美史克如何看待这次PPA事件、对消 费者与各级经销商有个怎样的说法等问题进行了提问。由于会前做了充分准备。史克对 外发言人的回答给与会媒体留下深刻印象。 例如:当生活时报的记者问道如果消费者目前有康泰克是否可以退货时,杨伟强先 生的回答是这样的:“这个问题是很多消费者都关心的问题。首先,现在政府的要求是 暂停销售和使用,因此消费者应该停止使用。其次,在政府组织专家对有关的问题进行 论证,得出结果之后,中美史克会跟进这方面的工作,目前消费者可以暂不考虑这方面 的问题,因为国家目前还没有这方面进一步的结论,但应该暂停使用。”杨伟强先生的 回答在当时中国政府后续政策尚不明朗的情况下,即安抚了广大消费者,解答了他们的 疑虑,同时又为史克今后的措施留有余地。 ——在恳谈会开始前一个小时,CCTV东方时空栏目组突然来电,希望采访史克公 司。环球认为这对史克公司是极好的机会,应该充分利用。电视媒体具有传播受众广, 时效好,且图文并茂等特点。特别是东方时空栏目作为中央电视台的名牌栏目,更应有 效发挥其作用。中国环球公共关系公司迅速行动,协调了史克公司,成功地安排了 CCTV东方时空栏目组对杨伟强先生的专访。会后,东方时空对PPA及康泰克均做了客 观公正的报道。
FDA严惩强生“标签外推销”

本 上 破 坏 了 美 国 FDA 的 权 威 和 监
管 ” 。 研 究 人 士 披 露 , 由 于 医 学 文 献 背 后往 往受 药厂 和商 家的 操纵 , 而 药 厂 发 给 医 生 的 文 J n sn 制 药 公 司 也 将 支 付 N i a se - 7 0 万 美 元 民 事 罚 金 。 几 天 前 ,美 50 国 联 邦 政 府 还 就 指 控 阿 斯 利 康 公 司 抗精 神病 药物 思瑞 康涉 嫌 标签 外促
公 司 向 医 生 推 荐 文 章 时 必 须 标 注 “ FDA 尚 未 审 查 该 项 用 途 ” 。 与 过 期 法律 不 同的是 , “ 指南 ”不 新
据 称 ,法 案 征 求 意 见 时 就 曾 遭 到 美
国 国 会 两 党 领 袖 的 严 厉 批 评 ,称 其
是 大 药 厂 “ 期 以 来 梦 寐 以 求 的 礼 长
i 责编邮箱:ail 1 y o c din@ @ a o o c l 8 h m n a
C N OS I O HIA H PT CE I AL 中国医院院长 ・ 5 2
所 谓 标 签 外 使 用 (f- a e) o f lb 1
是 指 已 经 上 市 的 药 品 用 于 FDA 尚
再 要 求制 药公 司把 有 关论 文提 交给 F DA审 查 ,而 可 以 直 接 推 荐 给 临 床
医师 。
促 销 已 经 成 为 药 厂 扩 大 销 售 、 改 善
盈利 的重 要手 段之 一 ,部 分药 品标
未 批 准 的 适 应 症 。 根 据 美 国 有 关 法 律 ,制药 公司 不能 向医 生推 销 药物 的 标 签 外 用 途 ,但 医 生 可 根 据 实 际
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
证券代码:000908 证券简称:景峰医药公告编号:2020-009
湖南景峰医药股份有限公司
关于子公司药品获得美国ANDA批准文号的公告
近日,湖南景峰医药股份有限公司(下称“公司”)之控股子公司Sungen Pharma, LLC(下称“尚进”)收到美国食品药品监督管理局(即美国FDA)的通知,尚进向美国FDA申报的雷诺嗪口服缓释片的简略新药申请(ANDA,即美国仿制药申请,申请获得美国FDA审评批准意味着申请者可以生产并在美国市场销售该产品)已获得批准。
现将相关信息公告如下:
一、药品基本情况
1、药品名称:雷诺嗪
2、剂型:口服缓释片
3、规格:500mg和1000mg
4、注册分类:仿制药
5、申请事项:ANDA
6、申请人:尚进
7、ANDA号:212781
8、审批主要结论:已经确定雷诺嗪口服缓释片所有规格的简略新药(500mg和1000mg)同原研参比制剂是生物等效的,因此治疗等效于吉利德科学公司(Gilead Sciences,Inc.)公司已上市的雷诺嗪缓释片(Ranexa ER) 原研(RLD)产品的所有规格(500mg和1000mg)。
二、药品的适应症及市场情况
雷诺嗪可降低心率不齐的发生,包括室性心率失常、新发动脉纤维颤动、因冠状动脉疾病导致的心动过缓,还可降低糖尿病病人的糖化血红素。
雷诺嗪缓释片是用于治疗慢性心绞痛,尤其适合于对常规药物最大剂量无效或出现严重副反应或不能耐受
者、使用多种药物治疗者、或有慢性阻塞性肺部疾病或慢性心功能不全者。
雷诺嗪缓释片是长效缓控释制剂,研发、临床等效试验壁垒较高。
目前美国市场的主要生产商有鲁宾(Lupin)、梯瓦(Teva)、太阳制药(Sun)等。
根据IMS数据显示,雷诺嗪口服缓释片2018年在美国市场的销售额为9.5亿美元,2019年为4.8亿美元。
三、对上市公司影响及风险提示
本次雷诺嗪口服缓释片获得美国FDA批准文号标志着公司首次具备了在美国市场销售该产品的资格,将对公司拓展美国制剂市场、提升公司业绩带来积极的影响。
该产品不涉及新型冠状病毒的防治。
由于该产品在国外市场销售的时间、市场规模、后续拓展进度具有不确定性,加之制剂出口业务容易受到国外市场环境变化、汇率波动等因素影响,敬请广大投资者理性投资,注意防范投资风险。
特此公告
湖南景峰医药股份有限公司董事会
2020年3月24日。
