晶体结构 补充习题
晶体结构 补充习题

晶体结构补充习题班级学号姓名一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画X)1、离子半径是离子型化合物中相邻离子核间距的一半。
..................................()2、所有层状晶体均可作为润滑剂和导电体使用。
.................................................()二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内)1、下列离子中极化力和变形性均较大的是...............................................................()。
(A)Mg2+;(B)Mn2+;(C)Hg2+;(D)Al3+。
2、金属钙具有面心立方结构,在每个单位晶胞中含有Ca原子的个数为....()。
(A)1;(B)2;(C)3;(4)4。
3、下列两组物质:①MgO、CaO、SrO、BaO ②KF、KCl、KBr、KI每组中熔点最高的分别是............................................................................................()。
(A)BaO和KI;(B)CaO和KCl;(C)SrO和KBr;(D)MgO和KF。
4、下列关于分子晶体的叙述中正确的是....................................................................()。
(A)分子晶体中只存在分子间力;(B)分子晶体晶格结点上排列的分子可以是极性分子或非极性分子;(C)分子晶体中分子间力作用较弱,因此不能溶解于水;(D)分子晶体在水溶液中不导电。
5、下列各组原子或离子半径大小顺序,其中错误的是.......................................()。
9-15章 习题及答案

四种晶体练习题及答案

四种晶体练习题及答案在化学和物理学科中,晶体是一种具有规律排列的原子、离子或分子组成的固体。
晶体结构的类型对于材料的物理性质有着重要的影响。
以下是四种常见晶体结构的练习题及答案。
练习题1:请描述简单立方晶体的排列特征,并说明其晶格常数的计算方法。
答案1:简单立方晶体中,原子或分子在立方体的每个顶点上排列,每个顶点的原子属于相邻的八个立方体共享。
晶格常数a可以通过测量立方体的边长来确定。
练习题2:面心立方(FCC)晶体和体心立方(BCC)晶体有何区别?请用原子填充率来说明。
答案2:面心立方晶体中,除了立方体的每个顶点上有一个原子外,每个面的中心也有一个原子。
体心立方晶体则在立方体的中心有一个原子,而顶点上没有原子。
FCC的原子填充率大约为74.05%,而BCC的原子填充率大约为68%。
练习题3:金刚石晶体是一种什么类型的晶体结构?请简述其原子排列方式。
答案3:金刚石晶体是一种面心立方晶体结构,但它的每个原子都与四个其他原子以四面体的方式连接,形成了一个非常稳定的三维网络。
练习题4:石墨的晶体结构是怎样的?请描述其层与层之间的连接方式。
答案4::石墨具有六角晶系的层状结构,每个碳原子与其三个最近邻的碳原子以sp²杂化形成平面六角网状结构,层与层之间通过范德华力连接。
练习题5:为什么说晶体的缺陷会影响其物理性质?答案5:晶体的缺陷,如点缺陷、线缺陷(位错)和面缺陷(晶界),会打断原子的规律排列,从而影响晶体的机械强度、导电性和光学性质等。
例如,位错的存在可以降低晶体的强度,而晶界的增加可以降低晶体的电导率。
结束语:通过以上练习题及答案,我们可以看到晶体结构的多样性及其对材料性质的重要影响。
了解和掌握不同晶体结构的特点对于材料科学和化学领域的研究至关重要。
希望这些练习题能帮助你更好地理解晶体结构的基本概念。
晶体学基础与晶体结构习题与答案

晶体学基础与晶体结构习题与答案1. 由标准的(001)极射赤面投影图指出在立方晶体中属于[110]晶带轴的晶带,除了已在图2-1中标出晶面外,在下列晶面中哪些属于[110]晶带?(1-12),(0-12),(-113),(1-32),(-221)。
图2-12. 试证明四方晶系中只有简单立方和体心立方两种点阵类型。
3. 为什么密排六方结构不能称作为一种空间点阵?4. 标出面心立方晶胞中(111)面上各点的坐标。
5. 标出具有下列密勒指数的晶面和晶向:a)立方晶系(421),(-123),(130),[2-1-1],[311];b)六方晶系(2-1-11),(1-101),(3-2-12),[2-1-11],[1-213]。
6. 在体心立方晶系中画出{111}晶面族的所有晶面。
7. 在立方晶系中画出以[001]为晶带轴的所有晶面。
8. 已知纯钛有两种同素异构体,密排六方结构的低温稳定的α-Ti和体心立方结构的高温稳定的β-Ti,其同素异构转变温度为882.5℃,使计算纯钛在室温(20℃)和900℃时晶体中(112)和(001)的晶面间距(已知aα20℃=0.29506nm,cα20℃=0.46788nm,aα900℃=0.33065nm)。
9. 试计算面心立方晶体的(100),(110),(111),等晶面的面间距和面致密度,并指出面间距最大的面。
10.平面A在极射赤平面投影图中为通过NS及核电0°N,20°E的大圆,平面B的极点在30°N,50°W处,a)求极射投影图上两极点A、B间的夹角;b)求出A绕B顺时针转过40°的位置。
11. a)说明在fcc的(001)标准极射赤面投影图的外圆上,赤道线上和0°经线上的极点的指数各有何特点,b)在上述极图上标出(-110),(011),(112)极点。
12. 图2-2为α-Fe的x射线衍射谱,所用x光波长λ=0.1542nm,试计算每个峰线所对应晶面间距,并确定其晶格常数。
全国高中化学竞赛教练员习题答案晶体结构

五、晶 体 结 构1. 因为立方晶系中,六个面都是等价的,若有底心立方晶胞存在,则必有面心立方晶胞存在,故立方晶系中不存在底心立方晶胞。
不带电荷的分子或原子(金属)之间的相互作用力小,若原子(非金属)以共价键连接,简单立方中的两个原子之间距离又太大,不利于共价键形成,所以不带电荷的分子或原子往往采取六方或立方最紧密堆积或立方体心密堆积结构。
由于六方最紧密堆积结构与立方紧密堆积的空间利用率相同,所以它们具有相同的密度。
在这两种紧密堆积中,原子的配位数为12。
2. Cu 为面心立方晶体,1个晶胞中Cu 原子个数=8×(18) + 6×(12)= 4(1)(2) =1.119 Å 3. ∵Fe 原子半径是相同的,在α型中,Fe3A 2M N a ααρ=g ,在γ型中, Fe γ3A γ4M N a ρ=g 在α型中,43r a α=,∴43a rα=;在γ型中,42r a γ=,∴22a r γ=∴Fe 3A (43)N rαρ=g ,Fe γ3A (22)N r ρ=g∴ 33γ(22)360.918682(43)r r αρρ===4. (1)(2) 原子堆积系数(100)=2222(4141)0.78544(22)r a r ππ⨯+=== 原子堆积系数(110)=22(414212)0.5554242r a π⨯+⨯== 原子堆积系数(111)= 22(316312)30.90696(12)(2)sin60r a ππ⨯+⨯==⨯o 23A 324A 463.548.936,8.97110(3.165)10m N V N ρ-⨯===⨯⨯⨯ 解得=Cu 42,24r a r a =∴=5. (1 ) MgO 与MnO 的d M —O 相差很大,这说明O 2–围成的正八面体空隙小,而Mg 2+、Mn 2+的半径差别大,导致d MnO >d MgO ;而S 2–和Se 2–半径大,围成的正八面体空隙既大于 ,又大于 ,所以d MgS ~d MnS ,d MgSe =d MnSe ,相当于Mg 2+和Mn 2+在S 2–和Se 2–围成的正八面体空隙中“扰动”。
竞赛习题-晶体结构题
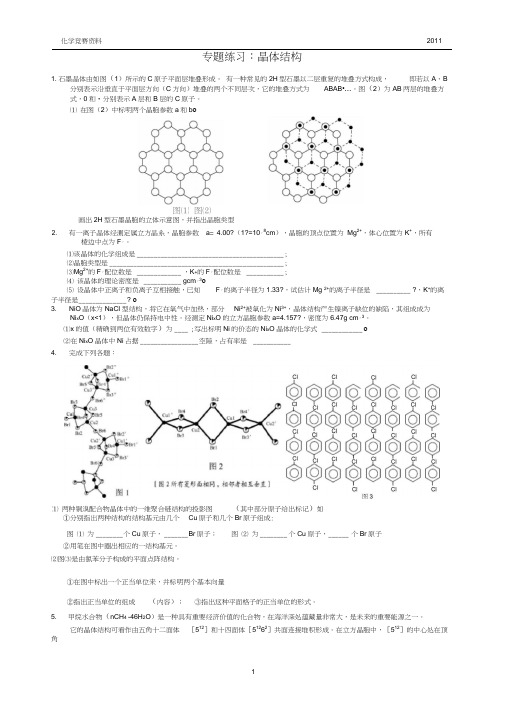
专题练习:晶体结构1. 石墨晶体由如图(1)所示的C原子平面层堆叠形成。
有一种常见的2H型石墨以二层重复的堆叠方式构成,即若以A、B 分别表示沿垂直于平面层方向(C方向)堆叠的两个不同层次,它的堆叠方式为ABAB•…。
图(2)为AB两层的堆叠方式,0和•分别表示A层和B层的C原子。
⑴ 在图(2)中标明两个晶胞参数a和b o图⑵画岀2H型石墨晶胞的立体示意图,并指岀晶胞类型有一离子晶体经测定属立方晶系,晶胞参数a= 4.00?(1?=10「8cm),晶胞的顶点位置为Mg2+,体心位置为K+,所有棱边中点为F「。
⑴该晶体的化学组成是___________________________________________ ;⑵晶胞类型是___________________________________________________ ;⑶Mg2+的F「配位数是_____________ ,K+的F「配位数是___________ ;⑷ 该晶体的理论密度是___________ gcm「3o⑸ 设晶体中正离子和负离子互相接触,已知F「的离子半径为1.33?,试估计Mg 2+的离子半径是__________ ?,K+的离子半径是______________ ?o3. NiO晶体为NaCI型结构,将它在氧气中加热,部分Ni2+被氧化为Ni3+,晶体结构产生镍离子缺位的缺陷,其组成成为Ni x O(x<1),但晶体仍保持电中性。
经测定Ni x O的立方晶胞参数a=4.157?,密度为6.47g cm「3。
⑴x的值(精确到两位有效数字)为____ ;写出标明Ni的价态的Ni x O晶体的化学式____________ o⑵在Ni x O晶体中Ni占据_________________ 空隙,占有率是___________4. 完成下列各题:①分别指出两种结构的结构基元由几个Cu原子和几个Br原子组成:图⑴ 为________ 个Cu原子,_______ B r原子;图⑵ 为________ 个Cu原子,______ 个Br原子②用笔在图中圈出相应的一结构基元。
晶体结构练习题纯答案

一、晶胞里有2个La 原子(处于晶胞的顶角和体心);有8个Fe 原子(处于锑形成的八面体的中心);锑八面体是共顶角相连的,平均每个八面体有6/2=3个锑原子,晶胞中共有8个八面体,8x3=24个锑原子;即:La 2Fe 8Sb 24。
化学式 LaFe 4Sb 12 铁的氧化态9/4 = 2.25二、(1)(在(面心)立方最密堆积-填隙模型中,八面体空隙与堆积球的比例为1︰1,在如图晶胞中,八面体空隙位于体心位置和所有棱的中心位置,它们的比例是1︰3,体心位置的八面体由镍原子构成,可填入碳原子,而棱心位置的八面体由2个镁原子和4个镍原子一起构成,不填碳原子。
)(2)MgCNi 3(化学式中元素的顺序可不同,但原子数目不能错)。
三、6:19 K 8[Nb 6O 19]·16H 2O 2四、1.4 4 8 CuFeS 22.与ZnS 晶胞相同(图略)3.A 3型(立方体心)堆积 四面体 1/24.4.31g/cm 3五、1.CaCu 52.Ca 18 Cu 4配位9个,3配位6个,平均3.63.六方 (0,0,0) (1/3,2/3,0) (2/3,1/3,0) (1/2,0,1/2) (0,1/2,0) (1/2,1/2,1/2) a =509pm c =410pm4.6.45g/cm 35.Cu 126pm Ca 168pm六、3,原子晶体,炸药,高聚氮分解成N2释放大量能量。
七、 2.晶胞中含有1个La 原子和5个Ni 原子。
3.计算过程:六方晶胞体积:V =a 2c sin120°=(5.11×10-8)2 ×3.97×10-8×31/2/2=89.7×10-24cm 3是氢气密度的1.87×103倍。
324231678.010774.8910022.6008.19--⋅=⨯⨯÷⨯==cm g V md八、(1)SiC 六方晶胞(2)每个晶胞中含有2个SiC 。
高中化学竞赛辅导晶体结构专练(精选精编试题,并附有详细解答)全国通用

高中化学竞赛辅导晶体结构专练(精选精编试题,并附有详细解答)全国通用晶体结构练习题1.(1)一种金属化合物中晶体结构为立方面心点阵,Mg 原子采用类似金刚石的排列,每4个Cu 原子形成四面体,相互之间共用顶点连接起来,排布在Mg 原子的空隙中。
请问该晶胞中有个原子,该金属化合物最简式为。
(2)以草酸铁和草酸锌为原料,按一定比例溶于水中充分搅拌混匀,加热并蒸去混合溶液的水分;逐渐共沉淀下来,产物几乎为Fe 3+与Zn 2+均匀分布的的固溶体型草酸盐混合物,过滤、灼烧,即成很好的固相反应原料“前驱物”的制备——即一种尖晶石型物质A :O 2-作立方最密堆积,Zn 2+占据1/8的四面体空隙,Fe 3+占据1/2的八面体空隙。
请写出该反应的化学方程式。
2.PdO 属四方晶系,在其晶体中,Pd 原子和O 原子分别以层状排布,其中O 原子层与层之间能够完全重合,而Pd 原子则每隔一层重复一次,试画出PdO 的晶胞,并指出距Pd 最近的原子有几个,呈何种立体构型?3.经 X 射线分析鉴定,某一离子晶体属于立方晶系,其晶胞参数a=403.lpm 。
晶胞顶点位置为Ti 4+所占,体心位置为Ba 2+所占,所有棱心位置为O2-所占。
请据此回答或计算:(1)用分数坐标表达各离子在晶胞中的位置。
(2)写出此晶体的化学式。
(3)指出晶体的点阵型式和结构基元。
(4)指出Ti 4+的氧配位数和Ba 2+的氧配位数。
(5)计算两种正离子的半径值(O 2-半径为 140 pm )。
(6)Ba 2+和O 2-联合组成哪种型式的堆积?(7)O 2-的配位情况怎样?4.SiC 具有高硬度、高耐磨性、高耐腐蚀性及较高的高温强度等特点,已成为一种重要的工程材料。
其晶体具有六方ZnS 型结构,晶胞参数为a =308pm ,c =505pm ,已知C 原子的分数坐标为0,0,0和;Si 原子的分数坐标为和(1)按比例画出SiC 六方晶胞。
(2)每个晶胞中含有SiC 个。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
晶体结构补充习题
班级学号姓名
一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画X)
1、离子半径是离子型化合物中相邻离子核间距的一半。
..................................()
2、所有层状晶体均可作为润滑剂和导电体使用。
.................................................()
二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内)
1、下列离子中极化力和变形性均较大的是...............................................................()。
(A)Mg2+;(B)Mn2+;(C)Hg2+;(D)Al3+。
2、金属钙具有面心立方结构,在每个单位晶胞中含有Ca原子的个数为....()。
(A)1;(B)2;(C)3;(4)4。
3、下列两组物质:①MgO、CaO、SrO、BaO ②KF、KCl、KBr、KI
每组中熔点最高的分别是............................................................................................()。
(A)BaO和KI;(B)CaO和KCl;(C)SrO和KBr;(D)MgO和KF。
4、下列关于分子晶体的叙述中正确的是....................................................................()。
(A)分子晶体中只存在分子间力;
(B)分子晶体晶格结点上排列的分子可以是极性分子或非极性分子;
(C)分子晶体中分子间力作用较弱,因此不能溶解于水;
(D)分子晶体在水溶液中不导电。
5、下列各组原子或离子半径大小顺序,其中错误的是.......................................()。
(A)Ca2+<K+<S2-;(B)Na+>Mg2+>Al3+;
(C)Ne>N3->Br-;(D)N3->O2->F-。
6、下列各种电子构型的正离子,其极化力和变形性均较小的是...................()。
(A)8电子构型;(B)9~17电子构型;
(C)18电子构型;(D)18+2电子构型。
7、比较下列物质熔点,其中正确的是...........................................................................()。
(A)MgO>BaO;(B)CO2>CS2;(C)BeCl2>CaCl2;(D)CH4>SiH4。
8、下列晶体中,具有正四面体空间网状结构(原子以sp3杂化轨道键合)的是......................................................................................................................................()。
(A)石墨;(B)金刚石;(C)干冰;(D)铝。
9、下列物质颜色变化可用离子极化来说明之,其中由浅到深的顺序正确的是............................................................................................................................................()。
(A)ZnI2,CdI2,HgI2;(B)PbS,PbO,Pb(OH)2;
(C)AgCl,Ag2S,Ag2O;(D)Bi2S,Sb2S3,As2S3。
10、下列物质按晶格结点上粒子间作用由小至大的顺序排列中,正确的是...()。
(A)H2S<SiO2<H2O;(B)H2O<H2S<SiO2;
(C)H2S<H2O<SiO2;(D)H2O<SiO2<H2S。
三、填充题(根据题意,在下列各题的横线处,填上正确的文字,符号或数值)
1、预测BeCl2的熔点比MgCl2的熔点________,这是因为Be2+的离子半径比Mg2+的离子半径________,Be2+的极化力比Mg2+的________,从而使BeCl2晶型向________转化更为显著所致。
2、在SO
3、H2O、CO2、NaCl和SiC的晶体中,只存在共价键的是________________;含有氢键的是________________;熔点最高的是________________;熔点最低的是_______________。
3、已知BeO的熔点比LiF的熔点高,这是因为离子电荷Be2+比Li+高,离子半径r(Be2+)比r(Li+)________,使BeO的晶格能必然比LiF的________,所以BeO的熔点高于LiF。
4、MgO晶体比金属镁的延展性________;石墨晶体比金刚石晶体的导电性________;SiO2晶体比SiF4晶体的硬度________;I2晶体比NaI晶体在水中的溶解度________。
5、下列离子:Mg2+、K+、Fe3+、Ca2+的极化力大小顺序为______________________,它们的氢氧化物脱水由易到难的顺序为_______________________________。
6、MgCl2、NaCl、SiCl4、AlCl3中离子极化作用由小到大的顺序是________________________,熔点由低到高的顺序是____________________________。
7、NaI、NaBr、NaCl、NaF中熔点最高的是________;SiF4、SiCl4、SiBr4、SiI4中熔点最低的是________。
8、已知O2-的离子半径为140pm,下列化合物的核间距为:MgO(205pm)、MgCl2(246pm)、KCl(314pm)、KI(349pm)。
推算下列离子半径:Cl-为________pm,I-为________pm。
