《酸和碱的中和反应》ppt课件
合集下载
《酸和碱的中和反应》酸和碱PPT课件

拉断的难易程度 难
较难 正常 易 很易
讨论:溶液的酸碱度对头发有什么影响?对你选择洗发 液有什么启示? 碱性物质对头发有损坏作用。所以洗发液应选接近中 性的,不要选碱性大的洗发液,然后再用微酸性的护 发素来保护头发。
知识点一、中碱中和反应的实验
时,有时需借助指示剂颜色的变化判断反应是否发生、完
可以涂抹肥皂水等碱性物质。肥皂水呈碱性,可以 中和蚊子叮咬后分泌在人体内的酸性物质。
那么其他酸和碱是否也能发生反应呢?
活动与探究
酸和碱之间的反应
用什么方法可以证明酸和碱之间可以发生反应? 补充实验:在一支装有少量Cu(OH)2固体的试管内加 入少量水,振荡。再向该试管加入稀盐酸,振荡。
结论:Cu(OH)2和水之间没有发生反应;Cu(OH)2和 稀盐酸确实发生了反应。
• C、Ba(OH)2+ H2SO4 = BaSO4 ↓+ 2H2O
AD
• D、AgNO3+HCl = AgCl↓ +HNO3
• 2、下列物质中,不属于盐类的是( )
• A、Fe(OH)2 B、AgCl
中和反应在实际中的应用
硫酸厂的废水直接排放, 会对环境造成污染,怎 么处理废水?
用熟石灰处理
原理:H2SO4+ Ca(OH)2 = CaSO4 + 2H2O
方案二:取样,加入金属锌,若有气泡产生,则所取溶液 呈酸性,该反应的化学方程式为_Z_n_+__2_H_C_l_=_=_Z_n_C_l_2_+_H_2_↑__; 若无明显现象,则呈中性。
1.中和反应:酸和碱作用生成盐和水的反应。 2.溶液的酸碱度可用pH表示,用pH试纸可测定溶液的 酸碱度。 pH<7,溶液为酸性; pH=7,溶液为中性; pH > 7,溶 液为碱性。 3.盐:在水溶液中能电离出金属离子和酸根离子的化合 物。
《酸和碱的中和反应》酸和碱PPT课件三

= 2NaOH
+
H2SO4==
Na2SO4
+
2H2O
盐 酸根离子
盐:由金属离子和酸根离子 组成的化合物
思考:食盐是盐吗?盐就是食盐吗?
“盐”是指一类物质,和平 时说的“食盐”不同。
中和反应:酸和碱作用生成 盐和水的反应
酸+碱→盐+水
一、常见的中和反应 酸+碱 = 盐 +水 HCl + NaOH = NaCl + H2O 2HCl + Ca(OH)2 = CaCl2 + 2H2O H2SO4+ 2 NaOH = Na2SO4 + 2H2O H2SO4+ Ca(OH)2 = CaSO4 + 2H2O HNO3 + NaOH = NaNO3 + H2O
2、处理工厂的废水
污 水 处 理
处理工厂的废水
3 、 用 于 医 药
胃 乐
胃乐说明书
[药品名称] 胃乐胶囊 [性状] 本品为胶囊剂,内容物为灰黄棕色,气味香,味微苦 [主要成分] 氢氧化铝[Al(OH)3 ]、甘草提取物、白芨、木 香等 [药理作用] 中和胃酸过多、抗溃疡、镇痛、抗炎 [功能与主治] 用于慢性胃炎胃酸和多酸胃痛。行气止痛,收 敛生肌,促进溃疡愈合。用于胃胀闷疼痛,嗳气泛酸,恶心 呕吐,气滞引起的胃腕疼痛。 [用法与用量] 口服,一次2~3粒,一日3次,空腹服用 [规格] 0.4g/粒 [贮藏] 密封,置干燥阴凉处 [包装] 20粒/盒 [有效期] 两年
好药用心制造
课堂练习一 胃酸的主要成分是 盐酸 胃乐胶囊的主要成分 氢氧化铝
氢氧化铝能中和胃酸 你能写出化学方程式吗?
Al(OH)3 + 3HCl === AlCl3 + 3H2O
10.2 酸和碱的中和反应课件-九年级化学人教版下册

5.“用微观的眼光看世界”是我们学习化学的重要思想方法,回答下列问题: (1)稀硫酸和氢氧化钠溶液发生反应的微观过程如图所示。从微观角度分析该反应 能 发 生 的 原 因 是 酸 中 的 ____氢__离_子_______ 和 碱 中 的 _____氢__氧_根__离_子________ 结 合 生 成 了 ____水_分__子______,反应的化学方程式是__H__2S_O__4_+__2_N_a_O__H_=_=_=_N__a_2_S_O_4_+__2_H_2_O__。 (2) 为了准确控制反应的进度,可先向氢氧化钠溶液中加入几滴无色酚酞溶液,当 二者恰好完全反应时,溶液的颜色变化是_____由_红__色_变__成_无__色___________,此时溶液中的 溶质是___氢__氧_根__离_子______。
• 被黄蜂蜇到,毒液呈碱性,可涂食醋
思考讨论
探究—洗发剂和护发剂的酸碱性
健康的头发
受损伤的头发
学完本课你应该知道
酸 和 碱 的 中 和 反应 应用
中和反应:酸+碱 盐+水
改良酸性或碱性土壤应用
1.下列应用与中和反应原理无关的是( B )
A.服用含Al(OH)3的药物,治疗胃酸过多症 B.用稀硫酸除去铁钉表面的铁锈 C.用NaOH溶液洗涤石油产品中的残余硫酸 D.用熟石灰改良酸性土壤
二 中和反应在实际中的应用
• 1.改变土壤的酸碱性
熟石灰
H2SO4+ Ca(OH)2 = CaSO4 + 2H2O 改良时能否用NaOH? 碱性太强,价格太贵
思考与练习
• 2.处理工厂的废水
用熟石灰处理
• 2.处理工厂的废水
方法1:可用熟石灰 进行中和处理。 方法2:在废硫酸中加入 废铁(硫酸亚铁可用来 做动物的食品添加剂。)
九年级初三化学酸和碱的中和反应ppt课件
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
浓度为1%的盐酸,和浓度为10%的盐酸 哪个酸性更强呢?你能用什么方法区分两 种溶液呢?石蕊可以吗?
三、溶液酸碱度的表示法—pH 为深入学习习近平新时代中国特色社会主义思想和党的十九大精神,贯彻全国教育大会精神,充分发挥中小学图书室育人功能 溶液的酸碱性: 表示溶液是酸性还是碱性 (用酸碱指示剂检验) 溶液的酸碱度: 表示溶液酸碱性的强弱程度 (用pH试纸测定) 1.pH的范围通常在0~14之间
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
8:某学生测定的下列数据中,不合理的是 (B) A、用10ml量筒量取了7.5ml水 B、用pH试纸测得某地水的pH为5.2 C、用托盘天平称得某小苏打样品的质量为
0
7
14
酸性增强
中性
碱性增强
⑴pH = 7,溶液显中性 。
如NaCl、Na2SO4等溶液
⑵ pH ﹤ 7,溶液显酸性, pH越小,酸性越强。
如HCl、H2SO4等溶液
⑶ pH ﹥ 7,溶液显碱性,pH越大,碱性越强。
如Na2CO3、 Ca(OH)2 、NaOH 等溶液
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
4.了解溶液的酸碱度有重要意义:
①化工生产中许多反应必须在一定pH溶液里才能 进行;
②在农业生产中,农作物一般适宜在pH为7或接近 7的土壤中生长;
③测定雨水的pH,可以了解空气的污染情况 [注:正常雨水(含H2CO3)的pH约为5.6,酸雨的pH小于 5.6];
广东省珠海十中九年级化学下册《10.2 酸和碱的中和反应(第一课时)》课件 新人教版

归纳下列反应方程式的共同特点
1、氢氧化钠和 盐酸反应 2、氢氧化钙和 盐酸反应 3、氢氧化钠和 硫酸反应
NaOH+HCl = NaCl + H2O
Ca(OH)2 + 2HCl == CaCl2 +2 H2O
2NaOH +H2SO4 == 2NaSO4 +2H2O
酸和碱作用生成盐和水的反应。
由金属离子(或铵根离子)和酸根 离子构成的化合物
练习:指出自测3哪些物质是盐
氢氧化钠与盐酸反应的本质:
酸溶液中的H+和碱溶液 中的OH-反应生成水的 过程。
二、中和反应在实际中的应用
1、改变土壤的酸碱性 2、处理工厂的废水 3、用于医药
植物需要在一定酸碱性的土壤中生长,但 近年来由于不合理使用化肥,或酸雨的形 成,破坏土壤的酸碱性,不利于植物的生 长, 应怎样去改变酸性土壤? 用熟石灰中和。
胃酸的主要成分是 盐酸 胃舒平的主要成分
氢氧化铝
氢氧化铝能中和胃酸,你能写出化学方程式吗?
Al(OH)3 + 3HCl==AlCl3 + 3H2O
判断盐酸是否过量? 提供药品:酚酞、石蕊、镁片 还有那些物质也可以检验?
布置作业
1、《课时学练考》P169-171,第4、5、12 (3)不写
能用生石灰代替熟石灰吗?为什么?
可以:
CaO + H2O == Ca(OH)2
某硫酸厂排出的废水中含有硫酸等 杂质,严重危害当地的生态环境,你会 怎样处理这些废水呢?
用碱性物质(例如熟石灰)进行中和处理。
你能写出化学方 程式吗?
Ca(OH)2 + H2 SO4 == CaSO4 + 2H2O
人教版九年级下册化学 《酸和碱的中和反应》PPT精品课件(第1课时)

稀硫酸与氢氧化钡溶液反应 生成白色沉淀
发生了反应
H2SO4+Ba(OH)BaSO4↓+2H2O
盐酸+氢氧化钠 无明显现象。
盐酸和氢氧化钠有没 有发生反应呢?怎样
验证?
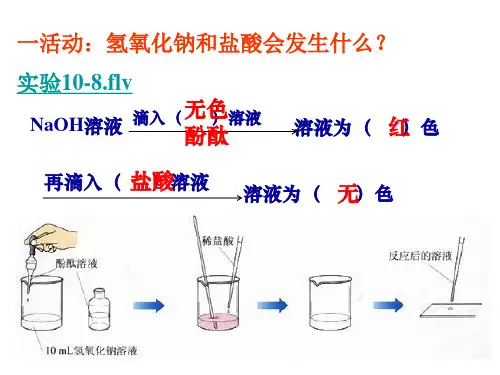
实验10-8
在烧杯中加入5mL氢氧化钠溶液,滴入几滴酚酞溶液。再用滴管慢慢滴入稀盐酸, 并不断搅拌溶液,至溶液颜色恰好变成无色为止。
D.稀盐酸与氢氧化钠溶液发生的反应是放热反应
感谢各位的聆听
无色酚 酞溶液
振荡
NaOH 溶液
稀盐酸
现象:氢氧化钠溶液中滴加酚酞后溶液显红色,随着滴加盐酸,颜色逐渐消 失至无色。
讨论
1、酚酞在实验中起什么作用? 借以判断反应有无发生
2、什么时候酸和碱恰好完全反应? 溶液刚好由红色变为无色
反应前后溶液中离子发生了怎样的变化?
盐酸与氢氧化钠溶液混合后,氢离子(H+)和氢氧根离子(OH-)结合成了水分子, 导致溶液原有的酸、碱性相互“中和”。
HCl+KOH=KCl+H2O 2HCl+Ca(OH)2=CaCl2+2H2O
H2SO4+2KOH=K2SO4+2H2O H2SO4+2NaOH=Na2SO4+2H2O
金属离子
酸根离子
盐
我们化学上所说的“盐”,是否就是我们日常生活中所说的“盐”?
由金属离子(或铵根离子)和酸根离子构成的化合物
例如:NaCl、Na2CO3、CaCO3、KMnO4、CuSO4、Fe(NO3)3、NaHCO3、 NH4NO3
第十单元 酸和碱
酸和碱的中和反应(第1课
时
)
目录 CONTENTS
人教版初中化学九年级下册10.2 酸和碱的中和反应 课件 (共16张ppt)
三.了解溶液酸碱度的重要意义(P63)(学生阅读)
(1)、化工生产中许多反应必须在一定pH溶液里 才能进行;
(2)、在农业生产中,农作物一般适宜在 pH为7或接近7的土壤中生长;
(3)、测定雨水的pH(因溶解有二氧化碳, 正常雨水的pH约为5.6,酸雨的pH小于 5.6),可以了解空气的污染情测量碱溶液的pH时,若事先将pH试纸用
蒸馏水润湿,则测量结果会( )
A.偏大 B. 偏小 C. 不变 D. 无法判断
4.下列叙述错误的是
()
A. 农作物一般适宜在中性或接近中性的土壤里生长
B. 当空气受硫或氮的氧化物污染时,可能会形成酸
雨
C. 测定人体内液体的pH,可以了解人的健康情况
二.溶液的酸碱性与pH的关系
1.pH<7,溶液显 酸 性,pH越小,酸性越 强;
pH=7,溶液显 中 性;
pH>7,溶液显 碱 性,pH越大,碱性越 强。
2. 无限稀释酸性或碱性溶液,pH值会无限接 近7,而不等于7
小组讨论:PH试纸如果先用水润湿, 对测定的结果有何影响?
3.实验10-10:测定生活中一些物质的pH 学生分组实验,合作完成,并汇报。
一.测定溶液的pH
1.测定pH最简便的方法是使用pH试纸
2.测定pH精确方法 pH计
3.pH试纸的使用方法
将一小片pH试纸放在玻璃片上,用玻璃棒蘸取待 测液滴在试纸上,将试纸显示的颜色与标准比色 卡比较,得出溶液的pH。 注意事项: (1)pH试纸 不能 直接浸入溶液 (2)pH试纸 不能 用水湿润 (3)在半分钟内显色读数 (4)pH取整数
(4)、测定人体内或排出的液体的pH,可 以了解人体的健康状况。
当堂达标促学
