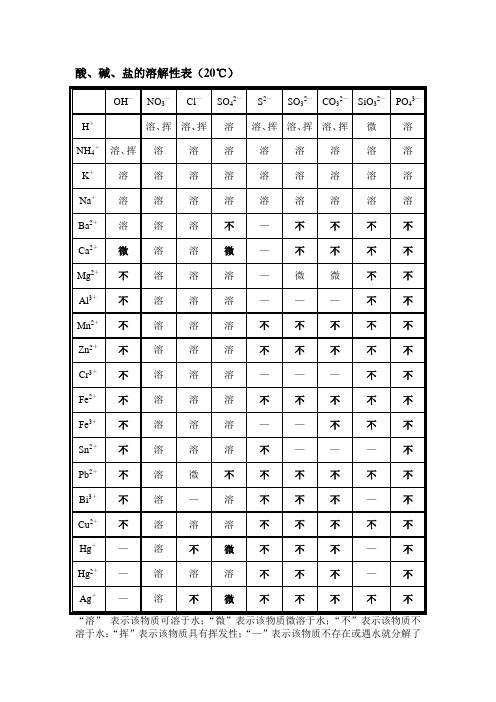
部分酸、碱和盐的溶解性表(20℃)
酸、碱、盐的溶解性表(20℃)
OH—
NO3—
Cl—
SO42—
S2—
SO32—
CO32—
SiO32—
PO43—
H+
溶、挥
溶、挥
溶
溶、挥
溶、挥
溶、挥
微
溶
NH4+
溶、挥
溶
溶
溶
溶
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
—
不
不
不
不
Ca2+
微
溶
溶
微
—
不
不
不
不
Mg2+
不
溶
溶
溶
—
微
微
不
不
Al3+
不
溶
溶
溶
—
—
—
不
不
Mn2+
不
溶
溶
溶
不
不
不
不
不
Zn2+
不
溶
溶
溶
不
不
不
不
不
Cr3+
不
溶
溶
溶
—
—
—
不
不
Fe2+
不
溶
溶
溶
不
不
不
不
不
Fe3+
不
溶
溶
溶
—
—
不
不
不
部分酸碱盐的溶解性表

\
不
\
不
不
不
溶
微
不
不
6不溶 1微溶
说明:“溶”表示该物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“\”表示该物质不存在或者遇到水就分解了。
部分酸、碱和盐的溶解性表(常温)
OH-
CO32-
HCO3-
Cl-
Br-
I-
NO3-
SO42-
SO32-
SiO32-
H+
溶、挥
溶、挥
溶、挥
溶、挥
溶、挥
溶、挥
溶
溶、挥
不
1不溶 7溶挥
NH4+
溶、挥
溶
溶
溶
溶
溶
溶
溶
溶
\
1溶挥
K+
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
全溶
Na+
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
全溶
Ba2+
溶
不
溶
溶
溶
溶
溶
不
不
不
4不溶
Ca2+
微
不
溶
溶
溶
溶
溶
微
不
பைடு நூலகம்
不
3不溶 2微溶
Mg2+
不
微
溶
溶
溶
溶
溶
溶
不
不
3不溶 1微溶
Al3+
不
\
\
溶
溶
常见酸碱盐的溶解性表(20度)+ 反应规律 + 化合价
不
17
Cu2+
不
溶
溶
溶
不
不
不
不
不
18
Hg+
—
溶
不
微
不
不
不
—
不
19
Hg2+
—
溶
溶
溶
不
不
不
—
不
20
Ag+
—
溶
不
微
不Байду номын сангаас
不
不
不
不
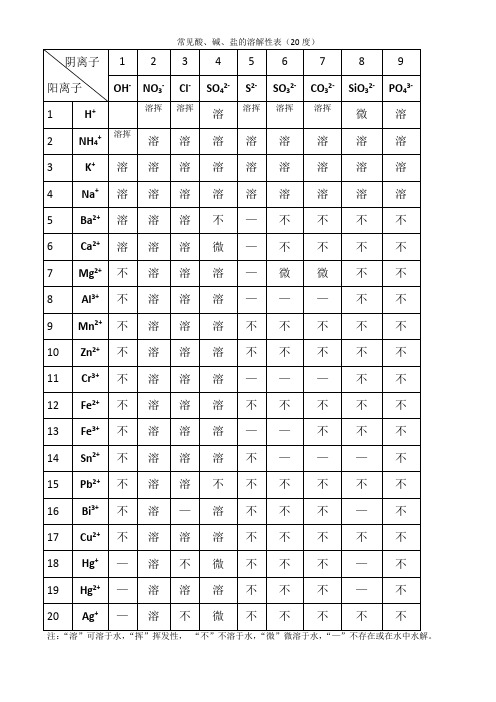
注:“溶”可溶于水,“挥”挥发性,“不”不溶于水,“微”微溶于水,“—”不存在或在水中水解。
常见酸、碱、盐的溶解性表(20度)
阴离子
阳离子
1
2
3
4
5
6
7
8
9
OH-
NO3-
Cl-
SO42-
S2-
SO32-
CO32-
SiO32-
PO43-
1
H+
溶挥
溶挥
溶
溶挥
溶挥
溶挥
微
溶
2
NH4+
溶挥
溶
溶
溶
溶
溶
溶
溶
溶
3
K+
溶
溶
溶
溶
溶
溶
溶
溶
溶
4
Na+
溶
溶
溶
溶
溶
溶
溶
溶
溶
5
Ba2+
溶
溶
溶
不
—
不
不
不
浙教版九年级上册科学:附录2 部分酸、碱和盐的溶解性表(20℃)

是(C) 溶质 A 质量
溶质
B 质量
如果改为向饱和硝 酸钾溶液,不断加 入硝酸钾,选哪个?
O
C 溶质
质量
加入硝酸钾 质量
O
D
溶质 质量
加入硝酸钾 质量
O
O 加入硝酸钾质量
加入硝酸钾 质量
欲使接近饱和的硝酸钾溶液转化成 饱和溶液可以采用三种方法:
• 1. • 2. • 3.
2、饱和溶液和不饱和溶液相互转化的方法:
120
少数固体物质溶解度受温度影响 110
不大随温度升 80
70
高反而减小,例如熟石灰。
60
50
钠硝 酸
钾硝 酸
氯化 铵氯化钾
40
氯化
30
钠
20
硼酸
10
0 10 20 30 40 50 60 70 80 90 100 温度/℃
下表为硝酸钾和氢氧化钙在不同温度下的溶解度。如图 所示甲、乙试管分别盛有20℃时硝酸钾、氢氧化钙的饱 和溶液,试管底部均有未溶解的固体。现向烧杯内的水 中加入某物质后,甲试管中固体消失,乙试管中的固体 增加,则加入的物质可能是( B )
的是( A )
溶液 悬浊液 乳浊液 A
溶液 悬浊液 乳浊液 C
悬浊液
乳浊液
溶液
B
乳浊液 悬浊液
溶液
D
2、溶液的其他特点:
(1)溶液的组成: 溶液由溶剂和溶质组成 溶质:被溶解的物质 (固、液、气或多种) 溶剂:能溶解其他物质的物质(水,相似相容) 溶液质量=溶剂质量+溶质质量 溶液的体积≠溶质的体积+溶剂的体积
鸡蛋和水的故事
要让鸡蛋上浮,加砂子或色拉油行吗?
考点一:溶液、悬浊液、乳浊液(b)
人教版九年级下册初中化学《附录Ⅰ 部分酸、碱和盐的溶解性表(室温)》_0
附录一部分酸、碱和盐的溶解性表(室温)教学设计一、教学目标1、通过对表格各离子不同组合,进一步加深对酸、碱、盐的组成理解,强化了酸碱盐化学式的书写。
2、从表中找出酸碱盐的溶解性特点,找出有效的记忆方法或口诀,快速判断出有沉淀生成的复分解反应能否实行。
3、利用表中常见的酸碱盐的溶解性,巩固酸碱盐的鉴别、转化、制取等实验技能,熟悉中考常考的特征离子的检验。
二、教学重难点1、教学重点:酸碱盐的溶解性规律及记忆方法。
2、教学难点:微溶物的处理。
三、课前准备:事先印一张表格,要求学生课前先完成化学式的书写。
附:酸碱盐化学式四、教学流程2、提问:酸碱盐之间发生复分解反应的条件是什么?注意学生往往没说到反应物应是溶液(可溶,酸例外)特别是“盐+碱”、“盐+盐”反应物一定要全溶。
3、引入问题:复分解反应要具备生成物有水、气体、沉淀三个条件之一才能实行,生成水或气体通过方程式很容易判断出来,最难是如何判断是否生成沉淀,所以今天我们来学习酸碱盐的溶解性表。
附练习:3、下列实验能观察到明显现象的()A、硫酸钠溶液滴入氯化铜溶液B、氯化钡溶液滴入氧化铜中C、氢氧化钾溶液滴入硝酸钠溶液中D、硝酸银溶液滴入氯化钠溶液4、只有一种试剂来鉴别NaOH、Ca(OH)2、稀H2SO4三种溶液,这种试剂是()A、氯化钡溶液B、石蕊溶液C、碳酸钠溶液D、酚酞溶液5、下列各种物质,相互不能发生反应的是()A、Ca(OH)2溶液和硫酸B、氧化铁和盐酸C、三氧化硫和氢氧化化钠溶液D、盐酸和二氧化碳6、下面是某同学实行碱的化学性质实验时记录的现象,其中与事实不符的是( )A、Ca(OH)2溶液中加入稀盐酸,无明显变化B、NaOH溶液中通入CO2气体,有白色沉淀生成C、Ca(OH)2溶液中加入石蕊溶液,溶液呈蓝色D、NaOH溶液中加入CuSO4溶液,有蓝色沉淀生成7、将下列各组物质放入水中,有化学反应发生,但无沉淀生成,也无气体生成,且溶液为无色的一组是( )A、K2CO3、BaCl2、NaClB、CaSO4、HNO3、NaClC、CaCl2、KOH、Na2CO3D、K2SO4、H2SO4、NaOH8.(2019广安市)酸、碱、盐的溶解性表为我们确定常见物质的溶解性提供了方便,下表是溶解性表中的一部分,结合表格和溶解度知识判断,下列说法不准确的是()常见酸、碱、盐的溶解性表(20℃)A.绘制表格的依据是物质的溶解度B.常见物质一般可分为:溶、微溶和不溶C.Ca(OH)2、CaSO4和CaCO3的溶解度都大于1gD.Ca2+、NO3-、Cl-三种离子在溶液中能大量共存9、完成发生的下列反应的化学方程式。
化学溶解性表的应用(共存_除杂)

2023/11/29
下列除杂的实验过程都正确的是(括号内为杂质) A.MnO2 (KCl) 加水溶解、过滤、蒸发、结晶 B.BaSO4(BaCO3)加足量稀盐酸、过滤、洗涤、 干燥 C.CuO(Cu)加足量稀盐酸、过滤、洗涤、干燥
√D.KCl(K2CO3)加足量稀盐酸、过滤、蒸发、
结晶
2023/11/29
大量共存;选项B中的CO32-与H+反应生成水和 CO2而不能大量共存;选项C中的Cl-和Ag+反应生 成不溶于水也不溶于酸的AgCl而不能大量共存;
选项D中各离子之间不反应,因而可以大量共存, 选项D正确。 2023/11/29
(2005苏州) 15.下列离子能在pH=13的水溶液中 大量共存的是( C )。 A.SO42-、Cl-、Na+、H+ B.K+、SO42-、Cu2+、NO3C.Cl-、K+、SO42-、Na+ D.Ca2+、Cl-、CO32-、Na+
反应的共有( D
)
A.5组 B.6组 C.7组 D.8组
2023/11/29
请你说出H2SO4可以分别和哪些物质反应生成 CuSO4?
2023/11/29
在水溶液中,一般不会和其他物质发生复分 解反应的是( A ) A。NaNO3 B。KCl C。HNO3 D。NaOH
2023/11/29
溶解性表的应用二:判断离子(或物质)能否在 溶液中大量共存 样品展示:
下列各组离子在pH=1的溶液里能大量共存的是
( D)
A。N 、 aB2 、 aC 、 lOH
B。S2 4 O 、 K 、 C2 a 、 C3 2O C。N3 、 O C 、 lA 、 gC2 u D。K 、 N、 aN3 O 、 Cl 题给条件是“在pH=1的溶液里”,即是含有大量
部分酸碱盐溶解性 颜色

阴离子
阳离子
OH-
NO3-
Cl-
SO42-
CO32-
H+
溶、挥
溶、挥
溶
溶、挥
NH4+
溶、挥
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
不
Ca2+
微
溶
溶
微
不
Mg2+
不
溶
溶
溶
微
Al3+
不
溶
溶
溶—Mn2+不溶溶
溶
不
Zn2+
不
溶
溶
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
钾钠钡钙铵碱溶,其余碱类都不溶。
溶
溶
—
Cu2+
不
溶
溶
溶
不
Ag+
—
溶
不
微
不
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“—”表示那种物质不存在或遇到水就分解了。
酸碱盐溶解性口诀
钾钠铵盐硝酸盐,入水溶于水中间;
盐酸盐类多数溶,记住氯化银不溶;
硫酸盐类多数溶,记住硫酸钡不溶;
碳酸钾钠铵镁溶,其余盐类都不溶;
部分酸、碱盐的溶解性归纳表(室温)(适用人教版九年级化学下册酸碱盐)

1 / 2部分酸、碱和盐的溶解性表(室温)注意:1、亚铁离子(Fe 2+)为浅绿色,形成的可溶性盐类物质形成的溶液为浅绿色,即Fe(NO 3)2溶液、FeCl 2溶液、FeSO 4溶液均为浅绿色;铁离子(Fe 3+)为黄色,形成的可溶性盐类物质形成的溶液为黄色,即Fe(NO 3)3溶液、FeCl 3溶液、Fe 2(SO 4)3均为黄色;Cu(NO 3)2溶液、CuCl 2溶液、CuSO 4溶液均为蓝色。
2、Fe(OH)3为红褐色、Cu(OH)2为蓝色不溶于水物质,AgCl 、BaSO 4均为不溶于盐酸和硫酸的白色物质。
读作:氢氧化某读作:硝酸某读作:氯化某读作:硫酸某读作:碳酸某氢氧根硝酸根盐酸根硫酸根碳酸根OH -NO 3-Cl -SO 42-CO 32-H +H 2O 溶、挥HNO 3溶、挥HCl 溶H 2SO 4溶、挥H 2CO 3酸K +溶KOH 溶KNO 3溶KCl 溶K 2SO 4溶K 2CO 3钾盐Na +溶NaOH 溶NaNO 3溶NaCl 溶Na 2SO 4溶Na 2CO 3钠盐NH 4+溶、挥NH 3·H 2O 溶NH 4NO 3溶NH 4Cl 溶(NH 4)2SO 4溶(NH 4)2CO 3铵盐Ba 2+溶Ba(OH)2溶Ba(NO 3)2溶BaCl 2不BaSO 4不BaCO 3钡盐Ca 2+微Ca(OH)2溶Ca(NO 3)2溶CaCl 2微CaSO 4不CaCO 3钙盐Mg 2+不Mg(OH)2溶Mg(NO 3)2溶MgCl 2溶MgSO 4微MgCO 3镁盐Al 3+不Al(OH)3溶Al(NO 3)3溶AlCl 3溶Al 2(SO 4)3---铝盐Mn 2+不Mn(OH)2溶Mn(NO 3)2溶MnCl 2溶MnSO 4不MnCO 3锰盐Zn 2+不Zn(OH)2溶Zn(NO 3)2溶ZnCl 2溶ZnSO 4不ZnCO 3锌盐Fe 2+不Fe(OH)2溶Fe(NO 3)2溶FeCl 2溶FeSO 4不FeCO 3亚铁盐Fe 3+不Fe(OH)3溶Fe(NO 3)3溶FeCl 3溶Fe 2(SO 4)3---铁盐Cu 2+不Cu(OH)2溶Cu(NO 3)2溶CuCl 2溶CuSO 4---铜盐Ag +---溶AgNO 3不AgCl微Ag 2SO 4不Ag 2CO 3银盐盐碱硝酸盐盐酸盐硫酸盐碳酸盐阳离子阴离子3、注意含Fe2+和Fe3+离子的碱和盐的读法。
