高一化学知识小卡片物质的量(1)
高中化学必修一1.2物质的量-知识点
小初高个性化辅导,助你提升学习力! 1 高中化学必修一1.2物质的量-知识点
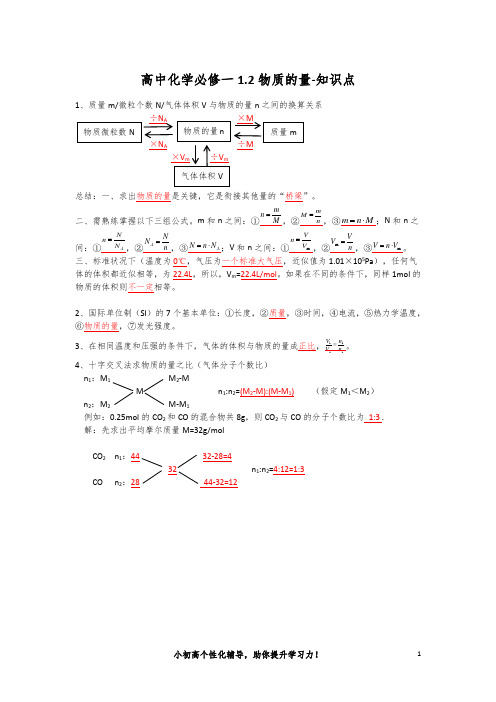
1、质量m/微粒个数N/气体体积V 与物质的量n 之间的换算关系
×N A ÷M
总结:一、求出物质的量是关键,它是衔接其他量的“桥梁”。
二、需熟练掌握以下三组公式。
m 和n 之间:①
M m n =,②n m M =,③M n m ⋅=;N 和n 之间:①A N N n =,②n N N A =,③A N n N ⋅=;V 和n 之间:①m V V n =,②n V V =m ,③m V n V ⋅=。
三、标准状况下(温度为0℃,气压为一个标准大气压,近似值为1.01×105Pa ),任何气体的体积都近似相等,为22.4L ,所以,V m =22.4L/mol 。
如果在不同的条件下,同样1mol 的物质的体积则不一定相等。
2、国际单位制(SI )的7个基本单位:①长度,②质量,③时间,④电流,⑤热力学温度,⑥物质的量,⑦发光强度。
3、在相同温度和压强的条件下,气体的体积与物质的量成正比,21
21n n V V =。
4、十字交叉法求物质的量之比(气体分子个数比)
n 1:M 1 M 2-M
M n 1:n 2=(M 2-M):(M-M 1) (假定M 1<M 2)
n 2:M 2 M-M 1
例如:0.25mol 的CO 2和CO 的混合物共8g ,则CO 2与CO 的分子个数比为 1:3 .
解:先求出平均摩尔质量M=32g/mol
CO 2 n 1 32-28=4
n 1:n 2=4:12=1:3
CO n 2:28 44-32=12。
物质的量 第1课时 高一上学期化学人教版(2019)必修第一册

阿伏伽德罗:意大利物理学家、化学家, 1776年生于意大利都灵市,他毕生致力 于物理学、化学领域中有关原子论的研究, 对微观世界的探索起到了重要的推动作用
÷ 6.02×1023 × 6.02×1023
n=
N NA
NA =
N
nN= n × NA练来自: 1. 1mol H2O中约含有
第三节
物质的量
微观:
点燃
2H2 + O2 = 2H2O
2个 1个 2个
×6.02×1023
2mol 1mol 2mol
÷2 ÷32 ÷18 宏观: 4g 32g 36g
物质的量是把微观粒子和宏观物质联系起来的一座桥梁。
1971年,在第14届国际计量大会上,正式宣布“物质的量” 是国际单位制的一个基本单位,其单位为摩尔。
符号:M
单位:g/mol ( g·mol-1)
2. 计算公式: M =
m n
n=
m
M
m= n × M
大量实验证明:若以克/摩(g/mol或g·mol-1 )为单位,物质的摩尔质量在数值
上与该粒子的相对原子质量或相对分子质量相等。
如:Fe的摩尔质量为 56 g/mol 、 H2SO4的摩尔质量为 98 g/mol 、 Na+的摩尔质量为 23 g/mol 。
6.02×1023
23
OH- 17
2.824×10-23
6.02×1023
17
结论:1 mol任何粒子构成的物质的质量以克为单位时,在
数值上等于该微粒的相对原子质量或相对分子质量。
1mol O2的质量是: 32 g ,1 mol H2SO4的质量是: 98 g 。
高一化学 物质的量知识点解读

第一节物质的量1.原子和相对原子质量原子是化学变化中的最小微粒。
原子是一种微观粒子,它具有一些不同于一般宏观颗粒的特点。
如:在化学变化中原子是不可分割的;原子的质量非常小,如12C 原子的质量仅有1.993×10-26kg 。
国际上规定,以12C 原子的质量的1/12作标准,其他原子的质量跟它比较所得的值,就是这种原子的相对原子质量。
如12C 原子的质量为1.993×10-26kg ,某氧原子的质量为2.657×10-26kg ,这种氧原子的相对原子质量为:00.1610993.11065722626=⨯⨯--kgKg 。
2.化学式和式量用元素符号来表示物质组成的式子叫做化学式。
如O 2、H 2O 、CO 2、MgO 、NaCl 分别表示了氧气、水、二氧化碳、氧化镁、氯化钠的组成。
有的化学式仅能表示有关物质的组成,如NaCl 。
也有的化学式不仅能表示这种物质的组成,同时也能表示这种物质的分子的组成,这种化学式也叫做分子式,如H 2O 既是水的化学式,也是水的分子式。
化学式中各原子的相对原子质量的总和就是式量。
若化学式同时又是分子式,则式量也叫做相对分子质量。
课本知识导学运用课本知识诠解重要提示1.物质的量单位物质的量是国际单位制中7个基本物理量之一,它是一个物理量的名称,用符号n 表示。
国际单位制(SI)中部分基本单位2.摩尔摩尔是物质的量的单位,作为计算原子、分子或离子等微观粒子的物质的量单位,简称摩,符号为mol ,物质含有阿伏加德罗常数个微粒,某物质的量就是1mol ,每摩尔物质含有约6.02×1023个粒子。
摩尔跟其他计量单位一样,也有其供数单位。
1Mmol=1000Kmol1Kmol=1000mol 1mol=1000mmol3.阿伏加德罗常数的涵义0.012kg12C 中所含的碳原子数称为阿伏加德罗常数,在计算时通常使用6.02×1023mol B这个近似值,它可用符号NA 表示,其单位是mol B。
高中化学 物质的量知识点学习卡片:卡片6 以物质的量为核心的计算

1.明确一个中心:必须以“物质的量”为中心——“见量化摩,遇问设摩”。
2.用好一个定律:阿伏加德罗定律及推论可概括为“三同定一同,两同见比例”,可用V =n ×V m 及m =V ×ρ等公式推导出:(1)同温同压时:①V 1∶V 2=n 1∶n 2=N 1∶N 2;②ρ1∶ρ2=M 1∶M 2;③同质量时:V 1∶V 2=M 2∶M 1。
(2)同温同体积时:①p 1∶p 2=n 1∶n 2=N 1∶N 2;②同质量时:p 1∶p 2=M 2∶M 1。
(3)同温同压同体积时:M 1∶M 2=m 1∶m 2。
3.注意三个守恒: 质量守恒—反应前后元素的质量、某原子离子或原子团的物质的量相等 电子守恒—氧化还原反应中,氧化剂得电子数=还原剂失电子数 电荷守恒—任何体系中,阳离子带的正电荷数=阴离子带的负电荷数4.熟记两个公式(1)气体溶质物质的量浓度的计算:标准状况下,1 L 水中溶解某气体V L ,所得溶液的密度为ρ g ·cm 3,气体的摩尔质量为M g ·mol -1,则c =1 000ρV 22 400+MVmol ·L -1。
(2)溶液中溶质的质量分数与物质的量浓度之间的换算:c =1 000ρw M(c 为溶质的物质的量浓度/mol ·L -1,ρ为溶液的密度/g ·cm -3,w 为溶质的质量分数,M 为溶质的摩尔质量/g ·mol -1)。
5.掌握两条规律:(1)稀释定律:如用V 1、V 2、c 1、c 2分别表示稀释前后溶液的体积和溶质的物质的量浓度,有c 1V 1=c 2V 2;如用m 1、m 2、w 1、w 2分别表示稀释前后溶液的质量和质量分数,有m 1w 1=m 2w 2。
(2)混合规律:同一溶质不同浓度的溶液混合后溶质质量分数的判断方法:设溶质质量分数分别为w 1和w 2的两溶液混合后所得溶液溶质的质量分数为w 。
高一化学物质的量的计算

高一化学计算复习:物质的量的计算1. 物质的量与阿德加德罗常数(1)物质的量是基本物理量之一(2)物质的量的单位——摩尔(3)mol 1任何物质中所含粒子数为阿伏加德罗常数,(近似为231002.6⨯)(4)使用物质的量时应指明粒子名称及种类(5)物质的量这一物理量将微观粒子与宏观物质联系起来。
2. 物质的量与其他物理量的关系3. 阿伏加德罗定律(1)含义:三同定一同(2)由定律引出的几种比例关系: 同温同压下:2121n n V V = 2121M M =ρρ 同温同体积:2121n n P P = 4. 有关溶液问题(1)溶解平衡在计算中的作用。
(2)溶解度的概念、影响因素。
(3)溶液浓度的几种表示方法。
① 溶质的质量分数② 物质的量浓度③ 几种浓度,溶解度等的换算31.取50.0 mL Na 2CO 3和Na 2SO 4的混和溶液,加入过量BaCl 2溶液后得到14.51 g 白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66 g ,并有气体放出。
试计算∶(1)原混和溶液中Na 2CO 3和Na 2SO 4的物质的量浓度;(2)产生的气体在标准状况下的体积。
32.在一定条件下,NO 跟NH 3可以发生反应生成N 2和H 2O 。
现有NO 和NH 3的混合物1 mol ,充分反应后所得产物中,若经还原得到的N 2比经氧化得到的N 2多1.4g 。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO 与NH 3的物质的量可能各是多少。
33.标准状况下,用一定量的水吸收氨气后制得浓度为12. 0 mol ·L -1、密度为0.915 g ·cm -3的氨水。
试计算1体积水吸收多少体积的氨气可制得上述氨水。
(本题中氨的式量以 17.0计,水的密度以1.00 g ·cm -3计)34.Cu 和浓硫酸反应产生SO 2气体33.6 L (标准状况下),试计算参与反应的Cu 质量和被还原的H 2SO 4的物质的量,如果反应后的CuSO 4溶液加水稀释至500 mL ,求该溶液的物质的量浓度。
高一化学物质的量笔记

高一化学物质的量笔记一、物质的量1.定义:物质的量是一个物理量,表示含有一定数目粒子的集合体。
符号为n,单位为摩尔(mol)。
2.意义:物质的量是联系宏观物质和微观世界的桥梁,是研究化学反应和化学计量问题的基本工具。
二、阿伏伽德罗常数1.定义:阿伏伽德罗常数是一个物理常数,表示1摩尔物质所含有的粒子数。
符号为NA,单位为个/摩尔。
2.意义:阿伏伽德罗常数是联系宏观物质和微观世界的桥梁,是研究化学反应和化学计量问题的基本工具。
三、摩尔质量1.定义:摩尔质量是指单位物质的量的物质所具有的质量。
符号为M,单位为g/mol。
2.意义:摩尔质量是研究化学反应和化学计量问题的基本工具,是物质的基本属性之一。
四、气体摩尔体积1.定义:气体摩尔体积是指单位物质的量的气体所占有的体积。
符号为Vm,单位为L/mol。
2.意义:气体摩尔体积是研究化学计量问题的基本工具,是物质的基本属性之一。
五、物质的量浓度1.定义:物质的量浓度是指单位体积溶液中所含有的溶质的物质的量。
符号为c,单位为mol/L。
2.意义:物质的量浓度是研究化学计量问题的基本工具,是溶液配制和化学反应速率计算的基本参数。
六、阿伏伽德罗定律及其推论1.定律:同温同压下,相同体积的任何气体含有相同的分子数。
2.推论:同温同压下,相同物质的量的气体占据相同的体积;同温同体积下,气体的压强与物质的量成正比。
七、物质的量与化学式的关系1.计算公式:n = m/M = V/Vm = cV。
2.意义:物质的量是联系宏观物质和微观世界的桥梁,是研究化学反应和化学计量问题的基本工具。
化学知识点高一物质的量

化学知识点高一物质的量化学知识点:高一物质的量化学是一门研究物质及其变化的科学,而物质的量则是化学中重要的基础概念之一。
在高中化学课程中,学生们需要学习和掌握物质的量的相关知识,如质量、摩尔、化学计量等。
本文将深入探讨高一化学中关于物质的量的知识点,帮助读者更好地理解和应用这些概念。
一、什么是物质的量?物质的量是指物质中包含的基本粒子数量,它用通用单位摩尔(mol)来表示。
摩尔是用来计量物质的数量的单位,其中1摩尔等于 6.02×10^23个基本粒子。
基本粒子可以是原子、分子或离子,具体是什么取决于给定物质的性质。
二、质量和物质的量之间的关系质量是物体所含物质的总量,可以用来描述物质的重量。
在化学中,质量和物质的量存在着固定的比例关系。
这种关系由摩尔质量所描述,摩尔质量是单位摩尔物质的质量,单位是克/摩尔(g/mol)。
以氢气和氧气的反应生成水为例,当2摩尔的氢气和1摩尔的氧气反应时,会生成2摩尔的水。
根据摩尔质量的关系,1摩尔氢气的质量为2克,1摩尔氧气的质量为32克,而1摩尔水的质量为18克。
通过这个例子可以看出,氢气和氧气在反应中的摩尔比例是2:1,而相对质量的比例是2:32:18。
这种比例关系在化学反应中非常重要,被称为化学计量关系。
三、如何计算物质的量?在化学实验中,需要进行物质的量的计算。
一种常见的计算方法是使用摩尔质量的关系。
根据物质的量可以计算得到质量,也可以根据质量计算得到物质的量。
例如,知道氧气的质量为16克,我们可以通过以下计算来求得它的物质的量:物质的量 = 质量 / 摩尔质量物质的量 = 16 g / 32 g/mol物质的量 = 0.5 mol在这个例子中,通过质量和摩尔质量的关系,可以求得氧气的物质的量为0.5摩尔。
同样的方法也可以用于其他物质的量的计算。
四、摩尔体积在化学实验中,涉及到气体反应时,我们还需要考虑到摩尔体积的概念。
摩尔体积是指一个摩尔气体所占据的体积,单位是升/摩尔(L/mol)。
高一化学第1章 第3节 第1课时 物质的量及其单位—摩尔 摩尔质量

可以表示为
()
A.12a/b
B.12b/a
C.bNA
D.aNA
[解析]
Ar(R)=
b 1
g
=12a b,B项正确;
12a g
M(R)=b g·NA mol-1=bNA g·mol-1,
Ar(R)=bNA,C项正确。
[答案] BC
已知3.01×1023个X气体分子的质量为16 g,则X气体的摩尔质
量是
A.6 g H2;B.0.5 mol CO2;C.1.204×1024个HCl分子; D.98 g H2SO4;E.92 g乙醇(C2H5OH);F.4℃时9 mL水[4℃时水 的密度:ρ(水)=1 g·mol-1]
[解析] 列表计算各项物质的相关物理量。
质量/g 物质的量/mol 分子个数 原子个数
解析:A项,1 mol OH-的质量为17 g;B项,CO2的摩尔 质量为44 g·mol-1;C项,铁原子的摩尔质量与其相对原子
质量不相等;D项,由M=m(原子)·NA⇒m(原子)=NMA 答案:D
4.若1g CO2中含有x个原子,则阿伏加德罗常数可表示为
()
1 A.44
mol-1
x B.22
mol-1
H2
6
3
CO2
22
0.5
HCl
73
2
H2SO4
98
1
C2H5OH
92
2
H2O
9
0.5
[答案] A A E D
3NA 0.5NA 2NA
NA 2NA 0.5NA
6NA 1.5NA 4NA 7NA 18NA 1.5NA
物理量之间的换算: (1)要明确各物理量与物质的量的关系。 (2)找出联系各物理量的公式,注意单位的换算。 (3)注意公式应用的条件,物质的组成等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.公式 :①标况下任何气体的密度都等于 :ρ (g/L) = _________;
知识点:物质的量、 NA 、M ( 1)
1.物质的量是一种物理量,实际上表示含有 _______________
____________ ,其单位是 __________。用它表示表示物质的量 时,应用 ________指明粒子种类[课本 44 页]。 2 .阿佛伽德罗常数为 __________12C 中所含碳原子数,符号 _______,近似值为 ____________mol —1。
② cB=
mB ( g)
M B (g mol 1) V ( L)
B ( g mL 1) 1000(mL L 1 ) M B ( g mol 1 )
③ cB= B
( g mL 1 ) 1000 ( mL L 1 )
M B ( g mol 1 )
( mol
L 1) 。
4.公式 : ①标况下任何气体的密度都等于 :ρ (g/L) = _________;
② cB=
mB (g )
M B ( g (mL L 1 ) M B ( g mol 1 )
③ cB= B
( g mL 1 ) 1000 ( mL L 1 )
M B ( g mol 1 )
( mol
L 1) 。
1
3.括号里为物理量的单位: m(g);n(mol) ;M(g/mol) ;气体 V(L) ; Vm(L/mol) ; cB(mol/L) ;粒子数 N;溶液 V(L) ;阿佛伽德罗常数 N A(mol -1 );气体 ρ (g/L) ;液体 ρ (g/cm3)。
高一化学知识小卡片 (19) _____班 姓名 _________
高一化学知识小卡片 (19) _____班 姓名 _________
知识点:物质的量、 N A、 M ( 1)
1.物质的量是一种物理量,实际上表示含有 _______________
____________ ,其单位是 __________。用它表示表示物质的量 时,应用 ________指明粒子种类[课本 44 页]。 2 .阿佛伽德罗常数为 __________12C 中所含碳原子数,符号 _______,近似值为 ____________mol —1。
