苏教版高中化学必修一化学专题1、2合测试卷
苏教版高一化学必修1全册综合测试题(含答案解析)

绝密★启用前苏教版高一化学必修1全册综合测试题本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间150分钟。
第Ⅰ卷一、单选题(共15小题,每小题3.0分,共45分)1.下列物质可用于干燥氨气的是()A.浓硫酸B.碱石灰C.过氧化钠D.活性炭2.下列图示所表示的分类法,属于交叉分类法的是()3.足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和二氧化氮、一氧化氮的混合气体2.24 L(标准状况),这些气体与一定体积(标准状况)氧气混合后通入水中,所有气体完全被水吸收生成硝酸。
若向所得硝酸铜溶液中加入4mol·L-1氢氧化钠溶液至铜离子恰好完全沉淀,则消耗氢氧化钠溶液的体积是50 mL,下列说法正确的是 ()A.混合气体中含二氧化氮1.12 LB.消耗氧气的体积为1.68 LC.此反应过程中转移的电子为0.3 molD.参加反应的硝酸是0.4mol4.过量的CO2通入下列溶液中,最终出现浑浊的是()A . 氯化钙溶液B . 石灰水C . 饱和亚硫酸钠溶液D . 水玻璃5.对于反应CaH 2+2H 2O===Ca(OH)2+2H 2↑,有下列判断,其中正确的是( )①氢气只是氧化产物 ②氢气只是还原产物 ③水是氧化剂 ④氢化钙中的氢元素被还原 ⑤此反应中的氧化产物与还原产物的分子个数之比为1∶1A . ①④B . ②③⑤C . ①D . ③⑤6.在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。
下列判断不正确的是( )A . 氧化性:ClO ->I 2>SO 42−B . 漂白粉溶液可使淀粉碘化钾试纸变蓝C . 向氯水中加入亚硫酸钠溶液,氯水褪色D . 次氯酸钠与亚硫酸钠在酸性条件下可以共存7.等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应,若生成硫酸钡沉淀的质量比为1∶2∶3,则三种硫酸盐的物质的量浓度之比为( )A . 1∶2∶3B . 1∶6∶9C . 1∶3∶3D . 1∶3∶68.高纯度单晶硅是典型的无机非金属材料,又称“平导体”材料,它的发现和使用曾引起计算机的一场“革命”。
2021-2022学年苏教版高中化学必修1试题:1.1.2物质的量 Word版含解析

2.下列关于阿伏加德罗常数的说法正确的是( ) A .阿伏加德罗常数是12 g 碳中所含的碳原子数 B .阿伏加德罗常数是0.012 kg 12C 中所含的原子数 C .阿伏加德罗常数是6.02×1023D .阿伏加德罗常数的符号为N A ,近似为6.02×1023【解析】 阿伏加德罗常数就是0.012 kg 12C 中所含有的原子数,符号为N A ,近似值为6.02×1023 mol -1,故B 正确,A 项未说明12 g 碳原子为12C 。
【答案】 B3.下列叙述中正确的是( )A .1 mol 任何纯洁物都含有相同的原子数B .1 mol O 2中约含有6.02×1023个氧气分子C .1 mol 氢中含有2 mol 氢原子D .阿伏加德罗常数就是6.02×1023【解析】 A 选项,纯洁物并不都是由原子构成的,A 选项错误;C 选项,1 mol 氢的表示法错误,并且没有说明是原子还是分子;D 选项,阿伏加德罗常数约是6.02×1023 mol -1,并不就是6.02×1023,所以D 选项错误。
【答案】 B4.若某原子的摩尔质量是M g/mol ,则一个该原子的真实质量是( )A .M g B.1M gC.M6.02×1023g D.6.02×1023M g【解析】 当质量以克为单位时,摩尔质量与相对原子质量及1 mol 原子的质量数值相等,故1 mol 该原子的质量为M g ,而1 mol 原子的数目为6.02×1023个,故1个原子的质量为M6.02×1023g 。
【答案】 C5.水电解的化学方程式为2H 2O=====电解2H 2↑+O 2↑,某同学电解肯定量的水,制得8 g H 2,则该8 g H 2的物质的量为( )A .2 molB .4 molC .8 molD .89.6 mol【解析】 H 2的摩尔质量为2 g/mol,8 g H 2的物质的量n =m M =8 g2 g/mol=4 mol 。
苏教版高中化学必修1专题2测试题1及答案

苏教版必修1专题2测试题1一、选择题1.从海水中获得的在常温下是液体的单质是()A.Mg B.K C.Br2D.I22.下列说法符合事实的是()A.漂白精的有效成分是NaClO B.碘化钾的水溶液遇淀粉现蓝色C.硫在空气中燃烧生成SO2,在纯氧中生成SO3D.漂白精露置空气中变质,既发生氧化反应又发生非氧化还原反应3.将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是()A.氯水B.硫酸C.硫酸锌D.氯化铜4.鉴别Clˉ、Brˉ、Iˉ三种离子,宜选用的试剂组是()A.溴水和淀粉溶液B.硝酸银溶液和稀硝酸C.氯水和四氯化碳D.氯水和碘化钾淀粉溶液5.ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。
工业上ClO2常用NaClO3和NaSO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和NaSO3的物质的量之比为()A.1:1 B.2:1 C.1:2 D.2:36.在烧杯中加一些水,滴入几滴酚酞溶液,然后把一块钠放入水中,从这个实验过程观察到的反应现象中,不可能得出的结论是()A.钠比较柔软B.钠与水反应生成碱C.钠与水反应放热D.钠与水反应放出气体7.下列关于钠离子的叙述中,正确的是()A.不能独立存在B.比钠原子活泼C.焰色反应呈黄色D.具有强还原性8.下列关于Na和Na+的叙述中,错误的是()A.具有相同的质子数B.它们的化学性质相似C.钠离子是钠原子的氧化产物D.灼烧时火焰都呈黄色9.海水中含的MgCl2是Mg的重要来源之一,从海水中提取镁,可按如下步骤进行:①将贝壳制成石灰乳;②在引入的海水中加入石灰乳、沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应、结晶、过滤、干燥产物;④将产物熔融后电解关于提取镁,下列说法中不正确的是()A.此法的优点之一是原料来源丰富B.进行①、②、③步的目的是从海水中提取MgCl2C.第④步会产生氯气D.以上过程中涉及分解反应、化合反应和置换反应10.等质量的钠进行下列实验,其中生成氢气最多的是()A.将钠投入到足量水中B.将钠用铝箔包好并刺一些小孔,再放入足量的水中C.将钠放入足量稀硫酸中D.将钠放入足量稀盐酸中11.下列各组中的两物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是()A.氧化钠和二氧化碳B.盐酸和碳酸钠C.氢氧化钠和二氧化碳D.碳和氧气12.可以用来断定碳酸氢钠粉末中混有碳酯钠的实验方法是()A.加热时有无色气体放出B.滴加盐酸时有气泡产生C.溶于水后,滴加CaCl2溶液,有白色沉淀生成D.溶于水后,滴加澄清石灰水,有白色沉淀生成13.下列化工生产过程所发生的反应不属于氧化还原反应的是()A.用红磷制白磷B.用氧化铝制金属铝C.用氯气制漂白精D.用金属钠制过氧化钠14.吸进人体的氧有2%转化为氧化性极强的活性氧,这些活性氧加速人体衰老,被称为“生命杀手”,科学家试用Na2SeO3消除人体内的活性氧,则Na2SeO3的作用是()A.氧化剂B.还原剂C.既是氧化剂和又是还原剂D.以上均不是15.在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中, 被氧化的硫原子数与被还原的硫原子数之比为()A.1:1 B.2:1 C.1:2 D.3:216.已知在某温度时发生如下三个反应:(1)C+CO2=2CO (2)C+H2O=CO+H2 (3)CO+H2O=CO2+H2由此可以判断,在该温度下C、CO、H2的还原性强弱顺序是()A.CO >C >H2B.C >CO >H2C.C >H2>CO D.CO >H2>C17.当X2O72-和SO32-离子数为1:3时恰好完全发生反应,X在还原产物中化合价为()A.+1 B.+2 C.+3 D.+418.下列离子方程式错误的是()A.钠投入硫酸铜溶液中:2Na+Cu2+ = 2Na++CuB.碳酸钙与盐酸反应:CaCO3+2H+ = Ca2++CO2↑+H2OC.硫酸与氢氧化钡反应:SO42-+2H+ + Ba2+ +2OH-= BaSO4↓+2 H2OD.氯气通入水中:Cl2+H2O = H++Cl-+HClO19.下列离子方程式正确的是()A.氯化铵与氢氧化钠两种浓溶液混合加热:OH-+ NH4+加热H2O + NH3↑B.碳酸氢钠溶液与少量石灰水反应:HCO3-+ Ca2+ + OH-= CaCO3↓+ H2OC.氢氧化镁与稀硫酸反应:H+ + OH-= H2OD.碳酸钠溶液与盐酸反应:Na2CO3 +2H+ == 2Na+ + H2O + CO2↑20.在强酸性溶液中可大量共存的离子组是()A.Na+、K+、Cl-、CH3COO-B.Fe2+、ClO-、NO3-、Na+C.Fe2+、Mg2+、SO42-、Cl-D.CO32-、SO42-、Na+、K+21.在溶液中能大量共存,若加入OH-就有沉淀析出,若加入H+就能放出气体的是()A.Na+、Ca2+、Cl-、HCO3-B.Ba2+、K+、OH-、NO3-C.H+、Al3+、NH4+、SO42-D.Mg2+、Na+、Cl-、CO32-22.向某溶液中加入过量盐酸生成白色沉淀,过滤后向滤液中加入过量的氨水(使溶液呈碱性),又生成白色沉淀;再过滤后向滤液中加入碳酸钠溶液,又生成白色沉淀,则原溶液中含有的离子可能是()A.Ag+、Cu2+、Ba2+B.Ag+、Al3+、Na+C.Ag+、Al3+、Ca2+D.Al3+、Mg2+、K+二、填空题23.新切开的金属钠放在空气中,可看到,这是因为钠和迅速反应生成了的缘故。
苏教版高中化学必修一专题1 检测试题.doc
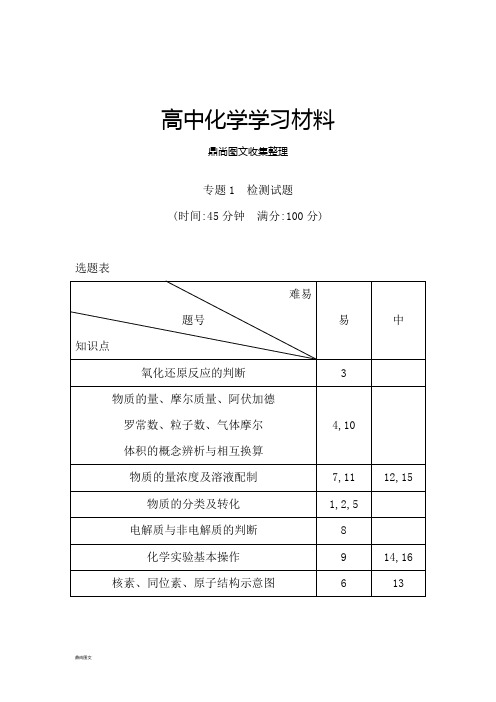
高中化学学习材料鼎尚图文收集整理专题1 检测试题(时间:45分钟满分:100分)选题表难易易中题号知识点氧化还原反应的判断 3物质的量、摩尔质量、阿伏加德4,10罗常数、粒子数、气体摩尔体积的概念辨析与相互换算物质的量浓度及溶液配制7,11 12,15 物质的分类及转化1,2,5电解质与非电解质的判断8化学实验基本操作9 14,16 核素、同位素、原子结构示意图 6 13一、选择题(共12小题,每小题5分,共60分)1.胶体区别于其他分散系的本质特征是( C )A.胶体的分散质通过滤纸空隙,而浊液的分散质不能B.产生丁达尔效应C.分散质粒子直径在1 nm~100 nm之间D.胶体在一定条件下能稳定存在解析:胶体区别于其他分散系的本质特征在于分散质粒子直径的大小。
2.(2012南京检测)下列说法中正确的是( A )A.红磷转化为白磷是化学变化B.原子是不能再分的最小微粒C.O3是由3个氧原子构成的化合物D.冰水混合物属于混合物解析:红磷→白磷,发生了键的断裂和形成,生成新物质,是化学变化,A正确;原子可以再分,B错;O3是单质,C错;冰水混合物是纯净物,D错。
3.厨房中的化学知识很多,下面是有关厨房中的常见操作或者常见现象,其中发生的变化不属于氧化还原反应的是( C )A.食物长时间放置后变质腐败B.燃烧液化石油气为炒菜提供热量C.用活性炭除去冰箱中的异味D.炒菜用过的铁锅出现红棕色斑迹解析:食物变质、燃料燃烧、铁锅生锈均是物质与空气中的氧气反应,均为氧化还原反应。
而活性炭除异味,是利用了活性炭多孔具有吸附性,属物理变化。
4.下列叙述中正确的是( D )A.NaOH的摩尔质量为40 gB.64 g SO2中含有1 mol O2C.1 mol N2的体积为22.4 LD.0.5 mol CO2约含有3.01×1023个CO2分子解析:摩尔质量的单位为g·mol-1,A错误;SO2中含氧元素,而不能说含氧气,B错误;不指明状况,不能确定1 mol N2的体积,C错误;D项正确。
苏教版高中化学必修一专题一、二习题

2007-2008永泰地区化学科苏教版必修1专题一、二习题说明:1、请将答案填写在答案卷上,考试结束后只交答案卷。
2、考试时间:60分钟;本卷满分:100分+10分可能用到的相对原子质量:H—1O—16Na—23 S—32Cl—35.5第一卷(选择题共45分)一、选择题(每小题只有一个选项符合题意,每小题3分,共45分)1.能区分胶体和溶液的方法是( )A.静置,有沉淀现象的是胶体B.有丁达尔现象的是胶体C.能透过滤纸的是溶液D.用肉眼观察,均匀透明的是溶液2.下列物质间不能发生反应的是()A. H2SO4和Ba(OH)2B. CO2和NaOHC.C aCO3和HCl D. Mg(OH)2和CuSO43.下列各组物质中,依次属于单质、酸、盐的一组是()A.干冰、石灰石、氧化钙 B.氧气、盐酸、熟石灰C.水、烧碱、食盐 D.液氯、硝酸、纯碱4.下列说法正确的是()A.金属钠能与NaOH溶液反应B.金属钠露置于空气中易被氧化生成Na2O2C.金属钠能置换出盐溶液中不活泼的金属单质D.金属钠着火可用水来灭火5.32He 可以作为核聚变材料,下列关于32He的叙述正确的是()A. 32He 和31H 互为同位素 B. 32He 原子核外电子数为2C. 32He 原子核内中子数为2 D. 32He 代表有2个质子和3个中子的氦原子6.下列说法错误的是()A.化合反应不一定是氧化还原反应B.置换反应一定是氧化还原反应C.氧化还原反应中,非金属单质一定是氧化剂D.氧化还原反应中,金属单质一定是还原剂7.下列关于氯水的叙述正确的是( )A.新制氯水中只含Cl2和H2O分子B.光照氯水有气泡放出,该气体是Cl2C.氯水放置一段时间后颜色将变深D.新制氯水可使紫色石蕊试液先变红后褪色8.下列反应中,硫元素只被氧化的是()A.SO2+2H2S===3S↓+2H2O B.SO3+H2O==H2SO4C.SO2+2H2O+Br2===2HBr+H2SO4D.3S + 6KOH = K2SO3 + 2K2S + 3H2O 9.能鉴别NH4Cl、K2SO4、(NH4)2SO4、NaCl四瓶无色溶液的试剂是()A. Ba(NO3)2溶液B.AgNO3溶液C. Ba(OH)2溶液D. NaOH溶液10.现有三组溶液:①CCl4和氯化钠溶液;②苯(沸点:80.1℃)和甲苯(沸点:110.6℃)的混合物(苯和甲苯是其他性质非常相似的一对互溶液体);③氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是()A.分液、萃取、蒸馏 B.萃取、蒸馏、分液C.蒸馏、萃取、分液 D.分液、蒸馏、萃取11.能使湿润的淀粉KI试纸变蓝的是()①氯水②溴水③碘水④氯化钠⑤溴化钾A.①②③B.①②④C.②③④D.③④⑤12.下列说法正确的是(N A表示阿伏加德罗常数的值)()A.在常温常压下,11.2L N2含有的分子数为0.5N AB.在常温常压下,18 g水中含有的分子数为N AC.含有分子数为N A的氧气的质量是16g/molD.在 2mol/L的MgCl2溶液中含有的Cl- 数为4 N A13.有下列物质:①0.5mol NH3②标准状况下22.4L He ③4℃时9mL H2O④0.2mol H3PO4按所含的原子数由多到少的顺序排列,正确的是( )A、①④③②B、④③②①C、②③④①D、①②③④14.配制一定体积一定物质的量浓度溶液时,下列情况对实验结果产生偏高影响的是()A.定容时仰视刻度线B.容量瓶中还有蒸馏水时即配溶液C.定容时液面高于刻度,用滴管小心吸去多余液体,使液面与刻度相切D.定容时俯视刻度线15.把4.6g钠投入到95.6g水中,发生化学反应。
苏教版高中化学必修一专题一测试卷.docx

高中化学学习材料唐玲出品专题一测试卷时间:90分钟满分:100分可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 S 32 Cl 35.5 K 39 Ca 40 Cu 64第Ⅰ卷(选择题共48分)一、选择题(本题包括16小题,每小题3分,共48分。
每小题只有一个选项符合题意)1.ClO2是生产饮用水的新一代消毒剂,从物质的分类角度看,ClO2属于( )A.氧化物B.酸C.碱 D.盐答案:A解析:ClO2由两种元素组成,其中一种为氧元素,A项正确。
2.下列原子结构示意图所表示的元素与氩元素的化学性质相似的是( )A. B. C. D.答案:D解析:D项中表示的元素为Ne元素,属于惰性气体元素,性质与氩元素相似,D项正确。
3.下列仪器:①普通漏斗②容量瓶③长颈漏斗④洗气瓶⑤量筒⑥蒸馏烧瓶。
常用于物质分离的是( )A.①④⑥ B.②⑤⑥C.①②③ D.②③⑥答案:A解析:普通漏斗用于过滤,洗气瓶用于气体分离,蒸馏烧瓶用于蒸馏分离,A项符合题意。
4.将4 g NaOH固体溶解于10 mL水中,再稀释至1 L,从中取出10 mL,则这10 mL 溶液的物质的量浓度是( )A.1 mol·L-1 B.0.1 mol·L-1C.0.01 mol·L-1 D.10 mol·L-1答案:B解析:将4 g NaOH固体溶解于10 mL水中,再稀释至1 L,其浓度为0.1 mol·L-1,从中取出10 mL,浓度不变,B项正确。
5.某阳离子M n+核外有x个电子,核内有y个中子,则M的质量数为( )A.x+y B.x-n+yC.x+n+y D.x+n-y答案:C解析:M n+的质子数为x+n,质量数为x+n+y,C项正确。
6.Fe(OH)3胶体区别于FeCl3溶液最本质的特征是( )A.外观颜色的不同B.胶体粒子直径在10-9~10-7 m之间C.稳定性不同D.胶体有丁达尔现象答案:B解析:胶体区别于其他分散系最本质的特征是胶粒直径的大小,B项正确。
苏教版高中化学必修一 专题综合测评2

苏教版高中化学必修一专题综合测评2(时间90分钟,总分值100分)一、选择题(此题包括16小题,每题3分,共48分)1.以下运用不触及氧化恢复反响的是()A.煅烧石灰石制生石灰B.氯水的消毒C.海水中提纯Br2D.Na2O2作供氧剂【答案】 A2.某化学教员为〝氯气与金属钠反响〞设计了如图装置与操作以替代相关的课本实验。
玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。
先给钠预热,待钠熔融成圆球时,撤火,通入氯气,即可见钠着火熄灭,生成少量白烟。
以下表达错误的选项是()A.反响生成的少量白烟是氯化钠晶体B.浸有NaOH溶液的棉花球用于吸收过量的氯气,以免其污染空气C.钠着火熄灭发生惨白色火焰D.在棉花球外沿滴一滴石蕊溶液,判别氯气能否被碱液完全吸收C[钠着火时火焰呈黄色;Na与Cl2反响生成NaCl固体小颗粒出现白烟,NaOH溶液可与Cl2反响,常用于尾气吸收,Cl2可使石蕊溶液先变红后褪色。
] 3.某同窗用以下装置制备并检验Cl2的性质。
以下说法正确的选项是() A.Ⅰ图:假定MnO2过量,那么浓盐酸可全部消耗完B.Ⅱ图:证明新制氯水具有酸性和漂白性C.Ⅲ图:发生了棕黄色的雾D.Ⅳ图:有色布条均褪色B[浓盐酸反响变为稀HCl时反响不再发作;C项,CuCl2为固体,不能构成雾,应构成烟;D项,枯燥的有色布条不褪色。
]4.海水是一个庞大的化学资源宝库,以下有关海水综合应用的说法正确的选项是A.从海水中可以失掉NaCl,电解熔融NaCl可制备Cl2B.海水蒸发制海盐的进程中只发作了化学变化C.海水中含有镁元素,只需经过物理变化就可以失掉镁单质D.目前工业上直接由海水提取I2A[蒸发进程为物理变化;海水中的镁元素为化合态,失掉单质镁为化学变化;虽然海水中碘的总藏量很大,但由于其浓度很低,目前工业上并不直接由海水提取I2。
]5.以下逻辑关系图示中正确的选项是()A B C DD[解答此题的关键是了解物质的分类规范,依据分散质粒子直径的大小将分散系分为溶液、胶体和浊液,而气溶胶属于胶体的一种,故A错误;氧化恢复反响与吸热反响和放热反响的分类规范不同,故B错误;钾盐与钠盐是依据盐中的阳离子停止分类的,碳酸盐是依据盐中阴离子停止分类的,故C错误。
苏教版高中化学必修一《专题2》检测题.docx

高中化学学习材料唐玲出品《专题2》检测题(时间:90分钟 满分:100分)可能用到的相对原子质量:H 1 C 12 O 16 Na 23 K 39 Cl35.5 Cu 64 Mn 55 第Ⅰ卷(选择题,共48分)一、选择题(本题共16道小题,每小题只有一个正确选项,每小题3分,共48分)1.下列变化中,属于化学变化的是( ) A .溴挥发B .氯水光照后褪色C .碘升华D .溴水加CCl 4后溴水层褪色 解析 Cl 2+H 2O HCl +HClO,2HClO=====光照O 2↑+2HCl 。
答案 B2.海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )A .从海水中可以得到NaCl ,电解熔融NaCl 可制备Cl 2B .海水蒸发制海盐的过程中只发生了化学变化C .海水中含有镁元素,只需经过物理变化就可以得到镁单质D .目前工业上直接由海水提取I 2解析 蒸发过程为物理变化;海水中的镁元素为化合态,得到单质镁为化学变化;虽然海水中碘的总藏量很大,但由于其浓度很低,目前工业上并不直接由海水提取I 2。
答案 A3.金属钠露置在空气中,在其表面不可能生成的物质是( ) A .NaCl B .NaOH C .Na 2CO 3D .Na 2O解析 Na 在空气中氧化生成Na 2O ,Na 2O 与空气中的H 2O 反应生成NaOH ,NaOH 与空气中的CO 2反应生成Na 2CO 3。
答案 A4.下列叙述不正确的是( ) A .液氯是纯净物,氯水是混合物 B .漂白粉的主要成分是Ca(ClO)2和CaCl 2 C .Ca(ClO)2比HClO 不稳定D .氢气在氯气中燃烧生成的气体溶于水中形成盐酸解析 HClO 不稳定,容易分解放出O 2,在阳光的照射下,HClO 分解加快,Ca(ClO)2比HClO 稳定。
答案 C5.在下列反应中,氧化剂和还原剂为同一种物质的是( ) A .2Na +2H 2O===2NaOH +H 2↑B .MnO 2+4HCl(浓)=====△MnCl 2+2H 2O +Cl 2↑ C .Na 2CO 3+CO 2+H 2O===2NaHCO 3 D .2Na 2O 2+2CO 2===2Na 2CO 3+O 2解析 D 项中Na 2O 2既是氧化剂又是还原剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学学习材料(精心收集**整理制作)化学必修1专题1、2合测试卷姓名 __________班级____________可能用到的相对原子质量 H:1 C:12 N:14 O:16 Na:23 S:32 Cl :35.5 K:39 Ba:137 Mn:55 Mg:24 Al:27第I卷(选择题共40分)一.选择题(共20小题,每小题只有一个正确答案,每题2分;答案请填入第II卷开始处相应表格内)1、 KHSO4在水溶液中能够电离出H+、K+和SO42-。
下列对于KHSO4几种分类不正确的是()A、KHSO4是盐 B、KHSO4是钾盐 C、KHSO4是酸 D、KHSO4是酸式盐2.下列基本反应类型中,一定是氧化还原反应的是()A.复分解反应 B.置换反应C.分解反应 D.化合反应3.下列实验操作中,正确的是()A.配制5%NaCl溶液时,将称量的NaCl放入烧杯中加计量的水搅拌溶解B.配制1mol·L-1NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶C.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释D.分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出4.设NA表示阿伏加德罗常数,下列叙述中正确的是()A.常温常压下,11.2 LCO2所含的原子数为1.5NAB.常温常压下,48 g O3含有的氧原子数为3NAC .标准状况下,22.4 L H 2中所含原子数为N AD .标准状况下,1 L 水所含分子数为4.221N A5、下列说法中正确的是 ( )A 、摩尔既是物质的量单位又是物质的质量单位B 、物质的量既表示物质的量又表示物质的质量C 、阿伏加德罗常数是12kg 12C 中含有的碳原子数目D 、1mol H 2O 中含有2mol H 和1mol O6、气体的体积主要由以下什么因素决定的:①气体分子的直径;②气体物质的量的多少;③气体分子间的平均距离;④气体分子的相对分子质量 ( )A 、①② B、①③ C、②③ D、②④7、现有下列各组气体,其中分子数一定相同的是 ( ) A 、34g NH 4和4g H 2 B 、11.2L N 2和0.5 mol N 2 C 、2L CO 2和2L H 2O D 、14g N 2和16g O 28、胶体区别于其他分散系的本质特征是 ( ) A 、胶体的分散质能通过滤纸空隙,而浊液的分散质不能 B 、分散质粒子直径在10-9~10-7m 之间 C 、胶体能产生丁达尔现象D 、胶体是纯净物,气体分散系是混合物9.化学实验中的很多气体是用盐酸来制取的,这就导致了这些制取的气体中往往含有HCl 杂质,要除去HCl 杂质而得到纯净的目标气体,可用右图所示装置。
如果广口瓶中盛装的是饱和NaHCO 3溶液,则可以用于下列哪种气体的除杂装置是( ) A .H 2B .CO 2C .H 2SD .SO 210、钠与水反应时可能产生的各种现象如下:①钠浮在水面上;②钠沉在水底;③钠熔化成闪亮的小球;④小球迅速四处游动,发出嘶嘶的声音;⑤小球逐渐减小,最后消失;⑥滴入酚酞后溶液显红色。
其中完整的正确的组合是:( )A 、①③④⑤⑥ B、②③④⑤⑥ C、①③④⑤ D、全部11.下列离子方程式正确的是 ( )A .硫酸镁溶液跟氢氧化钡溶液反应:-24SO +Ba 2+=BaSO 4↓ B .H 2SO 4溶液与Ba(OH)2溶液反应:Ba 2++OH -+H ++-24SO ===BaSO 4↓+H 2OC .铜片插入硝酸银溶液中:Cu + 2Ag + === Cu 2+ + 2AgD.澄清石灰水中加入盐酸 Ca(OH)2+2H+= Ca2++2H2O12.下列各组离子在溶液中能大量共存的是()A.Ba2+、C1-、-24SO、K+B.K+、OH-、-3HCO、Na+C.Ca2+、-3HCO、C1-、K+D.Ag+、-3NO、Cl-、K+13、离子方程式CO32-+2H+=H2O+CO2↑中的CO32-代表的物质可能是 ( )A、CaCO3 B、NaHCO3C、Na2CO3D、BaCO314、已知Cl-、I-、Fe2+、SO2、H2O2,均具有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2。
则下列反应不能发生的是()A、H2O2+H2SO4=SO2↑+O2↑+2H2OB、I2+SO2+2H2O=H2SO4+2HIC、2Fe3++2I-=2Fe2++I2D、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+15.下列带括号的气体在反应中只做氧化剂的是()A.2F2 (g) + 2H2O = 4HF + O2↑B.SO2 (g) +I2+ 2H2O = H2SO4+ 2HIC.H2S (g) + Br2= 2HBr + S↓D.3NO2 (g) + H2O = 2HNO3+ NO16、下列物质中不能导电的是 ( )A、氯化钾溶液B、澄清石灰水C、酒精D、石墨碳棒17、在AgNO3、KNO3和Cu(NO3)2的混合溶液中,加入一定量的铁粉充分反应后,过滤、洗涤,将滤渣放入盐酸中有气泡产生,滤液中存在的阳离子是()A、Cu2+B、只有Fe3+C、只有Fe2+D、K+和Fe2+18.等体积的NaCl、MgCl2、AlCl3三种溶液分别与等体积等物质和量浓度的AgNO3溶液恰好完全反应,则NaCl、MgCl2、AlCl3三种溶液的物质的量浓度之比是()A.1:1:1 B.1:2:3C.3:2:1 D.6:3:219.某地有甲、乙两工厂排放污水,污水中各含有下列8种离子中的4种(两厂不含相同离子):Ag+、Ba2+、Fe2+、Na+、Cl-、SO42-、NO3-、OH-。
若两厂单独排放都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便变成无色澄清只含硝酸钠而排放,污染程度会大大降低。
关于污染源的分析,你认为正确的是()A、Na+和NO3-来自同一工厂B、Cl-和NO3-一定在同一工厂C、Ag+和Na+可能在同一工厂D、SO42-和OH -可能来自同一工厂20、金属加工后的废切削液中含2%~5%的NaNO2,它是一种环境污染物。
人们利用NH4Cl溶液来处理此废切削液,使NaNO2转化为无毒物质。
该反应分两步进行:( )第一步:NaOH+NH4Cl=NaCl+NH4NO2,第二步:NH4NO2=N2↑+2H2O下列对第二步反应的叙述中正确的是①NH4NO2是氧化剂②NH4NO2是还原剂③NH4NO2发生了分解反应④只有氮元素的化合价发生了变化⑤NH4NO2既是氧化剂又是还原剂A、①③B、①④C、②③④D、③④⑤化学必修1专题1、2合测试卷答案纸姓名__________ 班级_______________一、选择题(40分)题号 1 2 3 4 5 6 7 8 9 10 答案 C B A B D C A B B A 题号11 12 13 14 15 16 17 18 19 20 答案 C C C A A C D D D D第II卷(非选择题 60分)二、填空题:(计38分)21.(5分)下列4组物质均有一种物质的类别与其它3种不同A.CaO、Na2O、CO2、CuO B.H2、C、P、CuC.O2、Fe、Cu、Zn D.HCl、H2O、H2SO4、HNO3(1)则这4种物质依次是(填化学式):A:____CO2_______________ ;B:_________Cu________C: _______O2____________ ;D :__H2O________________.(2)这四种物质相互作用可生成一种新物质(碱式碳酸铜,化学式Cu2(OH)2CO3),该反应_______是____氧化还原反应(填“是”或“否”)。
22.(12分)分别用一种试剂将下列物质中混入的少量杂质除去(括号内为混入的杂质)物质需加入的试剂有关化学方程式Mg(Al) NaOH 2Al+2NaOH+2H2O=2NaAlO2+3H2↑Cu(Fe) HCl Fe+2HCl=FeCl2+H2↑ZnSO4(CuSO4) Zn Zn+CuSO4=ZnSO4+CuNaCl(Na2CO3) HCl Na2CO3+2HCl=2NaCl+H2O+CO2↑23.(8分)现有以下物质:①NaCl溶液;②液态SO3;③冰醋酸;④汞;⑤BaSO4固体;⑥干冰;⑦乙醇(C2H5OH);⑧熔融的KNO3。
请回答下列问题(用序号填写):其中:(1)能导电的是____1 , 4, 8_________________________ (2)属于强电解质的是_____________5, 8________________(3)属于弱电解质的是__3___________________________(4)属于非电解质的是____2, 6, 7_________________________ 24、写出下列反应的离子方程式:(8分)(1)碳酸钠溶液中加入过量的醋酸:CO32-+2CH3COOH=2CH3COO-+H2O+CO2↑(2)氯化铝溶液中加入过量的氨水:Al3++3NH3.H2O=Al(OH)3↓+3NH4+(3)碳酸氢钙溶液中加入过量的氢氧化钠:Ca2++2HCO3-+2OH-=H2O+CaCO3↓+CO32-(4)氯气溶于水:Cl2+H2O=HClO+H++Cl-26.(5分)有一瓶澄清的溶液,其中可能含有K+、Na+、Ba2+、Mg2+、Fe3+、Cl—、CO32―、SO42―,取该溶液进行以下实验:⑴取PH试纸检验,表明溶液呈强酸性,排除________CO32-______离子的存在。
⑵另取部分溶液逐滴加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,则可排除__Mg2+,Fe3+____ 离子的存在。
⑶取上述碱性溶液滴加Na2CO3溶液,有白色沉淀生成,可排除____SO42-__ 离子存在。
⑷根据以上实验事实确定:该溶液中肯定存在的离子是___Ba2+,Cl-_____;可能存在的离子是:_____Na+,K+______ 。
三、实验题:(计8分)27、实验室需要250mL 0.5 mol/L的稀硫酸溶液,现用密度为1.84 g/mL,质量分数为98%浓硫酸配制。
请回答下列问题:(1)下列仪器中,用不到的是B C。
A、250mL容量瓶B、500mL容量瓶C、50mL量筒D、10mL量筒(2)若要进行配制,除上述仪器外,尚缺少的仪器或用品是烧杯,玻璃棒,胶头滴管。
(3)容量瓶上除有刻度线和容量规格外还应标有温度,容量瓶在使用前必须进行的操作是检查是否漏水。
