前列地尔注射液说明书--凯时
前列地尔产品信息

药品名称英文通用名中文通用名状态状态进程alprostadil 前列地尔上市上市异名中文名:前列地尔,前列地尔,前列地尔尿道栓,注射用前列地尔,注射用前列腺素E1,前列腺素E1乳膏,前列地尔注射液英文名:U-10136,Prostin,Prostivas,Prostin-VRPediatric,Prostine,Caverject,Prostandin,Prostin-VR,Alprostar,Liple^,PGE1,Minprog,alprostadil,Prostaglandin E1化学信息CA登录号745-65-3分子式C20H34O5化学名Prost-13-en-1-oic acid, 11,15-dihydroxy-9-oxo-, (11alpha,13E,15S)- [CAS]结构式知识产权状况专利优先权国家专利号专利申请日世界专利合作协定;World PCT US5741523 1994年11月06日基本药物药品名称剂型版本前列地尔(前列腺素E1) 注射剂2004医保情况药品名称剂型医保类别版本前列地尔注射剂乙类2004前列地尔注射剂乙2009版药品标准药品名称标准号出处前列地尔注射液WS1-(X-041)-2002Z新药转正标准(第29册)前列地尔WS1-XG-004-2002化学药品地方标准上升国家标准(第十六册)注射用前列地尔WS1-XG-005-2002化学药品地方标准上升国家标准(第十六册)前列腺素E1乳膏WS1-(X-288)-2004Z新药转正标准(第58册) 药典收藏情况剂型USP25 原料药USP25 注射剂国外企业开发和许可信息原创企业国家进程Pfizer美国;USA 上市许可企业国家进程Dong-A韩国;South Korea 上市Ono日本;Japan 上市Recordati意大利;Italy 上市治疗信息治疗类别代码治疗类别进程B02A 抑制纤维蛋白形成药上市H06A 前列腺素及有关药上市U02A 男性功能障碍上市C10B 周围血管扩张药上市靶点适应证进程未指明上市药理作用机制代码药理中文描述PG-E1+ 前列腺素E1激动剂产品状态说明书详细内容出处前列地尔注射液SDA注射用前列腺素NICPBP(中国药品生物制品检定所)注射用前列地尔NICPBP(中国药品生物制品检定所)市场动态国外市场情况国家状态上市年份许可机会阿根廷;Argentina 上市无奥地利;Austria 上市无巴西;Brazil 上市无丹麦;Denmark 上市无芬兰;Finland 上市无希腊;Greece 上市无印度;India 上市无荷兰;Netherlands 上市无马来西亚;Malaysia 上市无以色列;Israel 上市无爱尔兰;Ireland 上市无中国香港;Hong Kong 上市无泰国;Thailand 上市无菲律宾;Philippines 上市无日本;Japan 上市1979 无英国;UK 上市1981 无加拿大;Canada 上市1982 无美国;USA 上市1982 无澳大利亚;Australia 上市1983 无瑞士;Switzerland 上市1983 无西班牙;Spain 上市1983 无德国;Germany 上市1983 无法国;France 上市1983 无比利时;Belgium 上市1985 无韩国;South Korea 上市1986 无瑞典;Sweden 上市1986 无挪威;Norway 上市1988 无意大利;Italy 上市1993 无葡萄牙;Portugal 上市1994 无国内市场情况进口产品注册生产厂家商品名剂型规格注册证号批准日期台湾省永光化学工业前列地尔原料药XC20010012股份有限公司第二厂台湾省永光化学工业前列地尔原料药XC20010011股份有限公司第二厂Everlight ChemicalIndustrialCorporation, TheSecond Factory.前列地尔原料药HC20090040 2009-12-25Everlight ChemicalIndustrialCorporation, TheSecond Factory.前列地尔原料药HC20090041 2009-12-17TaishoPharmaceutical Co.,Ltd. Ohmiya Factory前列地尔原料药H20090371 2009-04-16Bayer HealthCare AG 注射用前列地尔注射剂20μg国药准字J200800562008-06-06Bayer HealthCare AG 注射用前列地尔注射剂20μg BH20080081 2008-05-09Bayer HealthCare AG 注射用前列地尔注射剂20μg H20080081 2008-03-07辉瑞制药有限公司注射用前列地尔注射剂20mg 2005.1.5台湾永光化学工业股份有限公司、台湾永光化学工业股份有限公司第二厂、明德国际仓储贸易(上海)有限公司前列地尔原料药2004.11.22台湾永光化学工业股份有限公司、台湾永光化学工业股份有限公司第二厂、明德国际仓储贸易(上海)有限公司前列地尔原料药2004.11.22大正制药株式会社大宫工厂、北京泰德制药有限公司TaishoPharmaceutical Co.,Ltd.前列地尔原料药H20030496 2003.9.23Schwarz Pharma AG 注射用前列地尔注射剂20μg BH20030027 2003.6.16Schwarz Pharma AG 注射用前列地尔注射剂20μg J20030051 2003.6.16Schwarz Pharma AG 注射用前列地尔注射剂20μg 2003.5.9Bayer AG 注射用前列地尔注射剂20μg H20030027 2003.1.30Pharmacia & Upjohn N.V./S.A. 注射用前列地尔注射剂20μg/瓶X20010456 2001Schwarz Pharma AG 前列地尔注射剂20mg/瓶X20000189 2000 Schwarz Pharma AG 前列地尔注射剂20μg/瓶BX20000189 2000Schwarz Pharma AG 注射用前列地尔注射剂20mcg/瓶BX970041 1999Pharmacia & UpjohnN.V./S.A.前列地尔粉剂20μg/瓶X980364 1998 国产产品注册申请单位剂型规格国药证字国药准字批准日期哈尔滨誉衡药业有限公司栓剂(尿道) 0.5mg国药准字H20040658哈尔滨誉衡药业有限公司栓剂(尿道) 1mg国药准字H20040659海南碧凯药业有限公司注射剂2ml:10ug国药准字H201032922010-6-22重庆药友制药有限责任公司乳剂10μg国药准字H201000482010-4-29重庆药友制药有限责任公司乳剂5μg国药准字H201000472010-4-29西安力邦制药有限公司注射剂2ml:10μg国药准字H201031002010-3-15西安力邦制药有限公司注射剂1ml:5μg国药准字H201031012010-3-15哈药集团生物工程有限公司注射剂1ml:5μg国药准字H200942032009-12-22本溪雷龙药业有限公司注射剂1mL:5μg国药准字H200931742009-02-10本溪雷龙药业有限公司注射剂2mL:10μg国药准字H200931752009-02-10哈药集团生物工程有限公司注射剂2ml:10μg国药准字H200845652008-12-19北京赛科药业有限责任公司注射剂100μg国药准字H200842742008-09-22吉林天强制药有限公司注射剂100ug国药准字H200842462008-09-22峨眉山通惠制药有限公司注射剂100μg国药准字H200836632008-06-30沈阳格林制药有限公司注射剂200g国药准字H200668322006-07-06沈阳格林制药有限公司注射剂100g国药准字H200668312006-07-06沈阳格林制药有限公司原料药5g国药准字H200668282006-07-06江苏吴中实业股份有限公司苏州第六制药厂注射剂100g国药准字H200659482006-06-18吉林省育华药业有限责任公司注射剂2ml:10ug国药准字H200607162006-05-12山西亚宝药业集团股份有限公司注射剂20g国药准字H200643862006-04-05山西亚宝药业集团股份有限公司注射剂100g国药准字H200643872006-04-05辽宁玉皇药业有限公司冻干注射剂20g国药准字H200631412006-01-10哈药集团生物工程有限公司原料药国药准字H200597872005-12-23重庆药友制药有限公司冻干注射剂40g国药准字H200578242005-09-27北京赛生药业有限公司冻干注射剂30g国药准字H200568082005-08-16北京赛生药业有限公司冻干注射剂20g国药准字H200568092005-08-16郑州永和制药有限公司冻干粉针剂20μg国药准字H410255632003.12.22长春天诚药冻干粉针剂0.1mg 国药准字2003.09.27业有限公司H22026344长春天诚药业有限公司冻干粉针剂20μg国药准字H220263432003.09.27天津市生物化学制药厂冻干粉针剂0.1mg国药准字H120212342003.07.01沈阳济世制药有限公司冻干粉针剂0.1mg国药准字H210240832003.07.01吉林玉皇药业有限公司冻干粉针剂20μg国药准字H220261242003.05.31江西赣南海欣药业股份有限公司冻干粉针剂0.1mg国药准字H360222562003.05.31杭州澳亚生物技术有限公司冻干粉针剂20μg国药准字H330223222003.05.31杭州澳亚生物技术有限公司冻干粉针剂80μg国药准字H330223212003.05.31吉林省辉南长龙生化药业股份有限公司冻干粉针剂80μg国药准字H220251952003.05.31吉林玉皇药业有限公司冻干粉针剂80μg国药准字H220258002003.05.31吉林省辉南长龙生化药业股份有限公司冻干粉针剂0.1mg国药准字H220251972003.05.31吉林省辉南长龙生化药业股份有限公司冻干粉针剂20μg国药准字H220251962003.05.31吉林玉皇药业有限公司注射剂0.1mg国药准字H220256622003.04.18吉林马应龙制药有限公司注射剂20μg国药准字H220256732003.04.18吉林马应龙制药有限公司注射剂0.1mg国药准字H220256742003.04.18厦门建发制药有限公司注射剂0.1mg国药准字H350213892003.03.25业有限责任公司原料药原料药国药准字H360221772003.03.25杭州澳亚生物技术有限公司注射剂0.1mg国药准字H330221512003.03.25四环药业股份有限公司注射剂0.1mg国药准字H110220872003.03.25吉林省集安益盛药业股份有限公司注射剂0.1mg国药准字H220245392003.03.25吉林省药物研究所制药厂原料药原料药国药准字H220251192003.03.25吉林华康药业股份有限公司注射剂0.1mg国药准字H220244232003.03.25武汉爱民制药厂冻干粉针剂0.1mg国药准字H420225012003.01.29益侨(湖南)制药有限公司冻干粉针剂0.1mg国药准字H430219812003.01.29白求恩医科大学制药厂生化分厂原料药原料药国药准字H220200032003.01.29沈阳药大集琦药业有限责任公司冻干粉针剂0.1mg国药准字H210230662003.01.29白求恩医科大学制药厂生化分厂注射剂20μg国药准字H220200012003.01.29白求恩医科大学制药厂生化分厂注射剂0.1mg国药准字H220200022003.01.29东北制药集团公司沈阳第一制药厂冻干粉针剂0.1mg国药准字H210227522002.12.18北京赛生药业有限公司冻干粉针剂0.1mg国药准字H110221092002.12.18哈尔滨三联药业有限公司冻干粉针剂0.1mg国药准字H230231062002.12.18鹅药业集团有限公司冻干粉针剂0.1mg国药准字H230230752002.12.18齐鲁制药厂冻干粉针剂0.1mg 国药准字H370234222002.12.18长春博奥生化药业有限公司冻干粉针剂0.1mg国药准字H220243942002.12.18长春博奥生化药业有限公司冻干粉针剂20μg国药准字H220243932002.12.18重庆药友制药有限公司冻干粉针剂30μg国药准字H500215972002.12.18重庆药友制药有限公司冻干粉针剂0.2mg国药准字H500215982002.12.18广西北生药业股份有限公司长春市凯旋制药分公司冻干粉针剂0.1mg国药准字H220244622002.12.18哈高科白天鹅药业集团有限公司原料药原料药国药准字H230230722002.12.18吉林省辉南辉发制药股份有限公司冻干粉针剂0.1mg国药准字H220244992002.12.18南阳普康集团化学制药厂冻干粉针剂20μg国药准字H410241862002.10.16南阳普康集团化学制药厂冻干粉针剂0.1mg国药准字H410241872002.10.16哈尔滨加滨药业有限公司冻干粉针剂0.1mg国药准字H230214072002.09.13尼克美制药(中山)有限公司乳膏剂0.25g:1mg国药准字H200007212002.09.13重庆药友制药有限公司冻干粉针剂0.1mg国药准字H500213942002.09.13重庆药友制药有限公司冻干粉针剂20μg国药准字H500213932002.09.13北京泰德制药有限公司注射剂1ml:5μg国药准字H109800232002.06.21北京泰德制药有限公司注射剂2ml:10μg国药准字H109800242002.06.21大事记大事记时间事件描述详细情况1992-07-15 新受让者Recordati 1993-03-15 再次注册Italy 1993-10-15 再次上市Italy 1995-01-15 再次上市Portugal。
前列地尔注射液

条件:温度 25 ℃,散射角为90°
1ml供试品 供试品温度 达到25 ℃
测定平均粒径、 90%累积粒径
结果
2015-7-1
平均粒径、90%累积粒径的变化
2015-7-1
平均粒径、90%累积粒径的变化
乳粒粒径为本品的重要质控指标, 国家标准规定平均粒径不得过 0.4μm,90%粒径累计值不得大于 0.6μm;
供 试 品
100ml5%葡萄糖注射液
D(0.1μg/ml)
0、2、4h(25 ℃、避光) 测定pH,观察外观
结果
2015-7-1
外观及 pH 值的变化
结果外观无明显变化,均呈白色乳状液体; pH 值在 4.0~6.0,无显著变化。
2015-7-1
含量及有关物质的变化
精密称取A1对照品2.5mg 置于25ml棕色量瓶
⑤使用简便:直接静脉注射,可在门诊治疗。
3.2临床应用:
治疗慢性动脉闭塞症(血栓闭塞性脉管炎、闭塞 性动脉硬化症等)引起的四肢溃疡及微小血管循环 障碍引起的四肢静息疼痛,改善心脑血管微循环 障碍。
脏器移植术后抗栓治疗,用以抑制移植后血管内 的血栓形成。
动脉导管依赖性先天性心脏病,用以缓解低氧血 症,保持导管血流以等待时机手术治疗。 用于慢性肝炎的辅助治疗。
2、脂微球制剂: 经肺循环仅10%被灭活,达到持续有效血药浓度
15
2015-7-1
持续性的比较
前列地尔注射液与传统制剂药效对比
血 60 栓 50 形 40 成 30 抑 制 20 率 10 % 0
15 20 25 30 35 40 45 50 55 60 65
16
Lipo PGE1
PGE1-CD
前列地尔注射液ppt

代谢
前列地尔在体内主要通过 酶代谢,代谢产物主要经 肾脏排出体外。
排泄
前列地尔的排泄速度较慢, 半衰期较长,一般可达24小时。
药物相互作用
与抗凝药合用
前列地尔与抗凝药合用时, 可能会增加出血的风险, 需密切监测凝血功能。
与降压药合用
前列地尔与降压药合用时, 可能会产生协同作用,导 致血压下降幅度过大,需 谨慎使用。
部分患者可能出现过敏反应, 如皮疹、瘙痒、呼吸困难等, 应立即停药并给予相应治疗。
不良反应的处理方法
注射部位疼痛
血管扩张
低血压
轻微疼痛可自行缓解, 疼痛较重时可采取局部 冷敷或口服止痛药缓解。
通常无需特殊处理,可 自行缓解。如症状较重, 可适当减慢滴速或停药。
应立即停药,并给予升 压药物及对症治疗。
前列地尔注射液的未来研究方向
探索前列地尔注射液在更多疾病领域的应用
目前前列地尔注射液主要用于治疗慢性动脉闭塞症,未来研究可探索其在其他血管疾病、 神经系统疾病等领域的应用。
改进制剂形式
目前前列地尔注射液为注射液剂型,未来可研究其制成口服制剂、吸入制剂等不同形式, 以满足不同患者的需求。
提高药效和降低副作用
糖尿病肾病治疗
总结词
前列地尔注射液在糖尿病肾病治疗中具有积极作用,能够保护肾脏功能、降低尿 蛋白、延缓肾损害进展。
详细描述
前列地尔注射液通过抑制炎症反应和免疫反应,减少肾脏损伤,同时能够扩张肾 血管、增加肾脏血流灌注,有助于保护肾脏功能。此外,该药物还能降低尿蛋白 排泄,延缓肾损害进展,从而改善糖尿病肾病患者的预后。
前列地尔注射液
• 前列地尔注射液概述 • 前列地尔注射液的药理作用 • 前列地尔注射液的临床应用 • 前列地尔注射液的副作用与注意事项 • 前列地尔注射液的研发与未来展望
前列地尔注射液说明书--凯时

前列xx 注射液说明书【药品名称】通用名:前列xx 注射液商品名:xx 时xx:Alprostadil Injection汉语拼音:Qianliedi'er Zhusheye【成份】1•本品主要成分为前列腺素E1,其化学名称为:(1R,2R,3R)-3羟基2-((E)-(3S)-3羟基-1-辛烯基卜5-氧代环戊烷庚酸其结构式为:分子式:C20H34O5 分子量:354.49CAS No:. 745-65-32.辅料:精制大豆油、精制软磷脂、浓甘油、油酸、氢氧化钠、注射用水【性状】本品为白色乳状液体。
【适应症】1.治疗慢性动脉闭塞症(血栓闭塞性脉管炎、闭塞性动脉硬化症等)引起的四肢溃疡及微小血管循环障碍引起的四肢静息疼痛,改善心脑血管微循环障碍。
2.脏器移植术后抗栓治疗,用以抑制移植后血管内的血栓形成。
3.动脉导管依赖性先天性心脏病,用以缓解低氧血症,保持导管血流以等待时机手术治疗。
4.用于慢性肝炎的辅助治疗。
【规格】2ml:10©【用法用量】成人一日一次,1-2ml (前列地尔5-10©)+10ml生理盐水(或5%的葡萄糖)缓慢静注,或直接入小壶缓慢静脉滴注。
【不良反应】1 .休克:偶见休克。
要注意观察,发现异常现象时,立刻停药,采取适当的措施。
2.注射部位:有时出现血管疼、血管炎、发红,偶见发硬,瘙痒等。
3.循环系统:有时出现加重心衰,肺水肿,胸部发紧感,血压下降等症状,一旦出现立即停药。
另外,偶见脸面潮红、心悸。
4.消化系统:有时出现腹泻、腹胀、不愉快感,偶见腹痛、食欲不振、呕吐、便秘、转氨酶升高等。
5.精神和神经系统:有时头晕、头痛、发热、疲劳感,偶见发麻。
6.血液系统:偶见嗜酸细胞增多、白细胞减少。
7.其他:偶见视力下降、口腔肿胀感、脱发、四肢疼痛、浮肿、荨麻疹。
【禁忌症】以下患者禁用:1.严重心衰(心功能不全)患者。
2.妊娠或可能妊娠的妇女。
3.既往对本制剂有过敏史的患者。
前列地尔注射液说明书--凯时

前列地尔注射液说明书【药品名称】通用名:前列地尔注射液商品名:凯时英文名:Alprostadil Injection汉语拼音:Qianliedi'er Zhusheye【成份】1. 本品主要成分为前列腺素E1,其化学名称为:(1R,2R,3R)-3-羟基2-((E)-(3S)-3-羟基-1-辛烯基]-5-氧代环戊烷庚酸其结构式为:分子式:C20H34O5分子量:354.49CAS No.:745-65-32. 辅料:精制大豆油、精制软磷脂、浓甘油、油酸、氢氧化钠、注射用水【性状】本品为白色乳状液体。
【适应症】1.治疗慢性动脉闭塞症(血栓闭塞性脉管炎、闭塞性动脉硬化症等)引起的四肢溃疡及微小血管循环障碍引起的四肢静息疼痛,改善心脑血管微循环障碍。
2.脏器移植术后抗栓治疗,用以抑制移植后血管内的血栓形成。
3.动脉导管依赖性先天性心脏病,用以缓解低氧血症,保持导管血流以等待时机手术治疗。
4.用于慢性肝炎的辅助治疗。
【规格】2ml:10μg。
【用法用量】成人一日一次,1-2ml(前列地尔5-10μg)+10ml 生理盐水(或5%的葡萄糖)缓慢静注,或直接入小壶缓慢静脉滴注。
【不良反应】1.休克:偶见休克。
要注意观察,发现异常现象时,立刻停药,采取适当的措施。
2.注射部位:有时出现血管疼、血管炎、发红,偶见发硬,瘙痒等。
3.循环系统:有时出现加重心衰,肺水肿,胸部发紧感,血压下降等症状,一旦出现立即停药。
另外,偶见脸面潮红、心悸。
4.消化系统:有时出现腹泻、腹胀、不愉快感,偶见腹痛、食欲不振、呕吐、便秘、转氨酶升高等。
5.精神和神经系统:有时头晕、头痛、发热、疲劳感,偶见发麻。
6.血液系统:偶见嗜酸细胞增多、白细胞减少。
7.其他:偶见视力下降、口腔肿胀感、脱发、四肢疼痛、浮肿、荨麻疹。
【禁忌症】以下患者禁用:1.严重心衰(心功能不全)患者。
2.妊娠或可能妊娠的妇女。
3.既往对本制剂有过敏史的患者。
前列地尔注射液的临床应用
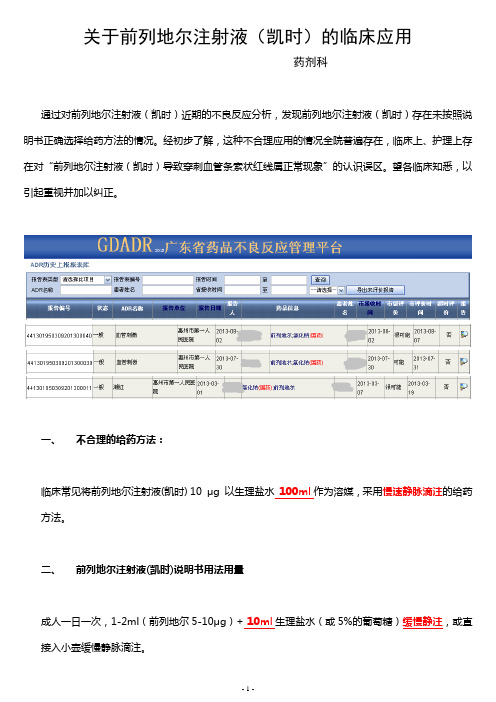
关于前列地尔注射液(凯时)的临床应用药剂科通过对前列地尔注射液(凯时)近期的不良反应分析,发现前列地尔注射液(凯时)存在未按照说明书正确选择给药方法的情况。
经初步了解,这种不合理应用的情况全院普遍存在,临床上、护理上存在对“前列地尔注射液(凯时)导致穿刺血管条索状红线属正常现象”的认识误区。
望各临床知悉,以引起重视并加以纠正。
一、不合理的给药方法:临床常见将前列地尔注射液(凯时) 10 μg 以生理盐水100ml作为溶媒,采用慢速静脉滴注的给药方法。
二、前列地尔注射液(凯时)说明书用法用量成人一日一次,1-2ml(前列地尔5-10μg)+10ml生理盐水(或5%的葡萄糖)缓慢静注,或直接入小壶缓慢静脉滴注。
三、从药剂学角度分析原因:前列地尔,也叫做前列腺素E1(PGE1),来源于花生四烯酸途径。
因为该前列地尔制剂以脂微球作为药物载体,由于脂微球的包裹,前列腺素E1不易失活,且具有靶向特性。
如果用100ml溶媒稀释,容易因为过度稀释造成脂微球破乳,不仅失去靶向性难以发挥治疗作用,反而容易因为PGE1的释放而刺激血管,导致注射臂静脉穿刺血管出现条索状红线、产生刺痛、颜面部潮红等不良反应。
建议严格按照说明书用法用量使用,尤其是缓慢推注5至10分钟。
四、避免药物资源的浪费临床上都知道前列地尔在体内代谢很快,代谢酶(15-羟基前列腺素脱氢酶)主要存在于肺、肝、肾,故循环血液每流经肺一次,将有90%以上前列腺素失活。
若是采用过度溶媒稀释的给药方案,不仅药物治疗效果上不佳,发挥不到靶向制剂浓集的作用,而且不可避免地造成药物资源的浪费。
五、关于说明书中的“小壶滴注”说明书中提到的“小壶”是指输液管中的茂菲氏/ 墨菲氏壶。
“小壶滴注”因无具体的操作规范、医院感染、卫生条件等资料参考,故此不予使用。
六、关于脂微球。
凯时前列地尔治疗糖尿病肾病的作用机制

凯时前列地尔治疗糖尿病肾病的作用机制
糖尿病是临床常见的疾病,糖尿病肾病(DN)是糖尿病主要的微血管并发症之一,也是患者重要的致残和致
DN
治
;
凯时对血液流变学的影响:治疗组治疗后全血粘度、血浆粘度及纤维蛋白平均明显下降,与治疗前相比有显著性差异P<O.05。
而对照组仅血浆粘度较治疗前有显著性差异P<O.05,治疗后两组间各指标比较有显著性差异P<0.05,说明凯时可明显改善血液流变学。
凯时对血糖的影响:经凯时治疗28d后,治疗组3O例空腹及餐后2h血糖均达标,对照组有2例空腹血糖未达标,3例餐后2h血糖未达标,说明在综合降糖治疗的同时加用凯时,有利于控制血糖。
治疗过程中治疗组3O例有1例发生注射部位血管轻微发红,疼痛,能耐受,减慢速度后缓解,但不影响治疗
4、讨论:。
凯时(前列地尔注射液)

凯时(前列地尔注射液)【药品名称】商品名称:凯时通用名称:前列地尔注射液英文名称:Alprostadil Injection【成份】前列腺素E1。
辅料:精制大豆油、精制卵磷脂、浓甘油、油酸、氢氧化钠、注射用水。
【适应症】1.治疗慢性动脉闭塞症(血栓闭塞性脉管炎、闭塞性动脉硬化症等)引起的四肢溃疡及微小血管循环障碍引起的四肢静息疼痛,改善心脑血管微循环障碍。
2.脏器移植术后...【用法用量】成人一日一次,1-2ml(前列地尔5-10μg)+10ml生理盐水(或5%的葡萄糖)缓慢静注,或直接入小壶缓慢静脉滴注。
【不良反应】1.休克:偶见休克。
要注意观察,发现异常现象时,立刻停药,采取适当的措施。
2.注射部位:有时出现血管疼、血管炎、发红,偶见发硬,瘙痒等。
3.循环系统:有时出现加重心衰,肺水肿,胸部发紧感,血压下降等症状,一旦出现立即停药。
另外,偶见脸面潮红、心悸。
4.消化系统:有时出现腹泻、腹胀、不愉快感,偶见腹痛、食欲不振、呕吐、便秘、转氨酶升高等。
5.精神和神经系统:有时头晕、头痛、发热、疲劳感,偶见发麻。
6.血液系统:偶见嗜酸细胞增多、白细胞减少。
7.其他:偶见视力下降、口腔肿胀感、脱发、四肢疼痛、浮肿【禁忌】以下患者禁用:1.严重心衰(心功能不全)患者。
2.妊娠或可能妊娠的妇女。
3.既往对本制剂有过敏史的患者。
1. 严重心衰(心功能不全)患者。
2. 妊娠或可能妊娠的妇女。
3. 既往对本制剂有过敏史的患者。
【注意事项】1.下述患者慎用本品:(1)心衰(心功能不全)患者,有报告可加重心功能不全的倾向。
(2)青光眼或眼压亢进的患者,有报告可使眼压增高。
(3)既往有胃溃疡合并症的患者,有报告可使胃出血。
(4)间质性肺炎的患者,有报告可使病情恶化。
2.用于治疗慢性动脉闭塞症、微小血管循环障碍的患者。
由于本药的治疗是对症治疗,停止给药后,有再复发的可能性。
3.给药时注意:(1)出现不良反应时,应采取减慢给药速度,停止给药等适当措施。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
前列xx注射液说明书
【药品名称】
通用名:
前列xx注射液
商品名:
xx时
xx:
Alprostadil Injection
汉语拼音:
Qianliedi'er Zhusheye
【成份】
1.本品主要成分为前列腺素E1,其化学名称为:
(1R,2R,3R)-3-羟基2-((E)-(3S)-3-羟基-1-辛烯基]-5-氧代环戊烷庚酸其结构式为:
分子式:C20H
34O5分子量:354.49
CAS No.:745-65-3
2.辅料:
精制大豆油、精制软磷脂、浓甘油、油酸、氢氧化钠、注射用水【性状】本品为白色乳状液体。
【适应症】
1.治疗慢性动脉闭塞症(血栓闭塞性脉管炎、闭塞性动脉硬化症等)引起的四肢溃疡及微小血管循环障碍引起的四肢静息疼痛,改善心脑血管微循环障碍。
2.脏器移植术后抗栓治疗,用以抑制移植后血管内的血栓形成。
3.动脉导管依赖性先天性心脏病,用以缓解低氧血症,保持导管血流以等待时机手术治疗。
4.用于慢性肝炎的辅助治疗。
【规格】2ml:10μg。
【用法用量】
成人一日一次,1-2ml(前列地尔5-10μg)+10ml生理盐水(或5%的葡萄糖)缓慢静注,或直接入小壶缓慢静脉滴注。
【不良反应】
1.休克:
偶见休克。
要注意观察,发现异常现象时,立刻停药,采取适当的措施。
2.注射部位:
有时出现血管疼、血管炎、发红,偶见发硬,瘙痒等。
3.循环系统:
有时出现加重心衰,肺水肿,胸部发紧感,血压下降等症状,一旦出现立即停药。
另外,偶见脸面潮红、心悸。
4.消化系统:
有时出现腹泻、腹胀、不愉快感,偶见腹痛、食欲不振、呕吐、便秘、转氨酶升高等。
5.精神和神经系统:
有时头晕、头痛、发热、疲劳感,偶见发麻。
6.血液系统:
偶见嗜酸细胞增多、白细胞减少。
7.其他:
偶见视力下降、口腔肿胀感、脱发、四肢疼痛、浮肿、荨麻疹。
【禁忌症】
以下患者禁用:
1.严重心衰(心功能不全)患者。
2.妊娠或可能妊娠的妇女。
3.既往对本制剂有过敏史的患者。
【注意事项】
1.下述患者慎用本品:
(1)心衰(心功能不全)患者,有报告可加重心功能不全的倾向。
(2)青光眼或眼压亢进的患者,有报告可使眼压增高。
(3)既往有胃溃疡合并症的患者,有报告可使胃出血。
(4)间质性肺炎的患者,有报告可使病情恶化。
2.用于治疗慢性动脉闭塞症、微小血管循环障碍的患者。
由于本药的治疗是对症治疗,停止给药后,有再复发的可能性。
3.给药时注意:
(1)出现不良反应时,应采取减慢给药速度,停止给药等适当措施。
(2)本制剂与输液混合后在2小时内使用。
残液不能再使用。
(3)不能使用冻结的药品。
(4)打开安瓿时,先用酒精棉擦净后,把安瓿上的标记点朝上,向下掰。
(5)本品要通过医生的处方和遵医嘱使用。
【孕妇及哺乳期妇女用药】妊娠或可能妊娠的妇女禁止使用本品。
【儿童用药】小儿先天性心脏病患者用药,推荐输注速度为5ng/kg/min。
【老年患者用药】无特殊提示,请遵医嘱。
【药物相互作用】避免与血浆增容剂(右旋糖苷、明胶制剂等)混合。
【药物过量】目前尚无每日剂量超过120μg的文献报道。
【药理毒理】
1.药理作用
本品是以脂微球为药物载体的静脉注射用前列地尔制剂。
由于脂微球的包裹,前列地尔不易失活,且具有易于分布到受损血管部位的靶向特性,从而发挥本品的扩张血管、抑制血小板聚集的作用。
另外,本品还具有稳定肝细胞膜及改善肝功能的作用。
2.毒理作用
静脉内给予小鼠、大鼠和狗至可能承受的最大容量50ml/kg[相当于前列地尔(前列腺素E1)250μg/kg],未见动物死亡,也未见严重的急性毒性。
本品无过敏性、致畸性及血管刺激性。
【药代动力学】
以[3H]标记的本品静脉给予大鼠5分钟后组织内前列地尔(前列腺素E1)含量最高,以后缓慢下降至消失。
前列地尔(前列腺素E1)主要分布在肾、肝、肺组织中,在中枢神经系统、眼球和睾丸内含量最低。
本品主要与血浆蛋白结合。
在血中代谢较快。
其代谢产物(
13、14-二氢-15-酮-PGE1)主要通过肾脏排泄。
给药后24小时内尿中排泄大约90%,其余经粪便排泄。
【贮藏】遮光,0-5℃保存,避免冻结。
【包装】无色安瓿,1支/盒。
【有效期】12个月。
