高考化学总复习之酸碱中和滴定专项训练.docx
高考化学总复习之酸碱中和滴定专项训练

酸碱中和滴定专项练习总分100分一、选择题〔此题包括5小题,每题3分,共15分,每题只一个选项符合题意.〕1.在一支25mL的酸式滴定管中盛入0.1mol/L HCl溶液,其液面恰好在5mL刻度处.假设把滴定管内溶液全部放入烧杯中,再用0.1mol/L NaOH溶液进行中和,那么所需NaOH溶液的体积〔〕A.大于20mL B.小于20mL C.等于20mL D.等于5mL2.进行中和滴定时,事先不应该用所盛溶液洗涤的仪器是〔〕A.酸式滴定管B.碱式滴定管C.锥形瓶D.移液管3.刻度“0〞在上方的用于测量液体体积的仪器是〔〕A.滴定管B.移液管C.量筒D.烧杯4.有甲、乙、丙三瓶等体积等物质的量浓度的NaOH溶液.假设将甲蒸发掉一半水,在乙中通入少量CO2,丙不变然后滴加指示剂酚酞后,用同浓度的H2SO4溶液滴定至完全反响后, 所需溶液的体积〔〕A.甲=丙>乙B.丙>乙>甲C.乙>丙>甲D.甲=乙=丙5.以下有关表达中正确的选项是〔〕A.滴定管下端连有橡皮管的为酸式滴定管B.在滴定时,左手操作锥形瓶,右手操作滴定管开关.C.滴定前应首先排除尖嘴局部的气泡.D.滴定过程中两眼应注视滴定管内液面的变化.二、选择题〔此题包括15小题,每题3分,共45分,每题有一个或两个选项符合题意.〕6.中和滴定时,用于量取待测液体积的仪器是〔〕A.胶头滴管B.量筒C.滴定管D.移液管7.25℃时,某溶液中由水电离产生的C〔H+〕和C〔OH-〕的乘积为1×10-18,以下说法正确的是〔〕A.该溶液的pH一定是9 B.该溶液可能pH=5C.该溶液的pH不可能是7 D.不会有这样的溶液8.常温下,0.1mol/L的一元酸HA溶液的pH=2,0.1mol/L的一元碱BOH的溶液中c(OH-)/c(H+)=1012,将此两种溶液等体积混合后,溶液中离子浓度大小关系正确的选项是〔〕A.c(OH-)>c(H+)>c(B+)>c(A-) B.c(OH-)<c(H+) <c(A-)< c(B+)C.c(H+)<c(OH-) c(A-)<c(B+) D.c(B+)=c(A-)>(H+)=c(OH-)9.氢氧化钠标准溶液因保存不当,吸收了少量的二氧化碳,假设有1%的NaOH转变为Na2CO3, 以此NaOH溶液滴定未知浓度的盐酸,选用甲基橙作指示剂;盐酸浓度的测定结果会〔〕A.偏低1% B.偏高1% C.无影响D.偏高0.1%10.用PH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为V1和V2,那么V1和V2的关系正确的选项是〔〕A.V1>V2 B.V1<V2 C.V1=V2D.V1≤V211.以下实验中,直接采用沾有水滴的仪器,对实验结果没有影响的是〔〕A.氨的喷泉实验B.实验室制氧气:试管C.中和滴定:锥形瓶D.中和滴定:滴定管12.用酸滴定碱时,滴定前读酸式滴定管读数时视线低于水平线,滴定结束时读数正确,这样会使测得的碱溶液的浓度〔〕A.偏高B.偏低C.不受影响D.不能确定13.25℃时,假设PH=a的10体积某强酸溶液与PH=b的1体积某强碱溶液混合后溶液呈中性,那么混合之前该强酸的PH与强碱的PH之间应满足的关系是〔〕A.a+b=14 B.a+b=13 C.a+b=15 D.a+b=714.将PH=3的强酸溶液和PH=12的强碱溶液混合,当混合液的PH等于11时,强酸与强碱溶液的体积比是〔〕A.9∶2 B.1∶9C.10∶1 D.9∶115.在通常状况下,把醋酸滴入氢氧化钠溶液中,当溶液中c〔CH3COO-〕=c〔Na+〕时,溶液的PH是〔〕A.大于7 B.等于7 C.小于7 D.不能确定16.将PH=3的盐酸与PH=11的氨水等体积混合后,溶液中离子浓度关系正确的选项是〔〕A.c〔NH4+〕>c〔Cl-〕>c〔H+〕>c〔OH-〕B.c〔Cl-〕>c〔NH4+〕>c 〔H+〕>c〔OH-〕C.c〔NH4+〕>c〔Cl-〕>c〔OH-〕>c〔H+〕D.c〔Cl-〕>c〔NH4+〕>c 〔OH-〕>c〔H+〕17.一种一元强酸HA溶液中参加一种碱MOH反响后,溶液呈中性,以下判断中正确的选项是〔〕A.参加的碱过量B.混合前酸与碱中溶质的物质的量相等C.生成的盐不发生水解D.反响溶液中c〔A-〕、c〔M+〕相等18.实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,以下操作中可能使测定结果偏低的是〔〕A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次B.开始实验时酸式滴定管尖嘴局部有气泡,在滴定过程中气泡消失C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次19.室温时某强酸溶液和某强碱溶液等体积混合后,所得溶液的PH为7.以下说法中正确的选项是〔〕A.原有的酸溶液和碱溶液的物质的量浓度一定相等B.如果生成盐的水溶液为碱性,那么酸的浓度大于碱C.原有酸、碱溶液的物质的量浓度没有确定关系D.原有碱溶液的物质的量浓度更大.20.用0.01mol/LH2SO4滴定0.01mol/LNaOH溶液,中和后加水至100mL.假设滴定时终点判断有误差:①多加了1滴H2SO4;②少加了1滴H2SO4〔设1滴为0.05mL〕.那么①和②中c 〔H+〕之比是〔〕A.5×103 B.104 C.50 D.10三、填空题(共30分)21.(3分)某学生中和滴定实验的过程如下:〔1〕取一支碱式滴定管;〔2〕用蒸馏水洗净;〔3〕即参加待测的NaOH溶液;〔4〕记录液面刻度读数;〔5〕用酸式滴定管精确放出一定量标准酸液;〔6〕置于未经标准酸液润洗的洁净的锥形瓶中;〔7〕参加适量蒸馏水;〔8〕参加酚酞试液两滴;〔9〕滴定时,边滴边振荡;〔10〕边注视滴定管内液面的变化;〔11〕当小心滴到溶液由无色变为粉红色时,即停止滴定;〔12〕记录液面刻度读数;〔13〕根据滴定管的两次读数得出NaOH溶液体积为22mL,指出上述实验过程中错误之处〔用序号表示〕 .22.(11分)25℃时,假设体积为VA、pH=a的某一元强酸与体积VB、pH=b的某一元强碱混合,恰好中和,且Va<Vb和a=0.5b,请填写以下空白;〔1〕a值可否等于3〔填“可〞或“否〞〕_________,其理由是____________________________________________;〔2〕a值可否等于5〔填“可〞或“否〞〕________,其理由是_____________________________________________;〔3〕a的取值范围是_______________________________________.23.(4分)用相同浓度的盐酸中和体积相同的三种溶液至中性:a.Ba(OH)2、b.NaOH、c.NH3·H2O(以下盐酸的体积分别用VA、VB、Vc表示)〔1〕假设A、B、c物质的量浓度相同,所消耗盐酸体积关系为 .〔2〕假设A、B、c溶液的pH相同,所消耗盐酸体积关系为 . 24.(12分)用酸碱中和滴定的方法测定NaOH和Na2CO3的混合液中的NaOH含量时,可先在混合液中加过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定〔用酚酞用指示剂〕,试答复:· · · 图15 不同温度下的电阻值〔1〕向混有BaCO 3沉淀的NaOH 溶液中滴入盐酸,为什么不会使BaCO 3沉淀溶解而能测定NaOH 的含量?.〔2〕滴定时,假设滴定管中滴定液一直下降到活塞处才到达滴定终点,那么能否由此准确地计算出结果?.〔3〕能否改用甲基橙作指示剂? ,假设用甲基橙作指示剂,那么测定结果如何? .25实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH 的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L 的盐酸进行滴定,试答复以下问题:(1)托盘天平称量 5.0g 固体试剂,用蒸馏水溶解于烧杯中,并振荡,然后立即直接转入500mL 容量瓶中,恰好至刻度线,配成待测液备用.请改正以上操作中出现的五处错误.(2)将标准盐酸装在25.00mL 滴定管中,调节液面位置在 处,并记下刻度.(3)取20.00mL 待测液,待测定.该项实验操作的主要仪器 有.用 试剂作指示剂时,滴定到溶液颜色由 刚好至 色时为止.(4)滴定达终点后,记下盐酸用去20.00mL,计算NaOH 的质量分数为 . (5)试分析滚蛋定误差可能由以下哪些实验操作引起的 . A 、转移待测液至容量瓶时,末洗涤烧杯 B 、酸式滴定管用蒸馏水洗涤后,直接装盐酸C 、滴定时,反响容器摇动太剧烈,有少量液体溅出D 、滴定到终点时,滴定管尖嘴悬有液滴E 、读滴定管开始时仰视,读终点时俯视26朱经武教授等人发现的高温超导材料YBa 2Cu 3O 7-x ,其零电阻转变温度T w =90K.YBa 2Cu 3O 7-x 中x的值与T W 有一定的关系,x 值介于0.00~0.50之间,一般x 的值越接近于零,T w 就越高.在YBa 2Cu 3O 7-x 中,Y 、Ba 、O 都有固定的化合价,分别为+3、+2、-2;而Cu 有+2、+3价的混合情况.可用碘量法测定Cu 的量继而求得x 的值.碘量法是氧化复原滴定法的一种,通常用标准碘溶液直接滴定复原性物质,也可根据某些氧化性物质在酸性溶液中与I -作用生成单质碘的性质,用标准复原剂Na 2S 2O 3溶液滴定生成的碘单质,间接计算该氧化性物质的含量.在滴定过程中,S 2O 32-转化为S 4O 62-,Cu 2+、Cu 3+均被复原为CuI.现取 4.00×10-2gYBa 2Cu 3O 7-x 样品,用稀盐酸溶解,在氩气保护下参加 1.00gKI 固体充分反响,Cu 2+、Cu3+均转化为CuI,用0.0100mol/LNa 2S 2O 3溶液滴定反响生成的I 2,在滴定终点时消耗0.0100mol/LNa 2S 2O 3溶液18.14mL.填空并答复:(1)盛装Na 2S 2O 3溶液进行滴定的仪器是 ,该实验选用的指示剂为 ,到达滴定终点的现象是 .(2)写出滴定过程中S 2O 32-转化为S 4O 62-的离子方程式:(3)求出所用样品中x 的值: x= .(4)根据题给YBa 2Cu 3O 7-x 的电阻与温度关系的R -T 图示说明曲线中AB 、BC 段的物理意义.四、计算题(10分)27.(10分)有PH 为13的Ba(OH)2、NaOH 的混合溶液100mL,从中取出25mL 用0.025mol/LH 2SO 4滴定,当滴定至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半.求:〔1〕当滴到沉淀不再增加时,溶液的PH 〔设体积可以加和〕 〔2〕原混合溶液中Ba(OH)2和NaOH 的物质的量浓度.参考答案一、二选择题 题号 1 2 3 4 5 6 7 8 9 10 答案 A C A A C CD BC C C B 题号 11 12 13 14 15 16 17 18 19 20 答案CBCABCDCCB三、填空题 21、〔3〕、〔10〕、〔11〕、〔13〕 22、〔1〕否,假设a=3,那么b=6,溶液显酸性,与题意不符,故a≠3〔2〕否,假设a=5,[H +]a =10-5mol·L -1,那么b=10,[OH -]b = 10-4mol·L -1,1]H []OH [V V ab b a >=+-,不符合题意,故a≠5 〔2分〕〔3〕110]H []H [10]H []OH [V V )14b a (ab 14a b b a <===-+++-+- 所以〔a+b-14〕<0,而a=0.5b即3a<14,a<314 ,又pH=b=3a>7,a>27 ,所以27<a<314.23、〔1〕Va=2Vb>2Vc 〔2〕Vc>Va=Vb24、〔1〕由于酚酞指示剂的变色范围为8.2~10,在此条件下BaCO 3不溶解.〔2〕不能〔3〕不能;结果偏大. 25、(1)①末搅拌 ②末冷却即转移 ③末用玻璃棒引流 ④末用胶头滴管加水定容 ⑤末振荡、摇匀 (2)酸式 “0〞刻度或“0〞 以下刻度 (3)碱式滴定管,锥形瓶 甲基橙 黄色 橙色 (4)80% (5)A 、B 、C 、D 、E 26、(1)碱式滴定管 淀粉 蓝色变为无色(2)2 S 2O 32-+I 2=S 4O 62-+2I - (3)0.06(4)AB 段表示温度降到B 点即90K 时,超导体YBa 2Cu 3O 7-x 电阻为零.BC 段表示自90K 起,随温度升高,电阻逐渐增大四、计算题 27、〔1〕12.4 〔2〕0.025mol/L;0.05mol/L.。
化学酸碱中和滴定计算练习题

化学酸碱中和滴定计算练习题滴定是一种化学实验方法,常用于酸碱中和反应的测定和计算。
在滴定实验中,一种溶液被称为滴定液,另一种溶液被称为被滴定液。
当溶液中的酸和碱按化学计量比配制时,它们将完全反应,此时称为等当点。
滴定计算的目的是确定滴定液与被滴定液之间的等当点。
在酸碱中和滴定计算中,有几个关键的参数需要了解和计算。
下面将使用几个实例来探讨这些参数的计算方法。
实例1:硫酸滴定氢氧化钠问题:用0.1mol/L的硫酸溶液滴定25mL的0.1mol/L氢氧化钠溶液,计算滴定液的浓度。
解答:酸碱滴定反应中,滴定液和被滴定液的摩尔比应该为1∶1。
由此可得到等当点时,滴定液和被滴定液的摩尔数应该相等。
被滴定液的摩尔数可以由以下公式计算:摩尔数 = 浓度 ×体积在这个问题中,被滴定液的摩尔数为:摩尔数 = 0.1mol/L × 0.025L = 0.0025mol因为滴定液和被滴定液的摩尔比为1∶1,所以滴定液的摩尔数也为0.0025mol。
滴定液的体积可以通过实验中消耗的滴定液体积来测量。
假设消耗了15mL的滴定液,那么滴定液的摩尔浓度为:浓度 = 摩尔数 / 体积浓度 = 0.0025mol / 0.015L = 0.1667mol/L因此,滴定液的浓度为0.1667mol/L。
实例2:氢氧化钠滴定硫酸问题:用0.1mol/L的氢氧化钠溶液滴定33.6mL的硫酸溶液,计算硫酸的浓度。
解答:根据酸碱中和滴定反应的摩尔比是1∶1,可得到硫酸的摩尔数等于氢氧化钠的摩尔数。
被滴定液的摩尔数为:摩尔数 = 浓度 ×体积摩尔数 = 0.1mol/L × 0.0336L = 0.00336mol因此,硫酸的摩尔数也为0.00336mol。
硫酸的浓度可以通过下面的公式计算:浓度 = 摩尔数 / 体积浓度 = 0.00336mol / 0.0336L = 0.1mol/L所以,硫酸的浓度为0.1mol/L。
2021届高考化学总复习 第二节 第3课时 酸碱中和滴定(word含答案)

第二节第3课时酸碱中和滴定[学习目标定位] 1.了解酸碱中和滴定的原理,熟记酸碱中和滴定的主要仪器的名称及用途。
2.掌握酸碱中和滴定的实验操作、计算方法和误差分析。
新课程探究一、酸碱中和滴定1.酸碱中和滴定的概念和原理(1)概念:是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。
(2)原理:在中和反应中,酸提供的H+与碱提供的OH-之间的物质的量相等。
即:c(H+)·V酸=c(OH-)·V碱,由此可计算c(H+),也可计算c(OH-)。
2.主要仪器及使用(1)仪器:滴定管,铁架台,滴定管夹,锥形瓶,烧杯。
仪器a是酸式滴定管,仪器b是碱式滴定管。
(2)滴定管的使用方法3.主要试剂(1)待测液;(2)标准液;(3)指示剂(一般用酚酞或甲基橙)。
4.滴定操作(1)实验前的准备工作:(2)滴定:(3)滴定终点的判断:(以盐酸滴定氢氧化钠溶液为例,酚酞作指示剂)当滴入最后一滴盐酸时,溶液变为无色,且半分钟内不变色,即为滴定终点。
读数并记录。
5.数据处理为减少实验误差,滴定时,要求重复实验2~3次,求出所用标准溶液体积的平均值,然后再计算待测液的物质的量浓度。
纳总结酸碱中和滴定注意事项(1)准确判断滴定终点:最后一滴恰好使指示剂颜色发生明显的改变且半分钟内不变色,即为滴定终点。
(2)滴定操作要点:左手控制活塞或玻璃珠,右手摇动锥形瓶,两眼注视锥形瓶内溶液颜色的变化。
例1下列说法正确的是( )A.用图示仪器Ⅰ准确量取25.00 mL酸性KMnO4溶液B.装置Ⅱ可用于已知浓度的氢氧化钠溶液测定未知浓度盐酸的实验C.中和滴定时,滴定管用所盛装的待装液润洗2~3次D.中和滴定实验时,用待测液润洗锥形瓶答案 C例2用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。
称量时,样品可放在________(填字母)称量。
最新-《高考化学复习专题》酸碱中和滴定图像题 精品

(3)NH4+ + OH- → NH3· H2 O;
将0.1mol/L氢氧化钠滴入等体积、浓度均为0.1mol/L的盐酸和醋酸 中,能正确反映溶液pH变化曲线的是(实线表示盐酸,虚线表示 醋酸))
√
√
7.25℃,向一定体积0.1mol/L的醋酸溶液中逐滴加入等浓度 的NaOH溶液,溶液中c(H+)与c(OH—)的变化关系如图所示,则 A.M点所示溶液的导电能力强于Q点 B.N点所示溶液中c(CH3COO―)>c(Na+) C.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 D.M点和N点所示溶液中H2O的电离程度相同
滴定过程中可能出现:
A.C(CH3COOH)>C(CH3COO-)>C(H+)>C(Na+)>C(OH-) B.点①所示溶液中:C(CH3COO-)+C(OH-)=C(CH3COOH)+C(H+) C.点②所示溶液中:C(Na+)= C(CH3COOH)+ C(CH3COO-) D.点③所示溶液中:
√ √
√ √
2.在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液, 曲线如下图所示,有关粒子浓度关系的比较正确的是( )。 A.在A、B间任一点,溶液中一定都有: c(Na+) > c(CH3COO-) > c(OH-) > c(H+) B.在B点,a>12.5,且有: c(Na+) = c(CH3COO-) > c(OH-) = c(H+) C.在C点:c(CH3COO-) > c(Na+) > c(H+) > c(OH-) D.在D点:c(CH3COO-) + c(CH3COOH) = c(Na+)
高三化学练习题:酸碱中和反应

高三化学练习题:酸碱中和反应1. 下列酸碱中和反应方程式中,正确的是:a) H2SO4 + HCl -> H2S + H2O + Cl2b) NaOH + H2SO4 -> Na2SO4 + H2Oc) HNO3 + NaOH -> NaNO2 + H2O + O2d) NH3 + HCl -> NH4Cl + H2O2. 下列化合物中,具有酸性的是:a) NaClb) H2SO4c) CH4d) NaOH3. 酸碱滴定实验中,当滴定管中滴加的溶液从酸性到碱性变化时,指示剂颜色变化的顺序是:a) 粉红色 -> 紫色 -> 蓝色b) 蓝色 -> 紫色 -> 粉红色c) 红色 -> 黄色 -> 绿色d) 黄色 -> 红色 -> 绿色4. 在酸碱中和反应中,下列哪种物质起中和作用:a) 水b) 酸c) 盐d) 碱5. 酸性溶液具有下列性质中的哪一项:a) 可导电b) 呈酸性气味c) 具有腐蚀性d) pH值大于76. 在酸碱中和反应中,酸和碱反应产生的溶液称为:a) 盐溶液b) 酸溶液c) 碱溶液d) 中和溶液7. 当溶液中的酸和碱摩尔比为1:1时,称其为:a) 相对中和点b) 终点c) 等当量点d) 中和点8. 酸碱中和反应是一种什么类型的化学反应:a) 氧化还原反应b) 双替换反应c) 合成反应d) 分解反应9. 下列物质中属于酸的是:a) 橙汁b) 醋c) 牛奶d) 蜂蜜10. 酸碱中和反应是一个:a) 放热反应b) 吸热反应c) 光合作用d) 无温度变化的反应请根据题目内容选择正确答案并与指导老师讨论,加深对酸碱中和反应的理解。
高考化学总复习《酸碱中和滴定及曲线》专项复习
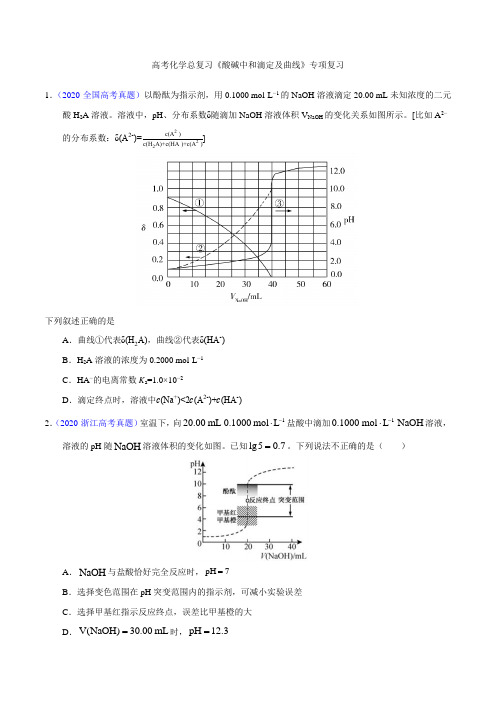
高考化学总复习《酸碱中和滴定及曲线》专项复习1.(2020·全国高考真题)以酚酞为指示剂,用0.1000 mol·L −1的NaOH 溶液滴定20.00 mL 未知浓度的二元酸H 2A 溶液。
溶液中,pH 、分布系数δ随滴加NaOH 溶液体积V NaOH 的变化关系如图所示。
[比如A 2−的分布系数:δ(A 2-)=c(A 2-)c(H 2A)+c(HA -)+c(A 2-)]下列叙述正确的是A .曲线①代表δ(H 2A),曲线②代表δ(HA -)B .H 2A 溶液的浓度为0.2000 mol·L −1C .HA −的电离常数K a =1.0×10−2D .滴定终点时,溶液中c (Na +)<2c (A 2-)+c (HA -)2.(2020·浙江高考真题)室温下,向120.00mL 0.1000mol L -⋅盐酸中滴加10.1000mol L NaOH -⋅溶液,溶液的pH 随NaOH 溶液体积的变化如图。
已知lg50.7=。
下列说法不正确的是( )A .NaOH 与盐酸恰好完全反应时,pH 7=B .选择变色范围在pH 突变范围内的指示剂,可减小实验误差C .选择甲基红指示反应终点,误差比甲基橙的大D .V(NaOH)30.00mL =时,pH 12.3=3.(2020·山东高考真题)25℃时,某混合溶液中()()133CH COOH CH COO 0.1mol L c c --+=⋅,1gc( CH 3COOH)、1gc(CH 3COO -)、lgc(H +)和1gc(OH -)随pH 变化的关系如下图所示。
K a 为CH 3COOH 的电离常数,下列说法正确的是A .O 点时,()()33CH COOH CH COO c c -= B .N 点时,a pH=-lgKC .该体系中,()()()+-13+a 0.1c H c CH COOH =mol L K +c H ⋅ D .pH 由7到14的变化过程中, CH 3COO -的水解程度始终增大4.(2019·全国高考真题)NaOH 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H 2A 的K a1=1.1×10−3 ,K a2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b 点为反应终点。
酸碱中和滴定专项训练

第五节 酸碱中和滴定专项训练【例题精选】:例一:有下列仪器:①托盘天平;②胶头滴管;③酸式滴定管(25ml );④碱式滴定管(25ml );⑤单刻度移液管(15ml );⑥量筒(50ml );⑦锥形瓶;若用0.1 mol/L 的NaOH 滴定20毫升未知浓度的盐酸。
应选用的仪器是( )A .③⑤⑦B .④⑥⑦C .④⑤⑥D .③④⑦ 解析:据中和滴定的操作要求,标准液为装在碱式滴定管中,待测液盐酸盛在锥形瓶中,如何量取20毫升的待测盐酸呢?由于⑤量程不够,⑥精确度达不到。
故只能用③。
答案:D 。
例二:用0.100 mol/L 的NaOH 溶液作标准液滴定0.100 mol/L 的HCl 。
(HCl 的体积取量为20ml 。
)(1)滴定前HCl 溶液中[H +]是多少?pH 值是多少?(2)当滴定NaOH 溶液至19.98 ml 时,溶液的pH 值是多少?(3)当滴加NaOH 溶液至20.02 ml 时,溶液的pH 值是多少? 解:(1)∵[HCl]=[H +]=0.100 mol/L∴pH=-lg0.100=1(2)当滴加NaOH 溶液至19.98 ml 时,即NaOH 不够量,少滴0.02 ml 。
(一般20滴为1 ml ,则一滴为120005=.ml 。
即少滴不到半滴。
) ∵[H +]=⨯-⨯+⨯--0120001998102019981033.(..)(.) =⨯=⨯--210399851035.()mol /L ∴pH=-lg5×10-5=5-lg5=4.3(3)当滴加NaOH 溶液至20.02 ml 时,即NaOH 液多滴半滴。
∵()[OH ]0.1(20.0220)10(2020.02)10510mol L 335----=⨯-⨯+⨯=⨯∴pOH=4.3 ∴pH=14-4.3=9.7 小结:在滴定接近终点时,少加NaOH 溶液0.02 ml 和多加0.02ml ,误差范围为0022000100%01%...⨯=,这些误差都是在允许范围内的,但溶液的pH 却从4.3突变到9.7。
高考化学总复习 第七章 第二节水溶液 酸碱中和滴定试题(含解析)

题号 1 1-1 2 3 4 4-1 5 5-1 6 6-1 7 7-1 8 8-1 答案高考化学总复习 第七章 第二节水溶液 酸碱中和滴定试题(含解析)一、单项选择题1.水的电离平衡为H 2O 高温H ++OH -,在25 ℃时水的离子积为K W =1.0×10-14,在35 ℃时水的离子积为K W =2.1×10-14,则下列叙述正确的是( )A .c (H +)随着温度的升高而降低B .35 ℃时c (H +)>c (OH -)C .35 ℃时的水比25 ℃时的水电离程度小D .水的电离是吸热过程解析:35 ℃时水的离子积大于25 ℃时水的离子积,说明35 ℃时水中的c(H +)、c(OH -)大于25 ℃时水中的c(H +)、c(OH -),但c(H +)仍等于c(OH -),亦说明升高温度,水的电离程度增大,即水的电离是吸热过程,故选D 项。
答案:D1题变式1-1.已知在100 ℃的温度下(本题涉及的溶液其温度均为100 ℃),水的离子积K W =1×10-12。
下列说法正确的是( )A .0.05 mol·L -1的H 2SO 4溶液pH =1B .0.001 mol·L -1的NaOH 溶液pH =11C .0.005 mol·L -1的H 2SO 4溶液与0.01 mol·L -1的NaOH 溶液等体积混合,混合溶液pH 为6,溶液显酸性D .完全中和pH =3的H 2SO 4溶液50 mL ,需要pH =11的NaOH 溶液50 mL解析:A 项,0.05 mol·L -1的H 2SO 4溶液中c(H +)=0.10 mol·L -1,pH =1;B 项,c(OH -)=1.0×10-3 mol·L -1,则c(H +)=1.0×10-121.0×10-3=1.0×10-9 mol·L -1,pH =-lg 1.0×10-9=9;C 项,pH =6时,c (H +)=c(OH -),显中性;D 项,pH =3的H 2SO 4溶液中n(H +)=0.001×0.05 mol =5×10-5 mol ,V(NaOH)=5×10-50.1=5×10-4L =0.5 mL 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酸碱中和滴定专项训练总分 100 分一、选择题(本题包括 5 小题,每小题 3 分,共 15 分,每小题只一个选项符合题意。
)1.在一支25mL的酸式滴定管中盛入0.1mol/L HCl溶液,其液面恰好在5mL刻度处。
若把滴定管内溶液全部放入烧杯中, 再用 0.1mol/L NaOH溶液进行中和,则所需 NaOH溶液的体积()A.大于 20mL B.小于 20mL C.等于 20mL D.等于 5mL2.进行中和滴定时,事先不应该用所盛溶液洗涤的仪器是()A.酸式滴定管B.碱式滴定管C.锥形瓶D.移液管3.刻度“ 0”在上方的用于测量液体体积的仪器是()A.滴定管B.移液管C.量筒D.烧杯4.有甲、乙、丙三瓶等体积等物质的量浓度的NaOH溶液。
若将甲蒸发掉一半水,在乙中通入少量 CO2,丙不变然后滴加指示剂酚酞后,用同浓度的H2SO4溶液滴定至完全反应后,所需溶液的体积()A.甲 =丙 >乙B.丙 >乙 >甲C.乙 >丙 >甲D.甲 =乙 =丙5.下列有关叙述中正确的是()A.滴定管下端连有橡皮管的为酸式滴定管B.在滴定时,左手操作锥形瓶,右手操作滴定管开关。
C.滴定前应首先排除尖嘴部分的气泡。
D.滴定过程中两眼应注视滴定管内液面的变化。
二、选择题(本题包括15 小题,每小题 3 分,共 45 分,每小题有一个或两个选项符合题意。
)6.中和滴定时,用于量取待测液体积的仪器是()A.胶头滴管B.量筒C.滴定管D.移液管7. 25℃时,某溶液中由水电离产生的+-1×10- 18,下列说法正确C( H )和 C( OH)的乘积为的是()A.该溶液的 pH 一定是 9B.该溶液可能 pH=5C.该溶液的 pH 不可能是 7D.不会有这样的溶液8.常温下, 0.1mol/L 的一元酸 HA溶液的 pH=2,0.1mol/L 的一元碱 BOH的溶液中c(OH- )/c(H+)=1012,将此两种溶液等体积混合后,溶液中离子浓度大小关系正确的是()A. c(OH- ) > c(H +) C. c(H +) < c(OH- )> c(B +) > c(A - )B. c(OH- ) < c(H +)<c(A-)<c(B+) c(A - ) <c(B +)D. c(B+ ) =c(A - ) > (H+) = c(OH- )9.氢氧化钠标准溶液因保存不当,吸收了少量的二氧化碳,若有1%的 NaOH转变为 Na2CO3,以此NaOH溶液滴定未知浓度的盐酸,选用甲基橙作指示剂;盐酸浓度的测定结果会()A.偏低 1%B.偏高 1%C.无影响D.偏高 0.1%10.用 PH均为 2 的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为V1和 V2,则 V1和 V2的关系正确的是()A. V1>V2B. V1<V2C. V1=V2D.V1≤ V211.下列实验中,直接采用沾有水滴的仪器,对实验结果没有影响的是()A.氨的喷泉实验B.实验室制氧气:试管C.中和滴定:锥形瓶D.中和滴定:滴定管12.用酸滴定碱时,滴定前读酸式滴定管读数时视线低于水平线,滴定结束时读数正确,这样会使测得的碱溶液的浓度()A.偏高B.偏低C.不受影响D.不能确定13.25℃时,若 PH=a的 10 体积某强酸溶液与PH=b的 1 体积某强碱溶液混合后溶液呈中性,则混合之前该强酸的PH与强碱的 PH之间应满足的关系是()A. a+b=14B. a+b=13C. a+b=15D.a+b=714.将 PH=3的强酸溶液和PH=12的强碱溶液混合,当混合液的PH等于 11 时,强酸与强碱溶液的体积比是()A. 9∶ 2B. 1∶9C. 10∶ 1D. 9∶115.在通常状况下,把醋酸滴入氢氧化钠溶液中,当溶液中-+c( CHCOO)=c( Na )时,溶液3的 PH是()A.大于 7B.等于 7C.小于 7D.不能确定16.将 PH=3的盐酸与 PH=11的氨水等体积混合后,溶液中离子浓度关系正确的是()+-+-A. c( NH4) >c( Cl ) >c( H ) >c( OH)+-(H ) >c ( OH)-+ B.c( Cl )>c(NH4) >c+--+)-+C. c( NH4)>c( Cl) >c( OH) >c ( H D.c( Cl)>c(NH4) >c -+)(OH) >c( H17.一种一元强酸HA 溶液中加入一种碱MOH反应后,溶液呈中性,下列判断中正确的是()A.加入的碱过量B.混合前酸与碱中溶质的物质的量相等C.生成的盐不发生水解-+D.反应溶液中 c( A)、 c( M)相等18.实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是()A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3 次B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3 次19.室温时某强酸溶液和某强碱溶液等体积混合后,所得溶液的PH 为7。
下列说法中正确的是()A.原有的酸溶液和碱溶液的物质的量浓度一定相等B.如果生成盐的水溶液为碱性,则酸的浓度大于碱C.原有酸、碱溶液的物质的量浓度没有确定关系D.原有碱溶液的物质的量浓度更大。
20.用 0.01mol/LH 2SO4滴定 0.01mol/LNaOH 有误差:①多加了 1 滴 H2SO4;②少加了( H+)之比是溶液,中和后加水至100mL。
若滴定时终点判断1 滴 H2SO4(设 1 滴为 0.05mL)。
则①和②中c()A. 5× 103B. 104C.50D.10三、填空题( 共30 分)21. (3分)某学生中和滴定实验的过程如下:(1)取一支碱式滴定管;(2)用蒸馏水洗净;( 3)即加入待测的NaOH溶液;( 4)记录液面刻度读数;( 5)用酸式滴定管精确放出一定量标准酸液;( 6)置于未经标准酸液润洗的洁净的锥形瓶中;(7)加入适量蒸馏水;(8)加入酚酞试液两滴;( 9)滴定时,边滴边振荡;( 10)边注视滴定管内液面的变化;(11)当小心滴到溶液由无色变为粉红色时,即停止滴定;(12)记录液面刻度读数;(13)根据滴定管的两次读数得出NaOH溶液体积为 22mL,指出上述实验过程中错误之处(用序号表示)。
22. (11 分 )25 ℃时,若体积为VA、pH=a 的某一元强酸与体积VB、pH=b 的某一元强碱混合,恰好中和,且已知Va<Vb和 a=0.5b ,请填写下列空白;(1) a 值可否等于 3(填“可”或“否”) _________,其理由是____________________________________________ ;(2) a 值可否等于 5(填“可”或“否”) ________,其理由是_____________________________________________ ;(3) a 的取值范围是 _______________________________________ 。
23. (4分)用相同浓度的盐酸中和体积相同的三种溶液至中性: a.Ba(OH) 2、 b.NaOH、c.NH3· H2O(以下盐酸的体积分别用VA、VB、 Vc 表示 )( 1)若 A、 B、 c 物质的量浓度相同,所消耗盐酸体积关系为。
( 2)若 A、 B、 c 溶液的 pH 相同,所消耗盐酸体积关系为。
24. (12 分 ) 用酸碱中和滴定的方法测定NaOH和 Na2CO的混合液中的NaOH含量时,可先在3混合液中加过量的 BaCl2溶液,使 Na2CO3完全变成 BaCO3沉淀,然后用标准盐酸滴定(用酚酞用指示剂),试回答:( 1)向混有 BaCO 3沉淀的 NaOH 溶液中滴入盐酸, 为什么不会使 BaCO 3沉淀溶解而能测定NaOH 的含量?( 2)滴定时, 若滴定管中滴定液一直下降到活塞处才达到滴定终点,。
则能否由此准确地计算出结果?。
( 3 )能否改用甲基橙作指示剂?,若用甲基橙作指示剂,则测定结果如何?。
25 实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH 的质量分数约为 82.0%,为了验证其纯度,用浓度为 0.2mol/L 的盐酸进行滴定,试回答下列问题:(1) 托盘天平称量 5.0g 固体试剂,用蒸馏水溶解于烧杯中,并振荡,然后立即直接转入500mL 容量瓶中,恰好至刻度线,配成待测液备用。
请改正以上操作中出现的五处错误。
(2) 将标准盐酸装在 25.00mL滴定管中,调节液面位置在处,并记下刻度。
(3) 取 20.00mL 待测液,待测定。
该项实验操作的主要仪器有。
用试剂作指示剂时,滴定到溶液颜色由刚好至色时为止。
(4) 滴定达终点后,记下盐酸用去20.00mL ,计算 NaOH 的质量分数为。
(5) 试分析滚蛋定误差可能由下列哪些实验操作引起的 。
A 、转移待测液至容量瓶时,末洗涤烧杯B 、酸式滴定管用蒸馏水洗涤后,直接装盐酸C 、滴定时,反应容器摇动太激烈,有少量液体溅出D 、滴定到终点时,滴定管尖嘴悬有液滴E 、读滴定管开始时仰视,读终点时俯视26 朱经武教授等人发现的高温超导材料YBa 2Cu 3O 7-x , 其零电阻转变温度 T w =90K 。
YBa 2Cu 3O 7-x中 x 的值与 T W 有一定的关系, x 值介于 0.00 ~ 0.50 之间,一般 x 的值越接近于零, T w就越高。
在 YBa 2Cu 3O 7-x 中, Y 、 Ba 、O 都有固定的化合价,分别为 +3、+2、 -2 ;而 Cu 有+2、+3 价的混合情况。
可用碘量法测定Cu 的量继而求得 x 的值。
碘量法是氧化还原滴定法的一种, 通常用标准碘溶液直接滴定还原性物质, 也可根据某些氧化性物质在酸性溶液中与 I - 作用生成单质碘的性质,用标准还原剂 Na 2S 2O 3 溶液滴定生成的碘单质,间接计算该氧化性2-2- 2+物质的含量。
在滴定过程中, S O转化为 S O,Cu 、2 34 63+Cu 均被还原为 CuI 。
·现取 4.00 ×10 -2 gYBa 2Cu 3 O 7-x 样品,用稀盐酸溶解,·在氩气保护下加入1.00gKI固体充分反应, 2+Cu 、·3+2 2 3溶液滴定反应Cu 均转化为 CuI ,用 0.0100mol/LNa S O生成的 I 2,在滴定终点时消耗 0.0100mol/LNa 2S 2O 3 溶液 图 15 不同温度下的电阻值18.14mL 。
