磷酸氢二钠-柠檬酸缓冲液配制
常用缓冲溶液的配制
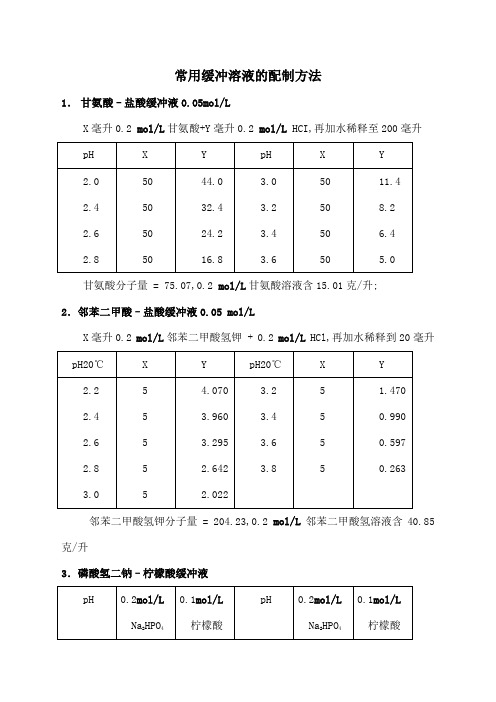
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液0.05mol/LX毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升甘氨酸分子量 = 75.07,0.2 mol/L甘氨酸溶液含15.01克/升;2.邻苯二甲酸–盐酸缓冲液0.05 mol/LX毫升0.2 mol/L邻苯二甲酸氢钾 + 0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na 2HPO 4分子量 = 14.98,0.2 mol/L 溶液为28.40克/升; Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液含35.01克/升; C 4H 2O 7·H 2O 分子量 = 210.14,0.1 mol/L 溶液为21.01克/升; 4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存;5.柠檬酸–柠檬酸钠缓冲液0.1 mol/L柠檬酸C 6H 8O 7·H 2O :分子量210.14,0.1 mol/L 溶液为21.01克/升; 柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升;6.乙酸–乙酸钠缓冲液0.2 mol/LNa 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升; 7.磷酸盐缓冲液1磷酸氢二钠–磷酸二氢钠缓冲液0.2Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液为85.61克/升; Na 2HPO 4·12H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升; Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升; 2磷酸氢二钠–磷酸二氢钾缓冲液1/15 mol/LNa 2HPO 4·2H 2O 分子量 = 178.05,1/15M 溶液为11.876克/升; KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升; 8.磷酸二氢钾–氢氧化钠缓冲液0.05MX 毫升0.2M K 2PO 4 + Y 毫升0.2N NaOH 加水稀释至29毫升9.巴比妥钠-盐酸缓冲液18℃巴比妥钠盐分子量=206.18;0.04M溶液为8.25克/升10.Tris–盐酸缓冲液0.05M,25℃50毫升0.1M三羟甲基氨基甲烷Tris溶液与X毫升0.1N盐酸混匀后,加水稀释至100毫升;三羟甲基氨基甲烷TrisHOCH2 CH2OHCHOCH2 NH2分子量=121.14;0.1M溶液为12.114克/升;Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严;11.硼酸–硼砂缓冲液0.2M硼酸根硼砂Na2B4O7·H2O,分子量=381.43;0.05M溶液=0.2M硼酸根含19.07克/升;硼酸H2BO3,分子量=61.84,0.2M溶液为12.37克/升;硼砂易失去结晶水,必须在带塞的瓶中保存; 11.硼酸-硼砂缓冲液0.2M硼酸根硼砂Na 2B 4O 7·10H 2O,分子量=381.43;0.05M 溶液=0.2M 硼酸根含19.07克/升; 硼酸H 2BO 3,分子量=61.84, 0.2M 溶液为12.37克/升; 硼砂 易失去结晶水,必须在带塞的瓶中保存; 12.甘氨酸–氢氧化钠缓冲液0.05MX 毫升0.2M 甘氨酸+Y 毫升0.2NnaOH 加水稀释至200毫升甘氨酸分子量=75.07;0.2M 溶液含15.01克/升; 13.硼砂-氢氧化钠缓冲液0.05M 硼酸根X 毫升0.05M 硼砂+Y 毫升0.2NNaOH 加水稀释至200毫升硼砂Na 2B 4O 7·10H 2O,分子量=381.43;0.05M 溶液为19.07克/升; 14.碳酸钠-碳酸氢钠缓冲液0.1M Ca 2+、Mg 2+存在时不得使用Na 2CO 2·10H 2O 分子量=286.2;0.1M 溶液为28.62克/升; N 2HCO 3分子量=84.0;0.1M 溶液为8.40克/升; 15.“PBS”缓冲液附录四常用缓冲溶液的配制一磷酸氢二钠-柠檬酸缓冲液pH0.2 mol/LNa2HPO4 mL 0.1 mol/L柠檬酸 mLpH0.2 mol/LNa2HPO4 mL0.1 mol/L柠檬酸 mL2.2 2.4 2.62.83.0 3.2 3.4 3.63.84.0 4.2 4.4 4.64.85.0 0.401.242.183.174.114.945.706.447.107.718.288.829.359.8610.3019.6018.7617.8216.8315.8915.0614.3013.5612.9012.2911.7211.1810.6510.149.705.25.45.65.86.06.26.46.66.87.07.27.47.67.88.010.7211.1511.6012.0912.6313.2213.8514.5515.4516.4717.3918.1718.7319.1519.459.288.858.407.917.376.786.155.454.553.532.611.831.270.850.55Na2HPO4分子量=141.98;0.2 mol/L溶液为28.40 g/L;Na2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L;Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L;C6H8O7·H2O分子量=210.14;0.1 mol/L溶液为21.01 g/L;二柠檬酸-柠檬酸钠缓冲液0.1 mol/L柠檬酸:C6H8O7·H2O分子量=210.14 ;0.1 mol/L溶液为21.01 g/L;柠檬酸钠:Na3C6H5O7·2H2O分子量=294.12 ;0.1 mol/L溶液为29.41 g/L; 三醋酸-醋酸钠缓冲液0.2 mol/LNaAc ·3H2O 分子量=136.09;0.2 mol/L 溶液为27.22 g/L; 冰乙酸11.8 mL 稀释至1 L 需标定; 四磷酸二氢钾-氢氧化钠缓冲液0.05 mol/LX 毫升 0.2 mol/L KH2PO4+Y 毫升0.2 mol/L NaOH 加水稀释至20毫升;五磷酸氢二钠-磷酸二氢钠缓冲液0.2 mol/LNa2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L; Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L; NaH2PO4·H2O分子量=138.01;0.2 mol/L溶液为27.6 g/L; NaH2PO4·2H2O分子量=156.03;0.2 mol/L溶液为31.21 g/L; 六巴比妥纳-盐酸缓冲液巴比妥钠分子量=206.18;0.04 mol/L溶液为8.25 g/L;七Tris-HCl缓冲液0.05 mol/L50毫升0.1mol/L三羟甲基氨基甲烷Tris溶液与X毫升0.1mol/L盐酸混匀并稀释至100毫升;Tris 分子量=121.14 ;0.1 mol/L 溶液为12.114 g/L;Tris 溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严;八、硼酸-硼砂缓冲液 0.2 mol/L 硼酸根硼砂:Na2B4O7·10H2O 分子量=381.43;0.05 mol/L 溶液等于0.2 mol/L 硼酸根含19.07 g/L;硼酸:H3BO3分子量=61.84;0.2 mol/L 的溶液为12.37 g/L; 硼砂易失去结晶水,必须在带塞的瓶中保存; 九硼砂-氢氧化纳缓冲液0.05 mol/L 硼酸根X 毫升0.05 mol/L 硼砂+Y 毫升0.2 mol/L NaOH 加水稀释至200毫升;硼砂Na2B4O7·10H2O分子量=381.43;0.05 mol/L硼砂溶液等于0.2 mol/L硼酸根为19.07 g/L;十碳酸钠-碳酸氢钠缓冲液0.1 mol/L此缓冲液在Ca2+、Mg2+存在时不得使用.Na2CO3·10H2O分子量=286.2; 0.1 mol/L溶液为28.62 g/L;NaHCO3分子量=84.0; 0.1 mol/L溶液为8.40 g/L;。
生物化学实验常用缓冲液的配制方法

生物化学实验常用缓冲液的配制方法1、0.2mol/L 磷酸缓冲液*组份浓度0.2mol/L (pH 6.0)*配制量1L*配置方法1.称取磷酸氢二钠.12水8.82 g。
2.称取磷酸二氢钠.2水27.34g。
3.用去离子水溶解并定容至1L。
室温保存。
注意:此为母液,使用时稀释40倍使用。
2、洗脱液*组份浓度0.15mol/L (含0.15mol/L 氯化钠的0.005mol/L pH 6.0的磷酸缓冲液)*配制量10L*配置方法1.称取氯化钠87.66g。
2.用0.2mol/L pH6.0的磷酸缓冲液250mL溶解。
3.用去离子水稀释至10L。
室温保存。
3、0.3mol/L 磷酸缓冲液*组份浓度0.3mol/L (pH7.8)*配制量0.5L*配置方法1.准确称取磷酸氢二钠.12水49.150g。
2.磷酸二氢钠.2水2.000g。
3.用去离子水溶解并定容至0.5L。
室温保存。
注意:此为母液,使用时稀释10 倍使用。
4、0.2mol/L 乙酸缓冲液*组份浓度0.2mol/L (pH4.6)*配制量2L*配置方法1.准确称取乙酸钠.3水54.44g。
2.加入23mL冰乙酸,溶解。
3.用去离子水溶解并定容至2L。
4℃保存。
5、0.2mol/L 磷酸-柠檬酸缓冲液(pH 2.6、4.6、6.6)*组份浓度0.2mol/L*配制量各1L*配置方法1.母液A(0.2mol/L 的Na2HPO4溶液):称取Na2HPO4.12 水143.256g,用去离子水定容至2L。
2.母液B(0.1mol/L 的柠檬酸溶液):称取柠檬酸.1水42.028g用去离子水溶解定容至2L。
3. pH2.6、4.6、6.6的三种缓冲液如下表配制:pH值A(mL)B(mL)2.6 109.0 891.04.6 467.5 532.56.6 727.5 272.54.按上表混匀后,4℃保存。
6、20×SSC 缓冲液*配制量1L(pH7.0)*配置方法1.准确称取175.2g氯化钠。
常用缓冲溶液的配制方法

常用缓冲溶液的配制方法磷酸氢二钠–柠檬酸缓冲液24Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液含35.01克/升。
C 4H 2O 7·H 2O 分子量 = 210.14,0.1 mol/L 溶液为21.01克/升。
pH 4.0 20mL :Na2HPO4 0.219g + C4H2O7·H2O 0.258g柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。
pH 4.0 20mL : C4H2O7·H2O 0.275g + Na3 C6H5O7·2H2O 0.203g乙酸–乙酸钠缓冲液(0.2 mol/L )Na 2Ac·3H 2O 分子量= 136.09,0.2 mol/L 溶液为27.22克/升。
pH 4.0 20mL :NaAc 0.098g + HAc 0.282mL甘氨酸–氢氧化钠缓冲液(0.05M )甘氨酸分子量=75.07; 0.2M溶液含15.01克/升。
pH 10.0 20mL :甘氨酸0.075g + NaOH 0.013g碳酸钠-碳酸氢钠缓冲液(0.1M ) 2+2+ 无水Na 2CO 2分子量=105.99;0.1M 溶液为10.60克/升。
Na 2CO 2·10H 2O 分子量=286.2;0.1M 溶液为28.62克/升。
Na 2HCO 3分子量=84.0;0.1M 溶液为8.40克/升。
pH 10.0 20mL :无水碳酸钠 0.127g +碳酸氢钠0.067g补注:pH 4.0 EDTA2-McIlvaine2O0. 05 mol/L EDTA(372.2)+ 0. 06 mol/L Na2HPO4·12HO(358.14)+ 0. 08 mol/L 柠檬酸(210.14)18. 61g/L EDTA + 21. 4884 g/L Na2HPO4·12HO + 16.8112 g/L 柠檬酸20mL 0. 372g EDTA + 0. 430 g Na2HPO4 ·12HO + 0.336 g 柠檬酸。
生物化学实验常用缓冲液的配制方法

生物化学实验常用缓冲液的配制方法1、0.2mol/L 磷酸缓冲液 *组份浓度0.2mol/L (pH 6.0)*配制量1L*配置方法 1. 称取磷酸氢二钠.12水8.82 g。
2. 称取磷酸二氢钠.2水27.34g。
3. 用去离子水溶解并定容至1L。
室温保存。
注意:此为母液,使用时稀释40倍使用。
2、洗脱液*组份浓度0.15mol/L (含0.15mol/L 氯化钠的0.005mol/L pH 6.0的磷酸缓冲液)*配制量10L*配置方法 1.称取氯化钠87.66g。
2.用0.2mol/L pH6.0的磷酸缓冲液250mL溶解。
3.用去离子水稀释至10L。
室温保存。
3、0.3mol/L 磷酸缓冲液*组份浓度0.3mol/L (pH7.8)*配制量0.5L*配置方法 1.准确称取磷酸氢二钠.12水49.150g。
2.磷酸二氢钠.2水2.000g。
3.用去离子水溶解并定容至0.5L。
室温保存。
注意:此为母液,使用时稀释10 倍使用。
4、0.2mol/L 乙酸缓冲液*组份浓度0.2mol/L (pH4.6)*配制量2L*配置方法 1.准确称取乙酸钠.3水54.44g。
2.加入23mL冰乙酸,溶解。
3.用去离子水溶解并定容至2L。
4℃保存。
5、0.2mol/L 磷酸-柠檬酸缓冲液(pH 2.6、4.6、6.6)*组份浓度0.2mol/L *配制量各1L*配置方法 1.母液A(0.2mol/L 的Na2HPO4溶液):称取Na2HPO4.12 水143.256g,用去离子水定容至2L。
2.母液B(0.1mol/L 的柠檬酸溶液):称取柠檬酸.1水42.028g 用去离子水溶解定容至2L。
3. pH2.6、4.6、6.6的三种缓冲液如下表配制:pH值A(mL)B(mL)2.6 109.0 891.04.6 467.5 532.56.6 727.5 272.54.按上表混匀后,4℃保存。
6、20×SSC 缓冲液*配制量1L(pH7.0)*配置方法 1.准确称取175.2g氯化钠。
常用缓冲溶液的配制方法

常用缓冲溶液的配制方法1. 磷酸氢二钠–柠檬酸缓冲液 (2)2.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L) (2)3.甘氨酸–盐酸缓冲液(0.05 mol/L) (3)4.邻苯二甲酸–盐酸缓冲液(0.05 mol/L) (3)5.乙酸–乙酸钠缓冲液(0.2 mol/L) (3)6.磷酸盐缓冲液 (3)7.磷酸二氢钾–氢氧化钠缓冲液(0.05M) (4)8.巴比妥钠-盐酸缓冲液(18℃) (4)9.硼酸–硼砂缓冲液(0.2M硼酸根) (5)10.甘氨酸–氢氧化钠缓冲液(0.05M) (5)11.碳酸钠-碳酸氢钠缓冲液(0.1M) (5)12.Tris–盐酸缓冲液(0.05M,25℃) (6)13.硼砂-氢氧化钠缓冲液(0.05M硼酸根) (6)14.PBS缓冲液 (6)15. B-R缓冲溶液配制 (7)16. 常用pH缓冲溶液的配制和pH值 (7)1. 磷酸氢二钠–柠檬酸缓冲液pH0.2mol/LNa2HPO4(mL)0.1mol/L 柠檬酸(mL)pH0.2mol/LNa2HPO4 (mL)0.1mol/L柠檬酸(mL)2.2 2.4 2.62.83.0 3.2 3.4 3.63.84.0 4.2 4.4 4.64.85.0 0.401.242.183.174.114.945.706.447.107.718.288.829.359.8610.3019.6018.7617.8216.8315.8915.0614.3013.5612.9012.2911.7211.1810.6510.149.705.25.45.65.86.06.26.46.66.87.07.27.47.67.88.010.7211.1511.6012.0912.6313.2213.8514.5515.4516.4717.3918.1718.7319.1519.459.288.858.407.917.376.786.155.454.553.532.611.831.270.850.55Na2HPO4分子量= 14.98,0.2 mol/L溶液为28.40克/升。
常用缓冲溶液的配制

常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(L)甘氨酸分子量= ,mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(mol/L)邻苯二甲酸氢钾分子量= ,mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量= ,mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量= ,mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= ,mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液( mol/L )柠檬酸C 6H 8O 7·H 2O :分子量, mol/L 溶液为21.01克/升。
柠檬酸钠Na 3 C 6H 5O 7·2H 2O:分子量, mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液( mol/L )Na 2Ac·3H 2O 分子量 = , mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液()Na 2HPO4·2H 2O 分子量 = , mol/L 溶液为85.61克/升。
Na 2HPO 4·12H 2O 分子量 = , mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = , mol/L 溶液为31.21克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L )18℃1M 溶液为12.114克/升。
Tris 溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
11.硼酸–硼砂缓冲液(0.2M 硼酸根)硼砂Na 2B 4O 7·H 2O,分子量=;0.05M 溶液(=0.2M 硼酸根)含19.07克/升。
各种缓冲液配制方法

各种缓冲液配制方法不同缓冲液的缓冲范围pH缓冲液是化学实验室中常用的一种试剂,可以帮助维持溶液的酸碱度。
下面介绍三种常用缓冲液的配制方法和缓冲范围。
一、甘氨酸-盐酸缓冲液(0.05 mol/L)配制方法:取X毫升0.2 mol/L甘氨酸和Y毫升0.2 mol/L 盐酸,加入适量的水稀释至200毫升。
缓冲范围:pH值在2.2至3.6之间,X和Y的取值见上表。
二、邻苯二甲酸-盐酸缓冲液(0.05 mol/L)配制方法:取X毫升0.2 mol/L邻苯二甲酸氢钾和Y毫升0.2 mol/L盐酸,加入适量的水稀释至20毫升。
缓冲范围:pH值在2.2至3.8之间,X和Y的取值见上表。
三、磷酸氢二钠-柠檬酸缓冲液配制方法:根据上表中的数据,取相应的0.2 mol/L和0.1 mol/L的Na2HPO4和柠檬酸,加入适量的水稀释至20毫升。
缓冲范围:pH值在2.2至8.0之间,具体取值见上表。
以上缓冲液的配制方法和缓冲范围可根据实验需要进行调整和改变。
在实验过程中,正确选择缓冲液可以提高实验的成功率和准确性。
以下是已经修改好的文章:柠檬酸的浓度可以用毫升表示,其浓度数据如下:9.28 mL8.85 mL8.40 mL7.91 mL7.37 mL6.78 mL6.15 mL5.45 mL4.55 mL3.53 mL2.61 mL1.83 mL1.27 mL0.85 mL0.55 mL对于Na2HPO4,其分子量为141.98,0.2 mol/L的溶液需要28.40 g/L。
而Na2HPO4·2H2O的分子量为178.05,0.2 mol/L的溶液需要35.61 g/L。
最后,Na2HPO4·12H2O的分子量为358.22,0.2 mol/L的溶液需要71.64 g/L。
对于C6H8O7·H2O,其分子量为210.14,0.1 mol/L的溶液需要21.01 g/L。
以下是柠檬酸-氢氧化钠-盐酸缓冲液的相关数据:pH: 2.2.3.1.3.3.4.3.5.3.5.8.6.5钠离子浓度(mol/L): 0.20.0.20.0.20.0.20.0.35.0.45.0.38柠檬酸(g) 氢氧化钠(g) 盐酸(mL)C6H8O7·H2O NaOH 97% HCl (浓)210 210 210210 245 285266 84 8383 144 186156 160 116106 45 68105 126最终体积(L):10使用时可以每升中加入1克酚。
常用缓冲溶液配制方法
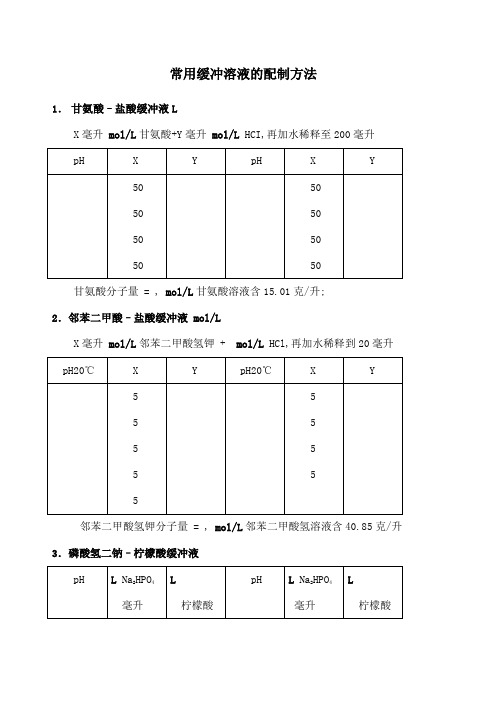
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液LX毫升 mol/L甘氨酸+Y毫升 mol/L HCI,再加水稀释至200毫升甘氨酸分子量 = , mol/L甘氨酸溶液含15.01克/升;2.邻苯二甲酸–盐酸缓冲液 mol/LX毫升 mol/L邻苯二甲酸氢钾 + mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = , mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量 = , mol/L溶液为28.40克/升;Na2HPO4·2H2O分子量 = , mol/L溶液含35.01克/升;C 4H2O7·H2O分子量 = , mol/L溶液为21.01克/升;4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存;5.柠檬酸–柠檬酸钠缓冲液 mol/L柠檬酸C 6H 8O 7·H 2O :分子量, mol/L 溶液为21.01克/升;柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量, mol/L 溶液为29.41克/毫升; 6.乙酸–乙酸钠缓冲液 mol/LNa 2Ac·3H 2O 分子量 = , mol/L 溶液为27.22克/升; 7.磷酸盐缓冲液1磷酸氢二钠–磷酸二氢钠缓冲液Na2HPO4·2H2O分子量 = , mol/L溶液为85.61克/升;Na2HPO4·12H2O分子量 = , mol/L溶液为克/升;NaH2PO4·2H2O分子量 = , mol/L溶液为克/升;磷酸盐是化学研究中使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,所以用它们配制的缓冲液,pH 范围最宽:NaH2PO4: pKa1=,pKa2=;Na2HPO4:pKa1=,pKa2=配酸性缓冲液:用NaH2PO4,pH=1~4,配中性缓冲液:用混合的两种磷酸盐,pH=6~8,配碱性缓冲液:用Na2HPO4,pH=10~12;用钾盐比钠盐好,因为低温时钠盐难溶,钾盐易溶,但若配制SDS-聚丙烯酰胺凝胶电泳的缓冲液时,只能用磷酸钠而不能用磷酸钾,因为SDS十二烷基硫酸钠会与钾盐生成难溶的十二烷基硫酸钾;磷酸盐缓冲液的优点为:①容易配制成各种浓度的缓冲液;②适用的pH 范围宽;③pH 受温度的影响小;④缓冲液稀释后pH 变化小,如稀释10倍后pH 的变化小于;其缺点为:①易与常见的钙Ca2+离子、镁Mg2+离子以及重金属离子缔合生成沉淀;②会抑制某些化学过程,如对某些酶的催化作用会产生某种程度的抑制作用;2磷酸氢二钠–磷酸二氢钾缓冲液1/15 mol/L15M11.876克15M9.078克0.05M0.2M18℃0.04M8.25克0.05M25℃0.1M严;11.硼酸–硼砂缓冲液0.2M 硼酸根硼砂Na 2B 4O 7·10H 2O,分子量=;溶液=0.2M 硼酸根含19.07克/升; 硼酸H 3BO 3,分子量=,溶液为12.37克/升; 硼砂易失去结晶水,必须在带塞的瓶中保存; 12.甘氨酸–氢氧化钠缓冲液0.05MX 毫升0.2M甘氨酸+Y 毫升加水稀释至200毫升甘氨酸分子量=;0.2M 溶液含15.01克/升; 13.硼砂-氢氧化钠缓冲液0.05M 硼酸根 X 毫升0.05M 硼砂+Y 毫升加水稀释至200毫升硼砂Na 2B 4O 7·10H 2O,分子量=;0.05M 溶液为19.07克/升; 14.碳酸钠-碳酸氢钠缓冲液0.1M Ca 2+、Mg 2+存在时不得使用Na 2CO 2·10H 2O 分子量=;0.1M 溶液为28.62克/升; N 2HCO 3分子量=;0.1M 溶液为8.40克/升; 15.“PBS”缓冲液pH标准缓冲溶液Standard pH Buffer Solutions注:为保证pH值的准确度,上述标准缓冲溶液必须使用pH基准试剂配制;常用pH缓冲溶液的配制和pH值Preparation and pH Values of Common pH Buffer Solutions。
