药物合成反应(闻韧_第三版)第六章课后答案
药物合成反应 第六章 氧化反应

1. Chromium Regent • (1)Jones :CrO3/acetone/H2SO4
对酸敏感化合物不能用此法; 如果起始原料是醛,可氧化成酸;
• (2)Sarret and Collins Regent
• 制备存在危险性; • 产品从吡啶中分离困难;
Example
(3)PCC、PDC
(氧环在位阻小的一侧形成)
PH值有影响:
2.不与羰基共轭的烯键的环氧化
O
CH3 H
CH3 H
+ CH3CO3H
CH3 H
C
C
CH3 H
+ CH3CO2H
烯烃在试剂的作用下,生成环氧化合物的反应称为环氧化反应。
O OH
+
OH R
+
H O
反 应 机 理
R
C O
+
[
R
C O
C O
O
-
O
] -
OH R C O O
• 2. 氧化生成酮、羧酸 • 应用特点
KMnO4、Na2Cr2O7、Cr2O3和稀HNO3作 氧化剂
空气氧化
用硝酸铈铵作氧化剂, 苄位亚甲基氧化成酮
SeO2试剂
(82%)
二 羰基a位活性烃基的氧化
1.形成a-羟酮
(1)反应通式
• (2)影响因素
加BF3可催化酮的烯醇化,KC有利,从而有 利于乙酰化。
• ②铬酰氯为氧化剂
(Chromychlorde)CrO2Cl2
机理:(自由型)
Etard复合体
机理:(离子型)
(Etard复合体)
• (3)影响因素 • ①反应温度
药物合成反应习题及答案

药物合成反应习题及答案一、举例解释下列概念:1,官能团保护;为什么保护?当分子中有多个官能团,想在某一官能团进行转换反应,为了不使其他官能团影响反应,需对这些官能团进行衍生化,这就是官能团的保护。
达到反应目的后再还原这些官能团。
理想保护基:试剂易得、无毒,保护基稳定,引入和脱去反应选择性好,收率高。
2,相转移催化剂; 一种与水相中负离子结合的两性物质,可以把亲核试剂转移到有机相进行亲核反应。
相转移催化剂优点:克服溶剂化作用;不需无水操作;可用无机碱代替有机金属碱;降低反应温度。
3,重排反应;重排反应是指在同一分子内,某一原子或基团从一个原子迁移至另一原子而形成新分子的反应。
按反应机理可分为亲电重排、亲核重排、自由基重排和协同重排。
4,合成子;合成子:组成靶分子或中间体骨架的各个单元结构的活性形式.包括:离子合成子、自由基或周环反应所需的中性分子。
离子合成子:包括 d 合成子和a合成子d 合成子: 亲核性的离子合成子d---donor of electrond 合成子等价试剂a合成子:氧化性或亲电性的离子合成子a合成子:等价试剂5,协同反应协同反应:在反应过程中,若有两个或两个以上的化学键破裂和形成时,都必须相互协调地在同一步骤中完成。
6, 非均相催化氢化: 催化剂、反应物、试剂和氢供体在两项或多项中反应,催化剂自成一相,称为非均相催化氢化。
催化剂自成一相称为非均相催化剂如Pd/C为催化剂,氢气为氢供体,在反应液中还原双键的反应。
1) DMAP2) DMF3) DCC4) TBAF1) Aromatic Electrophilic Substitution; 芳香亲电取代2) Phase-transfer catalyst; 相转移催化剂3) Carbocations; 碳负离子4) trifluoroacetic anhydride.三氟乙酸酐Ryoji Noyori was awarded the Nobel Prize in 2001, What did he discover?Ryoji Noyori日本名古屋大学的野伊良治因在手性催化氢化反应方面做出了突出贡献而被授予2001年Nobel化学奖。
药物合成反应(闻韧_第三版)第一章课后答案Chapter_1_Halogenation_Reaction
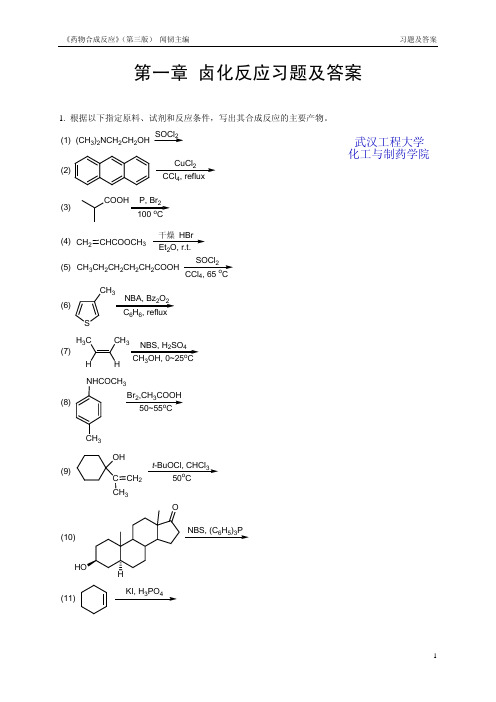
第一章 卤化反应习题及答案1. 根据以下指定原料、试剂和反应条件,写出其合成反应的主要产物。
(1)(CH 3)2NCH 2CH 2OHSOCl 2(2)CuCl 24(3)P, Br 2o(4)CH 2CHCOOCH 3干燥 HBr 2 (5)CH 3CH 2CH 2CH 2CH 2COOHSOCl 24o(6)S CH 32266(7)H 3C CH 3NBS, H 2SO 43o(8)NHCOCH 3CH 3Br 2,CH 3COOH o(9)OHC CH 3CH 2t -BuOCl, CHCl 3o(10)NBS, (C 6H 5)3P(11)KI, H 3PO 4武汉工程大学化工与制药学院(12)C 6H 5H 3Br 2,Cl 4o (13)CH 3CH CH CH 3232(14)(CH 3)3CCH 2OHHBr(15)OOP2(16)NBS, Et 3N ·3HF 22o(17)OHBr 24o(18)O23o2. 在下列指定原料和产物的反应式中分别填入必需的化学试剂(或反应物)和反应条件。
(1)CH 3CH 2CH 2CH 2CH CHCH 3CH 3CH 2CH 2CHCHCHCH 3Br(2)COOHBr(3)(4)OHBr(5)2CH 2BrBr(6)(7)(CH 3)3CCH 2OH(CH 3)3CCH 2Br(8)OOBocHNO OBocHNBr(9)OOBr OO BrBr2. 在下列指定原料和产物的反应式中分别填入必需的化学试剂(或反应物)和反应条件。
(参考答案)题号答案注释(1) NBS/(PhCO)2O, CCl4, △(2) Br2/HgO/tetrachloroethaneNaNO2, HCl, H2O; 2. HPF6; 3. △ (168℃)(3) 1.(4) Ph3P, Br2, CH3CN, △ (200-340℃)(5) NBS/(PhCO)2O, CCl4refluxing (10min. )acetone,(6) NaI,(7) Bu3P, Br2, DMF(8) NBS/hv, CCl4(9) NBS/(PhCO)2O, CCl4, reflux3. 阅读(翻译)以下有关反应操作的原文,请在理解基础上写出:(1)此反应的完整反应式(原料、试剂和主要反应条件);(2)此反应的反应机理(历程)。
药物合成反应(闻韧第三版)课后翻译

1、About 216–224 g. (1.62–1.68 moles) of powdered anhydrous aluminum chloride is added to a 1Lthree-necked flask.在1L的三口烧瓶中加入大约216-224g(1.62–1.68 moles)的无水三氯化铝。
While the free-flowing catalyst is stirred (Note 3), 81 g. (0.67 mole) of acetophenone is added from the dropping funnel in a slow stream over a period of 20–30 minutes. 自由流动的催化剂边搅拌边用滴液漏斗缓慢滴加81g苯乙酰。
Considerable heat is evolved, and, if the drops of ketone are not dispersed, darkening or charring occurs. 放热反应,假如滴加的酮不能被分散,就会变黑或是碳化。
When about one-third of the acetophenone has been added, the mixture becomes a viscous ball-like mass that is difficult to stir.当三分之一的乙酰苯被滴加,反应混合物变成一个很难搅拌的粘性的球状团块。
Turning of the stirrer by hand or more rapid addition of ketone is necessary at this point. 在这时,改用手动搅拌或快速滴加酮是非常必要的。
The addition of ketone, however, should not be so rapid as to produce a temperature above 180°. 然而,速度不能太快,当反应温度超过180℃时。
(完整word版)药物合成反应(闻韧_第三版)课后翻译(word文档良心出品)

1、About 216–224 g. (1.62–1.68 moles) of powdered anhydrous aluminum chloride is added to a 1Lthree-necked flask.在1L的三口烧瓶中加入大约216-224g(1.62–1.68 moles)的无水三氯化铝。
While the free-flowing catalyst is stirred (Note 3), 81 g. (0.67 mole) of acetophenone is added from the dropping funnel in a slow stream over a period of 20–30 minutes. 自由流动的催化剂边搅拌边用滴液漏斗缓慢滴加81g苯乙酰。
Considerable heat is evolved, and, if the drops of ketone are not dispersed, darkening or charring occurs. 放热反应,假如滴加的酮不能被分散,就会变黑或是碳化。
When about one-third of the acetophenone has been added, the mixture becomes a viscous ball-like mass that is difficult to stir.当三分之一的乙酰苯被滴加,反应混合物变成一个很难搅拌的粘性的球状团块。
Turning of the stirrer by hand or more rapid addition of ketone is necessary at this point. 在这时,改用手动搅拌或快速滴加酮是非常必要的。
The addition of ketone, however, should not be so rapid as to produce a temperature above 180°. 然而,速度不能太快,当反应温度超过180℃时。
闻韧版 药物合成反应 课后翻译

第六章
(1)、二吡啶三氧化铬
在一个干燥的装有密封机械搅拌器,温度计,和干燥管的1L的三颈烧瓶里面装入500毫升无水吡啶,搅拌,用冰浴冷却到大约15°。干燥管是定期拿开,将68克(0.68摩尔)无水三氧化铬在一个30分钟内通过瓶颈分次加入。氧化铬应增加在这样的速度,温度不超过20°,并以这种方式,迅速与吡啶氧化物混合,不粘附瓶内。随着氧化铬的加入,一种深黄色的,絮状沉淀物从吡啶中分离出来,混合物的粘度增加。当添加完后,这混合物
第四章
(1)、 在配有回流冷凝器的3L圆底烧瓶中加入625ml的95%酒精、500ml水、500g(476ml,4,7mol)的苯甲醛和50g 96-98%的氰化钠。混合物加热并保持沸腾1.5小时。在20分钟后晶体开始从热溶液中析出。在最后的30分钟,冷却溶液,抽滤并用少量水洗涤有450-460g白色或亮黄色的干燥的安息香。理论产率90-92%。为了得到纯度高的产品,粗产品要在酒精中重结晶,90g粗品溶解在700ml沸腾的酒精中,冷却, 得到83g熔点为129摄氏度的白色安息香纯品。
合并二氯甲烷溶液_可用稀盐酸,碳酸氢钠溶液和水洗涤,或直接通过助滤剂过滤,或通过色谱柱去除吡啶铬盐_痕迹。去除二氯甲烷获得该产品;少量残余吡啶可通过减少压力下去除。
(3)庚醛
在一个干燥,1L的装有机械搅拌器的三颈烧瓶中加入650ml无水二氯甲烷。开始搅拌,在室温下加入77.5g二吡啶三氧化铬,再一次性加入5.8g 1-庚醇。搅拌20分钟后,倒出上层溶液从这不溶性棕色胶状物中,并用3个100ml乙醚冲洗。乙醚和二氯甲烷的溶液相结合,并先后用300毫升5%氢氧化钠的水,100毫升5%的盐酸(注12),两个100毫升部分饱和碳酸氢钠,并最后用100毫升饱和氯化钠水溶液冲洗。无水硫酸镁干燥有机层,并通过蒸馏去除溶剂。在残余油通过Claisen缩合____减压蒸馏分离4.0-4.8克。 (70-84%)的庚醛,B.P. 80-84°(65毫米),n25D1.4094
药物合成反应(闻韧_第三版)课后翻译

1、216-224g(1.62–1.68 moles)的无水三氯化铝。
While the free-flowing catalyst isfunnel in a slow stream over a period of 20–30 minutes. 自由流动的催化剂边搅拌边用滴液漏斗缓慢滴加81g苯乙酰。
Considerable heat is evolved, and, if the drops of ketone are not dispersed, darkening or charring occurs. 放热反应,假如滴加的酮不能被分散,mixture becomes a viscous ball-like mass that is difficult to stir.当三分之一的乙酰苯被滴加,反应混合物变成一个很难搅拌的粘性的球状团块。
Turning of the stirrer by hand or more rapid addition of ketone is necessary at this point. 在这时,改用手动搅拌或快速滴加酮是非常必要的。
The addition of ketone, however, should not be so rapid as to produce a temperature above 180°. 然而,速度不能太快,当反应温度超过180℃时。
Near the end of the addition, the mass becomes molten and can be stirred easily时,团块开始融化,表明苯乙酰已经和三氯化铝混合完全,颜色也逐渐从黄褐色变为棕色。
Bromine (128 g., 0.80 mole) is added dropwise to the well-stirred mixture over a period of 40 minutes (Note 4). 在40分钟内在搅拌下把溴缓慢滴加到混合物中。
最新《药物合成反应(闻韧主编第三版)》人名反应整理资料

《药物合成反应(闻韧主编第三版)》人名反应整理一、卤化反应1、Hunsdriecke反应(汉斯狄克反应):羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
2、Sandmeyer反应(桑德迈尔反应):用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
3、Gattermann反应(加特曼反应):将Sandmeyer反应条件改为铜粉和氢卤酸。
4、Schiemann反应(席曼反应):将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或将芳胺直接用亚硝酸钠和氟硼酸进行重氮化,此重氦盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
二、烃化反应5、Willamson合成(威廉姆森合成):醇在碱(钠,氢氧化钠,氢氧化钾等) 存在下与卤代烃反应生成醚的反应。
6、Gabriel合成(盖布瑞尔合成):将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾形成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,肼解或酸水解即可得纯伯胺。
7、Delepine反应(德勒频反应):用卤代烃与环六亚甲基四胺(乌洛托品Methenamine)反应得季铵盐,然后水解可得伯胺。
8、Leuckart-Wallach反应(鲁卡特-瓦拉赫反应):用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
9、Ullmann反应(沃尔曼反应):卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
三、酰化反应10、Friedel-Crafts反应(傅列德尔-克拉夫茨反应,也称傅-克酰基化反应):羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
11、Hoesch反应(赫施):腈类化合物与氯化氢在Lewis 酸催化剂ZnCl2的存在下与烃基或烷氧基取代的芳烃进行反应可生成相应的酮亚胺,再经水解则羟基或烷氧基取代的芳香酮。
12、Gattemann反应(伽特曼反应):将羟基或烷氧基取代的芳烃在AlCl3、ZnCl2催化下与氰化氢及氯化氢反应生成牙胺盐酸盐,再经水解生成相应芳香醛的反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第六章 氧化反应习题及答案1. 根据以下指定原料、试剂和反应条件,写出其合成反应的主要产物(1)32o CrO 3(2)CCH 3O SeO 2(3)H 2CrO 4OH3CH(CH 3)2丙酮(4)HOCH 2CH 22CH=CHCO 2CH 3CH 3CH 3PCC(5)CO 2CH 332(6)CH 3CH 2CHCCH 2CH 3OMnO 2(7)CH 3CH=CHCO 2C 2H 5CF 3CO 3H(8)(CH 3)2CHCH=CHCH=CHCH 2OHDMSO(9)OHHOH 2C6(10)O222) KOH/MeOH武汉工程大学化工与制药学院(11)2) NaOHCOOH(12)OH 3CH 3HH 3C H 2SO 4(13)H 2O 2, CH 3CN 33(14)KMnO 4(15)NO322. 在下列指定原料和产物的反应式中分别填入必需的化学试剂(或反应物)和反应条件。
(1)ClCH 3ClCOOH(2)PhCH=CHCH 2OHPhCH=CHCH=O(3)O(4)C H2CO 2CH 3H C(CH 3)2HC HCH 2CO 2CH 3H C H CHO(5)CH H 3CO 2C CH H 3CO 2C (6)OHOCH 3OOCH 3(7)2H(8)CONH 2CH(CH 3)2CONH 2CH(CH 3)2O(9)OHOH(10)H 2C=CHCH(OC 2H 5)2H 2CCHCH(OC 2H 5)2OH OH(11)CH2CHCH2CH2OCPh3CH3OCHCH2CH2OCPh3CH3(12)Ph OCH2CH2OPh Ph COCH CHOPh2. 在下列指定原料和产物的反应式中分别填入必需的化学试剂(或反应物)和反应条件。
(参考答案)题号答案注释1 1. KMnO4, H2O; 2. HCl2 CrO3·(Py) 2 J. Org. Chem., 1969, 34: 1979.3 CrO3·(Py) 2J. Org. Chem., 1969, 34: 3587.4 CrO3·(Py) 2J. Org. Chem., 1979, 44: 2441.5 DMSO, Ac2O6 Org. Lett., 2003, 5: 3049.7 Ag2O8 J. Org. Chem., 1992, 57: 6696.9 CH3COOOH, NaHCO3 J. Org. Chem., 1987, 52: 4898.10 KMnO4, H2O, 5℃11 1. O3; 2. Zn, H2O J. Org. Chem., 1972, 37: 2877.12 SeO2, 80%AcOH(aq.)3. 阅读(翻译)以下有关反应操作的原文,请在理解基础上写出:(1)此反应的完整反应式(原料、试剂和主要反应条件);(2)此反应的反应机理(历程)。
(1) Dipyridine chromium(VI) oxide (Note 1).A dry, 1-l., three-necked flask fitted with a sealed mechanical stirrer, a thermometer, and a drying tube, is charged with 500 ml. of anhydrous pyridine (Note 2), which is stirred and cooled to approximately 15° (Note 3) with an ice bath. The drying tube is periodically removed and 68 g. (0.68 mole) of anhydrous chromium(VI) oxide (Note 4) is added in portions through the neck of the flask over a 30-minute period. The chromium trioxide should be added at such a rate that the temperature does not exceed 20° and in such a manner that the oxide mixes rapidly with the pyridine and does not adhere to the side of the flask (Note 5). As the chromium trioxide is added, an intensely yellow, flocculent precipitate separates from the pyridine and the viscosity of the mixture increases. When the addition is complete, the mixture is allowed to warm slowly to room temperature with stirring. Within one hour the viscosity of the mixture decreases and the initially yellow product changes to a deep red, macrocrystalline form that settles to the bottom of the flask when stirring is discontinued. The supernatant pyridine is decanted from the complex and the crystals are washed several times by decantation with 250-ml. portions of anhydrous petroleum ether. The product is collected by filtration on a sintered glass funnel and washed with anhydrous petroleum ether, avoiding contact with the atmosphere as much as possible. The complex is dried at 10 mm. until it is free-flowing,leaving 150–160 g. (85–91%) of dipyridine chromium(VI) oxide3 as red crystals. The product is extremely hygroscopic; contact with moisture converts it rapidly to the yellow dipyridinium dichromate.4 It is stored at 0° in a brown bottle (Note 6).(2) General oxidation procedure for alcohols.A sufficient quantity of a 5% solution of dipyridine chromium(VI) oxide (Note 1) in anhydrous dichloromethane (Note 7) is prepared to provide a sixfold molar ratio of complex to alcohol, an excess usually required for complete oxidation to the aldehyde. The freshly prepared, pure complex dissolves completely in dichloromethane at 25° at 5% concentration, giving a deep red solution, but solutions usually contain small amounts of brown, insoluble material when prepared from crude complex (Note 8). The alcohol, either pure or as a solution in anhydrous dichloromethane, is added to the red solution in one portion with stirring at room temperature or lower. The oxidation of unhindered primary (and secondary) alcohols proceeds to completion within 5 to 15 minutes at 25° with deposition of brownish-black, polymeric, reduced chromium–pyridine products (Note 9). When deposition of reduced chromium compounds is complete (monitoring the reaction by GC or TLC is helpful), the supernatant liquid is decanted from the (usually tarry) precipitate, which is rinsed thoroughly with dichloromethane (Note 10). The combined dichloromethane solutions may be washed with dilute hydrochloric acid, sodium hydrogen carbonate solution, and water, or filtered directly through a filter aid, or passed through a chromatographic column to remove traces of pyridine and chromium salts. The product is obtained by removal of dichloromethane; any pyridine that remains can often be removed under reduced pressure.(3) Heptanal.A dry, 1-l. three-necked round-bottomed flask is equipped with a mechanical stirrer, and 650 ml. of anhydrous dichloromethane (Note 7) is added. Stirring is begun and 77.5 g. (0.300 mole) of dipyridine chromium(VI) oxide (Note 1) is added at room temperature, followed by 5.8 g. (0.050 mole) of 1-heptanol (Note 11) in one portion. After stirring for 20 minutes, the supernatant solution is decanted from the insoluble brown gum, which is washed with three 100-ml. portions of ether. The ether and dichloromethane solutions are combined and washed successively with 300 ml. of aqueous 5% sodium hydroxide, 100 ml. of 5% hydrochloric acid (Note 12), two 100-ml. portions of saturated aqueous sodium hydrogen carbonate, and, finally, with 100 ml. of saturated aqueous sodium chloride. The organic layer is dried over anhydrous magnesium sulfate, and the solvent is removed by distillation. Distillation of the residual oil at reduced pressure through a small Claisen head separates 4.0–4.8 g. (70–84%) of heptanal, b.p. 80–84° (65 mm.), n25D 1.4094 (Note 13).3. 阅读(翻译)以下有关反应操作的原文,请在理解基础上写出:(1)此反应的完整反应式(原料、试剂和主要反应条件);(2)此反应的反应机理(历程)。
