北航 应用化学 教辅 课件第15章 杂环化合物(2)
合集下载
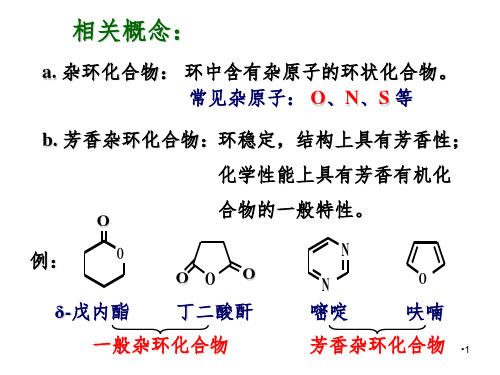
杂环化合物药专PPT课件

第十五章 杂环化合物和生物碱
基础化学教研室:王军 Tel:2983612 Email:huaxuewangjun@ 密码: 123456WJ(大写)
1
第十五章 杂环化合物和生物碱
第一节 杂环化合物
一、杂环化合物的分类 二、杂环化合物的命名 三、五元杂环化合物 四、六元杂环化合物 五、稠杂环化合物
4 3 OH 5
2
6 7
N1 H
3-羟基吲哚
特例:
6 7
54
3
7
8
N2 6 1
异喹啉
54
6
3
7 8
2 N 1
喹啉
89 1
N 5 10 4
吖(a)啶
13
O6H 7
2
1N
5 NN 8
32 H 2N
NN 3
4
NN HH
9
2-氨基-6-羟基嘌呤 (鸟嘌呤)
第一节 杂环化合物二、杂环化合物的命名(二)杂环母环的编号原则
意义:分布广泛,种类繁多。占有机物的65%以上, 已发表的论文中40%以上都涉及杂环化合物。 蛋白质、核酸、多种维生素、生物碱、血红素、 叶绿素、许多药物中含杂环化合物。
一、杂环化合物的分类
五元杂环:
单杂环
杂环
六元杂环:
NN
OS N H N
N
N
稠杂环
NN
N6
NN H
N
二、杂环化合物的命名
第一节 杂环化合物
2-甲基呋喃 (a-甲基呋喃)
N H
3-硝基吡咯 (b-硝基11 吡咯)
N
4-乙基吡啶 (g-乙基吡啶)
第一节 杂环化合物二、杂环化合物的命名(二)杂环母环的编号原则
基础化学教研室:王军 Tel:2983612 Email:huaxuewangjun@ 密码: 123456WJ(大写)
1
第十五章 杂环化合物和生物碱
第一节 杂环化合物
一、杂环化合物的分类 二、杂环化合物的命名 三、五元杂环化合物 四、六元杂环化合物 五、稠杂环化合物
4 3 OH 5
2
6 7
N1 H
3-羟基吲哚
特例:
6 7
54
3
7
8
N2 6 1
异喹啉
54
6
3
7 8
2 N 1
喹啉
89 1
N 5 10 4
吖(a)啶
13
O6H 7
2
1N
5 NN 8
32 H 2N
NN 3
4
NN HH
9
2-氨基-6-羟基嘌呤 (鸟嘌呤)
第一节 杂环化合物二、杂环化合物的命名(二)杂环母环的编号原则
意义:分布广泛,种类繁多。占有机物的65%以上, 已发表的论文中40%以上都涉及杂环化合物。 蛋白质、核酸、多种维生素、生物碱、血红素、 叶绿素、许多药物中含杂环化合物。
一、杂环化合物的分类
五元杂环:
单杂环
杂环
六元杂环:
NN
OS N H N
N
N
稠杂环
NN
N6
NN H
N
二、杂环化合物的命名
第一节 杂环化合物
2-甲基呋喃 (a-甲基呋喃)
N H
3-硝基吡咯 (b-硝基11 吡咯)
N
4-乙基吡啶 (g-乙基吡啶)
第一节 杂环化合物二、杂环化合物的命名(二)杂环母环的编号原则
15杂 环 化 合 物

N N
3
N N HBiblioteka N H122
4
N
1
2
吲哚
嘌呤
喹啉
没有特定名称稠杂环母环命名规则 1,基本环选择原则
按N,O,S顺序;最大环;杂原子数目及种类最多环;都相同 时稠合前编号最低的
O S HN Ph N N S
噻吩并吡咯
萘并呋喃
5-苯基咪唑并噻唑
命名:附加环并基本环
•2,稠合边的表示方法
• 按照单环时对每个环编号保证稠合原子序数较小,如下图黑色 和红色编号。基本环1-2号称为a边;2-3号位为b….,附加环用1、 2、3等表示原子位置
NH 3 4.76 N 8.80 9.42
NH 2
脂肪胺(2°>1°>3°)>氨>芳香胺
(2) 吡啶的亲电取代反应
(A) 吡啶N的亲核性:与亲电试剂生成吡啶鎓盐或络合物
+ N CH3 I
-
N
+
CH3I
COR RCOCl 石油醚
N H
H+
NO2+BF4乙醚 室温
+
Br2 CCl4
+ N Br Br -
定义:吡啶与氨基钠作用生成2-氨基吡啶的反应称
为齐齐巴宾反应。
100oC C6H5N(CH3)2
+ NaNH2
N
N
NH-Na+
H2O
N
NH2
(4) 氧化和还原反应
吡啶环本身不易被氧化,但它的侧链很容易被氧化成醛或羧酸。
CH3 N COOH
O2, DMF t-Bu O K, 室温
Se O 2
N
N
杂环化合物hPPT课件
N
1、吡咯的结构特点
H
(1)杂化方式: sp2
p
sp2 p
C:
C:
吡啶
sp2 p 吡咯
sp2 p
N:
N:
同: 成环的C、N原子均为sp2杂化 异: 吡啶N:孤电子对处于sp2杂化轨道中
吡咯N:孤电子对处于未杂化的p轨道中 •39
(2)成键方式: e
吡啶:
● ●
●
●
●
吡咯:
●
●
N● ●
●
e
●
●
●
●●
C H = C H2 N
奎宁 (抗疟疾药)
N
CH3
H3CO
α
合成原料应选择:
Nβ
4-甲基-6-甲氧基喹啉
NH2
+ OCH3
β αO CH2=CH-C-CH3
H3CO
NO2
浓H2SO4
H3CO
CH3
N •32
HOOC 例4: 以苯为起始物合成:
N C6H5
合成路线:
CH3Cl AlCl3
CH3
HNO3 H2SO4
① 与质子酸的成盐反应:(无机强酸)
反应:
+ HCl
N
② 与Lewis酸的成盐反应:
+
N
H
Cl -
反应: N + SO3
+
N
–SO-3
N • SO3
N-磺酸吡啶 (温和的非质子磺化剂)
N + CrO3
+
N
–CrO-3
N • CrO3
N-铬酸吡啶
(温和的非质子氧化剂) •15
(3)吡啶芳环的亲电取代反应
杂环化合物HeterocyclicCompounds

43
H3C 4 N3
5
O
2 CHO
1
5
2
N1
H
4 N3
5 H3C
S
2
1
2-呋喃甲醛
4-甲基咪唑 5-甲基噻唑
上页 下页 返回 退出
β' β
α'
α
H3C
O
CH3
α ,α'-二甲基呋喃 ,?
CH3 γ β
Nα
γ-甲基吡啶 -
上页 下页 返回 退出
12.3 五元杂环化合物
12.3.1 呋喃、噻吩和吡咯旳构造 12.3.2 呋喃、噻吩和吡咯旳性质 12.3.3 糠醛
有机化学
12 杂环化合物
(Heterocyclic Compounds)
下页 返回 退出
基本内容和要点要求
杂环化合物旳分类和命名; 杂环化合物旳构造和芳香性; 五元杂环化合物旳化学性质; 六元杂环化合物旳化学性质; 生物碱
要点要求掌握芳香性;五元、六元杂环化合物 旳化学性质,杂环化合物旳亲电取代反应旳活性及 规律;酸碱性规律。
呋喃是无色液体,沸点32℃,具有类似氯仿旳气 味,微溶于水,易溶于乙醇、 乙醚等有机溶剂。呋喃 能使盐酸浸过旳松木片显绿色,此现象可检验呋喃旳存 在。
噻吩与苯共存于煤焦油中, 噻吩是无色而有特殊 气味旳液体,沸点84℃。噻吩和靛红(吲哚满二酮)在 硫酸作用下呈蓝色,此现象可检验噻吩旳存在。
吡咯存在于煤焦油和骨焦油中,是无色液体,沸点 131℃,有弱旳苯胺旳气味。其蒸气遇盐酸浸湿旳松木 片则呈红色,可检验吡咯旳存在。
(1)制备
+ (C5H8O4)n
H2O
稀 H2SO4 加热
n C5H10O5 戊醛糖
十五章杂环化合物

N原子 sp2杂化
p sp2
H
H
H
O
H 呋喃
H
H
H
S
H 噻吩
p电子数 = 4n+2规则
H
H
H
NH
H 吡咯
• 五个原子含有六个π电子,富电子芳杂环, • 芳香稳定性不如苯环 • 亲电取代反应比苯
3.化学反应
比苯容易发生亲电取代反应 主要进入 α-位 活性:吡咯 > 呋喃 > 噻吩 >> 苯
1)卤代反应:
环状封闭的大π键,π电子数为6,符合4n+2规则 吡啶具有一定的芳香性
2.吡啶的 化学性质 (1)碱性 与质子酸成盐
+ HCl N
吡啶与路易斯酸作用,形成盐
N Cl 或 H 吡啶盐酸盐
HCl N
+ SO3 N
+ CrO3 N
N
( SO 3 )
N-磺酸吡啶
N
(一种温和的非质子性磺化试剂)
SO3
Cl2
O
-40℃
Br2 , 室温
S
AcOH
O Cl + Cl O Cl
S Br
78%
II
I2 , KI 或 HgO
N
IN I
H
H
2)硝化反应:
OO CH3COCCH3
+ HNO3
-5℃以下
O CH3CONO2 + CH3COOH
CH3COO-NO2+
O
-5~ -30℃
CH3COO-NO2+
S
Ac2O , -10℃
O CHO
Ag(NH3)2+
CH3COONa (CH3CO)2O
p sp2
H
H
H
O
H 呋喃
H
H
H
S
H 噻吩
p电子数 = 4n+2规则
H
H
H
NH
H 吡咯
• 五个原子含有六个π电子,富电子芳杂环, • 芳香稳定性不如苯环 • 亲电取代反应比苯
3.化学反应
比苯容易发生亲电取代反应 主要进入 α-位 活性:吡咯 > 呋喃 > 噻吩 >> 苯
1)卤代反应:
环状封闭的大π键,π电子数为6,符合4n+2规则 吡啶具有一定的芳香性
2.吡啶的 化学性质 (1)碱性 与质子酸成盐
+ HCl N
吡啶与路易斯酸作用,形成盐
N Cl 或 H 吡啶盐酸盐
HCl N
+ SO3 N
+ CrO3 N
N
( SO 3 )
N-磺酸吡啶
N
(一种温和的非质子性磺化试剂)
SO3
Cl2
O
-40℃
Br2 , 室温
S
AcOH
O Cl + Cl O Cl
S Br
78%
II
I2 , KI 或 HgO
N
IN I
H
H
2)硝化反应:
OO CH3COCCH3
+ HNO3
-5℃以下
O CH3CONO2 + CH3COOH
CH3COO-NO2+
O
-5~ -30℃
CH3COO-NO2+
S
Ac2O , -10℃
O CHO
Ag(NH3)2+
CH3COONa (CH3CO)2O
杂环化学课件

实例:
五元杂环
4 5
O 1
3β 2α
4 5
S 1
3β 2α
4 5 1N H
3β 2α
呋喃(furan)
噻吩(thiophene)
吡咯(pyrrole)
五元杂环苯并体系
4 5 6 7 O 1 3 2
4 5 6 7 S 1 3 2
4 5 6 7 N H1 3 2
苯并呋喃 (benzofuran)
苯并噻吩 (benzothiophene)
O
δ
Y + S8 + CN
Y Y = -CN, -COR, -CONH2 S NH2
机理:
O + SH C
Y
O
Y
O a)H迁移 b) OH
Y NH
N
S H
N
S
Y H迁移 S NH2
S
H Y NH
-H2O
H
OH
H Y NH
O
H Y NH
S
S
D:Fisselmann反应(与Gewald生成物方位相反)
呋喃、噻吩、吡咯在结构上具有共同点,即构成环的五个原子都为sp2杂化, 故成环的五个原子处在同一平面,杂原子上的孤对电子参与共轭形成共轭体系, 其π电子数符合休克尔规则(π电子数 = 4n+2),所以,它们都具有芳香性。
化学性质 •易发生亲电取代反应:反应活性
N H
•化学稳定性:
>
O
>
S
>
S
N H
N H
Ac2O/AcOH
N H 51 %
NO2 + N H 13 %
b:磺化反应
杂环化合物 PPT

+
N
CH 3
O
(1)N aN H 2
C
(2)H 2O
C 6 H 5 C 2 C O H N C 6 H 5
醇醛缩合型
二、喹啉
1、喹啉得性质
5 6 7
8
4 3 H + 2
N
1
碱性:喹啉 < 吡啶 亲电取代反应:苯(或萘)> 喹啉 > 吡啶
亲核取代反应主要在吡啶环上发生
(1)亲电取代反应
P222 浓浓浓HHN浓N浓HOONHHON33NOO3++3+3浓+浓+浓浓H浓HH2H2SH2S2OS2SOSOO4O4444
一、吡啶
H 1、 吡啶得结构 N
N
子对在 参与 为富
γ 0.87
1 1 γ N .N .4 4 3 30 α α β β .870 1 0 1 ..8 .0 .8 0 4 1 4 1 未Ns p 2参上轨与的电 亲 亲 道电 亲 亲 环孤荷 电 核 上荷 电 内核 电分 取 取 ,共子分 取 布 代 代 取 在轭对布 代 代 环α β 。N 在外, > 位 α β N β γ, > 位 > 位 β γ α
(4)傅克酰基化反应
S SO3H 70%
P206
O O ++A cA 2 cO 2O
B B 3F 3F
O O O O C C H C H 3C
大家有疑问的,可以询问和交流
可以互相讨论下,但要小声点
2、 加成反应
双键特征强弱次序: 苯 < 噻吩 < 吡咯 < 呋喃
(1) 加氢反应
H 2 , Ni or Pd O
有机化学 杂环化合物PPT课件

2021/7/23
第11页/共76页
五元杂环化合物亲电取代反应发生在α-位可用共
振论解释:
+ E+ Z
= Z ( NH、O、S )
+
E ZH
E +Z H
正电荷可在三个原子上离域
E
E
H
H
+
Z
Z
+
正电荷只能在两个原子上离域
E ZH
+
2021/7/23
由此可见,进攻2–位所形成的共振杂化体比进 攻3–位所形成的共振杂化体稳定。
2021/7/23
+ Ac2O
H3PO4
S
+ Ac2O
BF3
O
S COCH3 O COCH3
第17页/共76页
(5) 吡咯的特殊反应 吡咯十分活泼,活性类似于苯胺、苯酚.
H+ + C6H5N2+ClN H
N N=NC6H5 H
+ CHCl3 + KOH N H
2021/7/23
第18页/共76页
CHO N H
环状有机化合物中,成环原子除碳原子外还含有 其他原子,这种环状化合物称为杂环化合物。
2021/7/23
杂环化合物
、
非芳香性杂环化合物, 如: O
N H
内酯、环状酸酐等。
芳香性杂环化合物
本章讨论的是那些环为平面型,环内π电 子数符合4n+2规则,具有一定芳香性的 芳杂环化合物。
第1页/共76页
20.1 杂环化合物的分类与命名
5 - 位被占, 则进入4 - 位, 而不进入2 - 位
第19页/共76页
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
噻吩 噻唑
N
N H
吡咯
N
N H
咪唑
N N H
吡唑
六元杂环
N
吡啶
N
嘧啶
O
吡喃(无芳香性)
苯并杂环
N H
N N N
吲哚
N
喹啉
N
异喹啉
杂环并杂环
嘌呤
N H
二 五元杂环化合物的命名
五元杂环
4 5
O 1
3β 2α
4 5
S 1
3β 2α
4 5 1N H
3β 2α
呋喃(furan)
噻吩(thiophene)
吡咯(pyrrole)
有一个邻对位定位基。
呋喃、噻吩的结构请同学自己分析。
二 呋喃、噻吩、吡咯的反应
1. 呋喃、噻吩、吡咯的亲电取代反应 2. 呋喃、噻吩、吡咯的加成反应
1. 呋喃、噻吩、吡咯的亲电取代反应 (1)概述 *1 亲电取代反应的活性顺序为:
N H
>
O
>
S
>
①电子密度 ②σ-络合物
E N H H
E H
E N H H
(6) 吡咯的特殊反应
吡咯的性质与苯酚类似,都具有酸性,但吡咯的酸性 比苯酚小。吡咯与苯胺也有类似性质。
OH
OH-
O
N H
Na 或 K 或浓NaOH
N K+
pKa =10
pKa≈ 17.5
吡咯成盐后,使环上电荷密度增高,亲电取代反应更易进行。
3. 呋喃、吡咯、噻吩的加成反应
(1) 加氢反应 (2) Diels-Alder反应 呋喃最易发生Diels-Alder反应
吡嗪(pyrazine)
第二节 含有一个杂原子的五元杂环体系 一 呋喃、噻吩、吡咯的结构 二 呋喃、噻吩、吡咯的反应
一 呋喃、噻吩、吡咯的结构
吡 咯 的 结 构
共轭效应是给电子的。 诱导效应是吸电子的。
N H
N
孤电子对在p轨道上。
吡
咯
结构:吡咯N是sp2杂化,孤电子对参与共轭。 反应:碱性较弱,环易发生亲电取代反应,环上相当
吡咯、呋喃不太稳定,所以须用温和的磺化试剂 磺化。常用的温和的非质子的磺化试剂有:吡啶与三 氧化硫的加合化合物。
+ SO3 N
C H2C l2 室温
(固体,含量90 %)
N SO3
噻吩比较稳定,既可以直接磺化(产率稍低), 也可以用温和的磺化试剂磺化。
(4) 呋喃、噻吩、吡咯的卤化反应
反应强烈,易得多卤取代物。为了得一卤代(Cl, Br)产 物,要采用低温、溶剂稀释等温和条件。
5 6 O 1 O 4 3 2
5 6 O 1 4 3 2 O
吡啶(pyridine)
4 5 6 N 1 3 N2
吡喃(pyran)
4 5 6 N 1 N3 2
γ-吡喃酮 (γ-pyrone)
5 6 4 N N 1
α-吡喃酮 (α-pyrone)
3 2
哒嗪(pyridazine)
嘧啶(pyrimidine)
(5) 呋喃、噻吩、吡咯的傅氏酰基化反应
呋喃、噻吩的酰化反应在-C上发生,而吡咯的酰化 反应(不用催化剂)既能在 -C上发生,又能在N上发生。 在 -C上发生比在N上发生容易。
H N E
sp2杂化
N
sp3杂化
碳上酰化,正电荷处在 离域范围内,较稳定。
H E 氮上酰化,正电荷 不处在离域范围内。
1 脂杂环
三元杂环 四元杂环 五元杂环
没有芳香特征的杂环化合物称为脂杂环。
O
O O
(环氧乙烷) (β-丙内酯)
H N
O NH
(氮杂环丙烷) (β-丙内酰胺)
O O O
(顺丁烯二酸酐)
七元杂环
O
(氧杂 )
N H
(1H-氮杂 )
2 芳杂环
五元杂环
具有芳香特征的杂环化合物称为芳杂环
O
N O
呋喃 噁唑
S
N S
E H
E N H H
E H
八隅体结构最稳定
无最稳定结构
吸电子诱导:O(3.5) > N(3.0) > S(2.6) 给电子共轭:N > O > S 综合:N贡献电子最多,O其次,S最少
*2 取代反应主要发生在α-C上;
*3 吡咯、呋喃对酸及氧化剂比较敏感,选择试 剂时需要注意; *4 噻吩、吡咯的芳香性较强,所以易取代而不易 加成;呋喃的芳香性较弱,虽然也能与大多数 亲电试剂发生亲电取代,但在强亲核试剂存在 下,能发生亲核加成。
第十五章 杂环化合物
exit
本章提纲
第一节 杂环化合物的简解和命名 第二节 含一个杂原子的五元杂环体系 第三节 含一个杂原子的六元杂环体系
第一节 杂环化合物的简介和命名 一 杂环化合物简介 二 五元杂环化合物的命名 三 六元杂环化合物的命名
一 杂环化合物的简介
在环上含有杂原子(非碳原子)的有机物称为杂环化合物。
3. 吡啶的亲核取代反应
一般机制:
γ Nu (亲核取代)
-
H N Nu
Z (负氢接受体)
+ ZHN Nu
N
α
*1 亲核取代优先在α位上发生,如果α位上有取代基,则 反应在γ位上发生。
Байду номын сангаас
O O + O O O O O O 90 %
O +
COOCH3 H3C N CH3 + COOCH3
O
76 %
N
Al C l 3
COCH3 CH3 COOCH3
COCH3
H3C COOCH3
A l C3l
O N H C C H3 H3C COOCH COOCH
3 3
CH3
噻吩基本上不发生双烯加成,即使在个别情况下生成也 是一个不稳定的中间体,直接失硫转化为别的产物。
H3C
S
CH3 + NC-C
C-CN
60 - 120℃
S
CH3 CN
-S
CH3 CN CN
H3C CN CH3
第三节 含有一个杂原子的六元杂环体系
一 吡啶环系
1. 吡啶的结构
2. 吡啶的亲电取代反应 3. 吡啶的亲核取代反应
1. 吡啶的结构
孤电子对 在sp2杂 化轨道上。
N
=2.20D
N H
=1.17D
Br N 66 %
N
300 C,1d
o
6%
N
NO2
浓 H2SO4,KNO3
Br2,浮石
H3C
N
CH3
100 C
o
H3C
N 66 %
CH3
N
300 C
o
反 应 特 点
*1 不能发生傅氏烷基化、酰基化反应。 *2 硝化、磺化、卤化必须在强烈条件下才能发生; *3 吡啶环上有给电子基团时,反应活性增高; *4 吡啶N可以看作是一个间位定位基。
+ N CH3 I
-
N
+
CH3I
COR RCOCl 石油醚
N H
H+
NO2+BF4+ 乙醚 室温
+
Br2 CCl4
+ N Br Br -
N
SO3
+ N NO2 BF4-
+ N SO3-
(2) 在C上发生亲电取代反应
浓HNO3,H2SO4
NO2 N
浓 H2SO4,HgSO4 220 C
o
SO3H N 70 %
五元杂环苯并体系
4 5 6 7 O 1 3 2 5 6 7 S 1 4 3 2
4 5 6 7 N H1 3 2
苯并呋喃 (benzofuran)
苯并噻吩 (benzothiophene)
苯并吡咯 吲哚 (indole)
三 六元杂环化合物的命名
六元杂环
γ 4 5 6 N 1 3β 2α 5 6 O 1 γ 4 3β 2α
离域能:噻吩:121.3 kJ· -1 mol 呋喃:66.9 kJ· -1 mol
吡咯:87.8 kJ· -1 mol
(2) 呋喃、噻吩、吡咯的硝化反应
呋喃, 噻吩和吡咯易氧化, 一般不用硝酸直接硝化; 通常用比较温和的非质子硝化试剂,如:硝酸乙酰酯。
反应在低温下进行。
(3) 呋喃、噻吩、吡咯的磺化反应
共轭效应和诱导效应都是吸电子的
吡 啶 结构:吡啶N是sp2杂化,孤电子对不参与共轭。 反应:碱性较强。环不易发生亲电取代反应但易发生亲核 取代反应。发生亲电取代反应时,环上N起间位定 位基的作用。发生亲核取代反应时,环上N起邻对 位定位基的作用。
2. 吡啶的亲电取代反应
(1) 亲电试剂与吡啶N的反应
