实验室条件下蓝藻结皮对低温光照胁迫的响应与微结构变化_饶本强
螺旋藻对增强的UV-B胁迫的响应

( . 州交 通 大 学 化 学 与 生 物 工 程 学 院 , 1兰 兰州 707 ; 30 0
2 兰 州 大 学 生命 科 学 学 院 , 旱 农 业 教 育 部 重 点实 验 室 , 州 . 干 兰
700 ; . 西学 院 , 液 300 3 河 张
关 键 词 :U — VB胁 迫 ; 藻 ; 长 发 育 ; A; 性 氧 蓝 生 MD 活
中 图分 类 号 : 9 9 Q 4 文 献 标 识 码 : A 文 章 编 号 :0 03 0 ( 0 7 0 .2 1 7 10 —2 7 2 0 ) 20 0 — 0
2 0世纪 以来 , 由于氯 、 、 等 的大量 使 用 , 氟 烃 导致
作 为生 物 有 机体 重 要 组成 部 分 的蛋 白质 , 其最 大 吸收波 长正 好处 在 u . v B辐 射 波长 范 围 内 , 因此 , 蛋 白质本 身 会 受 到 u . V B辐 射 的 影 响 , 而许 多 重 要 的酶 对 u — v B更 加 敏感 。有关 增 强 u . v B胁 迫 对 蓝
增 加 , 可 能 是 螺 旋 藻 对 逆 境 胁 迫 的 一 种适 应性 反 应 。增 强 u — 这 V B胁 迫下 , 旋 藻 细 胞 内 MD 螺 A含 量 增 加 , 之 相 对 与
应 , 性 氧 的 产 生 速 率 也 增加 , 一 步 证 实 了 逆 境 胁 迫 下 , 物 细 胞 内 叶绿 素 含 量 的 下 降 、 A 的积 累 主 要 与 u — 活 进 植 MD VB 胁 迫 下 活 性 氧 的产 生 及 其 对 细 胞 的 氧 化 损 伤 有 关 。
的深度 , 可见 光 甚 至可 以穿入 水 下 1m 的深 处 。生 2 长发 育被认 为是 一种 重要 的生 理指标 可 以帮助人 们
煤沥青基功能碳材料的研究现状及前景

CHEMICAL INDUSTRY AND ENGINEERING PROGRESS 2016年第35卷第6期·1804·化 工 进 展煤沥青基功能碳材料的研究现状及前景肖南,邱介山(大连理工大学精细化工国家重点实验室暨能源材料化工辽宁省重点实验室,辽宁 大连116024) 摘要:我国煤沥青资源丰富,但深加工技术落后,产品附加值低,实现煤沥青高附加值利用是亟待解决的重大课题。
本文介绍了以煤沥青为原料合成高性能功能碳材料的主要技术,重点阐述了以煤沥青为原料制备中间相沥青、多孔碳材料、碳纤维、二维纳米碳材料及碳基复合材料的研究进展。
分析表明,高芳香性和高缩合度分子结构所引起的强π-π相互作用是阻碍煤沥青基高性能功能碳材料设计合成的瓶颈问题。
通过催化聚合、氧化、共热解等技术手段可有效改善煤沥青分子结构及其物理、化学性质。
结合模板复制、物理/化学活化、界面诱导以及催化石墨化等技术可实现多种功能性碳材料结构设计与表面化学性质调控。
发展煤沥青分子结构调控新技术作为改善煤沥青基碳材料性能的重要策略,需要系统深入研究。
关键词:煤沥青;碳材料;合成;电化学中图分类号:TQ 522.6 文献标志码:A 文章编号:1000–6613(2016)06–1804–08 DOI :10.16085/j.issn.1000-6613.2016.06.021Progress in synthesis and applications of functional carbon materials fromcoal tar pitchXIAO Nan ,QIU Jieshan(State Key Laboratory of Fine Chemicals ,Liaoning Key Laboratory for Energy Materials and Chemical Engineering ,Dalian University of Technology ,Dalian 116024,Liaoning ,China )Abstract: Coal tar pitch is abundant as a byproduct of coke production in iron-steel industry in China. However ,the traditional methods cannot efficiently convert coal tar pitch into value-added products and how to make effective use of coal tar pitch remains a big challenge. This review has summarized several techniques for further processing of coal tar pitch ,with a focus on the synthesis and applications of high performance functional materials including mesophase pitch, porous carbons ,carbon fibers ,two dimensional nano-sized carbon materials and carbon based composites. This review highlights that the strong π-π interactions between highly condensed polycyclic aromatic molecules in coal tar pitch is the bottle-neck that hinders the efficient conversion of coal tar pitch into functional carbon materials with tuned structure and properties. The molecular structure and properties of coal tar pitch can be improved through catalytic condensation ,oxidization or co -pyrolysis. With coal tar pitch as precursor ,methods including templating, physical/chemical activation, surface induction and catalytic graphitization have been developed for the controlled synthesis of high performance carbon materials. Novel methods that can tune the molecular structure of coal tar pitch are highly demanded to improve the performance of coal tar pitch based carbon materials and related researches should be intensified.及性能研究。
低温对结球白菜抗氧化系统的影响

低温对结球白菜抗氧化系统的影响周秋菊;彭剑涛;赵大芹;李桂莲【摘要】为了研究零上低温冷诱导和自然低温胁迫对结球白菜活性氧清除系统的影响,本试验以黔白5号、津青50和金黔小将等3个具有不同抽薹特性的结球白菜品种为材料,分别测定低温处理后叶片SOD、POD和CAT活性以及抗坏血酸和丙二醛含量.结果表明,低温下耐抽薹品种黔白5号叶片抗坏血酸含量以及SOD、POD、CAT活性值均高于其他2个品种,膜脂过氧化产物MDA含量则最低,表明其在低温胁迫下具有较强的活性氧清除能力,表现出更好的低温逆境适应性.【期刊名称】《山地农业生物学报》【年(卷),期】2014(033)003【总页数】4页(P5-7,77)【关键词】冷诱导;活性氧清除系统;抗冻性;抽薹特性;低温胁迫【作者】周秋菊;彭剑涛;赵大芹;李桂莲【作者单位】贵州大学生命科学学院,贵州贵阳550025;贵州大学生命科学学院,贵州贵阳550025;贵州省园艺研究所,贵州贵阳550006;贵州省农业科学院,贵州贵阳550006【正文语种】中文【中图分类】Q945.78植物为抵抗低温环境,在生长习性、生理生化、遗传表达等方面会形成各种特殊的适应特性,包括活性氧清除能力的提高、渗透调节物质积累以及膜脂组分的改变,等等[1-2]。
结球白菜(Brassica campestris L.ssp.pekinensis)是我国原产蔬菜,栽培历史悠久,品种资源丰富,在蔬菜生产中占有重要地位[3]。
大白菜越冬和早春生产过程中经常遭遇低温危害,影响其生长、光合、碳氮代谢、酶活性以及干物质的积累。
低温胁迫可导致植物细胞内活性氧伤害,进而引起膜脂过氧化以及正常代谢受阻。
因而,植物的抗寒性与其抗氧化能力密切相关[1]。
本文通过研究零上低温冷诱导和零下自然低温胁迫条件对不同抽薹特性结球白菜品种活性氧清除系统的影响,探讨抗氧化系统在结球白菜抗寒性获得中的作用,为抗逆生理育种以及冬、春蔬菜栽培提供一定的依据。
铜绿微囊藻在光限制胁迫下的超补偿生长响应

迫后初期增大了 23.71%,分别是对照组和处理组
光 胁 迫 前 的 97.39% 和 96.79%。 Manodharan
在解除光限制胁迫后,处理组藻细胞密度出现 大幅增加,培养至第 10天时的藻细胞密度为胁迫后 初始接种密度的 3.3倍,而对照组的藻细胞密度变 化不大(图 2b)。处理组藻解除胁迫后生长与对照 组比较,表现出显著差异(P<0.05)。 2.3 生长参数的变化 2.3.1 相对生长率 铜绿微囊藻在光限制胁迫培 养过程中,处 理 组 平 均 相 对 生 长 率 低 于 对 照 组 (图 3a),且为负值,这与处理组在光限制胁迫过程中藻 细胞密度下降相对应。在解除胁迫条件后,处理组 的相对生长率均大于各对照组相对生长率(图 3b), 且处 理 组 在 整 个 恢 复 阶 段 平 均 相 对 生 长 率 (01187)为对照组(00034)的 34.6倍,差异极显 著(P<0.01)。但随着培养时间的推移,处理组与 对照组 2组间平均细胞相对生长率的差异逐渐减 小。到了培养 后 期,2组 的 平 均 细 胞 相 对 生 长 率 趋 于接近。
光照是影响藻类生长繁殖的重要生态因子之 一,也是其生长的主要能量来源,在一定 pH、温度和 营养条件下,光照影响着光合作用产物的合成,从而 影响藻类的生长繁殖和密度(孙儒泳等,1993)。研 究表明,微小原甲藻(Prorocernturm minimum)(Ma noharanetal,1999)、蛋 白 核 小 球 藻 (Chlorellapyre noidosa)(刘宁宁和段舜山,2002)、四裂藻(Tetrasel mistetrethele)(郭 羽 丰 等,2004)、眼 点 拟 微 绿 球 藻 (Nannochloropsisocutala)(张珍萍等,2005)和三角 褐 指 藻 (Phaeodactylum tricornutum)(Caietal,
具鞘微鞘藻对干旱胁迫的响应机理

具鞘微鞘藻对干旱胁迫的响应机理通过接种丝状固沙蓝藻,在荒漠地区构建人工蓝藻结皮是我国率先采用的一种新型荒漠化防治方法。
干旱是接种后蓝藻面临的最严苛的环境胁迫因子,不仅会对藻体造成各种损伤,影响藻种存活率,还会影响人工结皮的形成及发育演替速率。
蓝藻及蓝藻结皮对荒漠逆境适应机理的研究,不仅是整个工程的理论基础,同时也是后期制定维护方案的重要依据。
本研究从野外荒漠地区自然结皮中分离纯化一株优势丝状蓝藻,对其进行形态及分子学鉴定,并以该藻为研究对象,模拟干旱条件,研究干旱时间及干旱重吸水对蓝藻生理生化的影响,主要研究结果如下:(1)利用平板培养法,经过多次转接,从内蒙古达拉特旗实验区自然结皮中分离得到一株荒漠蓝藻。
显微镜下观察显示,藻体呈蓝绿色,丝状,藻丝外有一层透明胶鞘,在藻丝端部有帽状体。
该藻在野外结皮样品中呈束状生长,藻丝束外部具有公共胶被,然而将该藻分离纯化并室内液体培养后,该公共胶被消失。
16S rDNA基因序列同源性分析结果表明,该藻与具鞘微鞘藻(Microcoleus Vaginatus)的同源性最高。
通过形态学鉴定及分子鉴定结果的综合分析,确定该藻为具鞘微鞘藻。
(2)对具鞘微鞘藻进行不同干旱时间处理,结果发现,干旱6天对具鞘微鞘藻生理生化活性无明显影响;干旱10天藻体开始出现轻微损伤,MDA含量显著增加。
干旱处理6天、10天的具鞘微鞘藻在重吸水后,其光合活性可以恢复到接近刚接种状态。
长期干旱(20天、24天)会对藻体造成不可逆损伤,生物量明显下降,Yield、Fv/Fm显著降低,MDA含量持续增加,呼吸作用略有下降,类胡萝卜素含量增加。
该研究结果说明,在接种后10天内予以适量补水,有利于提高蓝藻成活率。
(3)将液体培养的具鞘微鞘藻接种于流沙,构建室内人工蓝藻结皮。
对人工蓝藻结皮干旱处理1天后,结皮胞外多糖含量明显增加;完全干燥时,结皮蓝藻代谢活动停止,结皮生物量及胞外多糖含量保持在一个相对稳定水平。
2010—2021_年巢湖蓝藻水华暴发的动态变化规律及驱动因素分析

2010 2021年巢湖蓝藻水华暴发的动态变化规律及驱动因素分析高芮,陈希子,钱圆,钱华㊀(安徽省巢湖管理局湖泊生态环境研究院,安徽合肥238000)摘要㊀为了解巢湖蓝藻水华暴发的动态变化规律及其影响因素,基于2010 2021年巢湖水华暴发面积㊁频次㊁藻密度及叶绿体a含量,分析了巢湖近10年蓝藻水华暴发的动态变化规律㊂结果表明,巢湖蓝藻在每年4 9月增殖较快,巢湖蓝藻水华暴发面积在2010 2018年呈上升趋势,2018年达434km2,为巢湖蓝藻水华暴发的拐点,此后水华面积下降㊂2017 2021年巢湖藻密度稳中有降,水华面积呈下降趋势,但水华暴发频次未见减少㊂基于近10年巢湖营养盐浓度㊁气温㊁水位㊁降雨量㊁日照时数数据与蓝藻水华暴发面积的相关分析表明,氮㊁磷营养盐是诱发巢湖藻类增殖的主要原因,气温㊁降雨量㊁日照时数㊁水位等气象水文因子为巢湖蓝藻水华暴发的驱动因素㊂关键词㊀巢湖;蓝藻水华;动态变化;驱动因素中图分类号㊀X524㊀㊀文献标识码㊀A㊀㊀文章编号㊀0517-6611(2023)18-0069-05doi:10.3969/j.issn.0517-6611.2023.18.016㊀㊀㊀㊀㊀开放科学(资源服务)标识码(OSID):AnalysistoDynamicchangesandDrivingFactorsofCyanobacteriaBloomsinChaohuLakefrom2012to2021GAORui,CHENXi⁃zi,QIANYuanetal㊀(LakeEcologicalEnvironmentResearchInstituteofAnhuiChaohuManagementBureau,Hefei,Anhui238000)Abstract㊀TofindoutthedynamicchangesandinfluencingfactorsofcyanobacteriabloomsinChaohuLake,thedynamicchangesofcyanobac⁃teriabloomsinChaohuLakeinthepast10yearswereanalyzedbasedonthewaterbloomarea,frequency,algaldensity,andchloroplastcontenfrom2010to2021.TheresultsshowedthatcyanobacteriabloomsinChaohuLakeproliferatefasterfromApriltoSeptembereachyear,andtheareacyanobacteriabloomsshowedanupwardtrendfrom2010to2018,withatotalareaof434km2in2018,asaturningpointoftheoutbreakofcyanobacteriabloomsinChaohuLake.Followed,theareaofthebloomshasdecreased.From2017to2021,thedensityofalgaesteadilyde⁃creased,andtheareaofalgaehasshownadownwardtrend,butthefrequencyofcyanobacteriabloomsoutbreakshasnotdecreased.Basedonthecorrelationanalysisbetweennutrientconcentration,temperature,waterlevel,rainfall,sunshinehoursdatainthepast10yearsandtheout⁃breakareaofcyanobacteriablooms.TheresultshownedthatnitrogenandphosphorusnutrientsarethemaincausesofcyanobacteriabloomsinChaohuLake,andmeteorologicalandhydrologicalfactorssuchastemperature,rainfall,sunshinehours,andwaterlevelarethedrivingfactorsfortheoutbreakofcyanobacteriabloomsinChaohuLake.Keywords㊀ChaohuLake;Cyanobacteriablooms;Dynamicchanges;Drivingfactors基金项目㊀国家自然科学基金面上项目(52070063)㊂作者简介㊀高芮(1984 ),男,安徽庐江人,高级工程师,硕士,从事流域水环境治理和湖泊蓝藻水华防控研究㊂收稿日期㊀2023-05-30㊀㊀蓝藻是淡水湖泊中较常见的浮游植物种类,在适宜的气象条件和营养盐浓度下,就会暴发性地生长,形成蓝藻水华[1]㊂蓝藻水华导致水质恶化,继而破坏湖泊生态系统结构,引起水生态系统功能退化,造成严重的生态环境风险或直接的环境污染[2-3]㊂因此,掌握巢湖蓝藻水华的动态变化特征,对控制水华及建立预警机制㊁评价蓝藻生态环境风险㊁研究蓝藻水华暴发的原因非常重要㊂巢湖蓝藻水华历史悠久,可以追溯到19世纪末㊂据生长在巢湖周边群众反映,当地人沿巢湖一带每年捞取数百万担蓝藻作为农田肥料,称之为 巢湖之宝,禾苗之父 [4]㊂随着湖泊营养盐的累积,巢湖蓝藻水华自20世纪80年代逐渐加剧,至20世纪90年代初期,进入到蓝藻水华历史上的高峰期;自2005年,大规模水华发生的频度由原先集中在6月,发展至目前1 11月均有发生;从暴发范围上,从原先主要集中于西半湖,发展至目前扩延到东半湖龟山一带的全湖性水华暴发[5]㊂蓝藻水华的发生使得巢湖的生态服务功能和价值减弱,制约了区域社会经济可持续发展,因此有必要开展巢湖蓝藻水华近年来的动态变化特征研究㊂蓝藻水华暴发是湖泊受物理㊁化学㊁生物等因素综合影响的结果㊂一方面为内在因素,如较高的湖泊富营养化状态是蓝藻水华发生的根本原因,包括藻类生长需要的营养物质㊁藻类自身的生理结构[6]㊂另外一方面为外在因素,如在营养盐充足的情况下,环境因素对蓝藻水华的暴发和扩散起到重要作用[6-8],如风速㊁温度㊁降水等气象条件对蓝藻水华暴发有不容忽视的影响[9-10]㊂因此,有必要开展巢湖蓝藻水华暴发的驱动力因素研究,可结合风力㊁降雨㊁温度等环境条件,来提前预测巢湖蓝藻水华暴发现象,便于采取相关对策㊂该研究对2010 2022年巢湖蓝藻水华的时空变化特征进行分析,并进一步探究巢湖蓝藻水华暴发与气象因素间的响应关系,为巢湖蓝藻水华的预测预警及控制提供参考㊂1㊀材料与方法1.1㊀数据来源㊀为保证长序列数据分析的科学性和代表性,蓝藻水华监测数据采用2010 2021年安徽省巢湖管理局环境保护监测站对巢湖湖区的蓝藻应急监测数据,如藻密度均值㊁叶绿素a浓度均值㊁pH㊁DO㊁CODMn㊁氨氮㊁总磷㊁总氮;采用生态环境部卫星环境应用中心‘巢湖水华遥感监测日报“数据来统计2010 2021年巢湖蓝藻水华暴发频次㊁累积面积;累积气温㊁日降雨量及日照时数等气象数据采用巢湖湖区航标气象站自动监测数据;水文数据水位采用巢湖中庙水文站自动监测数据㊂所有自动监测数据经人工清洗后使用㊂1.2㊀分析方法㊀采用Origin2023软件对试验数据处理分析及作图;使用SPSS软件进行藻类指标与营养盐指标的Person相关性分析;使用Excel进行Chla与TN的相关性作图㊂安徽农业科学,J.AnhuiAgric.Sci.2023,51(18):69-73㊀㊀㊀2㊀结果与分析2.1㊀2010 2021年藻类密度㊁叶绿色a浓度的年际㊁月度变化特征㊀图1(a)显示,2010 2021年巢湖藻密度均值在277 1049万个/L,最大值出现在2015年,最小值出现在2021年㊂从总体趋势来看,巢湖蓝藻水华程度呈现先上升后下降趋势,峰值出现在2015年;2017 2021年巢湖藻密度稳中有降,水华程度有所好转㊂图1(b)统计2010 2021年巢湖蓝藻应急监测期间各月的藻密度及叶绿素a均值可以发现,藻密度和叶绿素均呈先上升后下降的变化过程,其中叶绿素在6月份相对较高,藻密度在8月份相对较高㊂根据蓝藻生长阶段理论,4月㊁5月是蓝藻开始复苏生长的季节,4 8月藻类生物量不断累积,至8月份藻类生物量达到极值,9月开始藻类进入消亡期,藻类生物量逐渐降低[5,11],可知该研究结果是符合蓝藻生长阶段理论的㊂图1㊀2010 2021年巢湖蓝藻水华藻密度年际变化(a)与藻类密度㊁叶绿素a年际月均变化(b)Fig.1㊀Interannualvariationofalgaldensityincyanobacteriabloom(a)andinterannualandmonthlychangesinalgaldensityandchloro⁃phylla(b)inChaohuLakefrom2010to20212.2㊀2010 2021年巢湖水华暴发频次㊁累积面积变化特征㊀由生态环境部卫星环境应用中心的水华遥感监测数据可知,巢湖蓝藻水华出现的次数与累积面积呈较大幅度波动,其中2011㊁2021年出现的次数较少,2011㊁2013年累积面积较小[12]㊂图2㊀2010 2021年巢湖蓝藻水华年际累积暴发面积㊁次数(a)与最大㊁平均暴发面积线性拟合(b)Fig.2㊀Interannualchangesinareaandfrequencyofaccumulatedoutbreakofcyanobacteriablooms(a)andlinearfittingofmaximumandav⁃erageoutbreakareas(b)inChaohuLakefrom2010to2021㊀㊀自2010年以来,巢湖蓝藻水华发生的最大面积呈逐渐增加趋势㊂2018年发生近10年来最大面积水华,水华发生面积达到434km2,其次是2015年,最大水华发生面积为322km2(图2)㊂从2010 2021年的蓝藻水华规模统计结果来看,2018年是蓝藻水华最严重的年份,蓝藻水华暴发次数㊁最大暴发面积㊁累积暴发面积㊁平均暴发面积均出现在该年;2011年是蓝藻水华情况较好的年份,其中水华暴发次数㊁累积暴发面积均最小,最大暴发面积和平均暴发面积相对较小㊂总体来看,巢湖水华发生规模呈上升趋势,分阶段来看,2018年是巢湖蓝藻水华暴发的拐点,近年来总体规模呈下降趋势,但暴发频次未见减少[13]㊂2.3㊀巢湖蓝藻水华驱动因素分析2.3.1㊀营养盐㊂从2010 2021年叶绿素a与各营养盐指标的多年月均变化情况分析可知(图3),氨氮和总氮从5月份开始呈下降趋势,10月份开始呈上升趋势,与叶绿素变化趋势相反,藻类的生长需要吸收水体中的营养盐物质,形成一种生物富集效应[11],因而除了随气温升高,水体生物脱氮和水体反硝化脱氮能力增强外,藻类的生长同样会影响水体中营养盐的含量,藻类生长导致水体中含氮营养盐浓度降低[12]㊂与水体中总氮及氨氮含量变化趋势不同,高锰酸盐指数和总磷从5月份开始呈上升趋势,10月份开始呈下降趋势,与叶绿素变化趋势相同[14]㊂巢湖为浅水湖泊,水体随风浪影响扰动大,理化条件的改变会很容易传导至巢湖底质上07㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀安徽农业科学㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀2023年图3㊀巢湖营养盐月均变化Fig.3㊀MonthlyaveragechangesinnutrientssaltsinChaohuLake覆水[13]㊂由于上覆水pH升高以及水体中总磷的生物富集,使得水体对底泥中的磷存在一种 泵吸作用 ,即底泥中磷的释放,导致水体总磷浓度上升[15]㊂㊀㊀表1 3分别采用2008年至2021年6月巢湖东西半湖及全湖的区域均值㊁各点位单次监测值㊁水温25ħ以上的单次监测值,用Person相关性分析方法,来判别藻类生长与各环境因子之间的相互关系㊂分析表明,水体中pH㊁DO与叶绿素a和藻密度呈显著正相关,说明藻类生长过程中藻类光合作用有利于水体中溶解氧的恢复,pH也随之上升[14]㊂叶绿素a与水体中CODMn㊁藻密度呈显著相关性,说明水体中CODMn主要来源于藻类生长产生的有机质㊂表1㊀巢湖藻类指标与营养盐指标区域均值矩阵Table1㊀CorrelationmatrixbetweenalgaeindexesandnutrientindexesinChaohuLake指标IndexpHDOCODMn氨氮NH3⁃N总磷TP总氮TN叶绿素aChlaDO0.674∗CODMn0.291∗0.299∗氨氮NH3⁃N-0.294∗-0.237∗0.103∗总磷TP0.091∗0.0410.333∗0.438∗总氮TN-0.170∗-0.080∗0.168∗0.636∗0.471∗叶绿素aChla0.105∗0.155∗0.276∗0.263∗0.297∗0.251∗藻类密度Algaldensity0.320∗0.345∗0.372∗0.0160.203∗0.101∗0.515∗㊀注:∗表示在0.05水平相关性显著;n=910㊂㊀Note:∗indicatesasignificantcorrelationatthe0.05level;n=910.表2㊀巢湖藻类指标与营养盐指标单次监测结果矩阵Table2㊀CorrelationmatrixofsinglemonitoringresultsofalgaeandnutrientindicesinChaohuLake指标IndexpHDOCODMn氨氮NH3⁃N总磷TP总氮TN叶绿素aChlaDO0.600∗CODMn0.236∗0.212∗氨氮NH3⁃N-0.220∗-0.172∗0.191∗总磷TP0.090∗-0.0080.426∗0.430∗总氮TN-0.181∗-0.081∗0.222∗0.700∗0.410∗叶绿素aChla0.144∗0.136∗0.340∗0.142∗0.272∗0.155∗藻类密度Algaldensity0.297∗0.321∗0.343∗0.0170.188∗0.063∗0.565∗㊀注:∗表示在0.05水平相关性显著;n=7055㊂㊀Note:∗indicatesasignificantcorrelationatthe0.05level;n=7055.表3㊀巢湖藻类指标与营养盐指标单次监测结果矩阵(水温>25ħ)Table3㊀CorrelationmatrixofsinglemonitoringresultsofalgaeindicesandnutrientindicesinChaohuLake(watertemperature>25ħ)指标IndexpHDOCODMn氨氮NH3⁃N总磷TP总氮TN叶绿素aChlaDO0.660∗CODMn0.247∗0.280∗氨氮NH3⁃N-0.177∗-0.135∗0.187∗总磷TP0.102∗0.070∗0.413∗0.452∗总氮TN-0.111∗-0.034∗0.253∗0.620∗0.477∗叶绿素aChla0.143∗0.174∗0.350∗0.170∗0.272∗0.198∗藻类密度Algaldensity0.289∗0.354∗0.337∗0.0260.179∗0.104∗0.567∗㊀注:∗表示在0.05水平相关性显著;n=4294㊂㊀Note:∗indicatesasignificantcorrelationatthe0.05level;n=4294.㊀㊀进一步筛选数据,选取水温>25ħ㊁藻密度>200万个/L时各指标监测值,取对数分析,结果见图4㊂ln(Chla)与ln(TN)㊁ln(TP)的正相关性表明了氮㊁磷营养盐是诱发藻类增殖的主要原因㊂2.3.2㊀气象因素㊂对巢湖气象数据进行分析,发现2010 2021年水华发生时对应的气温往往高于13ħ㊂将气温超过13ħ日均气温累加,作为适于巢湖蓝藻水华发生的活动积温,可以看出巢湖年累积气温和高于13ħ气温的年出现天1751卷18期㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀高芮等㊀2010—2021年巢湖蓝藻水华暴发的动态变化规律及驱动因素分析数均呈显著增长趋势(图5),这与前文分析的蓝藻水华规模总体趋势一致,表明巢湖蓝藻水华发生面积增大可能受全球气候变暖的影响[16]㊂图4㊀ln(Chla)与ln(TN)㊁ln(TP)的相关性Fig.4㊀Positivecorrelationbetweenln(Chla),ln(TN)andln(TP)图5㊀2010 2021年巢湖站高于13ħ的累积气温及高于13ħ出现天数Fig.5㊀Thecumulativetemperatureabove13ħandthenumberofdaysabove13ħinChaohuStationfrom2010to2021㊀㊀将2010年以来巢湖每年最大面积水华发生时间的前半个月的日降雨量及日照时数进行分析发现,最大面积水华发生前半个月基本均有集中降雨或暴雨事件(图6),推测可能是集中降雨造成的污染物集中入湖导致藻类的大量繁殖从而形成水华;另外还存在大面积水华发生前半个月无集中降雨或暴雨情况,但由图6可知,该种情况下水华发生前半个月基本都对应长时间的日照,适宜的光照条件加上适宜的温度也非常有利于蓝藻水华的形成[17]㊂图6㊀2010 2021年巢湖最大面积水华发生前半个月对应的日降雨量及日照时数变化Fig.6㊀ChangeofdailyrainfallandsunshinedurationcorrespondingtothefirsthalfmonthofthelargestareaofcyanobacteriabloomsinCha⁃ohuLakefrom2010to20212.3.3㊀水文㊂除气象㊁水质因素外,影响蓝藻水华发生强度及空间分布的还包括水位过程㊁湖泊换水周期等[18]㊂2010 2021年,巢湖最高水位为13.43m,发生在2020年7月22日,最低水位为8.13m,发生在2017年2月21日,二者相差5.30m,水位变幅较大(图7)㊂对比历年蓝藻水华面积可以发现,每年水位峰值过后,都会出现较为密集的蓝藻水华现象㊂这主要是因为水位峰值一般出现在汛期,持续降雨导致大量外源污染物汇入,加之持续高温,在静风条件下蓝藻水华极易暴发[19]㊂27㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀安徽农业科学㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀2023年图7㊀巢湖水位变化情况Fig.7㊀VariationofwaterlevelintheupperreachesofChaohuSluice3㊀结论与展望(1)2010 2018年,巢湖蓝藻水华发生规模总体呈上升趋势㊂但是,2018年是巢湖蓝藻水华暴发的拐点,2018年巢湖水华发生面积达到434km2,此后水华面积下降㊂2017 2021年巢湖藻密度稳中有降,水华面积呈下降趋势,但水华暴发频次未见减少㊂巢湖蓝藻在每年4 9月增殖较快㊂(2)Person分析表明叶绿素a㊁藻密度与巢湖高锰酸盐指数㊁总磷㊁氨氮㊁总氮浓度显著相关㊂在水温>25ħ㊁藻密度>200万个/L条件下,2010 2021年Chla浓度对数值与TN㊁TP浓度对数值呈正相关性,表明氮㊁磷营养盐是诱发巢湖藻类增殖的主要原因㊂(3)2010 2021年巢湖水华发生时,大气气温在13ħ以上㊂巢湖年累积气温㊁气温高于13ħ的年天数㊁水华发生前半个月的降雨量㊁年日照时数㊁水位变化趋势与巢湖蓝藻水华面积动态变化趋势一致,表明气温㊁降雨量㊁日照时数㊁水位均与巢湖蓝藻水华暴发有关㊂结合巢湖水体营养盐浓度,温度㊁降雨㊁水位等条件,可提前对巢湖局部水体区域的水华暴发趋势进行预测,便于巢湖环境管理部门采取相关对策与应急措施,减轻水华危害,这对巢湖水污染防治及周边生态平衡保护具有积极作用㊂参考文献[1]徐颢溪.巢湖蓝藻水华现象诱因及其治理措施[J].滁州学院学报,2020,22(2):6-9.[2]胡旻琪,张玉超,马荣华,等.巢湖2016年蓝藻水华时空分布及环境驱动力分析[J].环境科学,2018,39(11):4925-4937.[3]苟婷,马千里,王振兴,等.龟石水库夏季富营养化状况与蓝藻水华暴发特征[J].环境科学,2017,38(10):4141-4150.[4]土壤农化教研组,陆艾五.巢湖湖靛的调查研究初报[J].安徽农学院学报,1959(2):91-99.[5]孔繁翔,高光.大型浅水富营养化湖泊中蓝藻水华形成机理的思考[J].生态学报,2005,25(3):589-595.[6]蒋晨韵,唐晓先,王璨,等.气象因子对巢湖水源地蓝藻水华暴发的影响[J].江苏农业科学,2019,47(10):281-286.[7]吴珺,李浩,曹德菊,等.巢湖东半湖蓝藻水华暴发时空动态及成因[J].农业环境科学学报,2013,32(10):2035-2041.[8]于洋,彭福利,孙聪,等.典型湖泊水华特征及相关影响因素分析[J].中国环境监测,2017,33(2):88-94.[9]李加龙,罗纯良,吕恒,等.2002 2018年滇池外海蓝藻水华暴发时空变化特征及其驱动因子[J].生态学报,2023,43(2):878-891..[10]范裕祥,金社军,周培,等.巢湖蓝藻水华分布特征和气象条件分析[J].安徽农业科学,2015,43(4):191-193,198.[11]PETTERSSONK,HERLITZE,ISTVÁNOVICSV.TheroleofGloeotrichiaechinulatainthetransferofphosphorusfromsedimentstowaterinLakeErken[J].Hydrobiologia,1993,253(1):123-129.[12]黄钰铃,陈明曦,刘德富,等.不同氮磷营养及光温条件对蓝藻水华生消的影响[J].西北农林科技大学学报(自然科学版),2008,36(9):93-100.[13]朱广伟,秦伯强,高光.风浪扰动引起大型浅水湖泊内源磷暴发性释放的直接证据[J].科学通报,2005,50(1):66-71.[14]许海,刘兆普,袁兰,等.pH对几种淡水藻类生长的影响[J].环境科学与技术,2009,32(1):27-30.[15]张曼,殷鹏,支鸣强,等.太湖藻型及草型湖区底泥内源污染及释放机制研究[J].环境科学学报,2023,43(6):247-257,.[16]杨东方,陈生涛,胡均,等.光照㊁水温和营养盐对浮游植物生长重要影响大小的顺序[J].海洋环境科学,2007,26(3):201-207.[17]HULL,SHANK,HUANGLC,etal.Environmentalfactorsassociatedwithcyanobacterialassemblagesinamesotrophicsubtropicalplateaulake:Afocusonbloomtoxicity[J].Scienceofthetotalenvironment,2021,777:1-13.[18]高芮,唐晓先,蒋晨韵.引江济巢对巢湖水质及蓝藻水华的影响分析[J].水资源开发与管理,2018,16(6):54-57.[19]JONESID,ELLIOTTJA.Modellingtheeffectsofchangingretentiontimeonabundanceandcompositionofphytoplanktonspeciesinasmalllake[J].Freshwaterbiology,2007,52(6):988-997.3751卷18期㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀高芮等㊀2010—2021年巢湖蓝藻水华暴发的动态变化规律及驱动因素分析。
衣藻对盐胁迫下小麦幼苗生长和生理指标的影响研究

㊀㊀2024年第65卷第3期497收稿日期:2023-02-17基金项目:甘肃省科技计划(甘科技 2021 12号18JR2JG001)作者简介:王彦钦(1998 ),硕士,主要从事藻类生物肥料的研究,E-mail:765663632@㊂通信作者:孟宪刚(1974 ),教授,博士,主要从事工业微生物以及环境生物工程等研究工作,E-mail:mengxg@㊂文献著录格式:王彦钦,李武阳,孟宪刚,等.衣藻对盐胁迫下小麦幼苗生长和生理指标的影响研究[J].浙江农业科学,2024,65(3):497-504.DOI:10.16178/j.issn.0528-9017.20230162衣藻对盐胁迫下小麦幼苗生长和生理指标的影响研究王彦钦1,李武阳1,孟宪刚1∗,罗光宏2(1.兰州交通大学生物与制药工程学院,甘肃兰州㊀730070;2.河西学院甘肃省微藻工程技术研究中心,甘肃张掖㊀734000)㊀㊀摘㊀要:盐胁迫是植物面临的最主要非生物胁迫之一㊂对农业生产而言,研究生物肥料对盐胁迫下植物生理指标的影响具有重要意义㊂目前,藻类生物肥料对盐碱土壤的影响已被广泛研究,但是其对盐胁迫下植物生理指标的影响鲜有报道㊂以德巴衣藻(Chlamydomonas debaryana )藻粉作为生物肥料,通过实验模拟在高盐胁迫环境下,向小麦幼苗沙土中添加不同浓度的衣藻藻粉(0.25㊁0.5㊁ 1.0㊁ 2.0g㊃L -1),并测定了小麦生物量㊁可溶性糖含量㊁可溶性蛋白含量㊁抗氧化酶活性㊁丙二醛含量和离子平衡等相关指标㊂结果表明,盐胁迫使小麦根长㊁茎长㊁干重和鲜重等各项指标均受到显著抑制,可溶性糖含量和可溶性蛋白含量降低,抗氧化酶活性降低,丙二醛含量升高㊂添加不同浓度衣藻藻粉后,小麦根长㊁茎长㊁干重和鲜重等各项指标均有明显增长,可溶性糖含量和可溶性蛋白含量增加,抗氧化酶活性升高,丙二醛含量降低㊂相关分析表明,衣藻藻粉能够促进小麦生长,显著改变小麦生理指标,提升其耐盐性㊂综合比较,1g㊃L-1藻粉处理组效果最为显著㊂关键词:盐胁迫;小麦;衣藻藻粉;生理指标中图分类号:S512.1㊀㊀㊀文献标志码:A㊀㊀㊀文章编号:0528-9017(2024)03-0497-08Effects of Chlamydomonas debaryana powder on growth and physiological indices of wheat seedlings under salt stressWANG Yanqin 1,LI Wuyang 1,MENG Xiangang 1∗,LUO Guanghong 2(1.Collage of Biological and Pharmaceutical Engineering,Lanzhou Jiaotong University,Lanzhou 730070,Gansu;2.Microalgae Engineering Research Center of Gansu Province,Hexi University,Zhangye 734000,Gansu)㊀㊀Abstract :Salt stress is one of the most main abiotic stresses faced by plants.In terms of agricultural production,it isof great significance to study the effects of bio-fertilizers on plant physiological indices under salt stress.Currently,theeffects of algae bio-fertilizer on salinized soil have been widely studied.However,its effects on plant physiological indices under salt stress remains to be unclear.Chlamydomonas debaryana powder was used as bio-fertilizer in this study.algaepowder with different concentrations (0.25,0.5,1.0,2.0g㊃L -1)were added to wheat seedling sandy soil under highsalt stress,The biomass,soluble sugar content,soluble protein content,antioxidant enzyme activity,malondialdehydecontent and ion balance of wheat were measured.The results showed that salt stress significantly inhibited the root length,stem length,dry weight and fresh weight of wheat,decreased the contents of soluble sugar and soluble protein,decreasedthe activity of antioxidant enzymes,and increased the content of malondialdehyde.The root length,stem length,dry weight and fresh weight of wheat increased significantly,the contents of soluble sugar and soluble protein increased,the activity of antioxidant enzymes increased,and the content of malondialdehyde decreased after algae powder was added at differentconcentrations.Correlation analysis showed that the algae powder could promote wheat growth,significantly change wheatphysiological indices,and improve its salt tolerance.By comprehensive comparison,the effect of 1g㊃L-1algae powdertreatment group was the most significant.498㊀㊀2024年第65卷第3期Keywords:salt stress;wheat;Chlamyceous debaryana powder;physiological index㊀㊀盐胁迫现已成为生物所面临的主要非生物胁迫之一,我国盐渍化土壤在19个省份均有分布㊂据报道,中国西北㊁东北及滨海地区受盐碱胁迫的土地面积超过3.3ˑ107hm2,其中接近一半尚有农业利用潜力[1]㊂而且,中国西北土壤荒漠化形势严峻,其中盐渍化是主要诱发因子㊂研究表明,盐胁迫通过渗透胁迫㊁离子伤害等过程损伤植物,抑制生长[2]㊂当盐浓度过高时幼苗生长会受到抑制,主要原因是盐分过高破坏了细胞质的完整性,导致细胞选择透过性下降甚至丧失,Na+㊁Cl-等在细胞内大量积累,降低了K㊁Ca等元素的含量,细胞内离子平衡失调,引发一系列功能紊乱,从而影响幼苗的生长[3]㊂此外,在盐碱地上种植的小麦等作物,由于盐胁迫下,光合系统和酶系统受到干扰,进而影响产量和质量㊂微藻是一类光合利用度高的低等自养生物,分布广泛,种类繁多,具有固碳㊁固氮等特性[4]㊂文献报道,微藻细胞能分泌多聚阴离子大分子胞外多糖(EPS)黏液层,对Na+有强吸附能力,具有优良的脱盐效果㊂徐嘉男[5]利用螺旋藻和紫球藻处理盐碱土,发现螺旋藻可以使土壤有机质含量增加到19.60g㊃kg-1,紫球藻分泌的可溶性多糖能够吸附土壤中的Na+,使可交换性钠含量降低0.10 cmol㊃kg-1,土壤碱化度降低16.30%,土壤pH值降至8.3㊂Liu等[6]的研究发现,丝藻多糖(GFP)和低分子量丝藻多糖(LGFP)显著提升了盐胁迫下水稻种子的活力指数㊂此外,LGFP提升了盐胁迫下水稻幼苗清除活性氧的能力和抗氧化酶活性,并通过提升Na+/H+逆向转运基因的表达水平影响了其根系Na+的转运㊂另有研究表明[7],泡叶藻提取物处理可以使盐胁迫下拟南芥转录组发生显著改变,调节大量响应胁迫的基因表达,从而提高拟南芥的耐盐性㊂以上研究表明,微藻可以改良盐碱化土壤,微藻中的活性成分可以从生理层面和分子层面改变高等植物的耐盐能力,因此,微藻生物肥料在盐胁迫下农作物上有良好运用前景㊂但是鲜有将藻肥运用到盐胁迫下植物的报道,此外,直接将活体藻类作为生物肥料的应用研究不多,活藻对盐胁迫下植物生理特性的影响也不明确㊂衣藻是绿藻门衣藻科的单细胞藻类,其产生的孢子具有极强的耐受性,且藻株对环境无污染,对人畜没有致病性[8]㊂衣藻具有作为生物肥料的良好潜能,衣藻可以分泌大量海藻糖,这种物质具有优良的渗透调节和胁迫保护的作用[9-10]㊂另有研究表明,在正常光照下,衣藻不仅可以促进土壤微生物的生长,还能够将磷矿粉中作物不能吸收的磷转化为可吸收的磷,从而提高土壤中有效磷的含量,进而增强土壤酶活性,最终达到改善土壤质量以及促进作物生长的效果[11]㊂除此之外,刘翔等[12]的研究发现,沙角衣藻对重金属胁迫下的小麦幼苗有一定的保护作用㊂这表明衣藻有提升土壤肥力和提高植物抗逆性的作用㊂因此,衣藻作为生物肥料具有良好开发前景,此外,衣藻藻粉对盐胁迫下植物生理指标的影响鲜见报道㊂本实验采用德巴衣藻(Chlamydomonas debaryana)藻粉作为生物肥料,将不同浓度的衣藻藻粉添加到高盐胁迫的小麦幼苗中,测定了小麦生物量㊁可溶性糖含量及可溶性蛋白含量和离子平衡等生理指标㊂分析了添加不同浓度的衣藻藻粉对盐胁迫下小麦生长和生理指标的影响㊂1㊀材料与方法1.1㊀试验材料㊀㊀小麦长丰2112购自张掖当地农贸市场㊂衣藻藻粉由甘肃凯源微藻工程技术中心生产的微藻(德巴衣藻)干燥制成粉状,按比例利用无菌水配制藻液,与无菌水(CK)对照,进行试验研究㊂1.2㊀小麦不同处理㊀㊀首先用20%的过氧化氢对小麦种子表面消毒15min,然后用无菌水冲洗3次后置于温度为25ħ的培养箱内,在黑暗状态下萌发24h㊂待种子发芽后,挑选萌发一致的种子放入清洗灭菌后的沙土盆中,并将其置于25ħ㊁12h/12h(300μmol㊃m-2㊃s-1光照/黑暗)的培养箱内进行培养㊂培养期间,向沙土盆内继续添加清水保持沙土湿润,用于催发小麦种子㊂待小麦长至两心一叶时,对T0~T4处理组连续施加50mL150mmol㊃L-1 NaCl溶液10d,期间T0(150mmol㊃L-1NaCl溶液)处理组每天补加等量无菌水,T1~T4(藻处理组:衣藻浓度为分别0.25㊁0.5㊁ 1.0㊁ 2.0g㊃L-1)每3d添加50mL藻液,T0组同时添加50mL无菌水㊂1.3㊀指标测定㊀㊀待所有处理完成后12d时取样,先用蒸馏水将样品小麦冲洗3次,再用滤纸擦干植株表面残留水分,然后用剪刀使小麦根茎分离,再用直尺测定其根长和茎长㊂之后用分析天平称得鲜重,再将样品材料置于烘箱中120ħ杀青15min后转至80ħ烘箱烘至恒重,称得干重,以3株幼苗的平均值表示干重和鲜重,单位为g㊂测定下列指标:小麦茎长㊁根长,采用直尺测量;地上部分㊁地下部分鲜重并进行根系扫描㊂取测定鲜重后健康叶片,称取0.1g样品,采用考马斯亮蓝法测定可溶性蛋白的含量[13],采用硫酸蒽酮比色法测定小麦叶片中的可溶性糖含量[14]㊂采集处理完成后3㊁6㊁9㊁12d的健康小麦叶片,称重0.1g后在-80ħ冰箱保存㊂采用硫代巴比妥酸法测定丙二醛(MDA)含量,超氧化物歧化酶(SOD)活性以氮蓝四唑法测定,过氧化物酶(POD)活性以愈创木酚法测定,过氧化氢酶(CAT)活性的测定采用可见光法[15],上述参数采用DR600紫外分光光度计测定㊂1.4㊀数据处理㊀㊀试验数据采用Excel2013进行整理,用SPSS 21.0软件进行方差分析,用OriginPro8.5软件制图㊂2㊀结果与分析2.1㊀藻粉对盐胁迫下小麦生长指标的影响2.1.1㊀藻粉处理对盐胁迫下小麦根长和茎长的影响㊀㊀小麦幼苗经过盐胁迫后,T0组小麦茎长和根长有了明显的下降,与CK相比分别下降了29%和60%㊂和T0相比,T1的根长茎长没有显著性差异㊂而T2~T4处理组效果明显,与T0相比,其茎长分别增加了44.4%㊁34.7%㊁37.1%,根长增加了84.0%㊁53.6%㊁52.6%㊂在盐胁迫下,施加藻粉对小麦地下部的促进比地上部更加明显(图1)㊂2.1.2㊀藻粉对盐胁迫下小麦根和茎干重、鲜重的影响㊀㊀由图2㊁图3可见,不同浓度藻粉处理对盐胁迫条件下小麦干重具有明显的影响㊂其中,T0处理组茎干重和根干重相比于对照组分别下降了46%和61%㊂在添加藻粉后,T1处理组茎干重未见明显变化,但根干重相比于T0处理组增加了61%,T2~T4处理组相比于T0处理组茎干重和根干重均有明显上升,其中茎干重分别增加了17%㊁图1㊀藻粉对盐胁迫下小麦根长和茎长的影响Fig.1㊀Effects of algae powder on root and stemlength of wheat under salt stress 17%㊁11.1%,根干重增加了112%㊁81%㊁132%㊂藻粉处理对小麦地下部的促进作用更为明显㊂鲜重测量亦发现,各处理组与对照组相比,鲜重皆有明显下降,其中,T0与对照相比其茎鲜重和根鲜重分别下降了54.2%和19.4%,而添加藻粉处理各组,其茎鲜重和根鲜重相比于T0处理组,都有不同程度的提高,其中T2~T4增长较为明显,各处理组茎鲜重与T0处理组相比,分别增加了29.9%㊁58.8%㊁53.6%,根鲜重分别增加了69.7%,60.6%,121.2%㊂由此可见,在盐胁迫下,藻粉处理对小麦地下部鲜重的促进较地上部更为明显㊂图2㊀藻粉对盐胁迫下小麦干重的影响Fig.2㊀Effect of algae powder on dry weight ofwheat under salt stress2.1.3㊀藻粉处理对盐胁迫下小麦根系生长的影响㊀㊀对不同浓度藻粉处理下的盐胁迫小麦根系扫描500㊀㊀2024年第65卷第3期图3㊀藻粉对盐胁迫下小麦鲜重的影响Fig.3㊀Effect of algae powder on freshweight of wheat under salt stress结果如图4所示㊂由表1可见,在经过盐胁迫后,T0根部的各㊀㊀图4㊀小麦根系扫描照片Fig.4㊀Scanning photos of wheat roots项指标都有不同程度的显著下降,其中根表面积分枝数㊁分叉数下降较为明显,在添加藻粉处理后,各处理组小麦根部的生长状态得到明显好转㊂表1㊀小麦根系扫描数据Table1㊀Scanning data of wheat roots处理组总根表面积/cm2平均根系直径/cm分枝数分叉数CK15.188ʃ0.283a0.236ʃ0.012a1223.0ʃ94.0a315.7ʃ15.8a T0 6.242ʃ0.995c0.237ʃ0.002a344.3ʃ34.0d87.0ʃ11.6c T1 6.522ʃ0.362c0.228ʃ0.017ab607.3ʃ99.4c106.7ʃ14.7c T29.469ʃ1.929b0.232ʃ0.015ab601.0ʃ58.3c123.7ʃ9.4c T39.507ʃ0.088b0.205ʃ0.010b565.0ʃ41.7c178ʃ23.3b T410.372ʃ1.116b0.227ʃ0.006ab838.0ʃ40.2b120.7ʃ34.5c ㊀㊀注:同列数据后无相同小写字母表示不同处理间差异显著(P<0.05)㊂2.2㊀藻粉处理对盐胁迫下小麦可溶性蛋白及可溶性糖含量的影响㊀㊀可溶性蛋白是植物体内用于调节渗透胁迫的重要物质之一㊂本实验发现,在经过盐胁迫12d,藻粉处理9d后,小麦叶片内各处理组可溶性蛋白的含量有了明显的下降,其中T0处理组最为显著,相比于对照组CK下降了38.5%,而经过添加不同浓度的藻粉处理后,各处理组(T1㊁T2㊁T3㊁T4)可溶性蛋白的含量分别比盐胁迫处理组T0提高了14.7%㊁15.2%㊁46.2%和18.1%,其中以T3处理组最为显著,而T1和T4处理组无显著性差异(图5)㊂由此说明,用一定浓度的藻粉处理能有效地缓解盐胁迫带来的叶片中可溶性蛋白含量的下降㊂可溶性糖也是植物体内重要的渗透调节物质之一,其含量的变化能直观地反映出植物受到盐胁迫后体内的渗透调节过程㊂本实验发现,小麦盐胁迫㊀㊀同组柱上无相同小写字母表示不同处理间差异显著(P<0.05)㊂图6同㊂图5㊀藻粉对盐胁迫下小麦可溶性蛋白含量的影响Fig.5㊀Effect of algae powder on soluble protein content of wheat under salt stress处理12d,藻粉处理9d后,小麦叶片中可溶性糖含量如图6所示㊂图6㊀藻粉对盐胁迫下小麦可溶性糖含量的影响Fig.6㊀Effect of algae powder on soluble sugarcontent of wheat under salt stress由图6可见,在盐胁迫条件下,各处理组可溶性糖含量都有了明显的下降,其中盐胁迫处理组T0相比于对照组,其可溶性糖含量大幅下降了62.6%,而经过不同浓度的藻粉处理后,各处理组(T1㊁T2㊁T3㊁T4)与T0相比可溶性糖的含量都有了不同程度的提高,分别提高了28.5%㊁89.1%㊁100.5%㊁109.1%,各处理组提升的比例也有显著性差异,其中T1处理组可溶性糖含量的提升水平显著低于T2㊁T3和T4处理组,说明高浓度的藻粉处理对小麦叶片可溶性糖含量的提升要高于低浓度藻粉处理㊂2.3㊀藻粉处理对盐胁迫下小麦抗氧化酶活性及丙二醛含量的影响2.3.1㊀藻粉处理对盐胁迫小麦超氧化物歧化酶(SOD)活性的影响㊀㊀如图7所示,在处理后0~12d对照组CK的SOD活性呈缓慢上升的趋势,而T0处理组SOD 活性则呈现先上升后下降的趋势,在6d时其SOD活性达到最大,相比于对照组T0处理SOD 活性显著增加了24.7%㊂处理后3d,各处理组SOD活性相比对照组显著性上升,其中盐胁迫处理组T0比CK增加了22%,在盐胁迫处理6d,各处理组SOD活性继续增加,其中T3处理组增加最为显著,相比于处理3d时增加了27%㊂处理9d时,各处理组之间SOD活性开始出现显著性差异,其中T0和T1处理组SOD活性开始下降,相比于盐胁迫6d时分别下降了23.7%和30.2%,盐胁迫12d时,各处理组SOD活性开始维持稳定㊂同颜色柱上无相同小写字母表示同一处理不同时间差异显著(P<0.05),图8~10同㊂图7㊀藻粉对盐胁迫下小麦超氧化物歧化酶活性的影响Fig.7㊀Effect of algae powder on SOD activity ofwheat under salt stress2.3.2㊀藻粉处理对盐胁迫小麦过氧化物酶(POD)活性的影响㊀㊀如图8所示,在整个生长过程中,对照组CK 的POD活性随着时间缓慢上升并维持稳定,而盐胁迫处理组T0,在处理3d,其POD活性相比于对照组显著提高了59%,而后其POD活性随着时间缓慢上升,在6d时达到最大值,然后下降,在12d达到最小㊂而添加藻粉处理使盐胁迫下小麦POD活性得到回升,在9d时,T2㊁T3和T4处理组POD活性显著升高,分别相比于同期对照组提高了56.5%㊁71.2和53.1%,T1处理组无显著变化㊂到12d时,各藻粉处理组(T1~T4)POD活性均显著高于T0,其中T2处理组的POD活性相比于T0显著增加了133.5%㊂2.3.3㊀藻粉处理对盐胁迫小麦过氧化氢酶(CAT)活性的影响㊀㊀由图9可知,盐胁迫3d时,各处理组CAT活性均有显著性升高,随着时间的增加,对照组CK 的CAT活性变化不大,而盐胁迫处理组T0和各藻粉处理组CAT均呈先上升后下降的趋势,其CAT 活性在6d达到最大,而后开始缓慢下降㊂9d时,各处理组之间CAT活性开始出现显著差异性,其中相比于3d,T0和T1处理组的CAT活性显著下502㊀㊀2024年第65卷第3期图8㊀藻粉对盐胁迫下小麦过氧化物酶活性的影响Fig.8㊀Effect of algae powder on POD activity ofwheat under salt stress降了34.3%和42.8%,而T3和T4处理组CAT 活性略有下降但不显著,T2处理组CAT 活性的下降远小于T0和T1处理组㊂到12d 时,各处理组CAT 活性开始趋于稳定,各对照组和处理组CAT 活性相比于9d 无显著性变化㊂图9㊀藻粉对盐胁迫下小麦过氧化氢酶活性的影响Fig.9㊀Effect of algae powder on CAT activity ofwheat under salt stress2.3.4㊀藻粉处理对盐胁迫小麦丙二醛(MDA )含量的影响㊀㊀由图10可知,在处理3d 后,各处理组MDA含量有了明显的上升,盐胁迫处理组T0叶片中MDA 含量随处理时间开始缓慢升高,处理6d 时,各处理组MDA 含量略有上升,但变化并不显著,各处理组也没有明显的差异㊂盐胁迫处理9d 时,T2㊁T3和T4处理组MDA 含量出现显著下降,相比于T0分别低了35.8%,42.3%和36.4%㊂盐胁迫12d 时,各组MDA 含量趋于稳定,相比于9d的MDA 含量没有显著性变化㊂图10㊀藻粉对盐胁迫下小麦丙二醛含量的影响Fig.10㊀Effect of algae powder on MDA content ofwheat under salt stress2.4㊀藻粉处理对盐胁迫下小麦Na +/K +的影响㊀㊀本研究发现,在盐胁迫条件下,小麦盐胁迫对照组T0地上部和地下部的Na +/K +显著升高,相比于对照组增大了958.7%和1362.1%㊂而T3藻粉处理后有所下降,相比于T0组分别降低了54.3%和7.8%(图11)㊂图11㊀藻粉对盐胁迫下小麦幼苗Na +/K +的影响Fig.11㊀Effect of algae powder on Na +/K+in wheat seedlings under salt stress3㊀讨论㊀㊀盐胁迫是影响植物生长的非生物胁迫因子之一,盐浓度超过植物耐受阈值时会出现植物生长发育受到抑制和光合作用效率下降等现象,影响植物生长㊂微藻可以分泌多种生物活性物质,如植物激素和胞外多糖等,这些物质能够促进植物生长,改善土壤质量,减缓盐胁迫对植物生长的抑制作用㊂本研究中,盐胁迫处理组T0小麦幼苗的根长㊁茎长㊁干重和鲜重相比于对照组CK都有了明显下降,说明小麦生长发育和物质积累受到严重抑制㊂而在添加藻粉处理后,各处理组小麦幼苗的各项生长指标都有了明显增长㊂可能的原因是微藻分泌的多糖物质和生长刺激素促进了小麦幼苗的生长[16];或者衣藻自身富集了大量的NaCl,减轻了植株受胁迫的程度㊂该试验结果与Arroussi等[17]研究结果相一致㊂说明添加衣藻能够促进植物在盐胁迫条件下的生长㊂可溶性糖和可溶性蛋白是植物体内重要的渗透调节物质,其含量的变化反映了小麦渗透调节能力的变化[18-19]㊂植物遭受盐胁迫时,细胞内的蛋白质分解成氨基酸的速率提高,蛋白质合成受阻,故可溶性蛋白含量下降[20];而外源物质可以使受盐胁迫的植物渗透调节能力恢复[21],从而使受盐胁迫植物的可溶性糖含量和可溶性蛋白含量增加[22];这与本实验结果一致㊂说明衣藻藻粉可能参与植物渗透调节,维持正常生理代谢活动㊂在本实验中,经过12d的盐胁迫后,T0处理组的可溶性糖和可溶性蛋白的含量相比于同期对照组CK出现明显下降,表明小麦细胞在高浓度盐胁迫(150mmol㊃L-1NaCl)的条件下逐渐失去了渗透调节能力,而添加藻粉的各处理组(T1~T4)其可溶性糖含量和可溶性蛋白含量均出现不同程度的回升㊂综上,本研究表明藻粉可以帮助受到盐胁迫的小麦细胞恢复一定的渗透调节能力㊂而高浓度藻粉处理(1g㊃L-1)显著高于低浓度处理(0.25g㊃L-1),这表明藻液处理的作用效果跟浓度有很大关系,以1g㊃L-1最为适宜㊂当植物面临各种胁迫时,植物体内积累活性氧(ROS)增多会引起植物细胞遭受氧化胁迫[23],最终使植物细胞功能失常,植物生长受阻㊂SOD㊁POD和CAT是植物体内应对外部胁迫的抗氧化酶,当植物受到盐胁迫时,植物体内出于自我防御的需要,会提高这些酶的活性,从而提高自身抗逆性㊂本试验发现,当盐胁迫3d时,各处理组的SOD㊁POD和CAT的活性均持续上升,在处理后6d时达到最大㊂这表明盐胁迫对小麦自身抗氧化酶的活性有抑制作用㊂小麦幼苗体内抗氧化酶不足以清除积累过多的ROS,可能影响小麦生长㊂而在添加藻粉后,各处理组抗氧化酶的活性明显升高,其中POD活性的提升最为明显㊂这说明藻粉处理能够有效增加小麦抗氧化酶的活性从而加快清理因盐胁迫而积累在小麦体内的ROS,从而减缓盐胁迫对植物的损伤㊂MDA是植物膜脂质过氧化的主要产物之一,其在植物体内含量的变化能直观地反映植物细胞氧化损伤程度[24]㊂本研究中,在处理后3d 时,小麦叶片中MDA含量有了明显上升㊂而添加藻粉处理后,抗氧化酶活性得到明显提升,MDA 含量也开始下降㊂这与其他生物肥料处理[25-26]对盐胁迫下小麦的抗氧化酶活性和MDA含量的影响类似,这说明衣藻藻粉可有效降低小麦细胞氧化损伤程度,从而维持其正常功能,进而增强小麦的抗逆性并促进其生长㊂而在处理3~12d期间,T3处理组的POD㊁SOD㊁CAT活性基本是最高的,而MDA含量却是最低的,因此,1g㊃L-1藻液处理效果最佳㊂K+是所有高等植物里含量最多的离子,能够参与调控植物离子平衡㊁参与蛋白质合成㊁参与光合作用㊁调节细胞渗透压,是植物生长发育很重要的一种微量元素㊂而Na+元素因为其离子半径和水合能与K+类似,能够抢占细胞中K+的吸收位点,从而导致细胞对K+的吸收能力下降㊂因而,植物细胞内K+含量的稳定和较低的Na+/K+能反映细胞内离子平衡状态[27]㊂而在盐胁迫环境中,植物的Na+/K+会急剧增加直到超过其生长所能承受的最大临界值[28]㊂这与本研究结果相同㊂而各藻粉处理组小麦根和叶片中Na+/K+显著降低㊂这是因为藻粉处理改善了盐胁迫条件下的土壤微环境,使小麦根际Na+含量降低[29]㊂本研究说明在盐胁迫条件下添加一定浓度的衣藻藻液能有效维持小麦内部离子平衡,进而促进其生长㊂4㊀结论㊀㊀综上所述,微藻能够合成丰富的生物活性成分,为作物提供丰富的矿物质营养,促进农作物代谢生长[30]㊂本研究得出以下结论:藻粉处理能够促进盐胁迫下小麦植株的生长㊁促进其离子平衡的稳定并维持其渗透调节能力,一定程度上增加其抗氧化酶活性,使其抗盐胁迫能力增强㊂参考文献:[1]㊀王佳丽,黄贤金,钟太洋,等.盐碱地可持续利用研究综述[J].地理学报,2011,66(5):673-684.504㊀㊀2024年第65卷第3期[2]㊀余叔文,汤章城.植物生理与分子生物学[M].2版.北京:科学出版社,1998.[3]㊀景欣,张旸,李玉花.植物耐盐研究进展[J].生物技术通讯,2010,21(2):290-294.[4]㊀代森.解淀粉芽孢杆菌抑菌物质分离和调控研究[D].天津:南开大学,2011.[5]㊀徐嘉男.耐盐碱水高效固碳微藻种选育[D].青岛:青岛科技大学,2018.[6]㊀LIU H,CHEN X L,SONG L,et al.Polysaccharides fromGrateloupia filicina enhance tolerance of rice seeds(Oryza sativaL.)under salt stress[J].International Journal of BiologicalMacromolecules,2019,124:1197-1204.[7]㊀JITHESH M N,SHUKLA P S,KANT P,et al.Physiologicaland transcriptomics analyses reveal that Ascophyllum nodosumextracts induce salinity tolerance in Arabidopsis by regulating theexpression of stress responsive genes[J].Journal of PlantGrowth Regulation,2019,38(2):463-478.[8]㊀杜琼,孔维宝,韩锐,等.土壤微藻的种类及其功能研究进展[J].生物学通报,2015,50(1):1-5. [9]㊀SHETTY P,GITAU M M,MARÓTI G.Salinity stressresponses and adaptation mechanisms in eukaryotic greenmicroalgae[J].Cells,2019,8(12):1657. [10]㊀CARILLO P,CIARMIELLO L F,WOODROW P,et al.Enhancing sustainability by improving plant salt tolerancethrough macro-and micro-algal biostimulants[J].Biology,2020,9(9):253.[11]㊀叶华勋,兰利琼,卿人韦,等.土壤藻类对植物生长影响的研究[J].土壤通报,2007,38(5):950-956. [12]㊀刘翔,范勇,傅华龙,等.沙角衣藻对镉胁迫下小麦幼苗抗氧化酶活性的影响[J].四川大学学报(自然科学版),2009,46(4):1199-1202.[13]㊀BRADFORD M M.A rapid and sensitive method for thequantitation of microgram quantities of protein utilizing theprinciple of protein-dye binding[J].Analytical Biochemistry,1976,72(1/2):248-254.[14]㊀刘本帅,于立河,于崧,等.中性盐和碱性盐胁迫对芸豆可溶性糖及钾钠离子含量的影响[J].黑龙江八一农垦大学学报,2022,34(1):13-17,78.[15]㊀张治安,陈展宇.植物生理学实验技术[M].长春:吉林大学出版社,2008.[16]㊀张运红,孙克刚,杜君,等.海藻寡糖增效尿素对水稻产量和品质的影响[J].河南农业科学,2016,45(1):53-56. [17]㊀ARROUSSI H,ELBAOUCHI A,BENHIMA R,et al.Halophilic microalgae Dunaliella salina extracts improve seedgermination and seedling growth of Triticum aestivum L.undersalt stress[J].Acta Horticulturae,2016(1148):13-26.[18]㊀李瑞强,王玉祥,孙玉兰,等.盐胁迫对5份无芒雀麦苗期生长和生理生化的影响及综合性评价[J].草业学报,2023,32(1):99-111.[19]㊀SPERDOULI I,MOUSTAKAS M.Interaction of proline,sugars,and anthocyanins during photosynthetic acclimation ofArabidopsis thaliana to drought stress[J].Journal of PlantPhysiology,2012,169(6):577-585.[20]㊀石元豹,汪贵斌,黄广远,等.3个臭椿半同胞家系耐盐性比较研究[J].四川农业大学学报,2016,34(2):153-160. [21]㊀范夕玲,杨亚苓,任健,等.外源5-氨基乙酰丙酸对盐胁迫下花椰菜幼苗生理特性的影响[J].天津农业科学,2019,25(12):1-4.[22]㊀张春平,何平,胡世俊,等.外源5-氨基乙酰丙酸对盐胁迫下黄连种子萌发及幼苗生理特性的影响[J].中草药,2014,45(24):3618-3626.[23]㊀FEDINA I S,NEDEVA D,ÇIÇEK N.Pre-treatment withH2O2induces salt tolerance in Barley seedlings[J].BiologiaPlantarum,2009,53(2):321-324.[24]㊀WANG Y,LI J L,WANG J Z,et al.Exogenous H2O2improves the chilling tolerance of manilagrass andmascarenegrass by activating the antioxidative system[J].Plant Growth Regulation,2010,61(2):195-204. [25]㊀陈小娟,刘铠鸣,宣明刚,等.增强作物耐盐胁迫能力的根际促生菌筛选㊁鉴定及田间应用效果[J].南京农业大学学报,2020,43(3):452-459.[26]㊀KHALILZADEH R,SEYED SHARIFI R,JALILIAN J.Growth,physiological status,and yield of salt-stressed wheat(Triticum aestivum L.)plants affected by biofertilizer andcycocel applications[J].Arid Land Research andManagement,2018,32(1):71-90.[27]㊀田宪艺.外源NO-SA-Ca与有机肥对冬小麦盐胁迫的缓解效应及其机理研究[D].泰安:山东农业大学,2016. [28]㊀张睿,封晓辉,吴玉洁,等.长穗偃麦草(Thinopyrumponticum)幼苗对盐旱胁迫的生理响应[J].中国生态农业学报(中英文),2022,30(11):1795-1806.[29]㊀张巍.固氮蓝藻在松嫩平原盐碱土生态修复中作用的研究[D].哈尔滨:哈尔滨工业大学,2008.[30]㊀边建文,崔岩,杨宋琪,等.衣藻和固氮鱼腥藻对盐胁迫下小麦幼苗生长的影响[J].浙江农业学报,2020,32(10):1748-1756.(责任编辑:董宇飞)。
国家级大学生创新创业训练计划
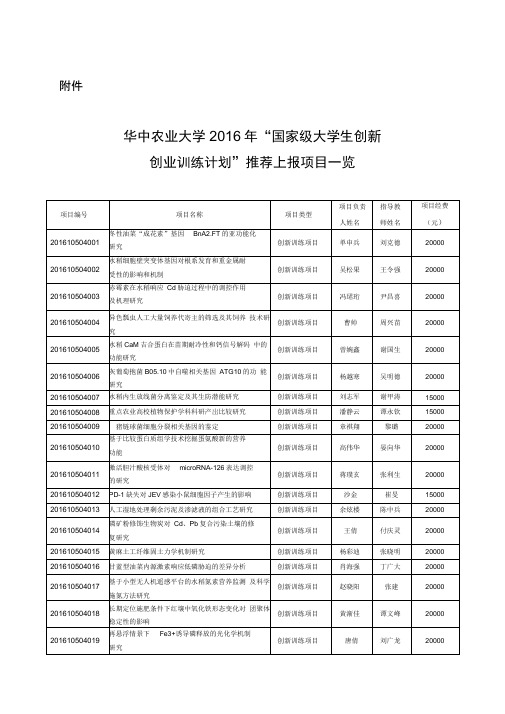
刘汉兰
20000
项目编号
项目名称
项目类型
项目负责
人姓名
指导教
师姓名
项目经费
(元)
201610504079
Bi/rGO/Bi2WO6三元复合材料的合成及光催化
性能研究
创新训练项目
刘文成
瞿阳
20000
201610504080
多孔金棒的生物模板合成方法研究
创新训练项目
梁晨楠
鲁哲学
20000
201610504081
20000
201610504050
白斑病毒分子蛋白A的分子研究
创新训练项目
李卓聪
兰江风
20000
201610504051
团头鲂颗粒溶素NK-lysin的生物学活性研究
创新训练项目
黄浩
袁改玲
20000
201610504052
光照和温度对蚤状溞生殖转化的诱导作用研究
创新训练项目
刘思甜
刘香江
20000
201610504053
创新训练项目
耿佩赟
பைடு நூலகம்刘睿
15000
201610504076
基于矩阵理论的亏损系统灵敏度模型
创新训练项目
黄文琳
沈婧芳
15000
201610504077
后基因组时代农药一基因相互作用数据库构建
创新训练项目
徐芳婷
位灯国,
郑芳
20000
201610504078
醚基离子液体的制备及其对纤维素溶解性能的
研究
创新训练项目
刘灵芝
20000
201610504090
大学生参与和使用众筹创业意愿及其影响因素 研究
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第33卷第8期2012年8月环境科学ENVIRONMENTAL SCIENCEVol.33,No.8Aug.,2012实验室条件下蓝藻结皮对低温光照胁迫的响应与微结构变化饶本强1,2,李华1,3,熊瑛4,兰书斌1,李敦海1,刘永定1*(1.中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,武汉430072; 2.信阳师范学院生命科学学院,信阳464000;3.中国科学院研究生院,北京100049;4.AECOM 易道公司,北京100025)摘要:低温光照是荒漠化地区蓝藻结皮经常面临的环境条件之一.报道了实验室条件下低温光照处理对蓝藻结皮形态、生理特性和超微结构的影响.本研究中,首先通过接种具鞘微鞘藻和爪哇伪枝藻形成人工蓝藻结皮,接着以人工蓝藻结皮为材料进行低温光照处理:28ħ+60μE·(m 2·s )-1(对照)、10ħ+60μE ·(m 2·s )-1、2ħ+60μE ·(m 2·s )-1和2ħ+黑暗.在不同低温光照处理的第0、5和12d 分别测定蓝藻结皮光合活性(F v /F m )、叶绿素a 、胞外多糖、伪枝藻素、类胡萝卜素和藻蓝蛋白的含量及藻蓝蛋白/叶绿素比值,同时采用扫描电镜观察低温光照处理下蓝藻结皮的微结构变化.此外,对结皮的表观形态特征如结皮颜色、厚度和干重等进行了测定.与对照结皮相比,低温光照下结皮的表观形态受到不利影响,所测定的结皮各项生理指标均呈现显著下降(P <0.05).在2ħ+60μE·(m 2·s )-1处理12d 时,结皮生物量、光合活性、胞外多糖含量、伪枝藻素含量、类胡萝卜素含量和藻蓝蛋白含量分别比同期对照结皮下降了61.48%、94.89%、66.37%、31.01%、59.38%和65.91%.电镜观察表明,低温光照导致蓝藻结皮的超微结构受到明显破坏,表现为结皮层出现大量蜂窝状空隙,藻丝体数量减少,呈网格状分布,对沙粒的束缚能力减弱等.研究表明低温光照对蓝藻结皮的形态和生理活性具有明显的抑制效应,而低温黑暗能较好地促进蓝藻结皮生理活性和结皮表观形态的恢复.本研究初步探索了蓝藻结皮对低温光照胁迫的耐受性,同时对于了解蓝藻结皮在野外极端环境条件下的生存状况具有一定的理论意义.关键词:荒漠化;人工蓝藻结皮;低温-光照;生理特性;超微结构中图分类号:X171文献标识码:A文章编号:0250-3301(2012)08-2793-11收稿日期:2011-10-20;修订日期:2011-12-08基金项目:中国博士后科学基金项目(20100480920);国家科技支撑计划项目(2009BADC2B04);武汉市科技局与内蒙古自治区发改委重大科技产业化专项(200720112031);河南省高等学校青年骨干教师资助计划项目(2010GGJS-106);淡水生态与生物技术国家重点实验室项目(2008FBZ21)作者简介:饶本强(1974 ),男,博士,副教授,主要研究方向为藻类环境生物学,E-mail :rbqxy@163.com *通讯联系人,E-mail :liuyd@ihb.ac.cn Response of the Artificial Cyanobacterial Crusts to Low Temperature and Light Stress and the Micro-structure Changes Under Laboratory ConditionsRAO Ben-qiang 1,2,LI Hua 1,3,XIONG Ying 4,LAN Shu-bin 1,LI Dun-hai 1,LIU Yong-ding 1(1.State Key Laboratory of Freshwater Ecology and Biotechnology ,Institute of Hydrobiology ,Chinese Academy of Sciences ,Wuhan 430072,China ;2.College of Life Sciences ,Xinyang Normal University ,Xinyang 464000,China ; 3.Graduate University of Chinese Academy of Sciences ,Beijing 100049,China ;4.AECOM EDAW Consultancy Co.Ltd.,Beijing 100025,China )Abstract :Low temperature and light are noticeable environmental conditions commonly experienced by cyanobacterial crusts growing indesert areas.Here we reported the effects of low temperature and light on the morphology ,physiological characteristics and ultrastructural changes of artificial cyanobacterial crust.Firstly artificial cyanobacterial crusts were formed by inoculating Microcoleus vaginatus Gom.and Scytonema javanicum (Kütz.)Born et Flah onto shifting sand in Petri dishes.Then ,the artificial cyanobacterialcrusts were selected as the experimental materials and subjected to the following treatments :28ħ+60μE·(m 2·s )-1(control ),10ħ+60μE ·(m 2·s )-1,2ħ+60μE ·(m 2·s )-1and 2ħ+dark.On the 0th ,5th and 12th days during the experimental period ,biomass (expressed as Chl-a ),photosynthetic activities (optimal quantum yield ,F v /F m ),exopolysaccharide (EPS ),scytonemin ,carotenoid and C-phycocyanin contents of the crusts in different treatments were determined.We also observed the ultrastructuralchanges of the cyanobacterial crusts in the control and 2ħtreatments by means of scan electron microscope (SEM ).Moreover ,the morphological properties such as crust color ,crust thickness and crust dry weight etc.were also examined.The results indicated thatthe morphology of the treated crusts suffered unfavorable effect under light and low temperature stress ,and Chl-a ,F v /F m ,EPS ,scytonemin and carotenoid contents as well as C-phycocyanin content of the treated crusts were all significantly lower than those of thecrusts under control conditions (P <0.05).When the cyanobacterial crusts were treated for 12days under 2ħ+60μE ·(m 2·s )-1,Chl-a ,F v /F m ,EPS ,scytonemin and carotenoid contents as well as C-phycocyanin content within the crusts decreased by 61.48%,94.89%,66.37%,31.01%,59.38%and 65.91%,respectively.Obvious destruction in ultrastructure was observed in theDOI:10.13227/j.hjkx.2012.08.017环境科学33卷cyanobacterial crust under cold stress,such as the presence of numerous honeycombs within the crusts and the sparse and loose appearance of the algal filaments,etc.The research verified that the acquired treatments had negative effects on the morphology,growth and microstructures of the cyanobacterial crusts,and the cooperation of low temperature and dark could provide effective protection for the morphological,physiological and microstructural features of the crust subjected to cold and light stress.The aim of this study was to primarily discuss the responses of cyanobacterial crusts to low temperature and light stress,and to offer a basic understanding of cyanobacterial crusts against extreme environments in fields,which may have certain academic significance for researches interested in cyanobactrial crusts.Key words:desertification;artificial cyanobacterial crusts;low temperature and light;physiological characteristics;ultrastructures生物结皮遍布于荒漠和半荒漠地区,主要由荒漠藻类、细菌、放线菌、真菌、苔藓和地衣等组成的土壤生物聚合体.早期形成的生物结皮主要由荒漠蓝藻组成,称之蓝藻结皮.蓝藻结皮是生物结皮形成的早期阶段,在生物结皮的发育演替中具有重要作用,已成为生物结皮研究的热点内容之一[1].荒漠化是当今国际社会普遍关注的生态环境问题,我国是受荒漠化危害最为严重的国家之一.伴随着荒漠化威胁的日益加重,生物结皮在防风固沙、防止土壤侵蚀、改善土壤养分和表层水分分布状况以及在荒漠化生态修复中的先锋拓殖作用引起了广泛重视,并成为荒漠地区生态研究的热点[2].当前国内外对生物结皮的研究主要集中在结皮的形成机制、发育演替机制[3,4],结皮物质转化[5]和结皮的干扰修复等方面[6].研究表明,蓝藻结皮的形成是由具外鞘的且分泌胞外多糖的丝状蓝藻所驱动,荒漠蓝藻能在荒漠地表形成固定流沙的蓝藻结皮[7].作为荒漠拓殖生物,荒漠蓝藻能够在条件恶劣的环境下(如干旱、强紫外辐射、高盐碱、营养贫瘠等)生长、繁殖,并通过自身的活动,影响并改变着环境.近年来本课题组开展了荒漠蓝藻及其结皮的基础与应用研究,并在内蒙古库布齐沙漠等地区采用人工藻结皮用于荒漠化治理,取得了一些研究成果[8 10].在干旱、半干旱地区,较大的昼夜温差和温度波动是影响蓝藻结皮生存的重要环境因子.特别是蓝藻结皮经常承受长期的低温光照环境,甚至在冰冻的土壤中生存.在野外自然条件下,蓝藻结皮的形成和发育过程不可避免会遭遇不同程度的寒冷和光照胁迫,二者也是影响人工藻结皮生长发育的重要环境因子.目前,很多研究热点集中于低温对高等植物和水体藻类的影响[11 14],但关于低温光照对蓝藻结皮的影响研究十分匮乏,国内外文献鲜见报道.在荒漠地区,低温光照条件将对蓝藻结皮造成怎样的危害?其对蓝藻结皮的生理特性和形态结构带来哪些影响?为此,本研究在实验室条件下以人工蓝藻结皮为材料,通过模拟低温光照条件对结皮进行处理,探讨蓝藻结皮对低温光照胁迫的耐受性.这对于深入理解野外条件下蓝藻结皮对荒漠极端环境的适应性以及应用蓝藻结皮防治荒漠化,具有重要的理论意义和实际指导作用.1材料与方法1.1材料培养1.1.1藻种培养试验中所采用的具鞘微鞘藻(M.vaginatus)和爪哇伪枝藻(S.javanicum)是生物结皮中2种广泛存在且重要的优势种(丝状蓝藻),也是形成蓝藻结皮的主要藻类,由本学科组科研人员从荒漠生物结皮中分离纯化所得.将M.vaginatus和S.javanicum 分别采用BG-11培养基和BG-11培养基,于(25ʃ1)ħ、白炽灯40μE·(m2·s)-1光照条件下通气培养15 18d后收集藻培养物,备用.1.1.2人工蓝藻结皮形成取直径12cm的培养皿和流沙(来自库布齐沙漠的野外流沙)分别进行灭菌处理,将适量流沙装填入培养皿中作为培养基质.在无菌条件下将M.vaginatus和S.javanicum的藻培养物以体积比4ʒ1充分混匀,起始接种量(以Chl-a计)为 2.95μg·cm-2,以无菌操作方式将混合藻培养物均匀地接种在培养皿中的流沙表面.接种藻体后的流沙培养皿置于28ħ的光照培养箱(PGX智能型可编程光照培养箱,宁波市机电工业研究设计院),在30μE·(m2·s)-1光照条件下进行结皮培养.培养期间每天喷洒无菌蒸馏水以促进结皮形成(25 mL·培养皿-1),至第8d时人工蓝藻结皮已基本形成.1.2低温光照处理试验处理时,分别将上述培养第8d的初始人工蓝藻结皮停水2d后,于第3d(作为试验处理的起始0d)分别转入28ħ+60μE·(m2·s)-1(对照)、10ħ+60μE·(m2·s)-1、2ħ+60μE·(m2·s)-1和2ħ+黑暗进行低温光照处理,于处理第0、5和12d测定相关指标.每种处理设置349728期饶本强等:实验室条件下蓝藻结皮对低温光照胁迫的响应与微结构变化4个平行,所测数据均重复3次以上,取平均值.1.3结皮采样于低温处理的第0、5和12d 用圆形的小采样器(面积为0.485cm 2)采集结皮小块并小心去掉结皮底层过多的沙粒,然后进行相关指标测定.1.4试验指标测定1.4.1蓝藻结皮生物量测定蓝藻结皮的生物量用叶绿素a 含量表示.用采样器定期采集单位面积的蓝藻结皮样品,将结皮样品加入5mL 80%丙酮充分研磨后,然后在冰箱4ħ下黑暗静置抽提24h ,8000r ·min -1离心15min 后取上清,于分光光度计(Ultrospec 3000,PharmaciaBiotech ,Britain.)663nm 和646nm 测定光密度值,以公式(1)c a =12.21D 663-2.81D 646[15]计算每cm2的结皮样品所含叶绿素a 的含量,表示为μg ·cm -2结皮.1.4.2蓝藻结皮最大光化学效率F v /F m 测定采集各种处理下的蓝藻结皮样品,放入培养皿中.每皿放置3 6个结皮核,于室温下采用PAM-2100型(Walz ,Effertlich ,Germany )脉冲调制式荧光仪测定结皮叶绿素a 荧光参数:最大荧光(F m )和固定荧光(F o ),以公式(2)F v /F m =(F m -F o )/F m [16]计算藻体PS Ⅱ最大光化学效率F v /F m .F v /F m 为可变荧光与最大荧光之比,可以反映结皮的光合活性.1.4.3蓝藻结皮胞外多糖测定取不同处理下的蓝藻结皮样品,胞外多糖含量测定采用蒽酮-硫酸比色法[7]并作适当修改.测定时,结皮多糖用H 2SO 4(6mol·L -1)和适量蒸馏水抽提20min ,将抽提液用Whatman No.5滤纸过滤得到多糖粗提物,然后比色测定并根据标准曲线计算多糖含量,表示为μg ·cm -2结皮.1.4.4蓝藻结皮伪枝藻素和类胡萝卜素测定取1cm ˑ1cm 的风干后的结皮小块,充分研磨后加入丙酮用研钵捣碎,4ħ过夜后,用WhatmanNo.5滤纸过滤.用分光光度计测定384、490和663nm 处的光吸收值.按公式(3):A 384(Scyt.)=1.04A 384-0.79A 663-0.27A 490和公式(4):A 490(Car )=1.02A 490-0.08A 384-0.026A 663分别计算伪枝藻素含量和类胡萝卜素含量[17],表示为A·cm -2结皮.1.4.5蓝藻结皮藻蓝蛋白测定用小采样器定期采集单位面积的蓝藻结皮样品,将结皮样品充分研磨后悬浮于5mL pH 7.8的磷酸缓冲液,冰水浴下超声波破碎,离心(8000r ·min -1,10min ),用分光光度计测定上清液在波长615nm 和652nm 处的光密度值.按公式(5):藻蓝蛋白(C-phycocyanin ,PC )=(D 615-0.474D 652)/5.34[18]计算结皮提取液的藻蓝蛋白含量,单位为mg ·mL -1,最后换算成单位结皮面积的含量(μg ·cm -2结皮).1.4.6蓝藻结皮藻蓝蛋白/叶绿素比值测定取不同低温处理第0和12d 的结皮样品适量,用80%丙酮抽提叶绿素.上清液于663nm 和646nm 波长下比色,所得光密度值(D )代入上述公式(1)以及公式(6):c b =20.13D 646-5.03D 663分别计算结皮叶绿素a 和叶绿素b 含量,并按照公式(7):R =PC /(c a +c b )计算藻蓝蛋白/叶绿素比值.1.4.7蓝藻结皮生长发育特性测定目测法观察蓝藻结皮的表面形态和结皮颜色.游标卡尺测定结皮厚度.pH 值采用电极法测定(水土比=5ʒ1),结皮干重采用烘干法(105ħ、48h )测定[19].1.5蓝藻结皮超微结构观察分别取28ħ(CK )和2ħ低温处理下的蓝藻结皮样品,将结皮样品用毛刷小心地刷去结皮底部多余的沙粒,并切成0.3cm ˑ0.5cm 的小块,黏贴于电子显微镜样品台上,喷金镀膜后用JSM-5610LV (JEOL ,Japan )型扫描电子显微镜进行超微结构观察,照相.1.6数据统计分析采用统计分析软件SPSS 13.0对试验数据进行单因素方差分析(one-way ANOVA ).多重比较采用Duncan 法进行,采用小写字母表示不同处理之间的差异显著性水平(P <0.05).文中所有数据均重复3次以上,表示为平均值ʃ标准差(用误差线显示).2结果与分析2.1实验室低温条件下人工蓝藻结皮早期发育特征在表1中可以看出,实验室条件下形成的人工蓝藻结皮经过45d 的生长发育,已经具有非常良好的结皮表观形态特征.同时可见,低温光照抑制了蓝藻结皮的生长,表现为结皮颜色呈灰绿色,厚度变薄、干重降低,其厚度和干重与对照结皮之间存在明显差异.低温黑暗处理时,结皮形态则获得了一定程度的修复.2.2实验室条件下人工蓝藻结皮形成过程生长曲线如图1所示,在实验室条件下将蓝藻培养物接入沙物质表面后喷洒适量的水分,藻类先经历前4d5972环境科学33卷表1实验室条件下蓝藻结皮发育特征(45d 培养)Table 1Developmental characteristics of artificial cyanobacterial crusts under laboratory conditions (culture for 45days )处理结皮颜色结皮形状pH 结皮厚度/mm 结皮干重/g ·cm -228ħ+光照(CK )蓝绿色光滑平坦型7.760.79ʃ0.0470.092ʃ0.00510ħ+光照黄绿色光滑平坦型7.840.64ʃ0.0520.067ʃ0.0082ħ+光照灰绿色光滑平坦型7.930.45ʃ0.0340.039ʃ0.0072ħ+Dark浅绿色光滑平坦型7.890.53ʃ0.0290.051ʃ0.004的短期适应(缓慢生长),第5d 后即在沙面迅速生长,藻类生物量开始出现大幅度增加,至第8d 时沙表面的生物量达到11.28μg ·cm -2,为起始接种量的3.82倍.此时还可肉眼观察到蓝藻的藻丝体与沙粒之间相互缠绕、胶结,呈现藻类-沙粒结构形态,表明人工蓝藻结皮已经形成.图1人工蓝藻结皮形成过程生长曲线Fig.1Growth curve of artificial cyanobacterial crust duringthe initial formation process2.3低温光照对人工蓝藻结皮生物量的影响由图2可知,低温光照处理下蓝藻结皮的生物量与对照结皮生物量相比显著降低(P <0.05).对照条件下蓝藻结皮生物量在第5d 和第12d 一直处于上升阶段,而低温光照处理下蓝藻结皮第5d 和第12d 生物量逐渐降低.在2ħ+60μE·(m 2·s )-1处理第12d 时,结皮生物量比同期对照结皮生物量下降61.48%,比起始结皮(第0d 结皮,下同)生物量降低了34.12%.2种低温光照处理下的结皮生物量也存在显著差异(P <0.05).在2ħ低温黑暗处理下,蓝藻结皮生物量与起始结皮生物量相比显著升高,也显著高于10ħ和2ħ下的结皮生物量(P <0.05).以上结果表明低温光照胁迫对蓝藻结皮生物量具有明显的抑制作用,而低温黑暗则在一定程度上有利于结皮生物量的恢复.2.4低温光照对人工蓝藻结皮光合活性的影响图3表明,与对照相比,低温光照处理下蓝藻结图2不同处理人工蓝藻结皮生物量变化Fig.2Biomass changes of artificial cyanobacterial crustin differenttreatments图3不同处理人工蓝藻结皮光合活性变化Fig.3Variations in photosynthetic activities of artificial cyanobacterial crust in different treatments皮光合活性F v /F m 均出现显著性下降(P <0.05).在2ħ+60μE ·(m 2·s )-1处理第12d 时,结皮F v /F m 比同期对照结皮F v /F m 下降了94.89%,比起始结皮F v /F m 降低了91.96%.10ħ和2ħ在第5d 和第12d 时F v /F m 之间存在显著性差异(P <0.05).在2ħ低温黑暗第5d 时,结皮光合活性出现很大程度的升高;处理第12d 时,结皮光合活性比起始结皮光合活性下降了80.36%.由此可见,低温光照胁迫对蓝藻结皮的光合活性具有显著的抑制作69728期饶本强等:实验室条件下蓝藻结皮对低温光照胁迫的响应与微结构变化用,低温对结皮的光合系统可能造成了严重的损害,而低温黑暗对结皮光合系统具有较好的保护作用.2.5低温光照对人工蓝藻结皮胞外多糖含量的影响从图4中可以看出,低温光照处理第5d 时蓝藻结皮EPS 均出现显著下降,随后在第12d 又都呈现显著性增加(P <0.05).在第12d 时,2ħ+60μE·(m 2·s )-1处理下蓝藻结皮EPS 比同期对照结皮EPS 降低了66.37%,比起始结皮EPS 下降了46.57%.第5d 时2ħ+黑暗处理下结皮多糖含量与同期2ħ光照条件下无显著性差异(P >0.05),第12d 时2ħ+黑暗下多糖含量出现明显增加,且与同期2ħ光照下结皮多糖含量存在显著性差异(P <0.05).此结果说明低温光照胁迫对蓝藻结皮EPS 的合成造成了明显抑制,而低温黑暗则促进了结皮EPS 的分泌.图4不同处理人工蓝藻结皮胞外多糖含量的变化Fig.4Variations in exopolysaccharide content of artificial cyanobacterial crust in different treatments2.6低温光照处理下人工蓝藻结皮伪枝藻素和类胡萝卜素含量的变化图5(a )显示,与对照比,第12d 时低温光照胁迫导致蓝藻结皮伪枝藻素含量的显著下降(P <0.05),2ħ低温光照处理使蓝藻结皮伪枝藻素含量比同期对照结皮伪枝藻素含量降低了31.01%.10ħ和2ħ低温处理时蓝藻结皮的伪枝藻素含量与起始含量相比均变化不大.在2ħ黑暗条件下伪枝藻素含量显著低于10ħ和2ħ处理(P <0.05),也显著低于起始的伪枝藻素含量(P <0.05).在图5(b )中,在第12d 时,2种低温光照处理下类胡萝卜素含量均显著低于对照值(P <0.05),比同期对照结皮类胡萝卜素含量降低了59.38%,且10ħ和2ħ处理之间也存在显著性差异(P <0.05).第12d时,与起始类胡萝卜素含量比,10ħ处理无显著性变化(P >0.05),2ħ则出现显著性下降(P <0.05).第12d 时,2ħ黑暗下类胡萝卜素含量与2ħ下含无显著差异,与起始类胡萝卜素含量也不存在显著差异(P >0.05).从以上结果可以看出,低温光照对结皮伪枝藻素的合成抑制程度并不大,但低温黑暗明显抑制了结皮伪枝藻素的合成.低温光照对结皮类胡萝卜素的合成抑制程度较大,而低温黑暗对结皮类胡萝卜素的含量影响不大.图5不同处理人工蓝藻结皮伪枝藻素和类胡萝卜素含量的变化Fig.5Variations in scytonemin and carotenoid contents of artificialcyanobacterial crust in different treatments2.7低温光照处理下人工蓝藻结皮藻蓝蛋白含量及藻蓝蛋白/叶绿素比值变化图6不同处理人工蓝藻结皮藻蓝蛋白含量的变化Fig.6C-phycocyanin contents of artificial cyanobacterialcrust in different treatments由图6可见,12d 时低温光照处理导致蓝藻结皮藻蓝蛋白含量显著低于对照处理(P <0.05,ANOVA ),2ħ+60μE ·(m 2·s )-1处理时结皮藻蓝蛋白含量比同期对照结皮藻蓝蛋白含量降低了65.91%,且10ħ和2ħ处理之间藻蓝蛋白含量存在7972环境科学33卷显著差异(P <0.05).12d 时10ħ下蓝藻结皮藻蓝蛋白含量显著高于起始含量(P <0.05),而2ħ下显著低于起始含量(P <0.05).2ħ、黑暗下结皮藻蓝蛋白含量与起始含量无明显变化(P >0.05),但显著高于2ħ处理(P <0.05).图7表明,对照处理下第12d 时单位面积结皮藻蓝蛋白/叶绿素比值显著高于起始值(P <0.05),10ħ处理下单位面积结皮藻蓝蛋白/叶绿素的比值显著高于起始值、对照值和其它处理值(P <0.05).2ħ、黑暗时藻蓝蛋白含量与2ħ处理和起始值均无显著差异(P >0.05).结果说明10ħ低温光照条件并未降低蓝藻结皮的藻蓝蛋白含量,而2ħ低温光照对结皮藻蓝蛋白含量有明显抑制作用,2ħ低温黑暗则对结皮藻蓝蛋白合成有轻微促进作用.图7不同处理人工蓝藻结皮藻蓝蛋白/叶绿素比值变化Fig.7C-phycocyanin /chlorophyll ratios of artificial cyanobacterial crust in different treatments2.8低温光照对人工蓝藻结皮超微结构的影响从TEM 试验中可以看出(图8 10),实验室条件下将荒漠蓝藻接入流沙,形成的人工蓝藻结皮能够在较短的时间内形成,可以观察到结皮的表层和底层长满丰富的藻丝体,并且藻丝体分泌的丰富的黏性胞外多糖将沙粒紧紧缠绕在一起,形成一种胶结现象.对照处理时(28ħ),发现大量的藻丝体密集成束分布结皮的表层,且藻丝体排列有序,密集的藻丝体交错分布形成致密的孔隙;在蓝藻结皮的底层,丰富的藻丝体对沙粒进行“捆绑”和包裹.在低温胁迫处理下,结皮表层稀薄的藻丝体敷在沙粒表面并形成蜂窝孔状,藻丝体数量减少且松散分布,藻丝体杂乱分布形成宽大的空隙,结皮底层则出现大量的未被藻丝缠绕的裸露沙粒,仅有稀疏的藻丝体对沙粒进行缠绕.3讨论荒漠生物结皮在野外条件下不可避免遭受受低温光照环境的胁迫.笔者在内蒙古库布齐沙漠地区测得28a 的月平均气温和月最低气温发现,该区7月最高平均气温仅为23ħ,最低气温在11.9ħ以下(图11),表明生长在此地的自然结皮和人工结皮经常遭受低温胁迫.温度和光照是决定生物分布与生物量的重要环境因子之一.低温胁迫包括冷胁迫(0ħ以上)和冻胁迫(0ħ以下).低温对植物细胞造成伤害的主要部位是膜系统,生物膜的变化对植物耐受低温起重要作用,此外低温对植物的光合作用也产生抑制作用,是植物遭受冷害(0ħ以上低温)的一个重要表现.本研究中,低温光照处理导致蓝藻结皮生物量(叶绿素a )显著降低,生长活性和发育特性受到抑制.原因可能是低温破坏叶绿素结构,导致叶绿素分解的结果.本研究表明,低温光照培养条件下,蓝藻结皮光合活性F v /F m 显著受到抑制,出现低温光抑制现象,这意味着低温光照胁迫对结皮的光系统带来了直接的损害.研究表明,植物在低温黑暗条件下几乎看不到光抑制损伤,但在低温光照条件下,光合系统Ⅱ(PS Ⅱ)则受到抑制,低温光照对光合系统损伤比低温黑暗更严重[20].Zak 等[21]在集胞藻PCC6803中发现在低温和弱光条件下PS Ⅰ可能是光抑制损伤的主要部位,PS Ⅰ反应中心蛋白PsaA 和PsaB 降解,而PS Ⅱ的活性及完整性并不受影响.低温光照引起细胞伤害的一个重要原因是降低清除活性氧(ROS )的抗氧化酶活性,阻碍抗氧化剂及其它保护物质生成,导致ROS 在体内积累[22].冷胁迫诱导了叶绿素和类胡萝卜素的非酶化加氧作用,使细胞内产生了氧自由基,发生了脂质过氧化以及DNA 损伤,这也造成藻类光合活性的下降[23].很多丝状蓝藻能够分泌大量的胞外多糖(EPS )进入周围的环境.蓝藻EPS 通过增加土壤稳定性,土壤肥力和提高干旱耐受性而在结皮的生存和发育中扮演重要角色[24].研究还表明,EPS 是蓝藻对抗各种环境胁迫的一种有效的保护剂[25].本研究发现,冷胁迫导致结皮EPS 含量的显著下降,这可能代表了结皮对冷胁迫的一种极为不利的响应,因为结皮分泌的EPS 可能对其提高低温或冷胁迫的耐受性起作用.本研究还表明,低温对蓝藻结皮伪枝藻素的合成影响不大,但低温黑暗时伪枝藻素含量降低,且低温对类胡萝卜素的合成造成了不利影响.生存在荒漠地区的蓝藻必须耐受荒漠生境中强烈的紫89728期饶本强等:实验室条件下蓝藻结皮对低温光照胁迫的响应与微结构变化(a )28ħ(对照)处理时结皮的上表层(比例尺为500μm ),箭头示结皮呈深色,浓密的藻丝体紧固地与沙粒缠绕并形成很多致密的孔隙;(b )28ħ(对照)处理时结皮的上表层(比例尺为100μm ),箭头示致密的藻丝体成束分布;(c )28ħ(对照)处理时结皮的上表层(比例尺为50μm ),箭头示丰富的藻丝体成片有序排列;(d )28ħ(对照)处理时结皮的上表层(比例尺为10μm ),箭头示大量的藻丝体胶结在一起;(e )2ħ处理时结皮的上表层(比例尺为500μm ),箭头示结皮呈灰白色,稀薄的藻丝体敷在沙粒表面并形成蜂窝孔状;(f )2ħ处理时结皮的上表层(比例尺为100μm ),箭头示杂乱的藻丝体松散分布;(g )2ħ处理时结皮的上表层(比例尺为50μm ),箭头示稀疏的藻丝体呈网状无序排列;(h )2ħ处理时结皮的上表层(比例尺为10μm ),箭头表示少量的藻丝体交错形成大的空隙图8低温光照处理下蓝藻结皮上表层微结构特征Fig.8Ultrastructural characteristics of the upper surface of cyanobacterial crusts in treatments with low temperature and light9972环境科学33卷(a )28ħ(对照)处理时结皮的下表层(比例尺为500μm ),箭头示沙粒被密集的藻丝体缠绕;(b )28ħ(对照)处理时结皮的下表层(比例尺为100μm ),箭头示丰富的藻丝体成簇分布;(c )28ħ(对照)处理时结皮的下表层(比例尺为100μm ),箭头示成片的藻丝体包裹沙粒;(d )2ħ处理时结皮的下表层(比例尺为500μm ),箭头示大量未被藻丝缠绕的裸露沙粒;(e )2ħ处理时结皮的下表层(比例尺为100μm ),箭头表示少量的藻丝体零散分布;(g )2ħ处理时蓝藻结皮的下表层(比例尺为100μm ),箭头表示稀疏的藻丝体对沙粒的附着图9低温光照处理下蓝藻结皮下表层微结构特征Fig.9Ultrastructural characteristics of the undersurface of cyanobacterial crusts in treatments with low temperature and light外辐射.蓝藻在长期的进化过程中,对紫外辐射形成了一定的保护性适应机制,这些机制主要包括:趋避迁移、产生保护色素、DNA 修复系统和抗氧化系统的高效诱导反应等[26].例如,蓝藻外鞘中含有紫外保护色素,如伪枝藻素、MAAs 和类胡萝卜素等[27].其中,伪枝藻素是一种由蓝藻产生的用于保护其对抗紫外辐射胁迫的重要紫外吸收物质,蓝藻结皮中丰富的伪枝藻素含量有利于结皮在辐射胁迫下的正常生长发育[28].研究表明,大量的伪枝藻素合成和积累通常发生在蓝藻藻丝体暴露于光辐射下,并且其合成量随辐射强度的增强而增加[17].Sakamoto 等[29]研究发现,在液体培养条件下低温会导致藻类藻蓝蛋白/叶绿素比值降低,积累糖原,生长减慢.在本研究中,发现低温对单位面积结皮的藻蓝蛋白/叶绿素比值影响不大,甚至在10ħ时出现升高的现象,这可能是低温下蓝藻结皮不同于低温082。
