配合物的磁性-宋友
第二章 2.4 过渡金属配合物的磁性

中心原子的磁矩: 中心原子的磁性与电子Βιβλιοθήκη 轨道运动、自 旋运动存在如下关系:
L+S = 4S(S1) L(L 1) 对第一系列过渡金属,轨道运动对磁矩的贡献很小,故 可以忽略, S 可由唯自旋公式计算: S ={4S(S+1)}1/2 B, 这儿 B为玻尔磁子
在 VO43 - 、 CrO42 - 、 MnO4 - 系 列中, 中心金属离子氧化性逐渐增强, 电荷迁移所需能量逐渐降低, 所以含 氧酸根离子颜色逐渐加深:
如MnO4-中的Mn(Ⅶ)比CrO42- 中的Cr(Ⅵ)的氧化性强, 跃迁能量低, 跃迁容易, 所以MnO4-吸收500-560 nm(绿色)的光, 呈现紫红色;CrO42- 吸收480-490 nm(绿蓝色)的光, 呈 现橙色。
Co3+ 的八面体配合物的颜色
[Co(H2O)6]3+ [Co(NH3)6]3+
蓝色
黄棕色
[Co(NO2)6]3- [Co(en)3]3+
橙黄色
黄色
[Co(C2O4)3]3 - [Co(en)2 (C2O4)]+ [Co(EDTA)]- [Co(CN)6]3-
绿色
紫红色
紫色
黄色
2.5.2 电荷迁移光谱
配体内部的电子光谱
配位体如水和有机分子等在紫外区经常出现吸收谱带。形成配合物后, 这 些谱带仍保留在配合物光谱中, 但从原来的位置稍微有一点移动。
配位体内部的光谱包括以下三种类型:
① n→* 处于非键轨道的孤对电子到最低未占据的空轨道 σ*反键轨道的跃迁。水、醇、胺、卤化物等配体常发生这类跃 迁。
2.4 配合物的磁性
作为单分子磁体的分子自旋电子研究进展

单分子磁体与分子自旋电子材料Single-Molecule Magnets and Materials of MolecularSpintronics姜国民陈婷婷史传国江国庆*石玉军*南通大学化学化工学院摘要:近年来,自旋电子和分子电子两个新颖学科在电子学研究中取得了革命性的进展。
这两个领域的基础桥梁是分子磁材料,尤其是单分子磁体。
分子自旋电子是在分子水平上对电子自旋和电荷进行研究,电子装置中包括一个或多个磁性分子,如分子自旋晶体管、分子自旋电子管和分子多量子点装置等。
建立在分子水平上的自旋电子磁材料,在信息储存和量子计算等方面上具有潜在的应用价值。
本文结合自己在这方面的研究和理解,介绍了作为磁性分子的单分子磁体在自旋电子器件研究中的最新成果。
关键词:自旋电子单分子磁体磁性质1、引言在基础和应用研究中,电子和自旋自由度的研究和开发是很有前途的领域[1]。
近十年来,自旋电子学科从基础物理到技术装置已经有了很大的进展[2]。
人们开拓了自旋电子体系这样的事实:电流是由向上和向下两个方向的电子流动产生的,电子的自旋状态实现了信息的编码和磁性材料之间的不同作用。
在没有外场和低能量的条件下,通过自旋的持久性进行信息编码的优势很小。
新的努力方向是直接得到具有持久的量子相干自旋电子装置,这一装置已经从金属、半导体[2,3]到有机材料[4]方面进行了基础研究。
后者在实际中得到了应用,如有机光放射二极管和有机晶体管的研制使电子装置达到了分子水平[5]。
分子自旋电子是用一个或几个磁性分子建立的分子装置[6]。
作为磁性分子的单分子磁体在低温时磁化强度的弛豫时间非常长(2K以下,达到数年时间[7])。
其在高密度信息储存和量子计算方面的优势在于,在分子水平上兼有块状磁材料的性质和长相干时间[8]。
建立在磁学行为的单分子磁体具有丰富的物理效应,如负微分电导特性和完全的电流抑制[9],这些性质可用在电极上。
此外,还可将一些特殊的功能(如作为光和电场的开关等)直接整合到分子水平上。
羧甲基纤维素钠辅助磁性Fe_3S_4纳米复合物的合成及其吸附与吸波性质研究

Fe3 S4 是一种具有潜在应用价值的多功能 化物, 材料, 可作为电材料、 磁性材料、 催化剂, 并运用于 生物领域
[4 ]
。 在已有文献中, Fe3 S4 具有不同的
[5 ] [6 ] [7 ] 、 纳米片 、 纳米粒子 等,
形貌, 包括纳米线 有很大的关联。
其性能与其形貌和结构, 取向等, 比如晶体大小、 目前,利用纤维素及其衍生物作为分散剂通 过溶胶凝胶法制备纳米粒子已引起人们的日益
图1 产物的粉末 X 射线衍射( XRD) 谱图( a) 和晶胞结构图( b) Fig. 1 XRD pattern ( a) and cell structure ( b) of the assynthesized samples 1998 垂直线是 Fe3 S4 的标准衍射图谱, 卡片号 89-
the presence of sodium carboxymethylcellulose ( CMCNa ) and characterized by XRD,SEM,TEM,FT IR,VSM, and UVVis spectrometry. The results indicated that the formation of the samples depends strongly upon the reaction temperature and time. The asprepared nanocomposites have efficient adsorption abilities for methylene blue ( MB) in waste water and microwave absorption property at room temperature. Keywords CMCNa,Iron sulfide,Methylene blue,Adsorption,Microwave absorbing
宋天佑无机(二)习题答案

12-2 完成并配平下列反应的化学方程式。
(1) H2+Ca=CaH2(2) Fe2O3+3Na2O2=2Na2FeO4+Na2O(3) BaO2+H2SO4=BaSO4+H2O2(4) Li2CO3=Li2O+CO2(5) 5Na2O2+2MnO4-+16H+=5O2+2Mn2++10Na++8H2O(6) 2Na2O2+2H2O=4NaOH+O2(7) 2Na2O2+2CO2=2Na2CO3+O2(8) 4KO3+2H2O=4KOH+5O2(9) Mg3N2+6H2O=3Mg(OH)2+2NH3(10) TiCl4+4Na=4NaCl+Ti12-6 拟除掉BaCl2溶液中的少量FeCl3杂质,试分析加入Ba(OH)2和BaCO3哪种试剂更好。
解:加入Ba(OH)2更好。
Ba(OH)2和BaCO3与FeCl3发生的反应分别为:2FeCl3+3BaCO3+3H2O=2Fe(OH)3+3BaCl2+3CO22FeCl3+3Ba(OH)2=2Fe(OH)3+3BaCl2由反应方程式可知,BaCO3与FeCl3反应产物中有CO2,CO2不能完全脱离体系,有杂质存在。
而Ba(OH)2与FeCl3反应没有杂质生成,若Ba(OH)2过量可以定量加入HCl转化为BaCl2。
12-16 在温度高于1020 K条件下,BeCl2气体以单分子形态存在,其中Be为杂化;当BeCl2气体温度低于该温度时,以二聚体形式存在,其中Be为sp2杂化;无水固态BeCl2具有链状结构,其中Be为sp3杂化。
试分析上述各种BeCl2的成键形式与空间构型。
解:单分子中Be以sp方式杂化,形成两个有单电子的杂化轨道,在空间呈直线型分布。
每个含有单电子的sp杂化轨道与Cl原子的单电子轨道重叠形成σ键,故BeCl2单分子呈直线型。
ClBe Cl二聚体中,Be 以sp 2方式杂化,形成两个有单电子的杂化轨道和一个空的杂化轨道,杂化轨道为平面三角形。
配合物的磁性宋友.pptx
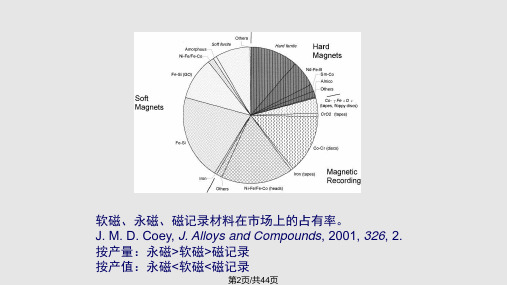
图7 变温磁性,室温下MT =
2.61 cm3 K/mol, C = 0.125
(2.22 1/23/23+ 221/23/22) = 2.11 cm3 K/mol, 铁磁性交换。
铁磁体降温过程是 Si (Si 1) 到 S j (S j 1) ST (ST 1)的过程,其中
i
j
i>j,但 ST (ST 1)>> Si (Si 1) 比如两个Cu2+离子形成一个磁畴。
12
Cp
0.2
m'
m''
11
长程有序,Neel温度
10
0.1
9
8
0.0
7
0
5
10
15
20
T/K
6 123456789 T/K
图11 交流信号和比热测试
第20页/共44页
图12 比热测试确定相变: 左图:Inorg. Chem. 2005, 44, 5322 右图:Inorg. Chem. 2005, 42, 8572.
第17页/共44页
铁磁体和亚铁磁体的交流磁性
m' / emu G mol-1 m'' / emu G mol-1
1.0
4.0
3.5 0.8
3.0
0.6
2.5
2.0
0.4
1.5
1.0
0.2
0.5
0.0
0.0
-0.5
20 30 40 50 60 70 80
30
40
50
60
T/K
T/K
图9 铁磁体和亚铁磁体的交流信号通常没区别。
5000 0
宋天佑无机化学 配位化学基础PPT学习教案

第10页/共96页
NH3
CI
Pt
NH3
CI
NH3
CI
Pt
CI
NH3
顺式(cis-) 同种配体处于相邻位置
u>0 棕黄色 S=0.2523 g/100g水
反式(trans-) 同种配体处于对角位置
u=0 淡黄色 S=0.036g/100g水
Ag+
4d Ag(NH3)2 +
sp 5p
例:[AgCl2]- , [CuCl2]- NH3 NH3
第39页/共96页
配位数为4的配合物
1S 2S
2P
Be2+
1s
sp3
[BeX4]2-
[
]
F- F- F- FH2O H2O H2O H2O
第40页/共96页
Ni2+
[Ni(CN)4]2-
[NiCL4]2-
第8页/共96页
§11-1 配合物的空间构型命名和磁性
11.1.1 配合单元的空间结构
为减小彼此间的静电排斥力,配体尽量对称 分布于中心离子周围。
单齿配体配位数 配合单元空间构型
2
直线
3
平面三角形
4
平面正方形或四面体
5
三角双锥或四方锥
6
八面体
第9页/共96页
11.1.2 配合物的异构现象
化学式相同,结构不同,性质不同 几何异构—配体在中心原子周围因排列方式不同 而产生的异构现象。
第37页/共96页
2.杂化类型与配合单元的几何构型
配位数 2 3
配合物的磁性全解

,这样的材料叫做软磁性材料。如:制电磁铁 3.矩磁材料:矩磁材料的磁滞回线接近于矩
形 算,机特的“点记是忆剩”磁元Br接件近。饱和值BS。可作电子计
“磁性”的发现历程: 任何物质都具有磁性,磁性是物质的一种基本性质。
零场冷却磁化强度(ZFCM)、场冷却磁化强度(FCM)
场冷(fieldcooling,FC):加磁场后降温测试M(or极 化率)随T的变化关系。如为超顺磁或顺磁则在加 场后磁矩趋向一致; 零场冷(zerofieldcooling,ZFC)先将样品的温度降 至样品的临界温度(Tc),再外加磁场,测量样品升温 过程磁矩对温度的变化。 两曲线经常放在一个图中比较,如果两者重合, 则说明可能是超顺磁性。 零场冷和场冷中的磁矩通常被用来决定超导转变 温度Tc
M 是摩尔磁化率(emu mol-1, cm3 mol-1),H是磁场
强度(G, Oe, T)
M
Ng
2
2 B
3k T
S(S 1)
C T
C居里常数。NB2/3k = 0.125 emu K mol-1,所以: C = 0.125g2S(S+1) = MT(室温) = 常数
M = 1M + 2M + 3M + ··· =iM = (Ng2β2/3kT)Si(Si+1)
0.2
1.0
0.1
0.9
0.0 0
0.8 50 100 150 200 250 300
T/K
图24 MT是一直线,拟合结果:g
= 2.05, J = -0.0355 cm-1
T / emu mol-1 M
化学竞赛中配合物磁性推断方法的探索

177学习版摘 要:磁性是配合物理论中的重要概念,如何推断配合物是顺磁性还是抗磁性是无机化学与结构化学中一个值得探索的问题,本文旨在归纳和探索一套推断配合物磁性的方法,容易理解,可供化学竞赛初学者参考。
关键词:配合物 磁性磁性是配合物理论中的重要概念,配合物的磁性一般可通过配合物价键理论推理,也可通过磁矩计算得知,这一点常常成为中学化学竞赛的考点,而通常的无机化学和结构化学教材中尚无专门的章节来系统的论述配合物的磁性,因而,这也留给了广大化学爱好者积极探索的空间,笔者经过仔细研究一些配合物的磁性情况,吸取教学中的方法,并结合自己对配合物价键理论的认知,笔者一些心得与各位同仁分享。
一、推断配合物磁性的方法:理论推理法,通常认为,根据配合物中心原子或离子(统称为中心原子)上是否有单电子(即未成对电子)把配合物的磁性分为顺磁性和抗磁性(或逆磁性)。
推断配合物磁性的要点,笔者提出的推断配合物磁性的方法,主要包括以下两个要点:一、中心原子上有单电子,则配合物的磁性为顺磁性;反之,中心原子上无单电子,则配合物的磁性抗磁性;二、中心原子上的价电子构成是轨道杂化后的价电子组态。
推断配合物磁性的步骤,用上面的方法推断配合物磁性,可采用下面步骤:其一、根据配合物的价键理论确定配合物中心原子的杂化类型;其二、确定配合物中心原子上的价电子构成;最后、根据配合物中心原子上是否有单电子确定配合物的磁性。
配合物的价键理论认为,配体提供来形成配位键的电子是进入中心原子的原子轨道的,或者说,只有中心原子提供原子轨道来接受配体提供的电子对,才能形成配位键。
而形成配位键时,中心原子提供的原子轨道必发生杂化,主要杂化类型有:常见配合物之所以有两种杂化轨道类型,是由中心原子有没有可提供的内层d 轨道决定的。
例如,FeCl 4-中Fe 3+有5个3d 电子,而Cl-为弱场配体,可提供接受配体孤对电子的只有外层4s 和4p 空轨道,四配位的FeCl 4-为sp3外轨型杂化,内层3d 轨道不参与杂化,因此中心原子上的价电子构成为3d5,5个3d(内层)轨道有5单电子,所以FeCl 4-磁性为顺磁,相反,Ni2+有8个3d 电子(占满3个3d 轨道,有2个3d 轨道均只填一个电子),当接受配体提供的4对孤对电子时,发生一个“压缩式”重排,挤出一个空的3d 轨道,因此四配位的Ni(CN)42-为dsp2内轨型杂化,重排后的3d(内层)轨道无单电子,所以Ni(CN)42-磁性为抗磁。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
桥联配体:O (OH, H2O),CN-,N3-,咪唑, 三氮唑,四氮唑等等 特殊结构要求的限制配体:任何含多个给 体原子的螯合配体。通常用于低维磁体的 合成。三维磁体则需要小的配体,和上述 桥配体类似。
相转变温度在100K以上的分子基磁体
化合物 Ni2A(O)x(H2O)y(OH)z : A = DDQ (2,3-dichloro-5,6-dicyano-1,4benzoquinone, A = TCNQ, A = TCNE Nature 2007, 445, 291 [{Ru2(O2CPh-m-F)4}2(BTDA-TCNQ)] KVII[CrIII(CN)6] V(tcne)2· 0.5CH2Cl2
南京大学配位化学 国家重点实验室
配合物的磁性 (磁性基础知识)
宋 友
磁性材料(无机和分子基)
5000
数 文
SCI 论
4000 3000 2000 1000 0 1975 1980 1985 1990 1995 2000 2005 2010
1975年-2011年2月以“磁性(magnetic)”和“材料 (materials)”为关键词的SCI论文数。
1.0 0.8
-1
-1
4.0 3.5 3.0
m' / emu G mol
0.6 0.4 0.2 0.0 20 30 40 50 60 70 80
m'' / emu G mol
2.5 2.0 1.5 1.0 0.5 0.0 -0.5 30 40 50 60
T/K
T/K
图9 铁磁体和亚铁磁体的交流信号通常没区别。
ˆ L lˆi
i
i
ˆ ˆ S si
i
ˆ ˆ ˆ J LS
g 1
S ( S 1) J ( J 1) L( L 1) 3 S ( S 1) L( L 1) 2 J ( J 1) 2 2 J ( J 1)
ˆ ˆ g B J
800 600 400 200 0 -200 0 5 10 15 20 25 30
1 0 -1 -2 -3 -4 -60000 -40000 -20000 0 20000 40000 60000
-1
T/K
H / Oe
图4 确定Tc = 16 K
图5 可确定饱和磁化强度: Ms = gisiB (M/6.022/9.274)
2 Ng 2 B M 3k T
S (S 1)
C T
C居里常数。NB2/3k = 0.125 emu K mol-1,所以: C = 0.125g2S(S+1) = MT(室温) = 常数 M = 1M + 2M + 3M + ·· · =iM = (Ng2B2/3kT)Si(Si+1)
2010 500
存储密度接近现有技术的极限
最新报道的研究数据: 1000 G/in2 产品年代
IBM公司硬盘驱动器存储密度发展趋势 Stipe, B.C. et al Nature Photonics 2010, 5, 1
与磁性相关的金属离子
用于三维有序分子磁体的合成:以第一过渡系金 属离子为主,V~Cu。稀土离子是近几年研究的 又一热点,但性质不好。
ac ( ) ' ( ) i " ( )
4.3 反铁磁体和反铁磁性化合物
↑↓↑↓↑↓↑↓↑↓
短程有序,非Neel温度
0.08 0.07 0.06
M / emu mol
M MT
2.0
0.08 0.07
1.5
M
MT / emu K mol
0.04 0.03 0.02 0.01 0.00 0 50 100 150 200 250 300
10 9 8 7 6
0.0
0
5
10
15
20
-1
0.1
Cp / J K mol
1
2
3
4
5
6
7
8
9
T/K
T/K
图11 交流信号和比热测试
图12 比热测试确定相变: 左图:Inorg. Chem. 2005, 44, 5322 右图:Inorg. Chem. 2005, 42, 8572.
图13 反铁磁体的变温磁化率曲线
6
40
5.0 4.5
M MT
4 2
-1
H//ab H//c
-1
35 30
4.0 3.5 3.0
MT / emu K mol
M / emu mol
M / N mol
25 20 15 10 5 0
0 -2 -4 -6
Ng MT 3k
2
2
S (S
i
i
1)
2.5 2.0 1.5 1.0 0.5 0.0 -0.5
低 维 磁 体 : 磁 各 向 异 性 强 的 离 子 , 如 Co(II) , Mn(III),低自旋的Fe(III)等。稀土离子具有非常 强的旋轨偶合和磁各向异性,但f电子耦合作用很 弱,目前见到真正的低维磁体还很少 。Dy3+ 、 Tb3+、U4+等单核化合物可以显示磁体的性质。
分子磁体合成中常用的配体
图1 常见磁体或磁耦合的种类
4.1. 铁磁体↑↑↑↑↑↑↑
H//[001]
H//[110]
顺磁相
铁磁相 无外场
铁磁相 磁场下
高场或低温 时铁磁相
图2 Si-Fe晶体中畴壁位移和磁畴转动示意图
30000 25000
磁场不为零的磁畴
zfc fc
M / cm G mol
20000 15000 10000 5000 0 0 50 100 150 200 250 300
-1
-3000 -2000 -1000
0
1000 2000 3000
0
50
100
150
200
250
300
H / Oe
T/K
图6 Ms = gisiB= gCu3/2 + gFe 2/2 = 5.3 NB mol-1, 实 验值5.61 NB mol-1
图7 变温磁性,室温下MT = 2.61 cm3 K/mol, C = 0.125 (2.22 1/23/23+ 221/23/22) = 2.11 cm3 K/mol,铁磁性交换。
1.0
M / emu mol
0.05
-1
-1
0.06 0.05 0.04 0.03
0.5
-1
0.0
0
10
20
30
40
50
T/K
T/K
图10 反铁磁体:NiII+2radical,但相变温 度要低于变温磁化率最大值。
12
0.2
-1
Cp
m' m''
11
-1
长程有序,Neel温度
mac / emu G mol
IC 2003, 42, 1625; JACS 2007, 129, 13872 JACS 2011, 133, 15113
315 310
270 240, 190 230, 125 150 115 106
1. 量子力学基础
量子力学认为原子中任一电子的状态可以用n, l, ml 和s四个量子数来描述: 主量子数n,n = 1,2,…,决定原子中电子的能 量 角量子数l,l = 0,1,2,…,n-1,决定电子绕核运 动的角动量的大小 磁量子数ml,ml = 0,± 1,± 2,…,± l,决定电 子绕核运动的角动量在外磁场中的取向 自旋量子数ms,ms = ± 1/2,决定电子自旋角 动量在外磁场中的取向
-T
4. 常见的磁性类型
4.5 4.0 3.5 3.0 2.5
M / NB
2.0 1.5 1.0 0.5 0.0 -0.5
H
Diamagnet Antiferromagnet Paramagnet with antiferromagnetic coupling Paramagnet Paramagnet with ferromagnetic coupling Metamagnet Ferrimagnet Ferromagnet
三个能量间的竞争: H, J, kT
3
-1
磁场为零的磁畴
T/K
图3 铁磁体的零场降温曲线(zfc)和有场升温曲线(fc)
Cu3[Fe(CN)6]2· 4NH3· 2O的磁性。 9H
1400 1200
zfcm fcm
4 3 2
polycrystalline
M / emu G mol
-1
1000
M / N mol
图14 二维反铁磁性化合物 [Mn(titmb)(N3)2]n· 1.5H2O
-1
T/K
0.000006
非反铁磁体
mac / emu
0.000005 0.000004 0.000003 0.000002 0.000001 0.000000 0 10 20 30 40
m' m''
短程有序峰常出现于Mn、 Ni等耦合作用弱的化合物 中。
[CrII0.36CrIII1.76(CN)6] · 2.8H2O CrII3[Cr (CN)6]2· 2O, Cs0.75[Cr 2.125(CN)6]· 2O 10H 5H (Et4N)0.5Mn1.25[V(CN)6] · 2O, Cs2MnII[VII(CN)6] 2H Phthalocyanine-Mn (2D) (VIVO)3[CrIII(CN)6]2· 2O 10H [Mn2(tea)Mo(CN)7]
