物质在溶解过程中有能量变化吗
物质溶解的本质

物质溶解的本质
物质的溶解是指固态、液态或气态的物质在另一种物质中均匀混合形成溶液的过程。
这个过程可以明显改变溶质和溶剂的物理性质,且伴随能量变化。
物质溶解的本质可以从以下几个方面来解释:
1. 分子间相互作用力的影响:在溶解过程中,溶质和溶剂之间相互作用力的强度对于溶解产生很大的影响。
当溶剂分子和溶质分子之间的作用力强于同种分子之间的作用力时,溶解过程将更为容易。
2. 熵增原理:物质溶解的过程是自由能变化的过程,因此受到熵增原理的制约。
溶解时,溶质分子进入溶剂中,从有序到无序的趋势是熵增的。
因此,溶解过程有助于增加体系的熵值,促进溶解的发生。
3. 热力学效应:物质溶解有时涉及放热或吸热过程。
一些物质的溶解是放热的,如氯化钠在水中的溶解;而一些物质的溶解是吸热的,如氨在水中的溶解。
热力学效应对于溶解的热力学稳定性和速率有很大影响。
4. 物质结构的影响:物质的分子结构对于溶解也有很大的影响。
溶剂分子必须能够与溶质分子间的相互作用力相匹配。
例如,有机物一般只能在有机溶剂中溶解,而无机物则通常只能在水中溶解。
物质溶解的本质是一个复杂的过程,它涉及分子间相互作用力、热力学效应、物质结构等多个因素。
通过深入了解这些因素,我们可以更好地掌握物质的溶解规律,并有助于寻找更高效的溶解方法。
物质溶解过程中的能量变化
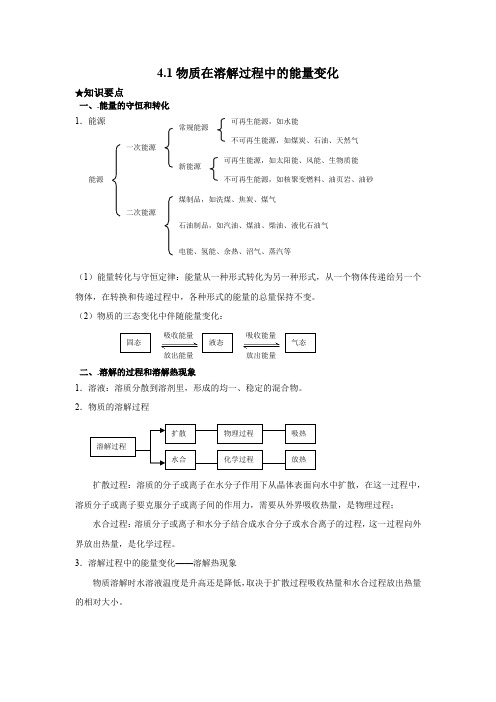
4.1物质在溶解过程中的能量变化★知识要点一、.能量的守恒和转化 1.能源(1)能量转化与守恒定律:能量从一种形式转化为另一种形式,从一个物体传递给另一个物体,在转换和传递过程中,各种形式的能量的总量保持不变。
(2)物质的三态变化中伴随能量变化:二、.溶解的过程和溶解热现象1.溶液:溶质分散到溶剂里,形成的均一、稳定的混合物。
2.物质的溶解过程扩散过程:溶质的分子或离子在水分子作用下从晶体表面向水中扩散,在这一过程中,溶质分子或离子要克服分子或离子间的作用力,需要从外界吸收热量,是物理过程; 水合过程:溶质分子或离子和水分子结合成水合分子或水合离子的过程,这一过程向外界放出热量,是化学过程。
3.溶解过程中的能量变化——溶解热现象物质溶解时水溶液温度是升高还是降低,取决于扩散过程吸收热量和水合过程放出热量的相对大小。
扩散 溶解过程 水合 物理过程 化学过程 吸热放热 能源 一次能源 二次能源 新能源 常规能源 可再生能源,如水能 不可再生能源,如煤炭、石油、天然气 可再生能源,如太阳能、风能、生物质能 不可再生能源,如核聚变燃料、油页岩、油砂 煤制品,如洗煤、焦炭、煤气石油制品,如汽油、煤油、柴油、液化石油气 电能、氢能、余热、沼气、蒸汽等 吸收能量 固态 液态 气态吸收能量 放出能量 放出能量三、溶解和结晶1.溶解:溶质分散到溶剂中的过程。
2.结晶:晶态溶质从溶液中析出的过程。
3.溶解和结晶的宏观现象和微观过程溶解和结晶作为宏观现象是不能同时观察到的。
但是,就微观粒子的运动状态而言,溶解和结晶这两个过程则是同时进行的相反(互逆)的过程,即在溶液里溶质进行溶解的同时,也进行着结晶,在一定条件下建立起一个动态平衡体系——溶解平衡。
4.溶解平衡在一定条件下的饱和溶液中,当物质溶解速率和物质晶体析出速率相等,这个溶液体系就达到了溶解平衡状态。
若改变外界的条件(包括改变溶剂量或温度),则可不同程度地改变微观粒子的溶解速率和结晶速率,原来的溶解平衡被破坏,并在新条件下建立新的平衡。
融解和溶解的区别的意思

融解和溶解的区别的意思
融解和溶解是化学术语,它们可以用来描述物质分解的不同过程。
它们之间有一定的差别,因此不要把它们混淆。
首先,融解可以指物质以液体形式发生化学变化,释放出有机物质,这种过程就是融解。
它可以发生在固体物质上,并且最常见的融
解过程是水和冰之间的融解过程。
水融解冰时,冰中的水分子释放出
热量,这种能量的释放使冰变得更灵活,因此导致冰的变形或消解。
溶解是指物质在液体中被解离,释放溶质分子,也就是固态物质
进入液态物质中,使得溶液中出现了新物质。
普通溶解过程中,添加
热量会帮助溶剂和溶质快速而有效地混合在一起,但热量并不会破坏
物质的结构。
在普通溶解过程中,物质本身会因为某种方式而被破坏,这可能会影响最终的结果。
两者之间有一定的差别,就是融解只需要改变温度使物质发生变化,而溶解需要将溶剂与溶质混合在一起才能形成新的物质。
因此,
溶解是添加溶剂可能会影响结果的过程,而融解是改变温度以改变状
态的过程。
总的来说,融解和溶解是完全不同的过程,尽管都属于物质分解
的范畴,但它们在化学上是完全不同的,因此不能混淆。
更准确地说,溶解是液体中发生化学反应的过程,而融解是只用改变温度来改变状
态的过程。
科普版九年级化学上册《单元物质的溶解过程》评课稿

科普版九年级化学上册《单元物质的溶解过程》评课稿1. 引言本篇评课稿旨在对科普版九年级化学上册的《单元物质的溶解过程》进行评价和总结。
本单元是九年级化学教学中的重要内容,涉及到物质的溶解过程及其背后的原理。
通过本单元的学习,学生将能够了解溶解的概念、溶解过程中的能量变化以及影响溶解的因素等。
2. 教材内容分析本单元的教材内容主要包括以下几个方面:2.1 溶解的概念教材首先介绍了溶解的概念,通过生活中的实际例子,让学生了解溶解是一种物质在溶剂中均匀分布的过程。
通过这一部分的学习,学生可以理解溶解的基本概念。
2.2 溶解过程中的能量变化接着,教材介绍了溶解过程中的能量变化,包括溶解过程中的吸热和放热现象。
通过示意图和简单的实验,让学生能够观察并理解溶解过程中热能的转化。
这对学生理解溶解过程中的能量变化有着重要的意义。
2.3 影响溶解的因素本单元还介绍了影响溶解的因素,包括溶质的种类、溶剂的种类、温度等。
通过对不同影响因素的实验操作及结果分析,学生可以了解不同因素对溶解过程的影响,并且能够解释一些现象,如温度升高溶质溶解度增大等。
2.4 溶液的浓度最后,教材讲解了溶液的浓度的计算方法和表示方式,包括质量分数、体积分数和摩尔浓度等。
通过实例的计算演示,学生能够熟练掌握溶液浓度的计算方法。
3. 教学设计与实施针对上述教材内容,本单元的教学设计与实施应包括以下方面:3.1 激发学生的学习兴趣在引入新知识之前,可以通过提问或展示一些和溶解相关的实际问题来激发学生的学习兴趣。
例如,通过“为什么在热天喝冰激凌会凉快呢?”这样的问题,引导学生思考和讨论,从而引入溶解的概念。
3.2 生活化实例辅助教学在讲解溶解的概念时,应该结合一些生活化的实例,让学生更容易理解。
例如,可以引导学生观察和描述一些日常生活中的溶解现象,如茶叶溶解在水中的过程等。
通过这些实例的引导,学生可以更加深入地理解溶解的过程。
3.3 实验操作与观察在介绍溶解过程中的能量变化和影响溶解的因素时,可以设计一些简单的实验操作,让学生亲自动手参与实验,观察实验现象并进行结果分析。
溶解过程中能量的变化是什么?

溶解过程中能量的变化是什么?
概述
溶解是物质从固态或气态转变为液态的过程。
在溶解过程中,
存在能量的转化和变化。
本文将探讨溶解过程中能量的变化以及相
关的能量转化原理。
能量转化原理
在溶解中,主要存在以下几种能量转化:
1. 吸热过程:当溶质与溶剂之间的相互作用力破坏时,需要提
供能量,这导致了能量的吸收。
因此,溶解过程中可以发生吸热反应。
2. 放热过程:当溶质与溶剂之间的相互作用力形成时,释放出
能量,这导致了能量的放出。
因此,溶解过程中可以发生放热反应。
能量变化
溶解过程中的能量变化可以包括以下几个方面:
1. 温度变化:当溶质与溶剂发生吸热反应时,会导致溶液的温
度升高;而当溶质与溶剂发生放热反应时,会导致溶液的温度降低。
2. 热量变化:吸热反应和放热反应分别导致溶解过程中的热量
增加和减少。
吸热反应吸收了外界的热量,使溶解过程变冷;而放
热反应释放出热量,使溶解过程变热。
3. 势能变化:溶质与溶剂之间的相互作用力形成或破坏时,会
引起势能的变化。
溶解过程中会伴随着溶质与溶剂之间的相互作用
能的变化。
结论
根据上述的能量转化原理和能量变化,我们可以总结出在溶解
过程中能量的变化是多方面的,包括吸热过程、放热过程以及温度、热量和势能的变化。
深入理解溶解过程中的能量变化有助于我们更
好地理解溶解现象及其相关的物理化学原理。
氢氧化钠溶于水的热量变化

氢氧化钠溶于水的热量变化氢氧化钠溶于水的热量变化是一个重要的热化学过程。
在这个过程中,固体氢氧化钠与水发生反应,生成氢氧化钠溶液,并伴随着放热现象。
本文将详细介绍氢氧化钠溶于水的热量变化过程。
我们来了解一下氢氧化钠和水的性质。
氢氧化钠是一种固体物质,化学式为NaOH,常温下为白色结晶体。
它是一种强碱,能够与酸反应生成盐和水。
水是一种无色、无味、无臭的液体,是地球上最常见的物质之一。
水具有良好的溶解性,可以溶解很多物质。
当氢氧化钠溶于水时,会发生热化学反应。
这个反应是放热反应,即释放热量。
这是因为在反应过程中,氢氧化钠分子和水分子之间的键被破坏,新的键被形成,伴随着能量的释放。
这个过程可以用以下化学方程式表示:NaOH(s) + H2O(l) → Na+(aq) + OH-(aq) + 热量在这个反应中,氢氧化钠的固体形式转化为水溶液的离子形式,同时释放出热量。
这个热量的大小取决于反应的热力学性质,可以通过实验测量得到。
在实际操作中,当氢氧化钠固体溶解于水中时,会产生大量的热。
这是因为氢氧化钠和水之间的化学反应是一个放热反应,热量会迅速释放到周围环境中。
因此,在操作过程中需要特别小心,以避免热量的积累和升高。
值得注意的是,溶解氢氧化钠的过程是一个放热反应,但是溶解过程中的热量变化与溶解度有关。
溶解度是指单位溶剂中能溶解的溶质的最大量。
在溶液达到饱和时,溶解度最大。
溶解度与温度有关,一般情况下随着温度的升高,溶解度会增加。
因此,溶解氢氧化钠的过程中,热量的大小也会受到温度的影响。
除了热量变化外,溶解氢氧化钠还会产生其他影响。
例如,溶解氢氧化钠会使溶液的pH值增加,变得更加碱性。
这是因为氢氧化钠是一种强碱,其溶液中会释放出氢氧根离子(OH-)。
这些氢氧根离子与水分子结合形成氢氧化物(OH-)离子,使溶液呈现碱性。
溶解氢氧化钠的过程也会释放出氢氧化钠的热量变化,可以应用在一些实际应用中。
例如,在实验室中,可以利用氢氧化钠溶解过程中的放热现象,来测量一些化学反应的热量变化。
自然现象中常见的物态变化现象

自然现象中常见的物态变化现象自然界中,我们常常能够观察到各种各样的物态变化现象。
物质在不同的条件下,会发生从一个状态到另一个状态的转变,这就是物态变化。
本文将介绍一些常见的物态变化现象,并探讨其原因和意义。
一、溶解溶解是指一种物质在另一种物质中完全分散形成透明或半透明的混合物。
常见的例子是将糖溶解在水中、盐溶解在水中等。
溶解是一种快速而普遍的物态变化现象,这是因为在溶解过程中,溶质的分子或离子与溶剂的分子进行相互作用,从而形成一个新的物质。
溶解的原理是溶质的分子或离子与溶剂的分子之间发生吸引力或排斥力。
当这种相互作用力大于溶质分子或离子之间的相互作用力时,溶解就会发生。
溶解现象在日常生活中非常常见,对于化学反应、生物过程等都有重要的影响。
二、沸腾沸腾是指液体在一定温度下,凝固体和气体之间发生反复转化的过程。
当液体加热到一定温度时,液体内部的分子能量增加,分子间的相互作用力减弱。
当液体内部的蒸气压等于外部气压时,液体就会发生沸腾。
沸腾时,液体内部会产生气泡,并释放出大量的热量和气体。
沸腾在我们的日常生活中随处可见,如水烧开时发生的沸腾现象。
沸腾的过程中,液体内部的分子与气体相互转化,这种相变过程对于烹饪、发酵等过程至关重要。
三、冻结冻结是指液体在一定温度下,变为固体的物态变化过程。
当液体的温度降低到冰点以下时,液体内部的分子的热能减小,分子的运动速度减慢,分子间的相互作用力增强。
这导致液体分子逐渐排列成规则的晶格结构,形成固体。
冻结现象在我们的生活中非常常见,比如水在零度以下凝固成冰。
冻结不仅对于现实生活有着重要的影响,还在工业生产、自然环境等方面起着重要作用。
四、蒸发蒸发是指液体在一定温度下,从表面向空气中转化为气体的过程。
液体的分子在不断运动中,有的分子能量较高,逃离液面,形成气体的分子,这个过程就是蒸发。
蒸发是一种常见的物态变化现象,比如水洗完衣服晾晒时,水分逐渐蒸发。
蒸发过程中,液体的温度会降低,所以蒸发是一种具有降温作用的物理过程。
hcl溶于水体积变化

当盐酸(HCl)溶于水时,总体积会发生变化。
为了理解和预测这种变化,我们需要深入探讨一些基本的化学原理。
首先,我们必须了解,当一种物质溶解于另一种物质中时,会产生分子间的相互作用。
具体到HCl溶于水的情况,HCl分子会与水分子结合,形成水合分子。
这种结合会导致原先的物质体积发生变化。
我们知道,物质溶解的过程伴随着能量的变化。
HCl溶于水时,会释放出能量,这会导致物质的体积膨胀。
然而,这种膨胀的程度是有限的,因为HCl与水结合形成的水合分子占据了较为固定的空间。
另一方面,我们还需要考虑到物质溶解过程中的熵变。
熵是衡量物质混乱度的物理量,熵值的改变可以反映物质状态的变化。
在HCl溶于水的过程中,由于分子间相互作用和结合方式的复杂性,熵值会有所降低。
这意味着,溶质和溶剂的混合并不是完全无序的,而是形成了一种新的有序结构。
综合以上因素,我们可以得出结论:当盐酸(HCl)溶于水时,总体积会发生变化。
具体来说,由于能量释放和熵值降低的影响,体积会有所膨胀,但这种膨胀是有限的,因为水合分子的形成限制了体积的进一步增加。
值得注意的是,这种体积变化在实际应用中具有重要意义。
例如,在化学实验中,我们需要精确控制溶液的体积,以便进行准确的实验操作和结果分析。
因此,了解HCl溶于水时的体积变化有助于我们更好地进行实验设计和操作。
总的来说,盐酸溶于水时,总体积会发生变化。
这种变化是由于分子间的相互作用、能量释放以及熵值改变等多种因素共同作用的结果。
了解这种体积变化有助于我们更好地理解和应用相关化学原理。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.1
物质在溶解过程中有能量变化吗ARE THERE ANY CHANGES OF ENERGY IN DISSOLVED PROCESS OF SUBSTANCES
1学习内容与要求
学习内容
学习水平4.1 物质在溶解过程中有能量变化吗 4.1.1溶解的过程和溶解热现象
B 4.1.2溶解平衡与结晶过程B
【4.1.1】溶解的过程和溶解热现象
²✧描述物质溶解于水包含的扩散和水合过程以及这两个过程的能量变化【4.1.2】溶解平衡与结晶过程
²✧复述溶解平衡的概念与溶解平衡的建立过程
²✧归纳溶解平衡的特征
²✧从溶解平衡角度解释物质结晶的过程
能量守恒定律
•能量从一种形式转化为另一种形式,从一个物体传递给另一个物体,在转换和传递过程中,各种形式能量的总量保持不变。
太阳能
植物
光合
作用地壳作用
矿物燃料(煤、石油、天然气)食物
燃料
动物热能动能地球上的一切生物能归根到底来自太阳能
一、能量的守恒和转化
阅读书本P74,回答:食物中产生能量的营养物质主要有哪些?
拓展视野:能源的种类P75
能源是指能产生机械能、光能、热能、电磁能、化
学能等各种能量的自然资源。
能源的分类:
1)形成和来源:4种(略)
2)利用状况:
常规能源(煤、石油、天然气、水能及生物能等)、新能源(核能、地热能、海洋能等)
3)原有形态是否改变:
一次能源(煤炭、石油、天然气等)、二次能源(电能、氢能、汽油等)
4)循环再生:
可再生能源(水力、沼气等)、
不可再生能源(煤、石油等)
5)第一代能源:薪柴
第二代能源:煤第三代能源:石油
探讨:
冬天下雪时冷,还是融雪时冷?是结冰时冷,还是融冰时冷?理由?
答:融雪时冷;融冰时冷。
物质三种状态转变中的能量变化
总结:同一物质在三种不同状态时的能量:
气态〉液态〉固态
固态物质(s)
solid 液态(l)liquid
⽓气态(g)
gas
放出能量吸收能量
放出能量水的三态变化
气态(g )液态(l )固态(s )吸收
能量吸收
能量放出能量
提问:什么是溶液?
溶液:由一种或一种以上的物质(溶质)分散到另一种
物质(溶剂)里,而形成的均一、稳定的混合物。
【问题】溶质是如何分散到溶剂中,又如何形成均匀、稳定的混合物?
【实验】KMnO4的溶解
【实验现象】溶液中紫红色范围逐渐扩大,最后溶液
都变成紫红色。
二、溶解的过程和溶解热现象
【结论一】溶解过程中存在着溶质的扩散过程,该过程是物理过程,需要克服离子间的作用力而吸收能量。
【问题】物质溶解过程是否只存在溶质的扩散过程?那么是否物质溶于水都吸热呢?通过怎样的外在现象或简单仪器测量溶解过程中能量的变化?
【方案设计】小组设计实验方案(注意安全性和可行性)
实验: 观察氯化铵、氢氧化钠,氯化钠晶体溶于水时,溶液的温度变化。
溶质NH 4Cl NaOH NaCl
温度变化能量变化结论:不同物质溶于水能量变化不同。
几乎不变放热吸热升高降低
几乎不变
1、溶解的两个过程
溶解
吸热Q 吸放热Q 放
扩散过程
(物理过程)
水合过程(化学过程)同时存在同时进行
2、物质溶解过程及能量的认识
溶解过程
溶液温度的变化变化过程
能量变化
总效应扩散过程吸热过程水合过程放热过程Q 吸<Q 放Q 吸=Q 放Q 吸>Q 放
温度升高温度不变
温度降低
总结:物质溶解时,溶液温度是升高还是降低,取决于溶质微粒扩散过程中所吸收的热量和水合过程中放出热量的相对大小。
思考和练习:书P77
【回顾与小结】
1.物质三种状态转变中的能量变化
2.溶解的两个过程
3.物质溶解过程及能量的认识
1.下列变化中只有吸热过程的是( )A.氯化钠固体溶于水 B.干冰气化
C.天然气燃烧
D.气态水变成液态水
2.相同质量的水在固、液、气三态中所具有的能量大小为。
3. 鉴别氯化钠,硝酸铵,氢氧化钠固体的试剂是理由。
B
固<液<气水三种物质溶解过程的温度变化不同
4.氯化钠溶液中存在的主要微粒有哪些?蔗糖呢?
水合钠离子,水合氯离子,水分子
蔗糖分子,水分子
5.下列能量中不来源于太阳能的是()
B
A.煤炭
B.水能
C.地热能
D.沼气
1. 溶质分子(离子)和水分子结合成水合分子(水合离子)的过程是。
A 物理过程
B 化学过程
C 吸收热量的过程
D 放出热量的过程
2. 物质在溶解时,溶液温度发生变化的原因是。
A 吸收热量
B 放出热量
C 扩散过程吸收的热量等于水合过程放出的热量
D 扩散过程吸收的热量不等于水合过程放出的热量B D D
三、溶液的微观组成
溶质的分子或离子
溶剂的分子
水合分子或水合离子
阅读:书p77溶解和结晶第一二段
从微粒运动的观点看,
溶解是溶质微粒离开溶质表面向溶剂里分散的过程;结晶是分散在溶液里的溶质微粒向溶质表面聚集的过程。
固体溶质
溶液里的溶质
溶解和结晶是同时进行,相反的两个过程。
(可逆过程)
1、溶解与结晶
⒈)结晶:晶态溶质从溶液中析出的过程。
当溶质开始溶解时,在单位时间内从固体溶质表面扩散到溶剂里的溶质微粒的数目,比回到固体表面的溶质微粒的数目多,即
v(溶)>v(结),从表面上看,固体溶质在不断地溶解,为不饱和溶液。
随着溶液内溶质微粒的增加,由溶液回到固体表面的微粒数也随之增加,当单位时间内扩散到溶液里的微粒数与回到固体表面的微粒数相等时,即v(溶)=v(结),溶解达到了平衡状态。
从表面上看,固体溶质不再减少,也不再增加,成饱和溶液。
蔗糖溶液微观图
当改变条件(如降低
温度或蒸发溶剂)时,
v(结)>v(溶),从表
面上看,溶液中不断有晶
体析出。
溶解速度结晶速度速度相对大小
看到现象
溶液状态
溶解速度
结晶速度
溶解速度结晶速度不断溶解不断结晶溶质不增减不结晶不溶解
(达到溶解结晶平衡)
不饱和饱和饱和
><=解释:为什么溶质不能无限制地溶解?
定义:
2 溶解平衡
特征:
在一定条件下,固体溶质不减少也不增加,溶解速率等于结晶速率。
(1)动——动态平衡(2)等——溶解速率等于结晶速率(3)定——溶质不变
(4)变——条件改变,平衡移动
注意:溶液达到溶解平衡时,溶质既在溶解又在结晶,
只是表面上不变。
工业上的利用P78:蒸发结晶法
冷却热饱和溶液法
(冷却结晶法/降温结晶)实验:书P79 硫酸铜和明矾的溶解和结晶
3、结晶水合物
(1)结晶水合物是怎么形成的?(2)结晶水合物是纯净物还是混合物?(3)胆矾加热失水是物理变化还是化学变化?(4)什么是风化?是物理变化还是化学变化?(5)什么是潮解?是物理变化还是化学变化?
皓矾:ZnSO 4·∙7H 2O 绿矾:FeSO 4·∙7H 2O 明矾:KAl(SO 4) 2·∙12H 2O 石碱:Na 2CO 3·∙10H 2O
熟石膏:2CaSO 4·∙H 2O 芒硝:Na 2SO 4·∙10H 2O
胆矾(蓝矾):CuSO 4.5H 2O 石膏:CaSO 4·∙2H 2O 书P80
4、风化和潮解
风化在室温和干燥空气里,失去部分或全部结晶水
潮解吸收空气里水蒸气,在晶体表面形成溶液
化学变化物理变化
风化和潮解不是可逆过程!
如:石碱
如:氯化钙和氢氧化钠
思考:书P80思考与讨论
A
B 干燥管4、常见干燥剂
(2)液态干燥剂(1)固体干燥剂碱性:固体NaOH,生石灰,碱石灰中性:无水CaCl 2酸性:P 2O 5酸性:浓H 2SO 4无水CaCl 2浓硫酸
固体NaOH,生石灰,碱石灰不能干燥酸性气体不能干燥碱性,还原性气体不能干燥NH 3A B
洗瓶
晶体的七个晶系
晶体生长
硫酸铜晶体的生长
糖晶体五水硫酸铜晶体
几种矿物晶体
练习:书p80/1,2,3,4作业:
3.下列说法正确的是( )
A.胆矾是混合物
B.从饱和溶液中析出的晶体都含有结晶水
C.在饱和溶液中,溶质的溶解速度小于结晶速度
D.氯化钙易吸水而发生潮解,所以可做某些气体的干燥剂
4.下列各说法正确的是()
A.氯化钠易潮解,所以食盐应密封保存
B.加热胆矾后颜色由篮变白是因为胆矾风化了
C.可用无水硫酸铜检验某酒精中是否含有微量水
D.纯碱是一种常用的强碱DC。
