可逆过程与可逆过程体积功的计算PPT课件
合集下载
2-10可逆过程和可逆体积功

•多次等外压膨胀
(3).外压比内压小一个无穷小的值
外压相当于一堆沙子,每次取一粒,这样的膨胀过程是 无限缓慢的,每一步都接近于平衡态。所作的功:
P终 p始
一粒粒取走砂粒 (剩余砂粒相当前述一 个重物)
(iii)
即 TV 1 常 : 数
结 pg状 方 有 合 态 程
:
pV 常 数
1
Tp
常 数
pV c
b、理想气体绝热可逆体积功
由 热 逆 程 绝 可 方 :
V2 V1
pV p1V1
W的定义式
Wr pdV p1V1
V2
V1
V dV
V2
V2
V2
(2)理想气体绝热可逆体积功
a、 理想气体绝热可逆过程方程式
d U δWr δ Qr 0 nRT 理想气体 nCV,m d T p d V dV V
对 热 逆 程 绝 可 过 ,
CV,m dT dV R T V
pg :C p,m CV, m R γ C p,m CV, m
W p (V V 1)
' '
p终 p始 p1 P1
p'' (V '' V ' )
p2 (V2 V '' )
(ii)
P始,V始 T
V1
1 P 1,V 1 T
p2 V2
2
P2
p终V3
3 P终,V终
P2,V2 T
可逆过程与可逆过程体积功
T2
= U
n CV ,mdT
T1
T2
= H
n C p,mdT
T1
7
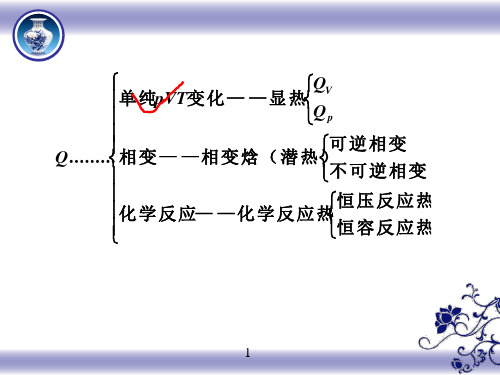
单
纯pVT变
化
—
—
显
热QQVp
Q......... 相
变
—
—
相
变
焓
(
潜
热
)可不
逆 可
相变 逆相
变
化
学
反
应—
—
化
学
反
应
热恒恒
压 容
反 反
应 应
热 热
8
§ 2.5 相变过程热的计算
1. 相及相变
(1)相的定义: 系统内性质完全相同且均匀的部分称为相。 (2)相变:物质从一相转移至另外一相,称为相变。 (3)常见相变:
ln
p2 p1
4. 理想气体绝热可逆过程
T2 T1
V2 V1
1
1 1
T2 T1
p2 p1
4 p1V1 p2V2
5. 绝热可逆过程体积功的计算
方法一:
Wr
pdV
V2 nRT dV V1 V
V2 p0V0
V V1
dV
p0V0
1 V2 V V1
dV p0V0
1
(V21 V11 )
Q Qp H 40.63kJ
28
(2) 100℃下向真空蒸发
H2O(l) T1 373.15K p1
p外0 H
H2O(g) T2 373.15K p2 101.325k Pa
H1
H2O(l) T 373.15K
H 2
p 101.325k Pa
体积功与可逆过程

Cp,m
晶Ⅱ 晶Ⅰ
液体
气体
T转晶
T熔
T沸
T
第四节 可逆过程与体积功
一、体 积 功
• pe = 外压
• A= 截面积
pe
• dl = 活塞移动距离
• dV = Adl = 体积的变化 • W = -F dl = -pe Adl
W = -pedV
dl
Gas 体系
A
对于宏观过程
W
V2 V1
pedV
二、不同过程的体积功
三、可逆过程
将准静态膨胀与压缩两图及(1)与(2)式相比 较,显然,准静态膨胀过程所作之功W4与准静态压缩 过程所作之功W ’3,大小相等,符号相反。在环境中没 有功的得失。
由 于 系 统 复 原 , U=0 , 根 据 热 力 学 第 一 定 律
U=Q+W,故Q=-W,所以在环境中也无热的得失。
一定量的气体从始态体积V1膨胀到终态V2, 若过 程不同,则所作的功就不相同。
设在定温下,一定量理想气体在活塞筒中克服外 压 ,经几种不同途径,体积从V1膨胀到V2所作的功。
自由膨胀(free expansion) 外压为零的膨胀过程。此时pe =0,所以
W1
V2 V1
pedV
0
二、不同过程的体积功
二、不同过程的体积功
若采取与(2)、(3)、(4)过程相反的步骤 ,将膨胀后的气体压缩到初始的状态,同理,由于压 缩过程不同,作的功亦不相同。
4.恒定外压p1下压缩过程 在恒定外压p1下将气体从V2压缩到V1,环境所做功为 W1’= -p1(V1-V2) 环境对系统做功的值相当于图中的阴影面积。
p
亦即当系统回复到原态时,环境也回复。
晶Ⅱ 晶Ⅰ
液体
气体
T转晶
T熔
T沸
T
第四节 可逆过程与体积功
一、体 积 功
• pe = 外压
• A= 截面积
pe
• dl = 活塞移动距离
• dV = Adl = 体积的变化 • W = -F dl = -pe Adl
W = -pedV
dl
Gas 体系
A
对于宏观过程
W
V2 V1
pedV
二、不同过程的体积功
三、可逆过程
将准静态膨胀与压缩两图及(1)与(2)式相比 较,显然,准静态膨胀过程所作之功W4与准静态压缩 过程所作之功W ’3,大小相等,符号相反。在环境中没 有功的得失。
由 于 系 统 复 原 , U=0 , 根 据 热 力 学 第 一 定 律
U=Q+W,故Q=-W,所以在环境中也无热的得失。
一定量的气体从始态体积V1膨胀到终态V2, 若过 程不同,则所作的功就不相同。
设在定温下,一定量理想气体在活塞筒中克服外 压 ,经几种不同途径,体积从V1膨胀到V2所作的功。
自由膨胀(free expansion) 外压为零的膨胀过程。此时pe =0,所以
W1
V2 V1
pedV
0
二、不同过程的体积功
二、不同过程的体积功
若采取与(2)、(3)、(4)过程相反的步骤 ,将膨胀后的气体压缩到初始的状态,同理,由于压 缩过程不同,作的功亦不相同。
4.恒定外压p1下压缩过程 在恒定外压p1下将气体从V2压缩到V1,环境所做功为 W1’= -p1(V1-V2) 环境对系统做功的值相当于图中的阴影面积。
p
亦即当系统回复到原态时,环境也回复。
2-09可逆功

' e,1
2015-1-14
4
2.多次等外压压缩 第一步:用 p" 的压力将体系从 V2 压缩到V " ; 第二步:用 p' 的压力将体系从V " 压缩到V ' ;
第三步:用 p1 的压力将体系从 V ' 压缩到 V1 。
W p (V V2 )
' e,1 " "
p (V V ) ' p1 (V1 V )
dU Q W
=W
(因为Q 0)
这时,若体系对外作功,热力学能下降,体系温 度必然降低,反之,则体系温度升高。因此绝热压缩,
使体系温度升高,而绝热膨胀,可获得低温。
2015-1-14 12
可逆绝热体积功的计算
Wr pdV
V1 V2
1. 理想气体可逆绝热过程方程 Q = 0, 理想气体 dU= W dU = nCV, mdT
de f
C p,m / CV ,m
T2 P2 T P 1 1
1
称作理想气体的绝热指数. dlnT = (1-γ) dlnV ln(T2/T1) = ln(V2/V1) 1-γ
T2 V2 T1 V1
1
P2 V2 P V 1 1 1
2015-1-14 7
可逆过程(reversible process)
过程中的每一步都接近于平衡态,可以向相反的 方向进行,从始态到终态,再从终态回到始态, 体系和环境都能恢复原状。
2015-1-14
8
可逆过程的特点: (1)状态变化时推动力与阻力相差无限小,体系 与环境始终无限接近于平衡态; (2)过程中的任何一个中间态都可以从正、逆两个 方向到达; (3)体系变化一个循环后,体系和环境均恢复原态, 变化过程中无任何耗散效应; (4)等温可逆过程中,体系对环境作最大功,环境 对体系作最小功。
2015-1-14
4
2.多次等外压压缩 第一步:用 p" 的压力将体系从 V2 压缩到V " ; 第二步:用 p' 的压力将体系从V " 压缩到V ' ;
第三步:用 p1 的压力将体系从 V ' 压缩到 V1 。
W p (V V2 )
' e,1 " "
p (V V ) ' p1 (V1 V )
dU Q W
=W
(因为Q 0)
这时,若体系对外作功,热力学能下降,体系温 度必然降低,反之,则体系温度升高。因此绝热压缩,
使体系温度升高,而绝热膨胀,可获得低温。
2015-1-14 12
可逆绝热体积功的计算
Wr pdV
V1 V2
1. 理想气体可逆绝热过程方程 Q = 0, 理想气体 dU= W dU = nCV, mdT
de f
C p,m / CV ,m
T2 P2 T P 1 1
1
称作理想气体的绝热指数. dlnT = (1-γ) dlnV ln(T2/T1) = ln(V2/V1) 1-γ
T2 V2 T1 V1
1
P2 V2 P V 1 1 1
2015-1-14 7
可逆过程(reversible process)
过程中的每一步都接近于平衡态,可以向相反的 方向进行,从始态到终态,再从终态回到始态, 体系和环境都能恢复原状。
2015-1-14
8
可逆过程的特点: (1)状态变化时推动力与阻力相差无限小,体系 与环境始终无限接近于平衡态; (2)过程中的任何一个中间态都可以从正、逆两个 方向到达; (3)体系变化一个循环后,体系和环境均恢复原态, 变化过程中无任何耗散效应; (4)等温可逆过程中,体系对环境作最大功,环境 对体系作最小功。
1.4可逆过程(物理化学)

W3 pe dV ( pi dp)dV pi dV
V2 V2 V2
V1
V1
V1
(2)
p
W ’3 的值相当于图 中阴影的面积。
W’3 V1 V2
V
二、不同过程的体积功
功与过程小结:
从以上的膨胀与压缩过程看出,功与变化的途径有 关。显然,准静态膨胀,系统对环境作最大功;准静态 压缩,环境对系统作最小功。
亦即当系统回复到原态时,环境也回复。
三、可逆过程
体系经过某一过程从状态(1)变到状态(2) 之后,如果能使体系和环境都恢复到原来的状态而 未留下任何永久性的变化,则该过程称为热力学可 逆过程。 上述准静态膨胀过程若没有因摩擦等因素造 成能量的耗散,可看作是一种可逆过程。过程中 的每一步都接近于平衡态,可以向相反的方向进 行,从始态到终态,再从终态回到始态,体系和 环境都能恢复原状。
三、可逆过程
可逆过程的特点:
(1)可逆过程是以无限小的变化进行,体系始终
无限接近于平衡态。 (2)体系在可逆过程中作最大功,环境在可逆过 程中作最小功,即可逆过程效率最高。 (3)循与过程原来途径相反方向进行,可使体系
和环境完全恢复原态。
Cp,m 晶Ⅰ 晶Ⅱ T转晶 T熔
液体
气体
T沸
T
再见!
V
V2
1
V2 nRT dV nRT ln V V1
W4相当于图中阴影部分的面积(见图) 显然,在准静态过程中,体系作功W4最大
二、不同过程的体积功
若采取与(2)、(3)、(4)过程相反的步骤 ,将膨胀后的气体压缩到初始的状态,同理,由于压 缩过程不同,作的功亦不相同。
4.恒定外压p1下压缩过程 在恒定外压p1下将气体从V2压缩到V1,环境所做功为 W1’= -p1(V1-V2) 环境对系统做功的值相当于图中的阴影面积。
2-10 可逆过程与可逆体积功

恒温可逆
n p2, V2, T
WT,r
V2 V1
pdV
V2 V1
nRT dV V
nRT ln V2 nRT ln V1
V1
V2
nRT ln p2 p1
U = 0 , H = 0 ,Q = W
(2)理想气体的绝热可逆体积功
理想气体 可逆过程
dU n CV ,m dT
||绝热过程
W p dV nRT dV
∵ΔU = W ∴ nCV,m(T2'-T1)= -pamb(V2'-V1) = -p2 (nRT2'/p2 - nRT1/p1)
解:(1) 绝热可逆膨胀
T2 T1
p2 p1
R/Cp,m
T2 = 143K
n = 4.41 mol
Q=0
W = ΔU = nCV,m(T2-T1) = -12070J
末态 T,p0, 3V0
沿3条途径实现:
(a) 将两堆细砂一次拿掉: p
3p0, V0 始态
a
p0
Wa
p0 3V0 V0
V0
2p0V0
2/ 3RT
3p0V0 = RT
p0, 3V0 末态
3V0 V
(b)将两堆细砂分两次拿掉:
T, 3p0, V0
pamb= 2p0 Ⅰ
T, 2p0, 1.5V0
pamb= p0 Ⅱ
答案:C。节流膨胀过程恒焓绝热且压力降低。
詹姆斯·普雷斯科特·焦耳
(JamesPrescottJoule;1818年12月24日- 1889年10月11日)
英国物理学家,出生于曼彻斯特近郊的沙弗 特(Salford)。由于他在热学、热力学和电方 面的贡献,皇家学会授予他最高荣誉科普利奖 章(CopleyMedal)。后人为了纪念他,把能量 或功的单位命名为“焦耳”,简称“焦”;并 用焦耳姓氏的第一个字母“J”来标记热量。
可逆过程

第1章
化学热力学基础
第1章
准静态过程
化学热力学基础
Ⅰ 热力学基本概念、热、功 §1.3 可逆过程、可逆过程的体积功 在过程进行的每一瞬间,系统都接近于平衡状态,
以致在任意选取的短时间dt 内,状态参量在整个系统的
各部分都有确定的值,整个过程可以看成是由一系列极 接近平衡的状态所构成,这种过程称为准静态过程。 准静态过程是一种理想过程,实际上是办不到的。 无限缓慢地压缩和无限缓慢地膨胀过程可近似看作 为准静态过程。
可逆体积功
对微小过程
W体=-P外dV
W V Pe d V V
V2
1
V2
1
nRT V
d V n R T ln
V2 V1
P 外= P e≈P 内
第1章
可逆过程特点
化学热力学基础
§1.3 可逆过程、可逆过程的体积功
A. 可逆过程是以无限小的变化进行的,整个过程进行
的无限慢,可理解为是一连串无限接近平衡的状 态所构成。
是无限缓慢的,每一步都接近于平衡态。所作的功为:
W e ,4 p e d V ( p i d p )d V
p
p1
p 1V1
V2
V1
pid V
nRT V
对理想气体
V1 V2
p 2V 2
p2
O
V2
d V n R T ln
V1
这种过程近似地可看作可逆 过程,系统所作的功最大。
B. 可逆过程中,物系对环境所做的功最大,而环境对
物系所做的功最小。即可逆膨胀过程W中最大, 可逆压缩过程W中最小。
第1章
可逆过程特点
化学热力学基础
第1章
准静态过程
化学热力学基础
Ⅰ 热力学基本概念、热、功 §1.3 可逆过程、可逆过程的体积功 在过程进行的每一瞬间,系统都接近于平衡状态,
以致在任意选取的短时间dt 内,状态参量在整个系统的
各部分都有确定的值,整个过程可以看成是由一系列极 接近平衡的状态所构成,这种过程称为准静态过程。 准静态过程是一种理想过程,实际上是办不到的。 无限缓慢地压缩和无限缓慢地膨胀过程可近似看作 为准静态过程。
可逆体积功
对微小过程
W体=-P外dV
W V Pe d V V
V2
1
V2
1
nRT V
d V n R T ln
V2 V1
P 外= P e≈P 内
第1章
可逆过程特点
化学热力学基础
§1.3 可逆过程、可逆过程的体积功
A. 可逆过程是以无限小的变化进行的,整个过程进行
的无限慢,可理解为是一连串无限接近平衡的状 态所构成。
是无限缓慢的,每一步都接近于平衡态。所作的功为:
W e ,4 p e d V ( p i d p )d V
p
p1
p 1V1
V2
V1
pid V
nRT V
对理想气体
V1 V2
p 2V 2
p2
O
V2
d V n R T ln
V1
这种过程近似地可看作可逆 过程,系统所作的功最大。
B. 可逆过程中,物系对环境所做的功最大,而环境对
物系所做的功最小。即可逆膨胀过程W中最大, 可逆压缩过程W中最小。
第1章
可逆过程特点
可逆过程与可逆过程体积功的计算PPT课件

定T
3
V终 {V}
2
V始
定T
V终 {V}
系统对环境做功,可逆过程做最大功(-W)
8
1
恒温可逆膨胀途径所做的功在 p-V 图中的表示
p2
p1 一粒粒取走砂粒
若在温度区间 T1 到T2 范围内,反应物或产物有相变化
例16:求1000K下,下列反应的 r Hm
CH4(g) + 2H2O(g) = CO2(g) + 4H2(g)
已知298.15K,下列热力学数据:
CH4(g)
f Hm /kJ·mol-1 -74.81
H2O(l) CO2(g) H2(g) -285.83 -393.51 0
24
1
常见pg单纯pVT变化过程:
恒容过程(dV= 0) 恒压过程(dp= 0)
Q W ΔU ΔH =0
恒温可逆过程 (dT= 0,可逆)
=0 =0
恒温不可逆过程 (dT= 0)
=0 =0
绝热可逆过程 ( Qr = 0)
=0
绝热不可逆过程 ( Q = 0)
=0
自由膨胀过程 (p环=0)
=0
恒温自由膨胀过程 (p环=0) =0 =0 =0 =0
dV p0V0
1
(V21 V11
)
方法二: 由绝热可逆过程方程求出终态温度T2,再求体积功.
ΔU
n T2
T1
CV
,mdT
nCV ,m(T2
T1)
U Q W Q 0
Wr ΔU
15
1
例19: 某双原子理想气体1mol从始态350K,200kPa 经过如下四个不同过程达到各自的平衡态,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
p1 V1
-dp
p2 V2
T
T
9
1
恒温压缩过程环境所做的功在 p-V 图中的表示
恒外压压缩过程
{p} p2
{p}
W = - p外V= - p终(V终-V始) p2
恒外压压缩过程 W =W1+W2
定T
1
定T
p1
p1
2
V2
V1 {V}
V2
状态1
状态2
系统复原,环境不可能复原
对于不可逆过程,无论采取何种措施使系统恢复原状 时,都不可能使环境也恢复原状.
自然界发生的任何变化都是不可逆过程。
2
1
2 可逆过程体积功的计算公式
δW p环dV
对可逆过程:
δWr p环dV p系 dp dV
p系dV dp dV
{p}
p始
p始
二次反抗恒外压膨胀过程 -W = -(W1+W2)
p终 V始
定T
V终 {V}
p终 1
V始
定T
2 V终 {V}
7
1
{p su}
{p }
-W =-( W 1+ W 2+ W 3)
-W = -(W 1+ W 2+ W 3+…..)
p始
= (p2V1+p3V2+p终V3) p始
1 2
V始
§2.8 可逆过程与可逆过程体积功的计算 1. 可逆过程与不可逆过程
状态1 →→→→ 状态2
例如:p外= p-dp, 则系统会无限缓慢地膨胀; 再如:T外=T- dT ,系统会放热δQ 给环境。
1
1
状态1←→←→←→←→状态2
系统复原,环境复原
系统内部及系统与环境间在一系列无限接近平衡条件 下进行的过程称为可逆过程。
求各过程的Q,W,U及H。
(1)恒温可逆膨胀到50kPa
(2)恒温反抗50kPa恒外压膨胀至平衡
(3)绝热可逆膨胀到50kPa
(4)绝热反抗50kPa恒外压膨胀至平衡。
16
1
(1)dT=0,可逆
n=1mol pg, T1=350K p1 = 200 kPa
dT=0,可逆
n=1mol pg, T2= 350K p2 = 50 kPa
a. 反抗 50kPa 的恒外压一次膨胀到末态。
b.先反抗100 kPa 的恒外压膨胀到平衡,再 反抗50kPa 恒外压膨胀到末态。
c.恒温可逆膨胀到末态
5
1
始末态相同,途径不同,功不同
解: a. 反抗 50kPa 的恒外压一次膨胀到末态。
V2
W V 1 p外dV = - p外 (V2 V1) = - 3.326 kJ
b.先反抗100 kPa 的恒外压膨胀到中间平衡态,再反抗 50kPa 恒外压膨胀到末态。
W= W1 + W2 = - 4.158 kJ c.恒温可逆膨胀到末态
Wr
nRTln
p2 p1
5.48kJ
6
1
途径a、b、c所做的功在 p-V 图中的表示
一次反抗恒外压膨胀过程
{p}
-W =p外V=p终(V终-V始)
定T
3
V终 {V}
2
V始
定T
V终 {V}
系统对环境做功,可逆过程做最大功(-W)
8
1
恒温可逆膨胀途径所做的功在 p-V 图中的表示
p2
p1 一粒粒取走砂粒
是理想气体 dT 0
Wr
nRTln
p2 p1
4.034kJ
U Q W
U 0
H 0
Q W 4.034kJ
17
1
(2)恒温反抗50kPa恒外压膨胀至平衡
n=1mol pg, T1=350K p1 = 200 kPa
dT=0, p外=50kPa
n=1mol pg, T2= 350K p2 = 50 kPa
V2 V1
理想气体
绝热可逆过程 的过程方程
T2 T1
p2 p1
1
1
p1V1 p2V2
13
1
2019/10/20
14
14
绝热可逆过程体积功的计算
方法一:
Wr
pdV
VV22 VV11
np0RVT0 VV
ddVV
p0V0
1 V2 V V1
V1 {V}
{p}
W = W 1+ W 2+ W 3
p2
{p }
p2
W = W 1+ W 2+ W 3+…..
定T
p1
1
23
V2
V1 {V}
p1 2
V2
定T V1 {V}
环境对系统做功,可逆过程做最小功(W)
10
1
总结,可逆过程的特点:
(1) 推动力无限小,系统内部及系统和环境间都无限接近平衡, 进行得无限慢,
是理想气体 dT 0 U 0 H 0
(2)过程结束后,系统若沿原途径逆向进行恢复到始态,则环境 也同时复原。
(3) 可逆过程系统对环境做最大功, 环境对系统做最小功。
11
1
4. 理想气体绝热可逆过程
绝热可逆过程 Qr=0: dU δQr δWr
dU δWr
nCV ,mdT pdV
nRT nT T
R dV V
即 : CV ,mdln T Rdln V
CV,m为定值,与温度无关:
CV
,m
ln
T2 T1
Rln V2 V1
12
1
T2 T1
V2 V1
R / CV ,m
定义: C p,m
CV ,m
1
T2 T1
p系dV
V2
Wr p系dV
V1
V2
Wr p dV
V1
3
1
3 理想气体恒温可逆过程
Wr
pdV V2 nRT dV nRT ln V2
V1 V
V1
Wr
nRT
ln V2 V1
Wr
nRT
ln
p2 p1
4
1
例18: 始态 T1 =300 K ,p1 = 150 kPa 的 2 mol某 理想气体,经过下述三种不同途径恒温膨胀到同 样的末态, p2 = 50 kPa 。求各途径的体积功。
dV p0V0
1
(V21 V11
)
方法二: 由绝热可逆过程方程求出终态温度T2,再求体积功.
ΔU
n T2
T1
CV
,mdT
nCV ,m(T2
T1)
U Q W Q 0
Wr ΔU
15
1
例19: 某双原子理想气体1mol从始态350K,200kPa 经过如下四个不同过程达到各自的平衡态,
-dp
p2 V2
T
T
9
1
恒温压缩过程环境所做的功在 p-V 图中的表示
恒外压压缩过程
{p} p2
{p}
W = - p外V= - p终(V终-V始) p2
恒外压压缩过程 W =W1+W2
定T
1
定T
p1
p1
2
V2
V1 {V}
V2
状态1
状态2
系统复原,环境不可能复原
对于不可逆过程,无论采取何种措施使系统恢复原状 时,都不可能使环境也恢复原状.
自然界发生的任何变化都是不可逆过程。
2
1
2 可逆过程体积功的计算公式
δW p环dV
对可逆过程:
δWr p环dV p系 dp dV
p系dV dp dV
{p}
p始
p始
二次反抗恒外压膨胀过程 -W = -(W1+W2)
p终 V始
定T
V终 {V}
p终 1
V始
定T
2 V终 {V}
7
1
{p su}
{p }
-W =-( W 1+ W 2+ W 3)
-W = -(W 1+ W 2+ W 3+…..)
p始
= (p2V1+p3V2+p终V3) p始
1 2
V始
§2.8 可逆过程与可逆过程体积功的计算 1. 可逆过程与不可逆过程
状态1 →→→→ 状态2
例如:p外= p-dp, 则系统会无限缓慢地膨胀; 再如:T外=T- dT ,系统会放热δQ 给环境。
1
1
状态1←→←→←→←→状态2
系统复原,环境复原
系统内部及系统与环境间在一系列无限接近平衡条件 下进行的过程称为可逆过程。
求各过程的Q,W,U及H。
(1)恒温可逆膨胀到50kPa
(2)恒温反抗50kPa恒外压膨胀至平衡
(3)绝热可逆膨胀到50kPa
(4)绝热反抗50kPa恒外压膨胀至平衡。
16
1
(1)dT=0,可逆
n=1mol pg, T1=350K p1 = 200 kPa
dT=0,可逆
n=1mol pg, T2= 350K p2 = 50 kPa
a. 反抗 50kPa 的恒外压一次膨胀到末态。
b.先反抗100 kPa 的恒外压膨胀到平衡,再 反抗50kPa 恒外压膨胀到末态。
c.恒温可逆膨胀到末态
5
1
始末态相同,途径不同,功不同
解: a. 反抗 50kPa 的恒外压一次膨胀到末态。
V2
W V 1 p外dV = - p外 (V2 V1) = - 3.326 kJ
b.先反抗100 kPa 的恒外压膨胀到中间平衡态,再反抗 50kPa 恒外压膨胀到末态。
W= W1 + W2 = - 4.158 kJ c.恒温可逆膨胀到末态
Wr
nRTln
p2 p1
5.48kJ
6
1
途径a、b、c所做的功在 p-V 图中的表示
一次反抗恒外压膨胀过程
{p}
-W =p外V=p终(V终-V始)
定T
3
V终 {V}
2
V始
定T
V终 {V}
系统对环境做功,可逆过程做最大功(-W)
8
1
恒温可逆膨胀途径所做的功在 p-V 图中的表示
p2
p1 一粒粒取走砂粒
是理想气体 dT 0
Wr
nRTln
p2 p1
4.034kJ
U Q W
U 0
H 0
Q W 4.034kJ
17
1
(2)恒温反抗50kPa恒外压膨胀至平衡
n=1mol pg, T1=350K p1 = 200 kPa
dT=0, p外=50kPa
n=1mol pg, T2= 350K p2 = 50 kPa
V2 V1
理想气体
绝热可逆过程 的过程方程
T2 T1
p2 p1
1
1
p1V1 p2V2
13
1
2019/10/20
14
14
绝热可逆过程体积功的计算
方法一:
Wr
pdV
VV22 VV11
np0RVT0 VV
ddVV
p0V0
1 V2 V V1
V1 {V}
{p}
W = W 1+ W 2+ W 3
p2
{p }
p2
W = W 1+ W 2+ W 3+…..
定T
p1
1
23
V2
V1 {V}
p1 2
V2
定T V1 {V}
环境对系统做功,可逆过程做最小功(W)
10
1
总结,可逆过程的特点:
(1) 推动力无限小,系统内部及系统和环境间都无限接近平衡, 进行得无限慢,
是理想气体 dT 0 U 0 H 0
(2)过程结束后,系统若沿原途径逆向进行恢复到始态,则环境 也同时复原。
(3) 可逆过程系统对环境做最大功, 环境对系统做最小功。
11
1
4. 理想气体绝热可逆过程
绝热可逆过程 Qr=0: dU δQr δWr
dU δWr
nCV ,mdT pdV
nRT nT T
R dV V
即 : CV ,mdln T Rdln V
CV,m为定值,与温度无关:
CV
,m
ln
T2 T1
Rln V2 V1
12
1
T2 T1
V2 V1
R / CV ,m
定义: C p,m
CV ,m
1
T2 T1
p系dV
V2
Wr p系dV
V1
V2
Wr p dV
V1
3
1
3 理想气体恒温可逆过程
Wr
pdV V2 nRT dV nRT ln V2
V1 V
V1
Wr
nRT
ln V2 V1
Wr
nRT
ln
p2 p1
4
1
例18: 始态 T1 =300 K ,p1 = 150 kPa 的 2 mol某 理想气体,经过下述三种不同途径恒温膨胀到同 样的末态, p2 = 50 kPa 。求各途径的体积功。
dV p0V0
1
(V21 V11
)
方法二: 由绝热可逆过程方程求出终态温度T2,再求体积功.
ΔU
n T2
T1
CV
,mdT
nCV ,m(T2
T1)
U Q W Q 0
Wr ΔU
15
1
例19: 某双原子理想气体1mol从始态350K,200kPa 经过如下四个不同过程达到各自的平衡态,
