《酸碱平衡》习题
6章酸碱平衡习题

酸碱平衡1.以下哪些物种是酸碱质子理论的酸、哪些是碱,哪些具有酸碱两性?SO 42-、S 2-、H 2PO 4-、NH 3、HSO 4-、[Al(H 2O)2OH]2+、CO 32-、NH 4+、H 2S 、H 2O 、OH -、H 3O +、HS -、HPO 42-、SO 42- 解:酸:NH 4+、H 2S 、H 3O + 碱:SO 42-、S 2-、CO 32-、OH -酸碱两性:H 2PO 4-、NH 3、HSO 4-、[Al(HO)2OH]2+、H 2O 、HS -、HPO 42-2. 苯甲酸(可用弱酸的通式HA 表示,相对分子质量122 )的酸常数K a =6.4×10-5试求:( 1 ) 中和1.22 g 苯甲酸需用0.4 mol ·dm -3的NaOH 溶液多少毫升? ( 2 ) 求其共轭碱的碱常数K b 。
( 3 ) 已知苯甲酸在水中的溶解度为2.06 g ·dm -3,求饱和溶液的pH 解:( l ) n =1.22 g / 122 g ·mol -1=0.0100 mol 中和苯甲酸需要0.4 mol ·dm -3 的NaOH 的体积为V mLV = 0.01mol/0.4 mol ·dm -3=0.025 L =25 ml( 2 ) K b =K w /K a =1.0×10-14/ 6.4×10-5= 1.6×10-10( 3 ) c =2.06 g ·dm -3/122 g ·mol -1= 1.7×10-2mol ·dm -3c/Ka>500 用最简式计算[H +]=31.010-==⨯3lg1.0103pH -=-⨯=3. 计算下列各种溶液的pH :( l ) 10 mL 5.0×10-3 mol ·dm -3的NaOH( 2 ) 10 mL 0.40 mol ·dm -3 HCl 与10 mL 0.10mol ·dm -3 NaOH 的混合溶液. ( 3 ) 10 mL 0.2 mol ·dm -3 NH 3·HO 与10 mL 0.2 mol ·dm -3 HCl 的混合溶液。
《酸碱平衡及酸碱滴定》习题答案

《酸碱平衡》习题答案1. 计算pH=5.00时,0.10mol·L -1的HAc 溶液中各型体的分布系数及平衡浓度。
解:()36.01076.11010][][500.500.5=×+=+=−−−++θδa r r K H H HAc ()()()1036.036.010.0−⋅=×=⋅=L mol HAc c HAc c r δ()()64.036.0111=−=−=−HAc Ac δδ()()()11064.064.010.0−−−⋅=×=⋅=L mol Ac c Ac c r δ2. 计算0.10mol·L -1的HCOONH 4溶液的pH 。
解:由于HCOO -和NH 4+分别为弱碱和弱酸,此溶液为两性溶液体系,其中:()()()5143441077.110/1077.1−−+−×==×=NH K K NHK HCOOH K b w a aθθθ所以,根据两性物质溶液体系pH 计算公式可得:()()500.6 1077.1101077.1lg lg 51444=×××−=−=−−−+NH K HCOOH K pH a aθθ* 两性物质溶液体系pH 计算公式中涉及到的两个平衡常数均是酸的解离常数。
* 根据有效数字修约规则,本题计算结果需要保留有效数字三位,也就是6.500。
3. 欲配置pH=5.00的缓冲溶液,现有0.1mol·L -1的HAc 溶液100mL ,应加0.1mol·L -1的NaOH 溶液多少毫升?解:设需要加0.1mol·L -1的NaOH 溶液x mL , 则根据缓冲溶液体系pH 计算公式可得:()()()()()()()()()00.5 101.0101001.0101.0lg1076.1lg lg lg ][][lg3335=××−××××+×−=−+=+=+=−−−−−−x x NaOH V NaOH c HAc V HAc c NaOH V NaOH c pK HA n A n pK HA A pK pH r r r a a rr a θθθ解方程得到:()()mL mL x 2106.064×≈=4. 取50mL0.10mol·L -1的某一元弱酸溶液,与20mL0.10mol·L -1的NaOH 溶液混合,稀释到100mL ,测得此溶液的pH=5.25,求此一元弱酸的θa K 。
酸碱平衡试题及答案高一

酸碱平衡试题及答案高一一、选择题(每题2分,共20分)1. 以下哪种物质属于酸?A. NaOHB. HClC. NaClD. H2O答案:B2. 酸碱反应的实质是:A. 离子交换B. 电子转移C. 质子转移D. 能量转换答案:C3. 根据酸碱理论,下列哪种物质是碱?A. H2SO4B. NH3C. Na2CO3D. HCl答案:C4. 强酸和强碱反应生成的产物是:A. 盐和水B. 酸和水C. 碱和水D. 盐和酸答案:A5. 溶液的pH值小于7,则该溶液是:A. 碱性B. 中性C. 酸性D. 无法判断答案:C6. 以下哪种物质是两性物质?A. NaOHB. H2SO4C. Al2O3D. HCl答案:C7. 以下哪种物质属于强碱?A. KOHB. NH3·H2OC. Ca(OH)2D. Na2CO3答案:A8. 以下哪种物质属于强酸?A. H2SO4B. CH3COOHC. H2CO3D. HClO答案:A9. 以下哪种物质属于弱酸?A. HClB. H2SO4C. HNO3D. CH3COOH答案:D10. 以下哪种物质属于弱碱?A. NaOHB. NH3C. Ca(OH)2D. KOH答案:B二、填空题(每空1分,共10分)1. 酸的定义是能够释放________(质子)的物质。
答案:H+2. 碱的定义是能够接受________(质子)的物质。
答案:H+3. 溶液的pH值等于7时,该溶液是________。
答案:中性4. 溶液的pH值大于7时,该溶液是________。
答案:碱性5. 溶液的pH值小于7时,该溶液是________。
答案:酸性6. 强酸和强碱反应生成的产物是________和________。
答案:盐;水7. 两性物质是指既能表现出酸性,又能表现出碱性的物质,例如________。
答案:Al2O38. 强酸是指在水溶液中完全电离的酸,例如________。
答案:HCl9. 强碱是指在水溶液中完全电离的碱,例如________。
《酸碱平衡》习题

HAc溶液 溶液〔 HAc溶液 溶液〔 的两倍。 4.0.2mol.L-1HAc溶液〔H+〕是0.1mol.L-1HAc溶液〔H+〕的两倍。 (× )
结束
判断题
7.强酸的共轭碱一般都很弱。 7.强酸的共轭碱一般都很弱。 强酸的共轭碱一般都很弱 (√ ) 8.酸性缓冲液(HAc-NaAc)可以抵抗少量外来酸对pH的影响, 8.酸性缓冲液(HAc-NaAc)可以抵抗少量外来酸对pH的影响, 酸性缓冲液 pH的影响 × 而不能抵抗少量外来碱的影响。 而不能抵抗少量外来碱的影响。 ( ) 9.纯水中 纯水中Kw=c(H c(OH (25℃),加入强酸后因H+ H+离 9.纯水中Kw=c(H+)·c(OH-)=10-14(25℃),加入强酸后因H+离 子浓度大大增加, Kw也大大增加 也大大增加。 子浓度大大增加,故Kw也大大增加。 (×) 10.在 溶液里通入CO 便可得到一种缓冲液. 10.在NaHCO3溶液里通入CO2,便可得到一种缓冲液. (
√
) )
11.pH值相等的缓冲液,未必具有相同的缓冲容量。 11.pH值相等的缓冲液,未必具有相同的缓冲容量。 ( √ 值相等的缓冲液 12.将氨水和HCl混合,不论两者比例如何, 12.将氨水和HCl混合,不论两者比例如何, 将氨水和HCl混合 一定不可能组成缓冲溶液。 一定不可能组成缓冲溶液。
(× )
结束
简答题
2.简述HAc—NaAc缓冲溶液的缓冲原理。 答:在HAc—NaAc缓冲溶液中:由于存在同离子效应, [HAc]、[Ac-]都很大。在此溶液中, 加少量的强酸时:Ac-+ H+ ≒ HAc ; 加少量的强碱时:HAc + OH— ≒H2O+ Ac均生成弱电解质,对溶液体系pH值影响很小,因此体系 的pH值能在一定范围维持基本不变。
03章酸碱平衡习题
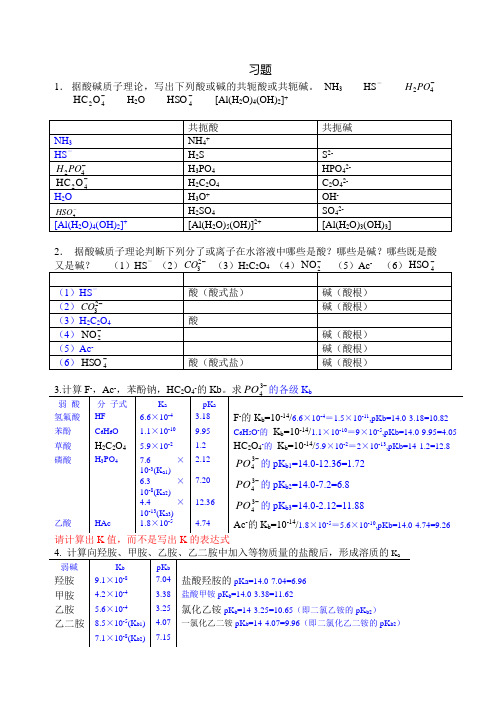
习题1. 据酸碱质子理论,写出下列酸或碱的共轭酸或共轭碱。
NH 3 HS --42PO H-42O HC H 2O -4HSO [Al(H 2O)4(OH)2]+2. 据酸碱质子理论判断下列分了或离子在水溶液中哪些是酸?哪些是碱?哪些既是酸--2-------3请计算出K 值,而不是写出K 的表达式5.人体正常血液pH 值在7.35~7.45之间变动,试计算此正常范围的[H +]是多少?因为:pH=-lg[H +], 所以pHH -+=10][ [H +]=10-7.35~10-7.45=4.5×10-8~3.55×10-86.向0.1mol/L 的磷酸溶液中加入固体NaOH (体积不变),至pH =7.0,求磷酸各型体的分布系数及平衡浓度。
3212121330][][][][a a a a a a K K K H K K H K H H +++=++++δ =13837832733737104.4103.6106.7]10[103.6106.7]10[106.7]10[]10[----------⨯⨯⨯⨯⨯+⨯⨯⨯+⨯+=8×10-6760431081081.0][--⨯=⨯⨯==δc PO H32121213211][][][][a a a a a a a K K K H K K H K H H K +++=++++δ =138378327337273104.4103.6106.7]10[103.6106.7]10[106.7]10[]10[106.7-----------⨯⨯⨯⨯⨯+⨯⨯⨯+⨯+⨯=0.6130613.0613.01.0][142=⨯==-δc PO H32121213212][][][][a a a a a a a a K K K H K K H K H H K K +++=++++δ =138378327337783104.4103.6106.7]10[103.6106.7]10[106.7]10[]10[103.6106.7------------⨯⨯⨯⨯⨯+⨯⨯⨯+⨯+⨯⨯⨯=0.3870387.0387.01.0][224=⨯==-δc HPO321212133213][][][a a a a a a a a a K K K H K K H K H K K K +++=+++δ=1383783273371383104.4103.6106.7]10[103.6106.7]10[106.7]10[104.4103.6106.7------------⨯⨯⨯⨯⨯+⨯⨯⨯+⨯+⨯⨯⨯⨯⨯=1.7×10-676334107.1107.11.0][---⨯=⨯⨯==δc PO7、计算0.2 mol ·dm -3H 2C 2O 4溶液中每种离子的浓度。
第九章 酸碱平衡 习题

第九章 酸碱平衡1根据酸碱质子理论,下列各离子中,既可作酸又可作碱的是………………………( )(A) H 3O +(B)CO 32- (C)NH 4+ (D) [Fe (H 2O)4(OH)2]2在反应BF 3 + NH 3−→−F 3BNH 3中,BF 3为…………………………………………( )(A) Arrhenius 碱(B) Br φnsted 酸 (C) Lewis 碱(D) Lewis 酸3 NH 4+的共轭碱是 …………………………………………………………………… ( )(A) OH -(B) NH 3 (C)NH 2- (D) NH 2-4不是共轭酸碱对的一组物质是………………………………………………………( )(A) NH 3、NH 2- (B) NaOH 、Na(C) OH -、O 2-(D) H 3O +、H 2O 5H PO 24-的共轭碱是 …………………………………………………………………( )(A) H 3PO 4 (B)HPO 42-(C)H PO 23-(D)PO 43- 6化学反应Ag(NH )32+ + Br -AgBr ↓ + 2NH 3按照路易斯酸碱理论,它应属于…………………………………………………………………………………………… ( )(A) 碱取代反应 (B) 置换反应(C) 酸取代反应 (D) 沉淀反应7根据软硬酸碱概念,下列物质属软酸的是……………………………………………( )(A) H (B) Ag (C) NH 3 (D) AsH 38根据酸碱的溶剂理论,在液态 SO 2 体系中的碱是…………………………………( )(A) SOCl 2 (B) Na 2SO 3 (C) Na 2SO 4 (D) PCl 39Fe 3+、Cl -、H +、SO 3 中能作路易斯酸的是 _______________,能作路易斯碱的是____________________。
酸碱平衡练习题

酸碱平衡练习题一、选择题(单选题)1.用电导实验测定强电解质溶液的解离度,总是达不到100%,其原因是(D)。
A、电解质本身不全部解离;B、电解质不纯;C、电解质与溶剂有作用;D、正负离子相互作用。
2.根据酸碱质子理论,下列叙述中正确的是(C)。
A、碱只能是阴离子;B、质子理论适用于水溶液和一切非水溶液;C、任何一种酸失去质子就成为碱;D、碱愈强,其共轭酸也愈强。
3.OH-的共轭酸是()。
A、H+;B、H2O;C、H3O+;D、O2-。
4.CH3OH的共轭酸是()。
A、H3O+;B、OH-;C、CH3OH2+;D、CH3O-。
5.H3O+的共轭碱是.()。
A、H+;B、OH-;C、H2O2;D、H2O。
6.根据酸碱质子理论,下列物质中可作为碱的是()。
A、NH4+;B、[Co(OH)(H2O)5]+;C、[Fe(H2O)6]3+;D、H3O+。
7.根据酸碱质子理论,对于反应HCl+NH3NH4++Cl-来说,下列各组物质都是酸的是()。
A、HCl和Cl-;B、HCl和NH4+;C、NH3和Cl-;D、NH3和NH4+。
8.根据酸碱电子理论,下列物质中,可作为Lewis碱的是()。
A、Fe3+;B、Cu2+;C、F-;D、SO3。
9.下列酸溶液浓度相同,其中c(H+)最大的是()。
A、H2S(aq);B、H2SO4(aq);C、H3PO4(aq);D、H2C2O4(aq)。
10.SbCl3水解产物为.()。
A、Sb(OH)3;B、SbOCl;C、Sb2O3;D、Sb(OH)2Cl。
11.BiCl3水解产物为()。
A、Bi2O3;B、Bi(OH)3;C、BiOCl;D、Bi(OH)Cl2。
12.SnCl2水解产物为()。
A、SnOCl;B、Sn(OH)2;C、SnO;D、Sn(OH)Cl。
13.已知:K(HCN)=6.2×10-10,则NaCN的标准水解常数为()。
A、1.6×10-6;B、6.2×10-10;C、6.2×10-24;D、1.6×10-5。
酸碱平衡习题

酸碱平衡练习题一。
是非题1.由于乙酸的解离平衡常数)()()(HAc c Ac c H c K a -+=θ,所以只要改变乙酸的起始浓度即c(HAc ),a K θ必随之改变。
2。
缓冲溶液的缓冲能力一般认为在pH=Pka ⊕±1范围内。
3。
稀释可以使醋酸的电离度增大,因而可使其酸性增强. 4。
溶液的酸度越高,其pH 值就越大。
5.在共轭酸碱体系中,酸、碱的浓度越大,则其缓冲能力越强。
6。
溶液的酸度越高,其pH 值就越小。
7.根据酸碱质子理论,强酸反应后变成弱酸。
8.在浓度均为0.01 mol ·L -1的HCl ,H 2SO 4,NaOH 和NH 4Ac 四种水溶液中,H + 和OH -离子浓度的乘积均相等。
9。
将氨水的浓度稀释一倍,溶液中OH — 离子浓度就减小到原来的一半。
,可以组成缓冲溶液.11.缓冲溶液中,当总浓度一定时,则c (A —)/c(HA )比值越大,缓冲能力也就越大。
12。
某些盐类的水溶液常呈现酸碱性,可以用来代替酸碱使用. 13。
由质子理论对酸碱的定义可知, NaHCO 3只是一种碱。
,可以组成缓冲溶液。
二.选择题1.某弱酸HA 的K a θ=1×10-5,则其0。
1 mol·L -1溶液的pH 值为 A. 1.0 B.2.0 C. 3。
0 D.3.52.有下列水溶液:(1)0.01 mol ·L —1CH 3COOH ;(2)0.01 mol ·L -1CH 3COOH 溶液和等体积0.01 mol ·L -1HCl 溶液混合;(3)0。
01 mol ·L -1CH 3COOH 溶液和等体积0.01 mol ·L —1NaOH 溶液混合; (4)0。
01 mol ·L —1CH 3COOH 溶液和等体积0。
01mol ·L—1NaAc 溶液混合。
则它们的pH 值由大到小的正确次序是A.(1)〉(2)〉(3)〉(4) B 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A:Na2CO3 –NaHCO3 pKa2θ =10.25 B:NH3·H2O – NH4CI
pKbθ =4.75
C: HAC –NaAc
pKaθ =4.75
D:NaH2PO4 – Na2HPO4 pKa2θ =7.20
2. HCN溶液中,加少量固体NaCN后,则( A )
A: HCN 酸度下降 C:HCN 酸度增大
10.质子酸碱理论认为:H2O既是酸又是碱,其共轭
酸是
H3O+ ,其共轭碱是 OH- 。
11.已知CH3CH2CH2COONa的水解常数是Kh=7.69×10-10,它 的共轭酸是 CH3CH2CH2C,OOH
该酸的Ka值应等于 1.3×10-5 。
结束
选择题
1.为了保证某工作液PH值为9,应选用( B )缓冲对配制 缓冲溶液。
9.在氨水中加入NH4Cl后,NH3的α和pH值变化是:( D )
A. α和pH值都增大
B. α减小,pH值增大
C. α增大,pH值变小
D. α 、pH值都减小
10.弱酸的电离常数值由下列哪项决定?( D )
A. 溶液的浓度
B. 酸的电离度
C. 酸分子中含氢数
D 酸的本质和溶液温度
结束
选择题
11.某混合液中含有0.2MNaHCO3和0.1MNa2CO3,其PH值应取( B )
课件制作:应用化学教研室
酸碱平衡
结束
填空题
1.根据酸碱质子理论,HAc的共轭碱为 A_c- NH3的共轭酸__N_H_4+_。 2.酸碱电离理论认为酸碱中和反应的实质是 H+ + OH- == H2O。
酸碱质子理论认为酸碱中和反应的实质是_质__子__的__传__递__反__应_。
3.同离子效应使弱电解质的电离度减 小 ,稀释溶液使弱 电解质的电离度 增 _大 ,盐效应使弱电解质的电离度
Happy Study!!!
结束
2.配制pH为5.00的缓冲溶液,需称取多少克结晶乙酸钠
(NaAc·3H2O,摩尔质量为136g·mol-1)溶于300ml0.50 mol·L-1 HAc中(忽略体积变化)?
3.维持人体血液、细胞液pH的稳定,H2PO4--HPO42- 缓冲体 系起了重要作用。(1)解释为什么该缓冲体系能起到缓冲
7.同一弱电介质,溶液越稀,电离度__越__大___. 相同 浓度的不同弱电介质,电离常数越大,电离度_越__大__。
结束
填空题
8.在氨溶液中,加入NH4Cl则氨的α 减小,溶液的 pH值 减小,这一作用称为 同离子效应。
9.对于二元弱酸H2A,其逐级解离常数为K1 、K2, 当K2很小时,那么c(A2-)= K2 。
A. 溶液OH-浓度变小 C. NH3的α降低
B. NH3的Kb变小 D. pH值变小
7.可逆反应HCO3-+OH- → CO32-+H2O 各物质中质子酸是: ( B)
A. HCO3-和CO32- C. H2O和OH-
B. HCO3-和H2O D. OH-和CO32-
结束
选择题
8.下列能做缓冲溶液的是( A )。
B: D:
KHaCNH电CN 离变度大升高
结束
选择题
4.等量的酸和碱中和,得到的pH值应是:( D )。
A. 呈酸性
B. 呈碱性
C. 呈中性
D. 视酸碱相对强弱而定
5.NaAc溶液被稀释后:( A )。
• 水解度增大 C. OH-浓度增高
B. pH值上升了 D. 前三者都对
6.在氨溶液中加入氢氧化钠,使:( B )。
A. 60mL 0.1 mol·L-1HAc和30mL 0.1 mol·L-1NaOH混合液
B. 60mL 0.1 mol·L-1HAc和30mL 0.2 mol·L-1NaOH混合液
C. 60mL 0.1 mol·L-1HAc和30mL 0.1 mol·L-1HCl混合液
D. 60mL 0.1 mol·L-1NaCl和30mL 0.1 mol·L-1NH4Cl混合液
而不能抵抗少量外来碱的影响。
( )×
9.纯水中Kw=c(H+)·c(OH-)=10-14(25℃),加入强酸后因H+
离子浓度大大增加,故Kw也大大增加。
(× )
10.在NaHCO3溶液里通入CO2,便可得到一种缓冲液. ( √ )
11.pH值相等的缓冲液,未必具有相同的缓冲容量。 ( √ )
12.将氨水和HCl混合,不论两者比例如何, 一定不可能组成缓冲溶液。
作用?(2)溶液的缓冲范围是多少?
(3)当
CH2PO4
0.050
mol
L ,C 1 HPO42
0.15mol L1
时缓冲溶液
的pH是多少?
4.某一元弱碱(MOH)的分子量为125,在298K时取0.500g
溶于50.0ml水中,测得溶液的pH=11.30,试计算MOH的Kb 值。
结束
c.计算所需缓冲对的量 因pKa与要求的pH值不严格相等, 需要按照所需pH值,利用缓冲基本公式,计算出弱酸和共 轭碱的浓度比或所需要的量。
d.用仪器进行校正 配制后用pH计测定和校准缓冲溶液, 必要时外加少量相应酸或碱使与要求的pH值一致。
结束
简答题
2.简述HAc—NaAc缓冲溶液的缓冲原理。 答:在HAc—NaAc缓冲溶液中:由于存在同离子效应, [HAc]、[Ac-]都很大。在此溶液中, 加少量的强酸时:Ac-+ H+ ≒ HAc ; 加少量的强碱时:HAc + OH— ≒H2O+ Ac均生成弱电解质,对溶液体系pH值影响很小,因此体系 的pH值能在一定范围维持基本不变。
A:Pka2+㏒2 B:Pka2 -㏒2 C:Pka1+㏒2
D:Pka1-㏒2
12.为了保证某工作液的PH值为4--5,应选用( C )缓冲对
配制缓冲溶液。
A:Na2CO3+NaHCO3 C:HAC-NaAc
B:NH3.H2O- NH4Cl D:NaH2PO4- Na2HPO4
结束
判断题
1.在一定温度下,改变溶液的PH值,水的离子积不变( √ )
(× )
结束
简答题
1.简述缓冲溶液的配制原则。
答:a.选择合适的缓冲对 选择缓冲对应考虑两个因素,首 先应使其中弱酸的pKa与所要求的pH值相等或接近。其次 还需考虑所选择的缓冲对物质是否与主反应的物质、主药 发生配伍禁忌;
b.总浓度要相宜 为了有较大的缓冲能力,一般所需弱 酸、共轭碱等缓冲对的浓度范围在0.05~0.5 mol·L-1 之 间为好。
结束
课后习题
1.计算下列混合溶液的pH值。 (1)20ml 0.1mol·L-1HCl与20ml 0.1mol·L-1NaOH (2)20ml 0.10mol·L-1HCl加20ml 0.10mol·L-1NH3·H2O (3)20ml 0.10mol·L-1HAc加20ml 0.10mol·L-1NaOH
稍微增大
_
4.在NaHCO3- Na2CO3的缓冲溶液中,抗酸成份是___N_a_2_C_O_3__, 抗碱成份是 NaHCO3 。
结束
填空题 5.根据酸碱质子理论,共轭酸碱对的酸常数Ka和碱 度常数Kb之间的关系为 Ka. Kb = Kw 。 6. NH3 + H2O≒NH4++OH-,用质子理论分析,其中属 质子酸的为_H_2O__._N_H_4+__,属质子碱的为—NH—3—.—OH— -。.
2.在0.1mol/LH2S溶液中,[H+]=2[S2-]。
( ×)
3.H2CO3——Na2CO3是缓冲溶液的缓冲对。
(× )
4.0.2mol.L-1HAc溶液〔H+〕是0.1mol.L-1HAc溶液〔H+〕的两倍。
碱一般都很弱。
(√ )
8.酸性缓冲液(HAc-NaAc)可以抵抗少量外来酸对pH的影响,
