有机化学第四章结构的表征习题答案
王全瑞主编《有机化学》习题及思考题答案
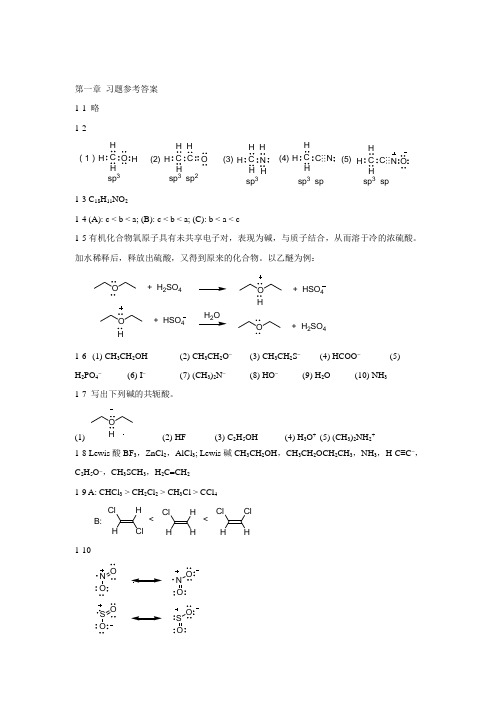
第一章 习题参考答案 1-1 略 1-2C O H H H C C OH H (1)(2)H(3)sp 3sp 3 sp 2C NH H H H C C H H H ⋯⋯N (4)(5)C C HHH ⋯⋯N O sp 3 sp 3sp sp 3 sp1-3 C 18H 11NO 21-4 (A): c < b < a; (B): c < b < a; (C): b < a < c1-5有机化合物氧原子具有未共享电子对,表现为碱,与质子结合,从而溶于冷的浓硫酸。
加水稀释后,释放出硫酸,又得到原来的化合物。
以乙醚为例:O+ H 2SO 4O + HSO 4H+ HSO 4HH OO+ H 2SO 41-6 (1) CH 3CH 2OH (2) CH 3CH 2O - (3) CH 3CH 2S - (4) HCOO -(5)H 2PO 4-(6) I -(7) (CH 3)2N -(8) HO -(9) H 2O (10) NH 31-7 写出下列碱的共轭酸。
(1) O H(2) HF (3) C 2H 5OH (4) H 3O + (5) (CH 3)2NH 2+1-8 Lewis 酸BF 3,ZnCl 2,AlCl 3; Lewis 碱CH 3CH 2OH ,CH 3CH 2OCH 2CH 3,NH 3,H-C ≡C -,C 2H 5O -,CH 3SCH 3,H 2C =CH 2 1-9 A: CHCl 3 > CH 2Cl 2 > CH 3Cl > CCl 4HCl H HHCl Cl H HCl HCl B:<<1-10N ON OS S ON OON OON OO第二章 习题参考答案 2-1(1)3-甲基-4-乙基庚烷;(2)2-甲基-4-异丙基己烷;(3)新壬烷;(4)2-甲基-5-乙基庚烷 (5)2-甲基-3-丙基己烷;(6)4-叔丁基辛烷;2-2 (1)(2)CH 3CHCHCH 3H 3CCH 3C CH 2CH 3CH 3CH 3H 3C (3)CH 3CHCH2CH 2CH 3CH32-3(1)庚烷(2)2-甲基己烷(3)(4)(5)(6)(7)(8)(9)3-甲基己烷2, 2-二甲基戊烷3, 3-二甲基戊烷2, 3-二甲基戊烷2, 4-二甲基戊烷3-乙基戊烷2, 2, 3-三甲基丁烷2-4CH 3—C —CH 2—CH —CH 2—CH 3CH 3CH 3CH 31°2°3°2°4°1°1°1°1°2-5 该化合物分子式为C 8H 18,结构式 命名为:2,2,3,3-四甲基丁烷 2-6 化合物沸点依次降低顺序:(4)>(2)>(3)>(5)>(1)H 3CH 3CC C CH 3CH 3H3CCH 3(7) (CH 3)2CHCH 2CH 3(8) (CH 3)2CHCHCH 2CH 2 CCH 2CH 3CH 2CH 3CH 3CH 2CH 3(9)(10)2-7 熔点:(1)>(2);沸点:(1)<(2) 2-8 稳定性大小:(1)>(3)>(2)>(4)2-9 1,2-二溴乙烷的四种典型构象式(从左到右稳定性依次降低)H HBr H H BrH H H HBrH H H HHHBr HBrH BrBr对位交叉式邻位交叉式 部分重叠式 全重叠式3, 4-二甲基己烷的优势构象为:2-10链引发:Cl 22Cl •链增长:Cl •+Cl•+ HCl•+ Cl 2Cl •+链终止:Cl •Cl •+Cl 2•Cl •+Cl•+•2-11 主要的原因是:甲基环己烷分子结构中有1个3º H ,10个2º H ,3个1º H ,进行溴代CH 3Br25反应时,不同类型氢原子的反应活性大小是3º H ∶2º H ∶1º H = 1600∶82∶1,可以初步计算出3º H 被溴取代后的产物所占百分比例大约是66%,因此反应主要得到 2-13 该化合物为: Cl 2++ HClC C H 3C H 3C H 3C CH 3CH 3CH 3C C H 3C H 3C H 3C CH 3CH 3CH 2Cl第三章 习题参考答案 3-1(1)甲基环戊烷 (2)1-甲基-4-乙基环己烷 (3)2-甲基-3-环丙基-6-环丁基辛烷 (4)反-1-甲基-2-异丙基环丁烷 (5)1-甲基-3-环戊基环己烷 (6)2-甲基-8-乙基螺[4.5]癸烷 (7)2, 7, 7-三甲基二环[4.1.0]庚烷 (8)二环[3.3.3]十一烷(9)1-甲基二环[2.2.2]辛烷(10) (11) (12) (13)3-2 该烃分子可能为下列化合物之一:甲基环己烷 乙基环戊烷 丙基环丁烷 丁基环丙烷 3-3(1)2) H 2OBrBr CH 2BrOHC C H 3C H 3C H 3C CH 3CH 3CH 3(2)HBrBr3-4顺-1-甲基-4-丙基环己烷的椅式构象式 反-1-甲基-4-丙基环己烷的椅式构象式CH 3C(CH 3)3H 3CC(CH 3)3CH 3C(CH 3)3C(CH 3)3CH 3最优势构象 3-5(1)CH 3H 3CC(CH 3)3(2) CH 3C 2H 5CH 3(3)CH 3(4) C(CH 3)3C 2H 5(5)C 2H 5C 2H 5H 5C 23-6 3, 4-二溴-1-叔丁基环己烷可能的构象异构体如下:C(CH 3)3C(CH 3)3Br BrC(CH 3)3BrBr C(CH 3)3BrBrC(CH 3)3Br BrBrBr C(CH 3)3BrBrC(CH 3)3BrBrC(CH 3)3BrBr3-7 化合物A 是: 化合物B 是: Br反应式:溴水褪色BrCH2BrBr3-8溴 水褪 色褪 色无变化无变化褪 色3-9 反-1,2-二甲基环己烷采用ee 构象时,亚甲基和甲基是处在对位交叉式,分子内能较小;而在aa 构象中,亚甲基和甲基是处在邻位交叉式,分子扭转张力相对比较大,同时由于1,3-竖键作用,空间张力大。
有机化学第四章习题答案

p941.解释下列名词。
共轭效应互变异构1,4-加成亲核加成乙烯基化反应氢化热离域能(共轭能)超共轭效应双烯合成亲双烯体红外活性键的伸缩振动键的弯曲振动解:共轭效应:由于结构的原因,双键π电子云不再只定域在双键上,也有部分离域到分子的其它部分,即发生了键的离域。
这种离域效应叫共轭效应。
互变异构:在一般条件下,两个构造异构体可以迅速地相互转变的异构现象。
1,4-加成:一分子试剂加在共轭双键两端的加成反应。
亲核加成:由亲核试剂进攻而引起的加成反应。
乙烯基化反应:反应物分子中的氢原子被乙烯基取代的反应。
氢化热:每一摩尔烯烃催化加氢时放出的能量叫氢化热。
离域能(共轭能):共轭分子中由于键的离域而导致分子的额外的稳定能,称为离域能。
超共轭效应:σ轨道与π轨道相互作用而引起的离域效应。
双烯合成:共轭二烯和某些具有碳碳双键的化合物发生1,4-加成,生成环状化合物的反应。
亲双烯体:在双烯合成中能和共轭二烯反应的重键化合物叫做亲双烯体。
红外活性:能吸收红外辐射的性质。
键的伸缩振动:只改变键长,而不改变键角的振动。
键的弯曲振动:只改变键角,而不改变键长的振动。
2.用系统命名法命名下列化合物:(1) (CH3)3CC≡CCH2CH3(2) HC≡CCH2Br (3) CH2=CHC≡CH (4)CH2=CHCH2CH2C≡CH (5) CH3CHClC≡CCH2CH3(6) CH3C≡CC(CH=CH2)=CHCH2CH3(7)解:(1) 2,2-二甲基-3-己炔(2) 3-溴丙炔(3) 1-丁烯-3-炔(4) 1-己烯-5-炔(5) 2-氯-3-己炔(6) 4 –乙烯基-4 –庚烯-2-炔(7) 1,3,5-己三烯3.写出下列化合物的构造式。
(1) 4 –甲基-1-戊炔(2) 3 –甲基-3-戊烯-1-炔(3) 二异丙基乙炔(4) 1,5 –己二炔(5) 异戊二烯(6) 丁苯橡胶(7) 乙基叔丁基乙炔解:(1) CH≡CCH2CH(CH3)CH3(2) CH≡CC(CH3)=CHCH3(3) (CH3)2CHC≡CCH(CH3)2(4) CH≡CCH2CH2C≡CH (5) CH2=C(CH3)CH=CH2(6) -[-CH2CH=CHCH2CH(C6H5)CH2-〕n- (7)CH3CH2C≡CC(CH3)34.写出1-丁炔与下列试剂作用的反应式。
有机化学第四版答案

有机化学第四版答案第一章绪论1.1 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:离子键化合物共价键化合物熔沸点高低溶解度溶于强极性溶剂溶于弱或非极性溶剂硬度高低1.2 NaCl与KBr各1mol溶于水中所得的溶液与NaBr及KCl各1mol溶于水中所得溶液是否相同?如将CH4 及CCl4各1mol混在一起,与CHCl3及CH3Cl各1mol的混合物是否相同?为什么?答案: NaCl与KBr各1mol与NaBr及KCl各1mol溶于水中所得溶液相同。
因为两者溶液中均为Na+ , K+ , Br-, Cl-离子各1mol。
由于CH4 与CCl4及CHCl3与CH3Cl在水中是以分子状态存在,所以是两组不同的混合物。
1.3 碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:1.4 写出下列化合物的Lewis电子式。
a. C2H2b. CH3Clc. NH3d. H2Se. HNO3f. HCHOg. H3PO4h. C2H6i. C2H2 j. H2SO4答案:1.5 下列各化合物哪个有偶极矩?画出其方向。
a. I2b. CH2Cl2c. HBrd. CHCl3e. CH3OHf. CH3OCH3答案:1.6 根据S与O的电负性差别,H2O与H2S相比,哪个有较强的偶极-偶极作用力或氢键?答案:电负性 O > S , H2O与H2S相比,H2O有较强的偶极作用及氢键。
第二章饱和脂肪烃2.2 用系统命名法(如果可能的话,同时用普通命名法)命名下列化合物,并指出(c)和(d) 中各碳原子的级数。
答案:a. 2,4,4-三甲基-5-正丁基壬烷5-butyl-2,4,4-trimethylnonaneb. 正己烷hexanec. 3,3-二乙基戊烷3,3-diethylpentaned. 3-甲基-5-异丙基辛烷5-isopropyl-3-methyloctanee. 2-甲基丙烷(异丁烷)2-methylpropane (iso-butane)f. 2,2-二甲基丙烷(新戊烷)2,2-dimethylpropane (neopentane)g. 3-甲基戊烷3-methylpentaneh. 2-甲基-5-乙基庚烷 5-ethyl-2-methylheptane2.3 下列各结构式共代表几种化合物?用系统命名法命名。
有机化学参考答案

答:(1)3,4-二甲基-1-戊烯(2)4-甲基-7-乙基-5-异丙基-5-癸烯
(3) 5-甲基-3-乙基-2-庚烯(4) 7-甲基-3-乙基-4-丙烯基-1,3,5-壬三烯
(5) 6,6-二甲基-3-庚炔(6) 6-甲基-3-乙基1-1辛炔
(7) 3-甲基-1-己烯-5-炔(8) 3-叔丁基-2-己烯-4-炔
(9)4-正丙基-8-异丙基-1,5-癸二烯-9-炔(10) 3-甲基-5-乙烯基-3,6,7-癸三烯-1-炔
2.7用系统命名法命名下列脂肪组化合物。
答:(1)乙基环丙烷(2)4-甲基-1-环丁基-1-戊烯(3)1-甲基-3-环丁基环戊烷
(4)1,6-二甲基环戊烯(5)1-甲基-6-乙基-8-氯螺[4.5]癸烷
(2)>(1) >(3) >(4)
1.11给出下列结构的共轭结构式,并指出哪个贡献最大?
.
答:
贡献大
贡献大
1.12判断下列共轭结构式的正误,说明理由。
答:(1)错。H原子位置发生了变化
(2)正确。
(3)正确
(4)正确
1.13下列物种哪些是亲电试剂?那些是亲核试剂?
答:亲电试剂:(1),(2),(6),(7),(8)。
答:(1)(2)(3)
无
(4)(5)(6)
1.6将下列各化合物按酸性排序:
. 答:从诱导效应分析:(1)D>C>A>B (2) A>B>D>E>C
1.7下列各组化合物氢化时,哪一个的氢化热较高?
答:氢化热用来判断烯烃稳定性。
1.8下列分子中各存在哪些类型的共轭?
答:⑴正常共轭(π、π共轭),超共轭(σ、π共轭)
答:略。
有机化学课后第四章习题答案
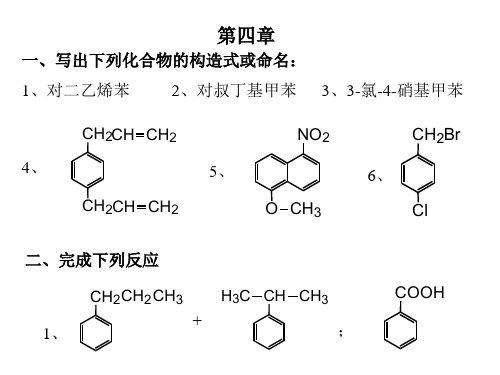
一、写出下列化合物的构造式或命名:
1、对二乙烯苯 2、对叔丁基甲苯 3、3-氯-4-硝基甲苯
CH2CH CH2
4、
5、
NO2CH2Br 6、 NhomakorabeaCH2CH CH2
O CH3
Cl
二、完成下列反应
CH2CH2 CH3
H3C CH CH3
1、
+
;
COOH
2、Cl2/光照; AlCl3 +
3、H2SO4/0~80℃; 165℃
CH3 Cl
NO2
CH3
Br2
CH3
3、
FeBr3
Br
Br
Br
4、
Br2
ClCOCH3
FeBr3
AlCl3
COCH3
CH3 KMnO4
7、
H+,△
COOH
HNO3 H2SO4 O2N
COOH NO2
八、指出下列化合物硝化时,导入的硝基在环上的位置:
CH3 CH3
CH3 OCH3
CH3
OH
SO3H
Cl
1、
>
NO2
NO2
>
>
NO2
OH
2、
>
COCH3 NO2
>
>
五、由苯或甲苯开始合成下列化合物:
CH3 HNO3
2、
H2SO4
CH3
Cl2
FeCl3
NO2
CH3 Cl
NO2
或:
CH3 浓H2SO4 100℃
CH3
Cl2
FeCl3
SO3H
CH3 Cl
H3O+ 150℃
有机化学课件 第二版 高占先主编 (第4章 结构的表征)

â × ¸ Æ
Ö Ó Ë ¯ ¹ ¼ ¯ ¢ ñ ¯ ¢ ª ¯ ¢ Ë â ç Ó Ë ¯ È ·×Ô ¶ £ Æ ¶ ¡ Õ ¶ ¡ ׶ ¡ ¹ Í µ ×Ô ¶ µ £ ¾ Ó ¯ Ä ¨Ü ¾ ä ¯ º ¬ ø £ Á ׺ µ £ Ä Á ±º ² Á Ð © ¾ ö Ö Ó Ð º Ü æ Ú º ¨ý ¾ Ä ª à · ·×Ö Ö Ä ´ Ô Ò ¶ Ê Á µ ×é ¯ ¢ ñ ¯ ¡ ç Ó ½ ¨Ü ¶ ¶ ¡ Õ ¶ ¢ µ ×Ô Ç Ä »
4.2.1 基 本 原 理
1. 分子振动的类型 (1)伸缩振动
成键的两原子沿键轴方向伸长和缩短的振动
称为伸缩振动,常用ν 表示。
振动频率(近似地按简谐运动处理)
振动频率ν 与两原子的质量m1、m2、 键的力常数 k 有关:
或用波数σ 表示为:
①键的力常数k与键能有关,键能大,力常数
大,振动频率也大。
d
化学位移
10
6
为什么选用TMS(四甲基硅烷)作为标准物质?
绝大多数吸收峰均出现在它的左边。 (2)结构对称,是一个单峰。 (3)容易回收(b.p低),与样品不反应、不缔合。
(1)屏蔽效应强,共振信号在高场区(δ 值规定为0),
例:在60MHz的仪器上,测得氯仿与TMS间吸收 频率差为437Hz,用δ 表示氢的化学位移为
•
各种官能团的红外吸收频率汇于下表:
4.2.3 红外吸收光谱图及其解析
1. 红外吸收光谱图
cm
1
1
横坐标:波长/λ或波数/cm-1。
m
10
4
A log(
1 T
)
纵坐标:吸光度A或透光率T。
第4章 结构表征

(3) —C—H伸缩振动 A. 不饱和碳原子上的=C—H( C—H )
C—H =C—H 苯环上的 C—H 3300 cm-1 3100 3000 cm-1 3030 cm-1 2820、2720 cm-1
>3000 cm-1
醛基的C—H —CH3 —CH2— —C—H
B. 饱和碳原子上的—C—H
结构表征 三种方法:物理常数测定法、化学法和近代物理方法 化学法——利用官能团的特征反应。 缺点:
样品用量大、工作繁重、大量的时间; 熟练的实验技巧,高超的智慧和坚韧不拔的精神; 准确性差; OH
O HO NCH3 吗 啡 碱
1805-1952
结构表征 近代物理方法:波谱法 四 谱
红外光谱(IR) —— 官能团种类 核磁共振谱(NMR) —— C-H骨架及所处化学环境 紫外—可见光谱(UV /Vis)—— 共轭结构 质谱(MS)—— 分子量及部分结构信息 ①样品用量少(μg-mg) ②分析时间短 -9 ③精确度高(误差:质谱法10 ,化学法 > 5%)
R C C R
偶极子在交 变电场中的 作用示意图
4、峰强 问题:C=O 强;C=C 弱;为什么? 吸收峰强度 偶极矩的平方
偶极矩变化大吸收峰强度大
符号:vs(很强);s(强);m(中);w(弱)
极性较强的基团(如C=O,C-X等)振动,吸收强度较 大;极性较弱的基团(如C=C、C-C、N=N等)振动,吸 收较弱。
绝大多数化合物在红外光谱图上出现的峰数远小 于理论上计算的振动数。
3、红外吸收光谱产生的条件——红外活性
满足两个条件: 辐射光的频率与分子振动能级跃迁所需的频率相当; 分子振动过程中能引起分子偶极距变化---辐射与物质间 有相互偶合作用。
第四章 有机化合物的结构表征
4,振动频率及其影响因
根据胡克定律和经典力学规律可以推导出其振动频率和 波数的公式:
化学键越强(即键的力常数k越大)原子折合质量越小,化 14 学键的振动频率越大,吸收峰将出现在高波数区。
P98-99
(1)力常数和折合质量的影
折合质量对振动频率的影响
15
(2),诱导效
O R C R' 1715 O R C F 1869
红外吸收产生条件
(1) 基团振动产生偶极矩变化。 (2) 辐射能量满足振动能级跃迁需要。 红外光谱适用范围广,无机和有机化合物都可以测定红外光 谱;各种相态都可以测定,如气态、液态、固态。 最常用溴化钾压片法,吸湿造成在3330cm-1处有吸收峰。
17
6.红外光谱图和波谱信
波数线性 4000~2000 cm–1等间距,2000~400 cm–1等间距。
43
44
二、1H-NMR的化学位移:
(一)屏蔽效应和化学位
感应磁场对外磁场的屏蔽作用称 作电子屏蔽效应(electronic shield effect)。 这种由于分子中各组氢核所处的化学环境不同,在不同的磁场 产生共振吸收的现象称为化学位移(chemical shift),也作为表 示不同信号间差距的度量。
近代物理方法 ——有机化合物的波谱学。
4
(5)化合物结构表征: 化学方法:利用官能团特征反应确定化合物类别,化 降解及合成方法,官能团转化法。 物理常数测定法:标准品对比法,如混合熔点法。 近代物理方法 ——有机化合物的波谱学。 近代物理方法的特点:试样用量少,测试时间 短,结果精确等。 有机化合物的结构表征往往需要多种方法结合 使用,才能确定化合物的结构。
羰基的伸缩振动频率(cm-1)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章 结构的表征4-1 如何用IR 光谱区别下列各组化合物。
(1)异戊烷分子中有异丙基,在1370—1380cm -1 的吸收峰分裂成两峰,强度接近; (2)在3000cm -1以上无吸收峰者为丁烷; (3)在3000—3100cm -1无吸收者为环已烷; (4)在3010cm -1附近有吸收峰者为甲叉基环已烷(亚甲基环已烷); (5)在3025cm -1附近和2720cm -1处有强吸收峰者为4-已烯醛; (6)在1060cm -1附近有强吸收峰者为正戊醇;(7)在1750—1860cm-1出现两个峰,其中高频峰强于低频峰者为乙酐。
4-2 如何用1H-NMR 谱区分下列各组化合物?(1)环丁烷只有一个单峰,而甲基环丙烷有四组吸收峰; (2)新戊烷只有一个单峰,而正戊烷有三组吸收峰;(3)前者(1-氯-2-溴乙烷)有两组峰,而后者(1,2-二溴乙烷)只有一个单峰。
4-3 比较下面两化合物中所标出的质子在1H-NMR 谱中化学位移大小,并从低场到高场的顺序排列。
(1)B →A →C →D ; (2)A →B →C 。
4-4 请将下列各化合物中画线的质子的化学位移按由低场至高场的顺序排列。
(2)→(1)→(3)。
4-5将下列化合物按C=O 健伸缩振动吸收波数由大到小排列成序。
(1)→(2)→(3)。
4-6 请将下列各组化合物按紫外吸收波长由大到小的顺序排列。
(1) B →D →A →C ; (2) D →C →B →A 。
4-7根据NMR 谱推测下列化合物可能的构造式。
C CH 3CH 3H 3CBrCH 2OHCH 3CH BrCH 3(1)(2)(3)(4)CH 2CH 2CHCH 3BrBr4-8某化合物的分子式为C 4H 8O,它的红外光谱在1715cm -1有强吸收峰,它的核磁共振谱有一单峰,相当于三个H ,有一四重峰相当于二个H ,有一三重峰相当于三个H.。
试写出该化合物的构造式。
CH 3CCH 2CH 3O该化合物为丁酮,其构造式为4-9根据光谱分析,分别推断下列各芳香族化合物可能的构造式。
(1)(2)(3)CH 2CH 2CH 2Br CH 2CCH 3OC CH 3CH 3CH 34-10某化合物A ,其分子式为C 8H 10O ,质谱得到分子离子峰为m/z=122;在IR 谱中,3200~3600cm -1有强宽峰,在3000 cm -1和700~750 cm -1处也有强吸收峰;1H-NMR 显示,δ7.5(m ,5H ),δ3.7(t ,2H ),δ2.7(t ,2H ),δ2.5(s ,1H ),请推测该化合物的结构,并标明化合物中各质子的化学位移值。
H 2CH 2C OH δ7.5δ2.7δ3.7δ2.5该化合物构造式为4-11某化合物的分子式为C 4H 6O ,其光谱性质为:UV 谱:在230nm 附近有吸收峰,κ>5000;1H-NMR谱:δ=2.03(3H )双峰,δ=6.13(1H )多重峰,δ=6.87(1H )多重峰;δ=9.48(1H )双峰;IR 谱:在1720 cm -1 2720cm -1处有强吸收。
试推该化合物的构造式。
δ2.03δ6.13δ6.87δ9.48该化合物构造式为CH 3CH C H CHO4-12根据光谱分析,分别推测下列各脂肪族化合物的构造式:(1)分子式为C 3H 6OUV 谱:210nm 以上无极大值;IR 谱:1080cm -1;1H-NMR 谱:δ=4.75(4H )三重峰,δ=2.75(2H )五重峰,J=7.1Hz 。
(2) 分子式为C 3H 7NO UV 谱:219nm(κ=60);IR 谱:3413cm -1,3236cm -1,1667cm -1; 1H-NMR 谱:δ=6.50(2H )宽单峰,δ=2.25(2H )四重峰,δ=1.10(3H )三重峰,J=7.5Hz 。
(3) 分子式为C 4H 7NUV 谱:219nm 以上无极大值;IR 谱:2273cm -1;1H-NMR 谱:δ=2.82(1H )七重峰,δ=1.33(6H )双峰,J=6.7Hz 。
(4)分子式为C 8H 8O 2UV 谱:270nm(κ=420);IR 谱:1725cm-1;1H-NMR 谱:δ=11.95(1H )单峰;δ=7.21(5H )多重峰,δ=3.53(2H )单峰。
(2)(3)(4)H 2C O H 2C CH 2CH 3CH 2CONH 2(CH 3)2CHCNCH 2C OOH(1)4-13化合物分子式为C 4H 6O 2,其13C-NMR 谱如下图所示,推断其可能的构造。
H 2CC HC OCH 31234该化合物构造式为:O 4-14化合物A ,mp :21℃;元素分析:C :79.97%,H :6.71%,O :13.32%;MS 、IR 、NMR谱如图所示,提出A 的结构式并解释三谱的归属。
答:A 为苯乙酮。
结构式如下示。
OC CH3MS图中m/z=120,是A的分子离子峰,m/z=105是A去甲基后离子峰,m/z=77是苯基离子峰。
IR谱图中1750cm-1处的强吸收峰是羰基的伸缩振动峰,在1300cm-1附近分别为甲基中C—H的弯曲振动和C—C的弯曲振动峰。
指纹区二个吸收峰(760cm-1、690cm-1)是C —H的面外弯曲振动峰。
1H-NMR较高场的单重峰,对应的是CH3—中3个H,较低场对应的是苯环中的5个H。
第五章饱和烃5-1 写出符合下列条件的C7H16的构造式,并各以系统命名法命名。
(1)庚烷(3)3-甲基已烷(4)2,2-二甲基戊烷(5)2,3-二甲基戊烷(6)2,4-二甲基戊烷(7)3,3-二甲基戊烷(8)3-乙基戊烷5-2 写出下列烷基的名称及常用缩写符号。
(1)甲基(Me—);(2)乙基(Et—);(3)正丙基(n-Pr—);(4)异丙基(i-Pr—);(5)正丁基(n-Bu—);(6)异丁基(i-Bu—);(7)仲丁基(s-Bu—);(8)叔丁基(t-Bu—)。
5-3 比较下列化合物沸点的高低,并说明原因。
(1) CH3(CH2)4CH3(2) (CH3)2CH(CH2)2CH3(3)CH3CH2C(CH3)3(4) CH3CH2CH(CH3)CH2CH3(1)>(4) >(2)>(3)同碳数的烷烃异构体,含支链越多,分子间作用力越弱,沸点越低。
5-4 完成下列反应式:OSO3HBrBr(1)HO2C(CH2)4CO2HHNO3+(2)BrBr-60℃Br 2+(3)CH(CH 3)2CO 2H 2OCl+ClClCl碳正离子重排导致的产物++CH(CH 3)2BrC(CH 3)2Br+(4)BrHBr(5)5-5 比较下列化合物构象的稳定性大小。
1,4-二甲基环已烷的构象稳定性(1)<(2)。
原因是(1)中的二个甲基均处于a 键上,而(2)中的二个甲基则皆处于e 键上,后者构象能量较低,较稳定。
3H 33CH 3CH 3H 3CCH 3(1)(2)5-6 下列异构体中哪个最稳定?题目所示二甲基环已酮三个异构体对应的构象式如下,从中可看出(3)最稳定,因为其两个甲基均处于e 键上,体系能量较低。
OOO(1)(2)(3)5-7 环丙烷内能高是由哪些因素造成的?环丙烷分子中碳原子为不等性sp 3杂化,轨道重叠比开链烷烃的小,形成的碳碳共价键键能小(即有角张力),容易断裂,不如开链烷烃牢固;其次是环丙烷的三个碳原子共平面,相邻两个碳原子上的C —H 键是重叠式构象,存在扭转张力。
基于上述原因,导致环丙烷的内能较高。
5-8 用费歇尔(Fischer )投影式表示下列化合物的构型,并用R / S 标记手性碳的构型。
3HCH 3BrHCH 3Br DC 2ClH 3C(1)(2)(3)三个化合物费歇尔投影式如下CH 2ClDHCH 3CH 3HCl CH 2CH 3CH 3H Br CH 3HBr (1)(2)(3)SS RS5-9 下列四个纽曼投影式表示的化合物,哪些是对映体?哪些是非对映体?哪些是同一化合物的不同构象?CH 3H Cl C 2H 5HBrH 32H 5C 2H 5BrHH3C Cl H(1)(4)(2)(3)32H 5C 2H H 332H 5C 2H 5BrHCH 3Cl HC 2H 5BrH H Cl CH 3C 2H 5Br HCH 3HClCH 3Cl H C 2H 5HBr C 2H 5Br H CH 3ClH H Cl H 3C C 2H 5HBrCH 3H ClC 2H 5HBrCH 3H Cl C 2H 5BrH C 2H 5HBr ClHCH 3C 2H 5H BrCH 3ClH(1)(2S ,3R )-2-氯-3-溴戊烷; (2)(2R ,3R )-2-氯-3-溴戊烷; (3)(2S ,3R )-2-氯-3-溴戊烷; (4)(2S ,3S )-2-氯-3-溴戊烷。
∴(2)和(4)是对映体;(2)和(1)或(3)、(4)和(1)或是非对映体;(1)和(3)是同一化合物的不同构象。
5-10 写出环戊烷生成氯代戊烷的反应机理并画出链增长阶段的反应势能变化草图。
在图上标明反应物、中间体、过渡态和生成物的结构。
并指出哪一步是反应的控制步骤。
反应机理如下三式所示:(1)(2)(3)Cl 2h υ或△Cl2C 5H 10HCl C 5H 9+Cl++C 5H 9Cl C 5H 9++Cl 2C 5H 9C 5H9C 5H 9Cl+C 5H 9Cl链引发链增长链终止反应势能变化草图:从反应势能草图中可看出,反应机理(2)中第一步即环戊基自由基生成步的活化能较大,所以是整个反应的速率控制步骤。
5-11 2,2,4-三甲基戊烷可以生成哪些碳自由基?按稳定性由大到小的顺序排列这些自由基。
可生成下列自由基。
3(CH 3)2(CH 3)3C(CH 3)2CHCH 2(CH 3)3CCH 2H 2CC H 2C CH 3CH 3CHCH 3CH 3H 3CC H CCH 3CH 3C HCH 3CH 3H 3CC H 2C CH 3CH 3C HCH 3CH 2H 3CC H 2C CH 3CH 3CCH 3CH 3CH 3CHCH 2C(CH 3)3其稳定性为:3°R ·>2°R ·>1°R ·>CH 3·C 5H 10+Cl •C 5H 9Cl+Cl •C 5H 9•+HCl中间体(自由基)过渡态1过渡态2能量5-12 下列反应 t -BuOCl + RH → RCl + t -BuOH 如果链引发反应为:t -BuOCl → t -BuO·+ Cl· ,写出链增长反应。
