电化学基础知识点总结最新版本
电化学基础知识点(大全)
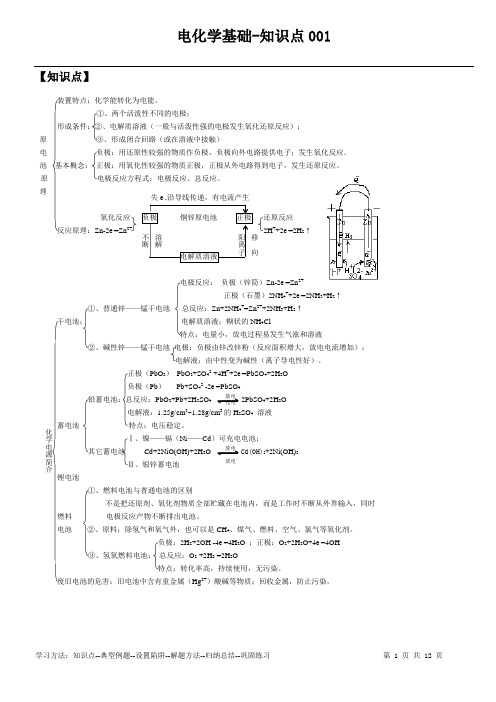
【知识点】装置特点:化学能转化为电能。
①、两个活泼性不同的电极;形成条件:②、电解质溶液(一般与活泼性强的电极发生氧化还原反应); 原 ③、形成闭合回路(或在溶液中接触)电 负极:用还原性较强的物质作负极,负极向外电路提供电子;发生氧化反应。
池 基本概念: 正极:用氧化性较强的物质正极,正极从外电路得到电子,发生还原反应。
原 电极反应方程式:电极反应、总反应。
理氧化反应 负极 铜锌原电池 正极 还原反应反应原理:Zn-2e -=Zn 2+ 2H ++2e -=2H 2↑电解质溶液电极反应: 负极(锌筒)Zn-2e -=Zn 2+正极(石墨)2NH 4++2e -=2NH 3+H 2↑①、普通锌——锰干电池 总反应:Zn+2NH 4+=Zn 2++2NH 3+H 2↑干电池: 电解质溶液:糊状的NH 4Cl特点:电量小,放电过程易发生气涨和溶液②、碱性锌——锰干电池 电极:负极由锌改锌粉(反应面积增大,放电电流增加);电解液:由中性变为碱性(离子导电性好)。
正极(PbO 2) PbO 2+SO 42-+4H ++2e -=PbSO 4+2H 2O 负极(Pb ) Pb+SO 42--2e -=PbSO 4铅蓄电池:总反应:PbO 2+Pb+2H 2SO 4 2PbSO 4+2H 2O电解液:1.25g/cm 3~1.28g/cm 3的H 2SO 4 溶液蓄电池 特点:电压稳定。
Ⅰ、镍——镉(Ni ——Cd )可充电电池;其它蓄电池 Cd+2NiO(OH)+2H 2O Cd(OH)2+2Ni(OH)2Ⅱ、银锌蓄电池锂电池①、燃料电池与普通电池的区别不是把还原剂、氧化剂物质全部贮藏在电池内,而是工作时不断从外界输入,同时燃料 电极反应产物不断排出电池。
电池 ②、原料:除氢气和氧气外,也可以是CH 4、煤气、燃料、空气、氯气等氧化剂。
负极:2H 2+2OH --4e -=4H 2O ;正极:O 2+2H 2O+4e -=4OH -③、氢氧燃料电池: 总反应:O 2 +2H 2 =2H 2O特点:转化率高,持续使用,无污染。
电化学基础知识讲解及总结

电化学基础知识讲解及总结电化学是研究电与化学之间相互作用的学科,主要研究电能转化为化学能或者化学能转化为电能的过程。
以下是电化学的基础知识讲解及总结:1. 电化学基本概念:电化学研究的主要对象是电解质溶液中的化学反应,其中电解质溶液中的离子起到重要的作用。
电池是电化学的主要应用之一,它是将化学能转化为电能的装置。
2. 电化学反应:电化学反应可以分为两类,即氧化还原反应和非氧化还原反应。
氧化还原反应是指物质失去电子的过程称为氧化,物质获得电子的过程称为还原。
非氧化还原反应是指不涉及电子转移的反应,如酸碱中的中和反应。
3. 电解和电解质:电解是指在电场作用下,电解质溶液中的离子被电解的过程。
电解质是指能在溶液中形成离子的化合物,如盐、酸、碱等。
4. 电解质溶液的导电性:电解质溶液的导电性与其中的离子浓度有关,离子浓度越高,导电性越强。
电解质溶液的导电性也受温度和溶质的物质性质影响。
5. 电极和电位:在电化学反应中,电极是电子转移的场所。
电极可以分为阳极和阴极,阳极是氧化反应发生的地方,阴极是还原反应发生的地方。
电位是指电极上的电势差,它与电化学反应的进行有关。
6. 电池和电动势:电池是将化学能转化为电能的装置,它由两个或多个电解质溶液和电极组成。
电动势是指电池中电势差的大小,它与电化学反应的进行有关。
7. 法拉第定律:法拉第定律是描述电化学反应速率的定律,它表明电流的大小与反应物的浓度和电化学当量之间存在关系。
8. 电解质溶液的pH值:pH值是衡量溶液酸碱性的指标,它与溶液中的氢离子浓度有关。
pH值越低,溶液越酸性;pH值越高,溶液越碱性。
总结:电化学是研究电与化学之间相互作用的学科,主要研究电能转化为化学能或者化学能转化为电能的过程。
其中包括电化学反应、电解和电解质、电极和电位、电池和电动势等基本概念。
掌握电化学的基础知识对于理解电化学反应和电池的工作原理具有重要意义。
《电化学基础》知识点归纳

第四章电化学基础第一节原电池原电池:1、概念:化学能转化为电能的装置叫做原电池。
2、组成条件:①两个活泼性不同的电极②电解质溶液③电极用导线相连并插入电解液构成闭合回路3、电子流向:外电路:负极——导线——正极内电路:盐桥中阴离子移向负极的电解质溶液,盐桥中阳离子移向正极的电解质溶液。
4、电极反应:以锌铜原电池为例:负极:氧化反应: Zn-2e=Zn2+(较活泼金属)正极:还原反应: 2H++2e=H2↑(较不活泼金属)总反应式: Zn+2H+=Zn2++H2↑5、正、负极的判断:(1)从电极材料:一般较活泼金属为负极;或金属为负极,非金属为正极。
(2)从电子的流动方向负极流入正极(3)从电流方向正极流入负极(4)根据电解质溶液内离子的移动方向阳离子流向正极,阴离子流向负极(5)根据实验现象①__溶解的一极为负极②增重或有气泡一极为正极第二节化学电池1、电池的分类:化学电池、太阳能电池、原子能电池2、化学电池:借助于化学能直接转变为电能的装置3、化学电池的分类:一次电池、二次电池、燃料电池一、一次电池1、常见一次电池:碱性锌锰电池、锌银电池、锂电池等二、二次电池1、二次电池:放电后可以再充电使活性物质获得再生,可以多次重复使用,又叫充电电池或蓄电池。
2、电极反应:铅蓄电池放电:负极(铅): Pb +SO 42--2e ?=PbSO 4↓正极(氧化铅): PbO 2+4H ++SO 42-+2e ?=PbSO 4↓+2H 2O充电:阴极: PbSO 4+2H 2O -2e ?=PbO 2+4H ++SO 42-阳极: PbSO 4+2e ?=Pb +SO 42-两式可以写成一个可逆反应: PbO 2+Pb +2H 2SO 4 2PbSO 4↓+2H 2O3、目前已开发出新型蓄电池:银锌电池、镉镍电池、氢镍电池、锂离子电池、聚合物锂离子电池 三、燃料电池1、燃料电池: 是使燃料与氧化剂反应直接产生电流的一种原电池2、电极反应:一般燃料电池发生的电化学反应的最终产物与燃烧产物相同,可根据燃烧反应写出总的电池反应,但不注明反应的条件。
电化学知识点总结

电化学知识点总结一、电化学基础1. 电化学的基本概念电化学是研究电化学反应的科学,它涉及到电流和电势的关系,以及在电化学反应中的能量转换和催化作用。
电化学反应通常发生在电极上,电化学反应的方向与电流的流动方向相反。
2. 电化学的基本原理电化学的基本原理包括电极反应、电解、电荷传递和能量转换等。
在电池中,通过氧化还原反应产生的电能被转化为化学能,进而转化为电能,从而产生电流。
3. 电化学的基本参数电化学的基本参数包括电压、电流、电解、电极电势、电导率、离子迁移速率等。
这些参数是电化学研究的基础,也是电化学应用的基本原理。
二、电化学反应1. 电化学反应的基本类型电化学反应包括氧化还原反应、电解反应、电化学合成反应等。
氧化还原反应是电化学反应中最常见的一种,它涉及到电子的转移,产生电压和电流。
电解反应是电化学反应中电流通过电解质溶液时发生的反应,通常涉及到离子的迁移和溶液中的化学反应。
电化学合成反应是指利用电能进行化学合成反应,通常包括电极合成和电解合成两种方式。
2. 电化学反应的热力学和动力学电化学反应的热力学和动力学是电化学研究的重要内容。
热力学研究电化学反应的热能转化和热能产生的条件,动力学研究电化学反应的速率和电化学动力学理论。
三、电化学动力学1. 电化学反应速率电化学反应速率是指单位时间内电化学反应所产生的物质的变化量。
电化学反应速率与电流和电压密切相关,它是电化学反应动力学研究的关键之一。
2. 催化作用催化作用是指通过催化剂来提高电化学反应速率的现象。
催化剂可以降低反应的活化能,提高反应速率,通常在电化学反应中有着重要的应用。
3. 双电层理论双电层是电极表面和电解质溶液之间的一个电荷层,它对电化学反应速率有着重要的影响。
双电层理论是电化学研究的重要理论之一,它涉及到电极和电解质溶液中的电位差和电荷分布。
4. 交换电流交换电流是指在电化学反应中与电流方向相反的电流,它是电化学反应速率的一个重要参数,也是电化学动力学研究的重要内容。
]电化学知识点总结
![]电化学知识点总结](https://img.taocdn.com/s3/m/be715be17e192279168884868762caaedd33baf2.png)
]电化学知识点总结电化学是研究化学变化与电能之间的关系的一个学科,它是化学和物理学的交叉学科。
电化学的研究对象是电解过程和电池,并且在化学分析、电镀、腐蚀、电解制氧等领域应用广泛。
下面是一些电化学的基本知识点总结。
1. 电化学基础概念- 电池:由阳极和阴极以及连接二者的电解质构成,能够将化学能转化为电能的装置。
- 电解:在电解质中施加外加电势,使其发生化学反应,将化学能转化为电能。
- 氧化还原反应:电化学过程中的基本反应类型,包括氧化(电子流从物质中流出)和还原(电子流进入物质)两个反应。
2. 电解过程中的电解质和电极- 电解质:电解质是指携带电荷的溶液或熔融物质,可以将其称为离子液体,它在电解过程中离子扮演着重要的角色。
- 电极:电解过程中用于传输电子的导体,包括阳极(电流从电池中流出的极)和阴极(电流流入电池的极)。
3. 电势和电位- 电势:电势是指电池两个电极之间的电势差,用于描述电化学反应的驱动力。
单位是伏特(V)。
- 电位:电位是电池中某个电极的电势,用于描述物质的氧化还原能力,单位也是伏特(V)。
4. 电极电势和标准电极电势- 电极电势:电极电势是单个电极与某种参考电极之间的电势差,用于表示电极的氧化还原能力。
- 标准电极电势:标准电极电势是指在特定条件下,使用标准氢电极作为参照电极时,其他电极与标准氢电极之间的电势差。
标准氢电极的电极电势被定义为0V。
5. 动力学和热力学电极反应- 动力学电极反应:描述电极反应速率的反应动力学方程,例如质子还原动力学反应可以用Tafel方程或Butler-Volmer方程表示。
- 热力学电极反应:描述电极反应发生与否以及方向的反应热力学条件。
通过比较标准电极电势可以得知电极反应的方向。
6. 电化学电池- 电化学电池分类:电化学电池分为两大类,即原电池和电解池。
原电池直接将化学能转化为电能,如干电池;电解池则是利用外部电势来促进电解反应。
- 实例:常见的电化学电池有锌-铜电池、铅蓄电池、锂离子电池等。
电化学基础知识点总结

电化学基础知识点总结电化学是研究电与化学之间相互转化和相互作用的科学。
它是物理学和化学的交叉学科,在电池、电解和电沉积等领域有着广泛的应用。
以下是电化学的基础知识点总结:1. 电化学反应:- 氧化还原反应(简称氧化反应和还原反应),是电化学最基本的反应类型,涉及原子、离子或分子的电荷变化。
- 氧化是指某物质失去电子,还原是指某物质获得电子。
2. 电池原理:- 电池是将化学能转化为电能的装置,由两个电极(阳极和阴极)和电解质组成。
阳极是发生氧化反应的地方,阴极是发生还原反应的地方。
- 在电池中,化学反应产生的电荷通过外部电路流动,从而形成电流。
3. 电解:- 电解是用电流将化合物分解成离子或原子的过程。
在电解槽中,正极是阴离子的聚集地,负极是阳离子的聚集地,而正负极之间的电解液是导电介质。
- 在电解过程中,正负电极上的反应是有差别的,称之为阳极反应和阴极反应。
4. 电解质:- 电解质是能够在溶液中或熔融态中导电的物质。
电解质可以是离子化合物,如盐和酸,也可以是离子溶剂如水。
- 强电解质能够完全离解成离子,而弱电解质只有一小部分离解成离子。
5. 电动势:- 电动势是电池或电化学系统产生电流的驱动力,通常用电压表示。
- 在标准状态下,标准电动势是指正极与负极之间的电压差。
它与化学反应的自由能变化有关,可以通过标准电动势表进行查阅。
6. 极化现象:- 极化是指在电解过程中阻碍电流通过的现象。
- 有两种类型的极化:浓差极化和活化极化。
浓差极化发生在反应物浓度在电极上发生变化的时候,活化极化发生在电化学反应速率受到限制的时候。
7. 电信号:- 在电化学中,电伏是电势大小的基本单位。
它表示单位电荷通过电路所产生的能量的大小。
- 电流是电荷通过导体的速率,单位是安培。
- 除了电伏和电流之外,还有许多其他电信号,例如电阻、电导率和电容。
8. 电化学测量方法:- 常用的电化学测量方法有电压法、电位法、电流法和电导法。
电化学基础知识点总结

电化学基础知识点总结电化学是研究电子与离子在电解质溶液中的相互转移和相互作用的科学。
它涉及电荷的移动和化学反应的同时发生。
在电化学中,我们主要关注两个方面的过程:电化学反应和电化学细胞。
1. 电化学反应电化学反应是指在外加电势的作用下,电子和离子之间发生的氧化还原反应。
电化学反应包括两个基本过程:氧化和还原。
氧化是指物质失去电子或氢离子,而还原则是指物质获得电子或氢离子。
在电化学反应中,常常涉及到电极反应和电解质的离子浓度变化。
2. 电化学细胞电化学细胞是一种将化学能转化为电能的装置。
它包括两个半电池:一个作为阳极,用于氧化反应;另一个作为阴极,用于还原反应。
两个半电池通过电解质溶液或电解质桥相连,并且在外部连接一个电路,使电子能够在阳极和阴极之间流动。
这个电路就是外部电路,而电解质溶液或电解质桥则是内部电路。
电化学细胞产生的电势差可以用来驱动电子在电路中进行功的转化。
3. 电化学基础概念在电化学中,有一些基本概念需要了解。
(1)电极:电极是电化学反应发生的场所。
它包括两种类型:阳极和阴极。
阳极是发生氧化反应的地方,电子从阳极流出;而阴极是发生还原反应的地方,电子流入阴极。
(2)电位:电位是指在标准状态下,电解质溶液中某个电极的电势相对于标准氢电极的差异。
标准氢电极的电势被定义为0V,其他电极相对于标准氢电极具有正负的电势。
(3)电解质:电解质是能够在溶液中分解出离子的物质。
电解质可以分为强电解质和弱电解质,具体取决于它们在溶液中的离解程度。
(4)电导率:电导率是指电解质溶液中离子传导电流的能力。
电导率高的溶液具有更好的导电性能。
4. 电化学技术和应用电化学不仅是一门基础科学,还在许多领域中有广泛的应用。
(1)电解:电解是指利用电流将化合物分解为离子的过程。
电解在电解制备金属、电镀、电解解析等方面有着重要的应用。
(3)蓄电池:蓄电池是一种将化学能转化为电能的设备。
它具有可充电性,常用于储存和提供电能。
第四章电化学基础知识点归纳

第四章电化学基础知识点归纳第四章电化学基础知识点归纳电化学是研究电和化学之间关系的分支学科,主要研究电能和化学变化之间的相互转化规律。
本章主要介绍了电化学基础知识点,包括电化学的基本概念、电池反应、电解反应以及其相关的电解池和电极。
一、电化学的基本概念1. 电化学:研究电和化学之间相互关系的学科。
2. 电解:用电能使电解质溶液或熔融物发生化学变化的过程。
3. 电解质:能在溶液中产生离子的化合物。
4. 电解池:由电解质、电极和电解物质组成的装置。
5. 电极:用来与溶液接触,传递电荷的导体。
二、电池反应1. 电池:将化学能转化为电能的装置。
由正极、负极、电解质和导电体组成。
2. 电池反应:电池工作时在正负极上发生的化学反应。
3. 氧化还原反应:电池反应中常见的反应类型,在正极发生氧化反应,负极发生还原反应。
4. 电池电势:电池正极和负极之间的电位差。
5. 电动势:电池正极和负极之间的最大电势差。
三、电解反应1. 电解:用电流使电解质发生化学变化的过程。
2. 导电质:在电解质中起导电作用的物质。
3. 离子:在溶液中能自由移动的带电粒子。
4. 阳离子:带正电荷的离子。
5. 阴离子:带负电荷的离子。
6. 电解池:由电解质溶液、电解质和电极组成的装置。
7. 电解程度:电解质中离子的溶解程度。
8. 法拉第定律:描述了电解过程中,电流量与电化学当量的关系。
四、电解池和电极1. 电解槽:承载电解液和电极的容器。
2. 阳极:电解池中的电流从电解液流入的电极,发生氧化反应。
3. 阴极:电解池中的电流从电解液流出的电极,发生还原反应。
4. 阳极反应:电解池中阳极上发生的氧化反应。
5. 阴极反应:电解池中阴极上发生的还原反应。
6. 电极反应速度:电极上反应的速度。
7. 电极反应中间体:反应过程中形成的中间物质。
电化学是现代科学和工程领域中的重要分支,广泛应用于电池、电解、蓄电池、电解涂层、电化学合成等领域。
了解电化学的基础知识,有助于我们更好地理解和应用电化学原理。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电化学基础知识点总结 装置特点:化学能转化为电能。
①、两个活泼性不同的电极;
形成条件:②、电解质溶液(一般与活泼性强的电极发生氧化还原反应);
原 ③、形成闭合回路(或在溶液中接触)
电 负极:用还原性较强的物质作负极,负极向外电路提供电子;发生氧化反应。
池 基本概念: 正极:用氧化性较强的物质正极,正极从外电路得到电子,发生还原反应。
原 电极反应方程式:电极反应、总反应。
理
氧化反应 负极 铜锌原电池 正极 还原反应
反应原理:Zn-2e -=Zn 2+ 2H ++2e -=2H 2↑ 电解质溶液 电极反应: 负极(锌筒)Zn-2e -=Zn 2+ 正极(石墨)2NH 4++2e -=2NH 3+H 2↑ ①、普通锌——锰干电池 总反应:Zn+2NH 4+=Zn 2++2NH 3+H 2↑
干电池: 电解质溶液:糊状的NH 4Cl
特点:电量小,放电过程易发生气涨和溶液
②、碱性锌——锰干电池 电极:负极由锌改锌粉(反应面积增大,放电电流增加);
电解液:由中性变为碱性(离子导电性好)。
正极(PbO 2) PbO 2+SO 42-+4H ++2e -=PbSO 4+2H 2O
负极(Pb ) Pb+SO 42--2e -=PbSO 4
铅蓄电池:总反应:PbO 2+Pb+2H 2SO 4 2PbSO 4+2H 2O 电解液:1.25g/cm 3~1.28g/cm 3的H 2SO 4 溶液
蓄电池 特点:电压稳定。
Ⅰ、镍——镉(Ni ——Cd )可充电电池;
其它蓄电池 Cd+2NiO(OH)+2H 2O Cd(OH)2+2Ni(OH)2
Ⅱ、银锌蓄电池
锂电池
①、燃料电池与普通电池的区别
不是把还原剂、氧化剂物质全部贮藏在电池内,而是工作时不断从外界输入,同时
燃料 电极反应产物不断排出电池。
电池 ②、原料:除氢气和氧气外,也可以是CH 4、煤气、燃料、空气、氯气等氧化剂。
负极:2H 2+2OH --4e -=4H 2O ;正极:O 2+2H 2O+4e -=4OH -
③、氢氧燃料电池: 总反应:O 2 +2H 2 =2H 2O
特点:转化率高,持续使用,无污染。
废旧电池的危害:旧电池中含有重金属(Hg 2+)酸碱等物质;回收金属,防止污染。
失e -,沿导线传递,有电流产生
溶解 不断 移
向 阳离
子 化学电源简介
放电 充电
放电 放电`
腐蚀概念:金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。
概述: 腐蚀危害: 腐蚀的本质:M-ne -→M n+(氧化反应)
分类: 化学腐蚀(金属与接触到的物质直接发生化学反应而引起的腐蚀)、电化腐蚀
定义:因发生原电池反应,而使金属腐蚀的形式。
负极(Fe ):Fe-2e -=Fe 2+;正极(C ):O 2+2H 2O+4e -=4OH - 电化 吸氧腐蚀: 总反应:2Fe+O 2+2H 2O=Fe(OH)2
腐蚀 后继反应:4Fe(OH)2 +O 2 +2H 2O =4Fe(OH)3 钢铁的腐蚀: 2Fe(OH)3 Fe 2O 3 +3H 2O 负极(Fe ):Fe-2e -=Fe 2+; 析氢腐蚀: 正极(C ):2H ++2e -=H 2↑ 总反应:Fe+2H +=Fe 2++H 2↑ 影响腐蚀的因素:金属本性、介质。
金属的防护: ①、改变金属的内部组织结构; 保护方法:②、在金属表面覆盖保护层; ③、电化学保护法(牺牲阳极的阴极保护法)
定义:使电流通过电解质溶液而在阴阳两极引起氧化还原反应的过程。
装置特点:电能转化为化学能。
①、与电源本连的两个电极;
形成条件 ②、电解质溶液(或熔化的电解质)
③、形成闭合回路。
电极 阳极:与直流电源正极相连的叫阳极。
概念 阴极:与直流电源负极相连的叫阴极。
电极反应: 原理:谁还原性或氧化性强谁先放电(发生氧化还原反应) 离子放电顺序: 阳极:阴离子还原性 S 2->I ->Br ->Cl ->OH ->SO 42-(含氧酸根)>F -
阴极:阳离子氧化性 Ag +>Fe 3+>Cu 2+>Pb 2+>Sn 2+>Fe 2+>Zn 2+>H +>Al 3+>Mg 2+>Na +
电子流向 e - e -
氧化反应 阳极 阴极 还原反应
反应原理:4OH --4e -=2H 2O +O 2 Cu 2++2e -=Cu 电解质溶液 电解结果:在两极上有新物质生成。
总反应:2CuSO 4+2H 2O 2Cu+2H 2SO 4+O 2↑ 金
属的腐蚀与防护
移向
阴离子 移
向 阳离
子 电解池
原理
△
粗铜板作阳极,与直流电源正极相连; ①、装置 纯铜作阴极,与直流电源负极相连; 用CuSO 4 (加一定量H 2SO 4)作电解液。
阴极:Cu 2++2e -=Cu
电解精炼铜 阳极:Cu-2e -=Cu 2+、Zn-2e -=Zn 2+
②、原理: Ni-2e -=Ni 2+
阳极泥:含Ag 、Au 等贵重金属;
电解液:溶液中CuSO 4浓度基本不变
③、电解铜的特点:纯度高、导电性好。
①、概念:利用电解原理在某些金属的表面镀上一薄层其它金属或合金的过程。
将待镀金属与电源负极相连作阴极;
②、方法:镀层金属与电源正极相连作阳极;
电镀: 用含镀层金属离子的电解质溶液配成电镀液。
③、原理:阳极 Cu-2e -=Cu 2+ ;Cu 2++2e -=Cu ④、装置: ⑤、电镀工业:镀件预处理→电镀液添加剂→ 装置:(如图) 现象 ①、阴极上有气泡;②、阳极有刺激性气体产,能使湿润的淀粉KI 变蓝; 电解食盐水 ③、阴极区附近溶液变红,有碱生成 原理: 通电前: NaCl =Na ++Cl - H 2 ++OH - 原理 阴极(Fe ):Na +,H +移向阴极;2H ++2e -=H 2↑(还原反应) 通电后:阳极(C ):Cl -、OH -移向阳极;2Cl --2e -=Cl 2↑(氧化反应) 总反应:2NaCl +2H 2O 2NaOH +Cl 2↑+H 2↑ 阳极、阴极、离子交换膜、电解槽、导电铜棒等 ①、组成:阳极:金属钛网(涂有钌氧化物);阴极:碳钢网(涂有Ni 涂层) 阳离子交换膜:只允许阳离子通过,阻止阴离子和空气通过;
②、装置:
离子交换膜
法制烧碱:
(此文档部分内容来源于网络,如有侵权请告知删除,文档可自行编辑修改内容,
供参考,感谢您的配合和支持)
电
解
的
应
用
氯碱
工业 电解。
