芳烃的化学性质
芳烃的性质实验报告

芳烃的性质实验报告
芳烃是一类含有苯环结构的碳氢化合物,具有特殊的化学性质。
本实验旨在通
过对芳烃的性质进行实验研究,以期深入了解其化学特性及应用价值。
首先,我们进行了对芳烃的物理性质的实验研究。
实验结果显示,芳烃具有较
高的沸点和熔点,这与其分子结构紧密相关。
此外,我们还测试了芳烃的溶解性,发现芳烃在非极性溶剂中溶解度较高,而在极性溶剂中溶解度较低,这与芳烃的分子极性有关。
接着,我们对芳烃的化学性质展开了实验研究。
在实验中,我们发现芳烃具有
较高的稳定性,不易发生化学反应。
但在适当的条件下,芳烃可以发生亲电取代反应和求核取代反应,这为芳烃的合成和改性提供了重要的理论基础。
此外,我们还对芳烃的燃烧性质进行了实验研究。
实验结果表明,芳烃在氧气
条件下可以发生完全燃烧,生成二氧化碳和水,释放大量的能量。
这为芳烃作为燃料的应用提供了重要的参考依据。
最后,我们对芳烃的环境影响进行了实验研究。
实验结果显示,芳烃在大气中
易发生光化学反应,产生有害的光化学污染物,对环境造成一定的影响。
因此,在芳烃的生产和使用过程中,需要采取相应的环保措施,减少对环境的影响。
综上所述,通过对芳烃的性质进行实验研究,我们深入了解了芳烃的物理性质、化学性质、燃烧性质以及环境影响等方面的特点。
这对于进一步的芳烃的应用和环境保护具有重要的理论和实践意义。
希望本实验能为相关领域的研究和应用提供一定的参考价值。
芳烃类化合物

芳烃类化合物芳烃是一类含有苯环结构的有机化合物,由于其分子结构的稳定性和广泛的应用,成为有机化学中的重要研究对象。
根据其分子结构和化学性质,芳烃可以分为单环芳烃、多环芳烃和杂环芳烃三类。
一、单环芳烃单环芳烃是指分子中只含有一个苯环结构的化合物,最简单的单环芳烃是苯。
苯分子中有六个碳原子和六个氢原子,呈六角形排列,每个碳原子上都有一个氢原子。
苯分子中的碳原子上有三个π电子,形成了一个共轭体系,使得苯分子具有很强的稳定性和反应活性。
苯可以发生加成反应、取代反应、氧化反应等多种反应,是有机合成中的重要原料。
二、多环芳烃多环芳烃是指分子中含有两个或两个以上苯环结构的化合物,最简单的多环芳烃是萘。
萘分子中有两个苯环结构,呈平面排列,分子中有十个碳原子和八个氢原子。
多环芳烃的稳定性和反应活性与单环芳烃相似,但由于分子结构的复杂性,多环芳烃的反应性更加多样化。
多环芳烃广泛存在于煤焦油、石油和煤矿等自然资源中,是环境污染和健康危害的重要来源。
三、杂环芳烃杂环芳烃是指分子中含有苯环结构以外的杂原子(如氮、氧、硫等)的化合物,最简单的杂环芳烃是吡啶。
吡啶分子中有一个苯环结构和一个氮原子,呈平面排列,分子中有五个碳原子和五个氢原子。
杂环芳烃的分子结构和化学性质与单环芳烃和多环芳烃有所不同,但同样具有广泛的应用价值。
杂环芳烃广泛存在于天然产物和药物中,是有机合成和药物研究中的重要原料。
总之,芳烃类化合物是有机化学中的重要研究对象,其分子结构和化学性质的多样性使得其具有广泛的应用价值。
在未来的研究中,我们需要深入探究芳烃类化合物的结构和性质,开发新的合成方法和应用领域,为人类的生产和生活带来更多的福利。
大学芳烃知识点总结

大学芳烃知识点总结一、芳烃的结构芳烃是一类含有苯环结构的碳氢化合物,其分子结构可以使用分子式(CnH2n-6)表示。
若n=6,则为苯,苯是最简单的芳香烃。
芳烃的分子结构稳定,具有特殊的共振结构。
在芳烃分子中,每个碳原子都与邻近的碳原子形成σ键,同时其中的3个sp2杂化碳原子上还存在一个与此共面的π键,形成单独的共轭环结构。
二、芳烃的性质1. 燃烧性能:芳烃在空气中燃烧时,产生的热量非常大,燃烧完全时生成的气体中只有水和二氧化碳。
因此具有高热值和热稳定性。
2. 溶解性:芳烃在非极性溶剂中溶解度较高,但在极性溶剂中溶解度较低。
这是因为芳烃分子中存在苯环结构,是由于共轭结构形成了大量的π键,因此芳烃分子呈现非极性特性。
3. 化学反应:芳烃具有很强的亲电性,与强亲电试剂发生亲电取代反应。
在苯环中存在的共轭结构会进一步增强芳烃的亲电性。
除此之外,芳烃还可以发生加成反应、氢化、氧化、取代、芳香核聚合等化学反应。
三、芳烃的制备1. 从石油中提炼:芳烃是石油加工过程中的重要产品之一。
石油中含有大量的芳烃类物质,通过裂化、裂解、加氢处理等工艺流程,可以从石油中提取得到芳烃。
2. 有机合成:芳烃可以通过有机合成的方法进行制备。
常见的合成方法包括芳基烷基化、芳基取代反应、芳基硝化和还原等。
3. 光照反应:一些有机化合物在光照条件下会发生光敏反应,而芳烃类物质对光敏反应具有一定的敏感性,通过光照反应也可以制备芳烃。
四、芳烃的应用1. 化工生产:芳烃在化工生产中有着广泛的应用。
如苯乙烯,苯甲酸,邻苯二甲酸二丁酯,对苯二甲酸等都是重要的芳烃类化合物。
这些物质广泛用于制备高分子材料、染料、颜料等。
2. 燃料与能源:芳烃具有高燃烧热值和热稳定性,因此在燃料和能源领域有着广泛的应用。
如苯、甲苯等可用于制备合成油、燃油、航空燃料等。
3. 医药领域:芳烃类化合物在医药领域也有着重要的应用。
许多药物的合成过程中都要用到芳烃类原料。
例如,水杨酸、草酸、间苯二酚等。
有机化学第四篇芳香烃
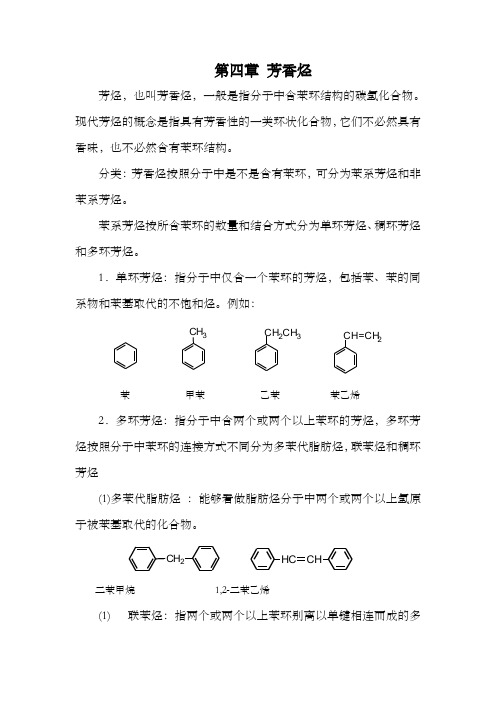
第四章芳香烃芳烃,也叫芳香烃,一般是指分子中含苯环结构的碳氢化合物。
现代芳烃的概念是指具有芳香性的一类环状化合物,它们不必然具有香味,也不必然含有苯环结构。
分类:芳香烃按照分子中是不是含有苯环,可分为苯系芳烃和非苯系芳烃。
苯系芳烃按所含苯环的数量和结合方式分为单环芳烃、稠环芳烃和多环芳烃。
1.单环芳烃:指分子中仅含一个苯环的芳烃,包括苯、苯的同系物和苯基取代的不饱和烃。
例如:CH3CH2CH3CH=CH2苯甲苯乙苯苯乙烯2.多环芳烃:指分子中含两个或两个以上苯环的芳烃,多环芳烃按照分子中苯环的连接方式不同分为多苯代脂肪烃,联苯烃和稠环芳烃(1)多苯代脂肪烃:能够看做脂肪烃分子中两个或两个以上氢原子被苯基取代的化合物。
CH2HC CH二苯甲烷1,2-二苯乙烯(1)联苯烃:指两个或两个以上苯环别离以单键相连而成的多环芳烃例如:联苯1,4-三联苯(2)稠环芳烃:两个或两个以上苯环彼此共用两个碳原子而成的多环芳烃,例如:萘蒽菲3.非苯芳烃:指分子中不含苯环的芳香烃,例如:环戊二烯负离子环庚三烯正离子第一节单环芳烃一,单环芳烃的异构现象和命名苯是最简单的单环芳烃。
单环芳烃包括苯、苯的同系物和苯基取代的不饱和烃。
1.异构现象(1)烃基苯有烃基的异构例如:CH2CH2CH3CHCH3CH3(2)二烃基苯有三种位置异构例如:RR'RRR'R'(3)三取代苯有三种位置异构例如: R R'RRR''R''R''R'R'2. 命名(1)苯基的概念芳烃分子去掉一个氢原子所剩下的基团称为芳基(Aryl)用Ar 表示。
重要的芳基有:CH 2(C 6H 5CH 2-)苄基(苯甲基),用Bz 表示苯基, 用Ph 或 表示ф(2)一元取代苯的命名a 当苯环上连的是烷基(R-),-NO 2,-X 等基团时,则以苯环为母体,叫做某基苯。
例如:CH CH 33NO 2Cl异丙基苯叔丁基苯硝基苯氯苯b 当苯环上连有-COOH ,-SO 3H ,-NH 2,-OH ,-CHO ,-CH=CH 2或R 较复杂时,则把苯环作为取代基。
有机化学第七章 芳烃

H
H
H
H
H
H
可以解释:为什么苯分子特别稳定? 为什么苯分子中碳碳键长完全等同? 为什么邻位二取代物只有一种?
(b)分子轨道理论 分子轨道理论认为:苯分子形成σ键后,苯的
六个碳原子上的六个P 轨道经线性组合可以形成六 个分子轨道,其中ψ1 、ψ2 和ψ3 是成键轨道,ψ4、 ψ5和 ψ6是反键轨道。当苯分子处于基态时六个电 子填满三个成键轨道,反键轨道则是空的。
-络合物
(b)硝化反应
2 H2SO4 HNO3
NO2
HNO3 H2SO4,45℃
CH3
HNO3 H2SO4,30℃
NO2
CH3 NO2
CH3
NO2
HNO3 H2SO4,95℃
NO2
NO2
NO2
H3O 2 HSO4
反应比苯容易 反应比苯困难
硝化反应机理
硝化反应中进攻试剂是NO2+,浓硫酸的作 用促进NO2+的生成:
苯环的特殊稳定性可以从它具有较低的氢化热 得到证明:
环己三烯氢化热=360kj/mol(假想值) 苯环氢化热=208kj/mol 相差152kj/mol
氢化热简图:
环己三烯+3H2
环己二烯+2H2
苯+3H2
环己烯+H2
231kj/mol
120kj/mol
208kj/mol
360kj/mol
环己烷
苯分子的近代概念
ቤተ መጻሕፍቲ ባይዱ
(1)煤的干馏
煤隔绝空气加热至1000~1300℃时分解所得到的 液态产物——煤焦油,其中含有大量芳烃化合物。 再经分馏得到各类芳烃。
馏分名称 轻油 酚油 萘油 洗油 蒽油
实验十三 芳烃的性质
实验十三芳烃的性质
一实验目的:
掌握芳烃的化学性质,重点掌握取代反应的条件;了解游离基的存在及化学检验方法;掌握芳烃的鉴别方法
二实验原理:
芳烃在化学限制上表现为相当稳定,不易被氧化,易发生亲电取代反应,如卤代,硝化,磺化和烷基化和酰基化反应。
当苯环上有取代基时,会影响取代反应的反应速率,供电子基团活化苯环使亲电取代反应容易进行,吸电子基团则使反应较难进行。
三实验记录:
(2)催化剂对溴代反应的影响
(3)磺化
(
4)硝化
3、芳烃的显色反应
(1)甲醛——硫酸实验
液体试样1—2滴+1mI非芳烃溶剂滴加大滴点板上。
再加一滴试剂,苯和甲苯变成红色,萘变成蓝绿色。
](2)无水AICI3—CHCI3试剂
0.1g—0.2g无水AICI3,棉花塞住,加热,取升华的AICI3粉末置点滴板中,滴加2—3滴样品,苯及甲苯产生橙色,萘变成蓝色。
四实验小结:
本次实验中部分实验仪器要干燥,否则现象不明显,例如催化剂对溴代反应的影响的装置,无水AICI3—CHCI3试剂实验,硝化反应;第三,对反应温度的很好控制,第三,本次实验大多数为有毒物质应尽量避免与人体直接接触。
芳烃知识点总结

芳烃知识点总结一、基本概念芳烃是一类化学结构中含有苯环或其取代物的有机化合物。
在芳烃中,苯环或其取代物被称为芳香环,其特点是环上所有碳原子都是sp2杂化的,各碳原子间的键角为120°,具有很高的稳定性。
芳香环上的每一个碳原子上都有一个π电子,这些π电子是由碳原子的p轨道形成的,这些π电子在芳烃的化学性质中起着重要作用。
芳烃通常可分为单环芳烃和多环芳烃两类。
单环芳烃的代表是苯、甲苯、二甲苯等,它们的分子结构简单,化学性质稳定。
多环芳烃则是由两个以上的苯环简单结合而成,其代表物是萘、菲、芘等。
二、结构特点1. 芳香环结构芳香环是芳烃的结构基础,具有六个碳原子组成的六元环。
芳香环上的每个碳原子都与相邻的两个碳原子形成σ键,同时与另外一个碳原子形成一个π键。
芳香环上所有的碳原子都处于sp2杂化状态,形成了120°的键角。
由于π键的范德华半径远大于σ键的范德华半径,因此芳香环具有很高的稳定性。
2. 取代基取代的位置芳烃可以通过取代基进行取代反应,取代基取代的位置是有一定规律的。
对取代基而言,芳烃的芳香环上三个相对邻近的碳原子被标记为1、2、3号碳原子,另外三个相对邻近的碳原子被标记为4、5、6号碳原子。
与取代基连接的碳原子称为取代基所连接的碳原子,芳烃中取代基取代位置的规律可以总结出为:(1)取代基偏向于连接到相对邻近的位置上;(2)取代基偏向于连接到离键极等电子密度较大的位置上;(3)取代基偏向于连接到离相对邻近位置电子密度较大的位置上;(4)取代基偏向于连接到使取代基离得远的位置上。
三、物理化学性质1. 沸点和熔点芳烃的沸点和熔点通常较低,易挥发。
这是因为芳烃分子间的相互作用力较弱,使得芳烃具有较低的沸点和熔点,便于在常温下从固态和液态向气态转化。
2. 溶解性芳烃在水中不溶解,但它们可以与有机溶剂如醚、醇、酮等溶解生成适当的溶液。
这是因为芳烃分子中含有较为稳定的π键,呈现较为规则的空间结构,使得与水分子之间的相互作用力不足以克服芳烃分子内部的相互作用力,从而导致芳烃不溶于水。
芳烃的特点与结构特征

SO3H
C12H25
SO3Na
合成洗涤剂
阴离子表面活性剂—— 十二烷基苯磺酸钠 LAS
高效去污、润湿、起泡、乳化及分散能力,稳定性好
C12H25 C12H25
SO3Na
H2O
SO3-
4. 苯环上的Friedel-Crafts反应
㈠ Friedel-Crafts 烷基化反应
+ RX
AlCl3
R
烷基化剂:卤代烃、烯烃、醇等
2 亲电取代反应
环状闭合π电子云
与亲电试剂反应分析:
不易破坏稳定环
Nu
而发E生加成反应
H
E -H+
Nu
H
作为电H 子来源
不利
可发E生亲电(取失代去芳香性)
有利 E (恢复芳香性)
亲电取代反应机理
亲电取代反应遵循一个共同的历程:
a)亲电试剂进攻芳环,生成苯基正离子,这是决定反应速度的一步.
H
H
H
E
1 芳烃的特点与结构特征 2 亲电取代反应 3 氧化反应 4 芳烃侧链上的反应
1 芳烃的特点与结构特征
C6H6
芳香性: 芳香烃易取代、难加成、难氧化的化学特性。
1.芳烃的特点:
Br2 / CCl4
一些能与烯烃 反应的试剂
HBr
与烯烃相比较,
KMnO4
H2 / Pt or Ni 常温常压
不反应! 苯环性质不活泼,
非常稳定:难加成、
难氧化。
与亲电试剂发生取代反应,而不发生加成反应
Br
Br
Br2 / Fe
Br
2. 单环芳烃的结构特征
sp2
H 1s -Csp2
Csp2 -Csp2 (a)苯分子中σ键 (b) p轨道形成封闭的大π键 (c)环平面上下的π电子云
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
萘的键长 萘的离域能为254.98kJ/mol; 苯的离域能为150.48kJ/mol;
萘的π 分子轨道
Cl
Cl2, FeCl3 100-110 0C
95%
NO2
HNO3, H2SO4 30-60 0C
95%
萘的卤代和硝化主要在α -位。
萘的磺化是可逆的,低温主要发生在电子云 密度高的α -位;高温时α -位、β -位都能反应, 但β -位异构体更稳定。
O2N
NO2
Br
4、定位规则在合成中应用
Cl NO2 SO3H
Cl
67% HNO3 0 20-40 C
Fe, Cl2 0 80 C
Cl
浓H2SO4 95-100 0C
SO3H
CH3
NO2
CH3Cl AlCl3
Br
CH3
Fe, Br2
HNO3 H2SO4
CH3
Br
1、萘
甲、萘的结构
0.142nm 0.139nm 0.136nm 0.140nm
浓 HNO3, 浓 H2SO4 100-110 C
93%
0
NO2
NO2
1%
6%
CH3
CH3
CH3
浓 HNO3, 浓H2SO4 30 C
0
CH3
NO2
NO2
59%
NO2
37%
4%
丙、磺化反应
芳烃与浓 H2SO4 作用,芳环上 H 原子被磺(酸)基 -SO3H 取 代生成芳磺酸
a. 磺化剂: 浓H2SO4 或 发烟H2SO4 b. 底物活性:烷基苯>苯>苯磺酸
CH3
CH3Cl, 0 C AlCl3
CH3
0
CH3
CH3 CH3
CH3 AlCl3
CH3 CH3
CH3
CH3CH2CH2Cl AlCl3
CHCH3
CH2CH2CH3
70%
g. 酰基化不可逆,产物单一
O CH3CH2CH2C Cl AlCl3
O CCH2CH2CH3 Zn— Hg HCl,
CH2CH2CH2CH3 73%
戊、氯甲基化
在无水ZnCl2存在下,芳烃与甲醛及HCl作用,芳环上氢 原子被氯甲基(—CH2Cl)取代 与烷基化反应相似,芳环上不能连有强吸电基。实际操 作中可以用多聚或三聚甲醛代替甲醛
CH2Cl
3
(CH2O)3
3 HCl
无水ZnCl2 700C
3
—CH2Cl 可以方便的转化为—CH3、—CH2OH、—CH2CN、 —CH2COOH、—CH2N(CH3) 2
1%
d. 烷基苯和卤代苯的卤代物主要为邻对位异构体
乙、硝化反应
芳烃与混酸作用,芳环上H原子被硝基取代生成硝基取代芳烃
a. 硝化剂:浓HNO3 + 浓H2SO4(简称混酸) b. 底物活性:烷基苯>苯>硝基苯
浓HNO3 浓 H2SO4 50-60 C
NO 2
0
NO2 75-85%
NO2
NO2
NO 2 NO 2
R= -H -OCH3 -NHCOCH3 -CH3 -C(CH3) 3 -CH2Cl -Cl -Br
Krel 1 200000 很快 25 15 0.3 0.033 0.03
o 74 19 58 16 32 30 36
p 11 79 38 73 52 69 63
m 15 2 4 11 16 1 1
4、定位规则在合成中应用
1.两类定位基
Z E
+
Z E
Z
Z
E E
理论上计算:
40%
40%
20%
实际结果并非如此,亲电试剂的位置与原取 代基电子效应与空间效应有关。
a 、第一类定位基 — 邻对位定位基(邻对位之和 >60%): 使亲电试剂进入其邻对位且使苯环活化(卤素除外)。
—O-、—N(CH3) 2、—NH 2、—OH、—OR、 —NHCOR、 —OCOR、—Ar、—CH=CH 2、 —R、 —F、—Cl、 —Br、 —I 等。
芳烃的化学性质
1、取代反应
甲、卤化 乙、硝化 丁、Friedel-Crafts 反应 丙、磺化 戊、氯甲基化
甲、卤化反应 芳烃与卤素作用生成卤代芳烃 a.催化剂:FeCl3 、FeBr3 、AlCl3等 b.卤素活性:F>Cl>Br>I c.芳烃活性:烷基苯>苯>卤代苯
Cl2
Cl
FeCl3 25 0 C
Cl 90%
Cl
Cl
Cl Cl
Cl
Cl2 FeCl3
39%
Cl 55%
6%
CH3
Cl2, FeCl3 , CH3COOH 25 0C
CH3 Cl
CH3
CH3
Cl
60%
Cl 39%
1%
FeBr3 ?
CH3
Br2, FeCl3 , CH3COOH 25 0C
CH3 Br
CH3
CH3
Br
33%
Br
66%
SO 3H
SO3H
浓 H2SO4 , 70-800C 或 20%发烟H2SO4, 250C
CH3
CH3
66%发烟H2SO4 90 0C
90% SO3H
CH3
SO3H
CH3
浓 H2SO4
SO3H
SO3H
0℃ 100℃
43% 13%
53% 79%
4% 8%
丁、Friedel-Crafts 反应
在催化剂作用下,芳烃中芳环上氢原子被烷基或酰基取代的反应
a、当两个取代基定位作用一致时,与单取代苯定位作用相似
CH3
CH3
COOH
Cl
SO 3H
NO 2
b、两个取代基为同类定位基且定位作用不一致时,服从强者
OCH3 COOH
CH3 Cl
CH3
NHCOCH3
CH3 NO2
Br
C、 两个取代基为不同类定位基且定位作用不一致时, 服从I类
NHCOCH3
COCH3
58.4 45
30 15.8
37.2
4.4 6.5 7.7 11.5
48.5 62.3 72.7
CH3 R+
CH3
CH3 R
CH3 R
R
R= CH3 CH2CH3 CH(CH3)2 C(CH3)3
53.8 45 37.5 0
28.8 25 32.7 93
17.3 30 29.8 7
3、二取代苯的定位规则
H2O
CH3
H+, H2O
CH2COOH
CH2MgCl
Mg 乙醚
CO2
CH2Cl NaOH
H2O
CH2OH
MnO2
CHO
NaCN
HN(CH3)2
CH2CN
H+, H2O
CH2COOH
CH2N(CH3)2
2、芳环上亲电取代反应机理
甲、硝化
+
乙、卤化
丙、磺化
E+
丁、 烷基化和酰基化
戊、氯甲基化
E
π -络合物
b、第二类定位基—间位定位基(间位异构体>40%):使 亲电试剂进入其间位且使苯环钝化。
—N+(CH3) 3、—N+H3、—NO 2、—CN、 —SO3H —COR、—COOR、—CONH 2、 —CONR 2等
取代苯硝化时相对速率与异构体分布
R HNO3 H2SO4 NO2 NO2 R NO2 R R
H E sp 杂化
3
E
σ -络合物
H+
取代苯
3、加成反应 甲、加氢
3 H2
Ni , 180-210 C 2.81MPa
0
乙、加氯
Cl
3 Cl2
Cl Cl Cl Cl
紫外光
Cl
六六六有多少种立体异构体?
8种
七、苯环上取代反应定位规则
1、两类定位基
2、 苯环上取代反应定位效应理论解释 3、二取代苯的定位规则
a.常 用催化剂:AlCl3、FeCl3、ZnCl2、(HF、BF3、H2SO4) b. 常用烷基化剂:卤代烃、烯烃(醇) c. 常用酰基化剂:酰卤、酸酐(酸)
CH3CH2Br
AlCl3, 850C
CH2CH3
74%
(CH3CO)2O
AlCl3, 40 C CS2
0
O CCH3
90%
d. 芳环上不能连有强吸电基(-NO2、-CN、-COR、-SO2R) e. 烷基化对吸电基更敏感 f. 烷基化时易发生多烷基化、可逆、重排反应
SO 3H
60 C H2SO4
0 165 C
0
96%
0 165 C H2SO4
H
SO3H
SO3H 85%
H SO3H H
-COOC2H5 -COOH -NO2 -N+(CH3) 3
0.0037 24 0.001 19 0.00000006 6 0.000000012
4 1 <1
72 80 93 100
空间效应 空间效应越大,邻位异构体越少。
R HNO3 H2SO4 NO2 R NO2
NO2
R
R
R= CH3 CH2CH3 CH(CH3)2 C(CH3)3
