地球化学 实习二 实验二_pH-Eh关系图解的制作
实验二 双液系沸点-成分图的绘制
双液系沸点-成分图的绘制一、实验目的1、用冷凝回流法测定不同浓度的环己烷-乙醇体系的沸点;2、正确使用阿贝折射仪;3、绘制沸点-成分图,确定体系的最低恒沸点和相应的组成。
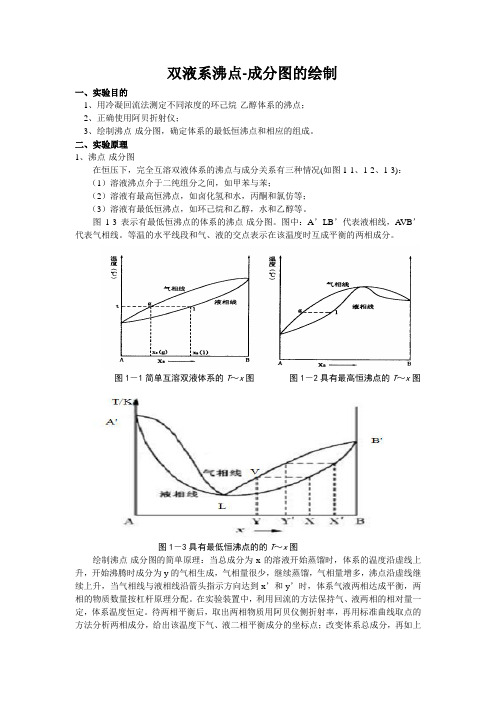
二、实验原理1、沸点-成分图在恒压下,完全互溶双液体系的沸点与成分关系有三种情况(如图1-1、1-2、1-3):(1)溶液沸点介于二纯组分之间,如甲苯与苯;(2)溶液有最高恒沸点,如卤化氢和水,丙酮和氯仿等;(3)溶液有最低恒沸点,如环己烷和乙醇,水和乙醇等。
图1-3表示有最低恒沸点的体系的沸点-成分图。
图中:A’LB’代表液相线,A VB’代表气相线。
等温的水平线段和气、液的交点表示在该温度时互成平衡的两相成分。
图1-1简单互溶双液体系的T~x图图1-2具有最高恒沸点的T~x图图1-3具有最低恒沸点的的T~x图绘制沸点-成分图的简单原理:当总成分为x的溶液开始蒸馏时,体系的温度沿虚线上升,开始沸腾时成分为y的气相生成,气相量很少,继续蒸馏,气相量增多,沸点沿虚线继续上升,当气相线与液相线沿箭头指示方向达到x’和y’时,体系气液两相达成平衡,两相的物质数量按杠杆原理分配。
在实验装置中,利用回流的方法保持气、液两相的相对量一定,体系温度恒定。
待两相平衡后,取出两相物质用阿贝仪侧折射率,再用标准曲线取点的方法分析两相成分,给出该温度下气、液二相平衡成分的坐标点;改变体系总成分,再如上法找出另一对坐标点。
将所有气相点和液相点连成气相线和液相线,即得T-x平衡图。
2、阿贝仪的使用阿贝仪利用了折射和全反射全反射原理设计而成。
将样品滴在棱镜上,旋转棱镜使目镜能看到半明半暗现象。
旋转补偿棱镜消除色散,在转动棱镜使明暗界线正好与目镜中的十字线交点重合,从标尺上直接读取折射率。
三、实验仪器及药品1、仪器恒沸点仪阿贝尔折射仪(WZS-I 940168)蒸馏瓶电阻丝变压器水银温度计(50~100℃,分度值0.1℃)恒温水浴装置5mL、20mL移液管滴瓶万分之一天平2、药品乙醇环己烷图1-4 恒沸点仪四、实验内容1、沸点和两相成分的测定1)洗净、烘干蒸馏瓶,加20mL乙醇使温度升高并沸腾,每隔30s记一次数据;2)待温度稳定3min后,记最终温度及大气压;3)断电,用两只滴管取支管口处气相冷凝液及蒸馏瓶中液体,用阿贝折射仪测折射率,气相冷凝液测1次,液相测2次;4)蒸馏瓶中依次加2mL、2mL、3mL、4mL、5mL环己烷,按上述方法测沸点及气液两相折射率;5)回收母液,少量环己烷洗蒸馏瓶3~4次,注入20mL环己烷,测纯沸点及气液两相折射率;6)再向蒸馏瓶中依次加0.5mL、0.5mL、0.5mL、2mL、5mL、5mL乙醇,分别测沸点及气、液两相折射率。
电势pH图-物化实验报告

3.3 讨论分析
(1)对测定数据及计算结果的分析、比较 由图2曲线可见, ① pH 比较低时(小于4.0),Fe3+/Fe2+-EDTA体系与饱和甘汞电极(为负极)组成的电
池的电动势随pH升高而降低,说明Fe3+/Fe2+-EDTA体系电极电势随pH升高而降低。 此时的电极反应为
相应的
FeY- + H+ + e- = FeHY-
一个 pH 值和值,得出该溶液的一系列电极电势和 pH 值,直至溶液变浑浊(pH 约等于 2.3 左右)为止。随着溶液体积的增大,可适当加快搅拌速度以保证混合均匀。
3 结果与讨论
3.1 原始实验数据
实际称取 6.99 g EDTA,1.07 g 无水 FeCl3,1.65 g FeSO4∙7H2O。 实验现象:.
电势—pH 曲线的测定
2 实验操作
2.1 实验药品、仪器型号及测试装置示意图
实验室 pH 计(FE20,梅特勒-托利多仪器(上海)有限公司),万用表(LINI-T UT58E, 优利德),铂电极,饱和甘汞电极,复合电极,85-2 型恒温磁力搅拌器(上海司乐仪器有限 公司),DC-0510 节能型智能恒温槽(宁波新芝生物科技有限公司),50 mL 塑料小烧杯 2 个, 100 mL 烧杯 1 个,250 mL 烧杯 1 个,玻棒 1 支,100mL 量筒(公用),电热水壶(公用), 电陶炉(公用)。
论值更小)。 注意到不同组停止实验(即加酸后出现沉淀)的pH不同,猜想可以通过控制投料量和
水量以获得更大范围的曲线。 ③误差分析 温度误差:虽然有超级恒温槽,但实际实验温度不一定就是25 ℃,这样实验得出的
Fe3+/Fe2+-EDTA体系电极电势与25 ℃时计算的S/ H2S体系电势就不能进行对比(从而确定 脱硫液pH)了。
地球化学图制作步骤

打开数字地质调查综合信息平台。打开工程文件原始数据点,综合数据处理 →等值线图→出现对话框(图 11-1),依次选择点图层→字段名称(各元素名, 如 Au)→单击计算数字特征→单击下一步。出现对话框(图 11-2 设置),选择 Tin 方法→自定义 文件名改为 Au 极值→单击下一步→出现设置等值线参数对 话框,将步骤 7 中保存的色阶文件导入(单击装设置...找到色阶文件打开)→确 定→上一步→上一步,回到了图 11-1 对话框→字段名称改为其它元素(如 Ag) →单击计算数字特征→单击下一步。出现对话框(图 11-2 设置)→自定义 文件 名改为 Ag 极值→单击下一步→出现设置等值线参数对话框,将步骤 7 中保存的 色阶文件导入→单击确定→上一步→如此往返直到所有元素都做完为止。
10
广西浦北
往返,直到添加完所有元素为止,关闭工程文件。 9、裁剪地球化学图:
打开元素地球化学图的工程文件(如 Ag),观察图件边框外的区,如出现图 9-1 情形(红色箭头所指,应该叫窜色),就得加以修改,特别是图 9-1 所示在边
图 9-1
图 9-2
图 9-3(左侧为修改前、右侧为修改后) 框内就已经窜色的,以备裁剪后易于修改。修改后效果见 9-2。出现图 9-3 左侧
3.2
1.6
4.0
1.7
5.0
1.8
6.3
1.9
7.9
2.0
10
…
图上标注的真值 µg/g (或 ng/g)
12.5 16.0 20.0 25.0 32.0 40.0 50.0 63.0 79.0 100.0 …
图 7-9
9
广西浦北
新规范地球化学图色区设置见表 7-2,建议采用表 7-2 色区设置。
实验三 地球化学制图

实验四地球化学制图
一实验目的与要求
通过实验,加深对地球化学场和地球化学异常的理解,掌握元素地球化学图和地球化学剖面图的绘制方法。
二实验内容与实验步骤:
(一)元素地球化学图(单元素含量等值线图)的绘制
作图步骤如下:
1 根据工作比例尺,并在相应的比例尺下的图纸上,用实心小圆点标注出测区内所有的采样点位置及其相应的位置编号(图1);
2 在每个采样点位置标出该点样品的元素含量分析结果,一张图上一般只标注一种元素,最多不超过两种元素;
3 按照对数或算数等间隔采用内插法勾绘等值线。
通常,如果异常强度很高(例如异常强度达到背景值的数倍、十数倍乃至上百倍)时,采用对数等间距;异常强度不高时,则采用算数等间距。
本实验以4ppm 为等值线间隔进行作图。
(二)地球化学剖面图的绘制
作图步骤如下:
1 元素含量按照一定的比例尺,绘出所在测线长度,并按照一定间距标出相应位置标号;
2 将剖面上采集样品的元素分析结果按照一定的纵向比例尺于剖面相应采集点位处的上方(与侧线水平轴线垂直方向)通过实心小圆点标出;
3 将相邻测点上对应的标志点用线段连接在一起,则会形成一条起伏变化的曲线,成为元素含量剖面图;
表1为内蒙某地Ⅴ号剖面采样点位及W元素的含量,请按照1:10000的横向比例尺,1:20(1cm=20ppm)的纵向比例尺绘制一张元素地球化学剖面图。
表1 内蒙某地Ⅴ号剖面采样点位及W元素的含量
实验报告要求内容:
一、实验目的与要求;
二、实验方法与步骤;
三、绘制地球化学剖面图;
四、绘制元素地球化学图;
图1 某区Co元素地球化学元素含量数据图。
电势-PH图的绘制

学号:基础物理化学实验报告实验名称:电势-PH图的绘制班级:药学2班组号:1组实验人姓名:蔡慧同组人姓名:曾白霜、俞超文指导老师:杨平实验日期:湘南学院化学与生命科学系一、实验目的:(1)测定Fe3+/Fe2+ -EDTA 络合体系在不同PH 条件下的电极电势,绘制电势-PH 曲线(2)了解电势-PH 图的意义及应用(3)掌握电极电势,电池电动势和PH 的测量原理和方法二、主要实验原理,实验所用定律、公式:很多氧化还原反应不仅与溶液中离子的浓度有关,而且与溶液的pH 值有关,即电极电势与浓度和酸度成函数关系。
如果指定溶液的浓度,则电极电势只与溶液的pH 值有关。
在改变溶液的pH 值时测定溶液的电极电势,然后以电极电势对pH 作图,这样就可得到等温、等浓度的电势-pH 曲线。
对于Fe 3+/Fe 2+-EDTA 配合体系在不同的pH 值范围内,其络合产物不同,以Y 4-代表EDTA 酸根离子。
我们将在三个不同pH 值的区间来讨论其电极电势的变化。
1、高pH 时电极反应为Fe(OH)Y 2-+e FeY 2-+OH -根据能斯特(Nernst)方程,其电极电势为:φ=φ--2--2Fe(OH)Y OH FeY ln a a a F RT ⋅稀溶液中水的活度积K W 可看作水的离子积,又根据pH 定义,则上式可写成φ=φ-b 1-FRTm m F RT 303.2ln -2-2Fe(OH)Y FeY -pH (1)在EDTA 过量时,生成的络合物的浓度可近似看作为配制溶液时铁离子的浓度。
即 m FeY 2- ≈m Fe 2+ 。
在m Fe 2+ / m Fe 3+不变时,φ与pH 呈线性关系。
如图中的cd 段。
2、在特定的PH 范围内,Fe 2+和Fe 3+能与EDTA 生成稳定的络合物FeY 2-和FeY -,其电极反应为FeY - +e FeY 2-其电极电势为φ=φ --2FeY FeY ln a a F RT -(1) 式中,φ 为标准电极电势;a 为活度,a =γ·m(γ为活度系数;m 为质量摩尔浓度)。
地球化学实习报告

一、实习背景与目的随着科技的不断进步,地球化学在资源勘探、环境保护、灾害预警等领域发挥着越来越重要的作用。
为了更好地将所学知识与实践相结合,提高我们的专业技能和综合素质,我们于[实习时间]在[实习单位]进行了为期[实习天数]的地球化学实习。
本次实习旨在通过实际操作,加深对地球化学理论知识的理解,提高野外勘查能力,培养团队协作精神。
二、实习内容与方法1. 实习内容(1)野外勘查:了解地球化学勘查的基本流程,掌握样品采集、分析、处理等方法。
(2)实验室分析:学习地球化学实验室的基本操作,包括样品前处理、仪器分析、数据处理等。
(3)地质地貌考察:观察实习区域的地形地貌特征,了解区域地质背景。
(4)地球化学异常分析:分析实习区域的地球化学异常特征,识别成矿有利地段。
2. 实习方法(1)野外勘查:采用实地考察、样品采集、仪器测量等方法。
(2)实验室分析:采用化学分析、仪器分析等方法。
(3)地质地貌考察:通过实地观察、地形地貌分析等方法。
(4)地球化学异常分析:采用地球化学数据处理、异常识别、成矿预测等方法。
三、实习过程与成果1. 野外勘查实习期间,我们深入实习区域,对地形地貌、地质构造、地球化学特征进行了详细考察。
通过实地采样,采集了土壤、水、岩石等样品,为后续分析提供了基础数据。
2. 实验室分析在实验室,我们学习了样品前处理、仪器分析、数据处理等基本操作。
通过对样品的分析,了解了实习区域的地球化学特征,为成矿预测提供了依据。
3. 地质地貌考察通过对实习区域的地形地貌考察,我们掌握了区域地质背景,为地球化学勘查提供了基础。
4. 地球化学异常分析通过对实习区域的地球化学异常分析,我们识别出多个成矿有利地段,为后续资源勘探提供了重要线索。
四、实习体会与收获1. 实习过程中,我们深刻认识到地球化学在资源勘探、环境保护、灾害预警等领域的重要作用。
2. 通过实际操作,我们对地球化学理论知识有了更深入的理解,提高了野外勘查能力。
pH-Eh

• 水溶液的pH和Eh值分别可以改变元素在溶液中的存在形式和离子价
态,影响元素参与化学作用的能力和方式。各种主要的溶解物质沉 淀时,都需要一定的pH-Eh条件,也就是说平衡的建立需要一个稳定 的物理化学条件。
• ⑤ pH>5.9 Fe +2OH-= Fe(OH)2 +2e- E0=-0.89V
代入能斯特方程 E=-0.89+0.059log(1/[OH-]3)
E=-0.062-0.059pH
4. 绘制pH-Eh关系图解
5. 圈定自然界pH-Eh的变化范围
• 水的pH是由于溶解在水中的酸性和碱性物质共同作用来调节的,天
3. 计算Fe的pH-Eh的关系 (Fe2+ Fe(OH)2)
• ④ pH<5.9,Fe = Fe2++2e- E0=-0.41V
给定[Fe2+]=1mol,E=E0 关系为一水平线,其上下为Fe2+、Fe优势场。 给定[Fe2+]=10-3mol,E=E0-0.05917log(1/[ Fe2+])/2=—0.499V,也为一条直线, 其上下为Fe2+、Fe优势场。
• E0和Eh值对化学作用的影响:
(1) E0和Eh值确定了变价元素的价态,元素的价态和存在形式不同, 元素的迁移能力也就不同;
(2) Eh值对于像Fe、Mn等变价元素化合物的溶解度有很大影响,且 形成的Fe、Mn矿物的类型不一样,而对非变价元素如 pH和Eh作为介质(包括水、土壤等)环境物理化学性质的综合性指标。
化学酸和碱中和反应和pH新ppt

4
5
Part Three
酸碱指示剂与滴定 实验
酸碱指示剂的种类与选择
01
02
03
04
酸碱指示剂:能 够指示溶液酸碱 性的物质
常见酸碱指示剂: 酚酞、甲基橙、 甲基红等
选择原则:根据 溶液的酸碱性和 实验要求选择合 适的指示剂
指示剂变色范围: 不同指示剂的变 色范围不同,需 要根据实验要求 选择合适的变色 范围
酸碱反应的产物:盐和 04
水,其中盐的性质取决 于酸和碱的性质
中和反应的实质
01
02
03
04
中和反应是酸和 碱之间的反应
反应的实质是氢 离子和氢氧根离 子的结合
反应产物是盐和 水
中和反应的实质 是酸和碱的质子 转移和电子转移
中和反应的应用
01
污水处理:中和酸 性或碱性废水,降 低环境污染
02
食品加工:调节食 品的酸碱度,改善 口感和保质期
局限性:需要精 确的仪器和试剂, 操作复杂
误差来源:人为 操作误差、仪器 误差、试剂误差 等
改进方法:采用 自动化滴定系统, 提高实验精度和 效率
Part Four
酸碱平衡与缓冲溶 液
酸碱平衡的概念与影响因素
酸碱平衡:溶液中 酸和碱的浓度保持 相对稳定,pH值 不变
影响因素:温度、 浓度、离子强度、 溶剂性质等
滴定终点的判断: 根据指示剂的颜 色变化确定滴定 终点
滴定体积的计算: 根据滴定管中消 耗的滴定液体积 计算滴定体积
酸碱浓度的计算: 根据滴定体积和 酸碱浓度的换算 关系计算酸碱浓 度
酸碱滴定误差分 析:分析滴定实 验中的误差来源 和影响因素,提 高实验精度
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《地球化学》实习二
pH-Eh关系图解的制作
一、实习目的
1、掌握H2O对自然环境中Eh的控制作用。
2、掌握pH-Eh关系图解的制作方法。
3、了解pH-Eh关系图解在地球化学研究中的意义。
二、实习原理
1、自然氧化-还原环境的极限
氧化上限:
H2O ⇔ 1/2O2 + 2H+ + 2e-E0=1.23V (P O2=0.21)
E = E0 + (0.059/n)⋅log K
E = 1.22 – 0.059pH
还原上限:
H2⇔ 2H+ + 2e-E0=0.00V (P H2=1)
E = E0 + (0.059/n)⋅log K
E = – 0.059pH
2、pH-Eh关系图解
以Eh为纵坐标,pH为横坐标,图示pH与Eh的关系。
以Fe3+-Fe2+、Fe(OH)3-Fe(OH)2、Fe2+-Fe(OH)3半反应为例,绘制pH-Eh关系图解。
三、实习内容
1、绘制H2O的pH-Eh关系图解
⑴H2O的电化学半反应方程式:
(-)H2O→1/2 O2 +2H++ 2e- E0 =1.23 V
E = 1.23 + 0.03 log[p O2]1/2[H+]2
E = 1.22-0.059 pH
当pH=4时,E=0.984
当pH=9时,E=0.689
(+)H2 → 2H+ + 2e- E0 =0.00V
E =-0.059pH-(0.059/2)log p H2
E =-0.059pH
当pH=4时,E=-0.236
当pH=9时,E=-0.531
2、以Fe2+、Fe(OH)2、Fe3+、Fe(OH)3形式为例,绘制Fe的pH-Eh关系图解。
选定条件:[Fe2+]=1 M和[Fe2+]=10-3 M两种情形。
铁的Eh-pH相图编制;根据Fe2+→Fe3+反应形式分三段作图
⑴当pH<2时,反应为:
Fe2+ = Fe3++e- E0=0.77V
线形为水平线,其上下为Fe3+、Fe2+优势场
⑵当pH=2-10时,反应为:
3 H2O + Fe2+ = Fe(OH)3 + 3H+ + e- E0= 1.06V;
代入能斯特方程E = 1.06 +0.059log([H+]3/[ Fe2+])
给定[Fe2+] = 1 mol, E = 1.06-0.177pH
[Fe2+] =10-3 mol, E = 1.237-0.177pH
⑶当pH>10时, 反应为:
Fe(OH)2 + OH- = Fe(OH)3 + e- E0 = -0.56V
E = -0.56 + 0.059 log[1/OH-] = 0.27 - 0.059pH
⑷当pH<5.9时,反应为:
Fe = Fe2++2e- E0=-0.41V
给定[Fe2+] = 1 mol,E=E0,线形为水平线,其上下为Fe、Fe2+优势场;
[Fe2+] =10-3 mol,E=E0-0.059 log(1/[ Fe2+])/2=-0.4985V,也为一条直线,其上下为Fe、Fe2+优势场。
⑸当pH>5.9时,反应为:
Fe+2 OH- = Fe(OH)2 + 2e- E0 = -0.89V
代入能斯特方程E = -0.89+0.059log(1/[OH-]3)E=-0.062-0.059pH
四、实习步骤
1、建立电化学半反应方程式,查阅相关参数。
2、以设定的条件计算pH-Eh的关系。
3、绘制pH-Eh关系图解。
4、圈定自然界pH-Eh的变化范围。
5、探讨pH-Eh关系图解在地球化学研究中的意义。
五、实习要求
每人完成一份实习报告。
