胶体界面化学华东理工大学
合集下载
华东理工大学研究报告生课程

生物物理化学
研—504
材料科学中电化学过程及方法
化学生物学
现代仪器分析
研—505
线性与非线性规划
线性与非线性规划
高等分析化学
研—506
测控系统软件设计方法/机械制造过程
工程测试与信号处理/
过程测试与信号处理/
研—507
机械工程CAD/CAT
工业水处理/
工业水处理/
研—509
物理中的数学方法
物理中的数学方法
2018
周
教室
8:00 —9: 35 第 1、2 节
9: 55—11: 30 第 3、 4 节
1: 30— 3: 05 第 5、6 节
3: 25 — 5: 00 第 7、8 节
晚6: 00开始
研—501
基础数学专题选讲
研—503
废水治理理论/能源与坏境
废水治理理论/计算流体力学
胶体与界面/过程开发方法
教室
8 :00—9: 35 第 1、2 节
9:50 — 11:35 第 3、4 节
1 : 30 — 3: 05 第 5、6 节
3: 25— 5: 00 第 7、8 节
晚6: 00开始
研—501
基础英语15班 < 六-203)「
基础英语22班 <六-203)
研—503
基础英语16班 < 六-204)
基础英语23班 <六-204)
/计算机控制与接口技术寸
研—504
高分子合金
基础英语3班 <六-205)
基础英语9班 <六-204)
研—505
/现代计算机系统结构
/现代计算机系统结构
基础英语10班 <六-205)
研—506
研—504
材料科学中电化学过程及方法
化学生物学
现代仪器分析
研—505
线性与非线性规划
线性与非线性规划
高等分析化学
研—506
测控系统软件设计方法/机械制造过程
工程测试与信号处理/
过程测试与信号处理/
研—507
机械工程CAD/CAT
工业水处理/
工业水处理/
研—509
物理中的数学方法
物理中的数学方法
2018
周
教室
8:00 —9: 35 第 1、2 节
9: 55—11: 30 第 3、 4 节
1: 30— 3: 05 第 5、6 节
3: 25 — 5: 00 第 7、8 节
晚6: 00开始
研—501
基础数学专题选讲
研—503
废水治理理论/能源与坏境
废水治理理论/计算流体力学
胶体与界面/过程开发方法
教室
8 :00—9: 35 第 1、2 节
9:50 — 11:35 第 3、4 节
1 : 30 — 3: 05 第 5、6 节
3: 25— 5: 00 第 7、8 节
晚6: 00开始
研—501
基础英语15班 < 六-203)「
基础英语22班 <六-203)
研—503
基础英语16班 < 六-204)
基础英语23班 <六-204)
/计算机控制与接口技术寸
研—504
高分子合金
基础英语3班 <六-205)
基础英语9班 <六-204)
研—505
/现代计算机系统结构
/现代计算机系统结构
基础英语10班 <六-205)
研—506
胶体界面化学(华东理工大学)-8

胶体系统的稳定机制
3 静电稳定胶体的稳定机制 —— DLVO理论
戎
宗
3胶体的破坏
明
3高分子稳定胶体的稳定机制
版
权 所
有
(1) 颗粒间的范德华引力 主要由静电作用 诱导作用 色散作 用和电子云间的斥力构成 可近似用 兰纳-琼斯位能函数式表示
戎
宗
σ 12 σ 6 ε p = 4ε − r r
由Hamaker结果
戎
版
A R UA = − ⋅ 12 H 0
权 所
• Keeson力
2 2 µ12 µ2 UK = − 3 kTr 6 2 α1µ2 + α 2 µ12 UD = − r6 3 h ν 1ν 2 α1α 2 UL = − ⋅ 6 2 r ν1 +ν 2
有
胶粒间的长程van der Waals引力
戎
UR =
2 64n0 kTν 0
宗
κ∝ n01/2
κ
exp(− 2dκ )
κ∝z
UR ∝ exp(-2d)
R O1
h
dh H0 O2
权 所
R 1−
h2 R2
H
由几何关系
(
i 环间斥力能增量
有
)
1/ 2
两球形胶粒双电层重叠时的斥力位能
1/ 2 H − H0 = R − (R 2 − h 2 ) 2
有
位阻效应
高分子能够保护胶体的机制主要是 位阻效应 在颗粒表面的高分子 形成了厚度为δ 的保护层 它们阻 止了颗粒的聚结
Ep c
O
b
a
版
权 所
h
明
加入高分子物质后 总位 能曲线EvdW的变化 高分子在保护层中的密度 a>b>c>d
3 静电稳定胶体的稳定机制 —— DLVO理论
戎
宗
3胶体的破坏
明
3高分子稳定胶体的稳定机制
版
权 所
有
(1) 颗粒间的范德华引力 主要由静电作用 诱导作用 色散作 用和电子云间的斥力构成 可近似用 兰纳-琼斯位能函数式表示
戎
宗
σ 12 σ 6 ε p = 4ε − r r
由Hamaker结果
戎
版
A R UA = − ⋅ 12 H 0
权 所
• Keeson力
2 2 µ12 µ2 UK = − 3 kTr 6 2 α1µ2 + α 2 µ12 UD = − r6 3 h ν 1ν 2 α1α 2 UL = − ⋅ 6 2 r ν1 +ν 2
有
胶粒间的长程van der Waals引力
戎
UR =
2 64n0 kTν 0
宗
κ∝ n01/2
κ
exp(− 2dκ )
κ∝z
UR ∝ exp(-2d)
R O1
h
dh H0 O2
权 所
R 1−
h2 R2
H
由几何关系
(
i 环间斥力能增量
有
)
1/ 2
两球形胶粒双电层重叠时的斥力位能
1/ 2 H − H0 = R − (R 2 − h 2 ) 2
有
位阻效应
高分子能够保护胶体的机制主要是 位阻效应 在颗粒表面的高分子 形成了厚度为δ 的保护层 它们阻 止了颗粒的聚结
Ep c
O
b
a
版
权 所
h
明
加入高分子物质后 总位 能曲线EvdW的变化 高分子在保护层中的密度 a>b>c>d
胶体界面化学(华东理工大学)-2

mg = 2πrσ
精确测定还应乘以一个经验的液滴形状校正因子 mg = 2πrσf σ = ρVg / 2πrf 形状校正因子 f 可根据液滴的半径和体积计算得到 Harkins-Brown: f = ϕ (r / a ) = θ (r / V 1/ 3 )
Wilkenson: 吴树森-王飞虹
f = 0.9045 − 0.7249(r / V 1 / 3 ) + 0.4293(r / V 1 / 3 )
宗
明
恒速滴重法——结果
2004 年 3 月 10 日修改 第 6 页
表面与胶体化学 课程
1 根据正己烷-水 甲苯-水 醋酸正戊酯-水的实验数据回归得到 (U0/Ri)⋅(u2/u1) = 19.989+3.110(Re)+0.186(Re)2+1.115(Re)3 2 由溶液的σt与液滴的表面寿命ta的关系 σt∼ ta 推算扩散系数D 由σt外推求平 衡界面张力 3 拟合σt与浓度c的关系 计算Gibbs等温式 动表 界 面张力的意义 由动表 界 面张力可研究溶质从体相扩散到表面层上吸附动力学 当新界面 产生时 次表面层的溶质向表面层扩散的速度一般大于体相向次表面层扩散的速 度 根据 Fick 第一 第二定律 表面上分子吸附的速率为 dn(t) / dt = D [∂c(0,t) / ∂t]z=0 式中表面吸附量 n(t)和次表面层浓度 c(0,t)可由 Gibbs 吸附等温式计算 动表面张力的研究在气体吸收 萃取 乳化和润湿等过程是十分重要的 表面活性剂的吸附速度 主要决定于表面活性剂分子从溶液内部向表面的扩散 在时 分子到达表面的速度可表达为 dn D 2 −21 N 0 = ct dt π 1000 1 1 1 t2 1 N D 2 2 n = 2 ct − ∫ φ( z )d (1 − z )2 0 π 1000 φ(t)为紧靠在吸附膜下面的溶液中溶质随时间变化
精确测定还应乘以一个经验的液滴形状校正因子 mg = 2πrσf σ = ρVg / 2πrf 形状校正因子 f 可根据液滴的半径和体积计算得到 Harkins-Brown: f = ϕ (r / a ) = θ (r / V 1/ 3 )
Wilkenson: 吴树森-王飞虹
f = 0.9045 − 0.7249(r / V 1 / 3 ) + 0.4293(r / V 1 / 3 )
宗
明
恒速滴重法——结果
2004 年 3 月 10 日修改 第 6 页
表面与胶体化学 课程
1 根据正己烷-水 甲苯-水 醋酸正戊酯-水的实验数据回归得到 (U0/Ri)⋅(u2/u1) = 19.989+3.110(Re)+0.186(Re)2+1.115(Re)3 2 由溶液的σt与液滴的表面寿命ta的关系 σt∼ ta 推算扩散系数D 由σt外推求平 衡界面张力 3 拟合σt与浓度c的关系 计算Gibbs等温式 动表 界 面张力的意义 由动表 界 面张力可研究溶质从体相扩散到表面层上吸附动力学 当新界面 产生时 次表面层的溶质向表面层扩散的速度一般大于体相向次表面层扩散的速 度 根据 Fick 第一 第二定律 表面上分子吸附的速率为 dn(t) / dt = D [∂c(0,t) / ∂t]z=0 式中表面吸附量 n(t)和次表面层浓度 c(0,t)可由 Gibbs 吸附等温式计算 动表面张力的研究在气体吸收 萃取 乳化和润湿等过程是十分重要的 表面活性剂的吸附速度 主要决定于表面活性剂分子从溶液内部向表面的扩散 在时 分子到达表面的速度可表达为 dn D 2 −21 N 0 = ct dt π 1000 1 1 1 t2 1 N D 2 2 n = 2 ct − ∫ φ( z )d (1 − z )2 0 π 1000 φ(t)为紧靠在吸附膜下面的溶液中溶质随时间变化
材料表界面华东理工大学PPT课件

第4309页/共56页
三、表面自由能(surface free energy)
狭义的表面自由能定义:
(G / A) p,T ,nB
狭义表面自由能的定义:保持温度、压力和组成不变,每增加单位表面积时, Gibbs自由能的增加值称为表面Gibbs自由能,或简称表面自由能或表面能,用 符号σ表示,单位为J·m-2。
第332页/共56页
表面张力
• 在图2-1中,设在F力作用下 金属丝移动dx的距离,则所 做的功为:
dW fdx σ • 2L • dx
(2 2)
• 但2L*dx等于液膜的面积增 量dA,所以:
dW σ • dA
(2-3)
• 将上式形式改写成如下形式:
σ=dW/dA
(2-4)
第343页/共56页
第221页/共56页
1.3表界面研究的重要性
表、界面现象一览表
界面现象
分类
表、
剂)
作为表面活性剂
肥皂和洗涤剂(表面活性
材料制造的产品 活性剂)
乳化剂和稳定剂(非表面
除草剂和杀虫剂
织物软化剂
表界面现象的直接应用 润滑、粘接、泡沫、润湿和
防水
第232页/共56页
1.3表界面研究的重要性
• 登月计划失败例 ; • MDF水泥; • 复合材料偶联剂; • 纳米材料;
第3209页/共56页
表面张力
表面张力示意:
如果在金属线框中间系一线圈,一 (a)
起浸入肥皂液中,然后取出,上面形 成一液膜。
由于以线圈为边界的两边表面张 力大小相等方向相反,所以线圈成任 意形状可在液膜上移动,见(a)图。
(b)
如果刺破线圈中央的液膜,线圈 内侧张力消失,外侧表面张力立即将 线圈绷成一个圆形,见(b)图,清楚 的显示出表面张力的存在。
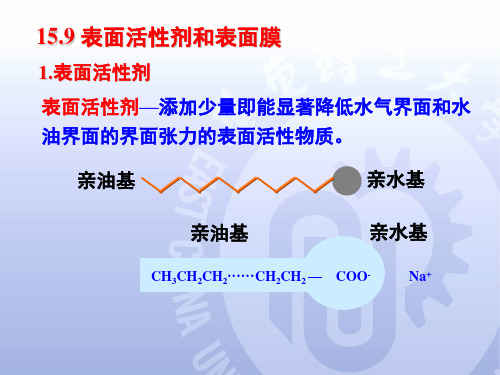
华东理工大学《物理化学》课件15.9 表面活性剂、兰缪尔吸附等温式(新)
铺展润湿过程
G As 液,固 气,液 气,固 def 液,固 气,液 气,固 G / As
4.不溶性单分子膜
(1)-As关系
膜天平示意图
(2)LB膜
(3)双层膜和囊泡
X膜 Z膜 Y膜
(4)膜的表面结构
18-Ar-18,2Br-1的LB膜 的AFM图象
尺度/
在水溶液中 亲水基团为 阴离子,主 要有:羧酸 盐,硫酸酯 盐,磺酸盐 磷酸酯盐、 脂肪酰-肽 缩合物等。
在水溶液中 亲水基团既 有阳离子, 主要为铵盐 和季铵盐又 有阴离子, 如羧酸盐, 硫酸酯盐, 磺酸盐等。
在水溶液中 不电离,主 要由聚环氧 烷基构成, 还有一部分 多醇为基础 结构。
2.胶束和临界胶束浓度
尔吸附等温式中的吸附系数b;(2) CHCl3(g)的平衡压力为
6.667kPa时的吸附量 (STP)。(3) 如何用作图法检验此吸附是
否确属兰缪尔吸附。
解: (1)
bp 1 bp
b
p
82.5
13.375 93.8
82.5
k
Pa1
0.546 kPa1
例:在273.15 K时测定吸附质 CHCl3(g)在活性炭上的吸附作 用。当 CHCl3(g) 的平衡压力为13.375 kPa 及吸附达饱和时, 每克活性炭吸附 CHCl3(g) 的量分别为82.5 cm3 (STP)和93.8 cm3 (STP)。设该吸附服从兰缪尔吸附等温式,试求:(1) 兰缪
"for his discoveries and investigations in surface
chemistry”
1903年毕业于哥伦比亚大学矿业学院。留学德 国,师从能斯特。1906年获哥丁根大学博士学 位。
胶体界面化学(华东理工大学)11

2 扩散慢
权 3 不能透过半透膜
版 不相同性质
1 溶质和溶剂间有亲和力 自 动溶解
明 2 稳定系统
3 平衡系统 符合相律 有一
宗 定的溶解度 戎 4 均相系统 Tyndall效应弱
5 粘度大
1 分散相和分散介质间没有亲
和力 不溶解 2 不稳定系统 3 不平衡系统 不符合相律
无一定的溶解度 4 多相系统 Tyndall效应强 5 粘度小 和水相似
6 对电解质不敏感
6 对电解质很敏感
高分子的统计平均分子量
• 数均分子量Mn
所有 之和
各种分子量的摩尔分数与其相应的分子量的乘积
∑ ∑∑ ∑∑ Mn =
xi M i =
ni M i = ni
Wi ni
• 重均分子量Mw
版权 之和
各种分子量的质量分数与其相应的分子量的乘积
∑ ∑∑ ∑∑ Mw =
wi M i =
/
η0 c
− 1
=
KM
α η
ni
M
3 i
ni
M
2 i
各种平均分子量大小的比较
有 M n < Mη < M w < M z 所 • 这是普遍性的结论 权 • 小分子量聚合物的存在对Mn的影响大 而对 版 其它较小 分子量大的分子对Mw Mz特别敏
感
明 • 分子量的差异愈大 Mw/Mn的比值愈大 戎宗 定义 分散度 Dn = M w / M n
+ቤተ መጻሕፍቲ ባይዱ
k ' ' [η ]3 c3
+ ...
戎宗明 Huggins方程
ηsp = [η]+ k'[η]2 c
权 3 不能透过半透膜
版 不相同性质
1 溶质和溶剂间有亲和力 自 动溶解
明 2 稳定系统
3 平衡系统 符合相律 有一
宗 定的溶解度 戎 4 均相系统 Tyndall效应弱
5 粘度大
1 分散相和分散介质间没有亲
和力 不溶解 2 不稳定系统 3 不平衡系统 不符合相律
无一定的溶解度 4 多相系统 Tyndall效应强 5 粘度小 和水相似
6 对电解质不敏感
6 对电解质很敏感
高分子的统计平均分子量
• 数均分子量Mn
所有 之和
各种分子量的摩尔分数与其相应的分子量的乘积
∑ ∑∑ ∑∑ Mn =
xi M i =
ni M i = ni
Wi ni
• 重均分子量Mw
版权 之和
各种分子量的质量分数与其相应的分子量的乘积
∑ ∑∑ ∑∑ Mw =
wi M i =
/
η0 c
− 1
=
KM
α η
ni
M
3 i
ni
M
2 i
各种平均分子量大小的比较
有 M n < Mη < M w < M z 所 • 这是普遍性的结论 权 • 小分子量聚合物的存在对Mn的影响大 而对 版 其它较小 分子量大的分子对Mw Mz特别敏
感
明 • 分子量的差异愈大 Mw/Mn的比值愈大 戎宗 定义 分散度 Dn = M w / M n
+ቤተ መጻሕፍቲ ባይዱ
k ' ' [η ]3 c3
+ ...
戎宗明 Huggins方程
ηsp = [η]+ k'[η]2 c
胶体和界面化学1-6

根据实验结果的推断:
◆胶体是一定分散范围内物质存在的一种状态, 而不是物质固有的特性。它的一相或多相以一定 大小(10-7~10-9m)分散于另一连续相中,
◆胶体是高度分散的体系,具有很大的表面积 ◆有扩散慢和不能透过半透膜,推断胶体溶液中的
质点不是以小分子而是以大粒子形式分散在介质 中 ◆胶体粒子在重力场中不沉降或沉降速度极慢, 推断分散质点不会太大,约1nm-1μm
第一章 胶体和界面简介
在Graham(格雷厄姆)之后四十多年,俄国化学 家Benmaph(本麦夫)用200多种物质做试验,证 明无论任何物质都可制成晶体状态也可制成胶体 状态。例如,典型的结晶物质氯化钠在水中形成 真溶液,在酒精中则可形成胶体溶液。因此,晶 体与胶体并不是不同的两类物质,而是物质的两 种不同的存在状态。由扩散慢和不能透过半透膜 这些特性可以推断,胶体溶液小的质点不是以小 分子,而是以大粒子的形式分散在介质中. 被分散的物质——分散相; 另一种物质——分散介质
近几十年来,由于实验技术的不断发展(像超离心 机、光散色、X射线、多种电子显微镜、红外线以 及各种能谱等的应用),又使胶体和表面化学在微 观研究中跃进了一大步。
1861年,英国化学家T. Graham首先提出了“胶 体”这个名词,确立了一门科学。
1902年,发明了超显微镜,首次观察到溶胶中粒 子的运动,证明了溶胶的超微不均匀性;
Wa l-g sg ls
界面热力学的奠基人吉布斯(Gibbs)在1878年提出 了界面相厚度为零的吉布斯界面模型,他还导出了联 系吸附量和界面张力随体相浓度变化的普遍关系式即 著名的吉布斯吸附等温式。
d RT
(1) i
d
ln
ai
胶体化学与表面化学1(共4个)

这种稳定剂又称胶溶剂。根据胶核所能吸附的离
子而选用合适的电解质作胶溶剂。 这种方法一般用在化学凝聚法制溶胶时,为了将 多余的电解质离子去掉,先将胶粒过滤,洗涤,然后 尽快分散在含有胶溶剂的介质中,形成溶胶。
例如:
Fe(OH)3 (新鲜沉淀) Fe(OH)3 (溶胶)
加FeCl3
AgCl(新鲜沉淀) AgCl(溶胶)
B. 还原反应制金溶胶
2HAuCl(稀溶液) 3HCHO(少量) 11KOH 4
加热 2Au(溶胶) 3HCOOK 8KCl 8H 2O
C. 水解反应制氢氧化铁溶胶
FeCl3 3H2O(热) Fe(OH)3 (溶胶) 3HCl
D.氧化还原反应制备硫溶胶
止。 而大颗粒大到一定程度即发生沉淀,这就是产 生老化过程的原因。
均分散胶体的制备和应用
在严格控制的条件下,有可能制备出形状相同、 尺寸相差不大的沉淀颗粒,组成均分散系统。颗粒的 尺寸在胶体颗粒范围之内的均分散系统则称为均分散 胶体系统。 制备均分散系统的方法有: 1.金属盐水溶液高温水解法; 2.金属络合物高温水解法;
(Q s ) (Q s ) v1 k v2 DA s (Q s) 当 的值很大时,有利于形成溶胶 s (Q s) 当 的值较小时,有利于生成大块沉淀 s (Q s) 当 的值很小时,也有利于形成溶胶 s
即使是经过纯化后的胶粒也会随时间推移而慢 慢增大,最终导致沉淀,这一过程称之为溶胶的 化学工艺专业 材料科学专业
研究生教学
目录
第一章 绪论
§1.1 早期人们对胶体的认识 §1.2 憎液溶胶的基本性质 §1.3 溶胶的制备及净化 §1.4 胶体化学与界面化学的联系 §1.5 胶体与界面化学的应用
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
表面活性剂胶束结有构
当表面活性
剂的浓度超过 cmc时 水溶液 中的表面活性剂
版权所
分子就几十 几
百地聚集在一起
明 排列成球形胶束
还可生成棒状胶
宗 束 乃至层状胶 戎 束
表面活性剂分子聚集体的形态
版权所有 球状 柱状 双层式以及反式聚集体
明
锥体
梯形锥体
圆柱体
宗头基面积 α0
烃基链体积 v
戎烃基链的最大可能长度 Ic
n≈7
其它的选择
胶束溶液 权所有 临界胶束浓度
版 其它表面物性及其测定 明 胶束作用的热力学 戎宗增溶的热力学模型
有 表面张力随浓度的关系
σ
版权所
c log c
明 当表面活性剂在溶液表面达到单分子吸附后 在 宗 体相内形成胶束 导致表面活性剂的溶液性质与表面性 戎 质有内在的联系
表面活性剂的基本特性——临界胶束浓度
权 我们称之为HLB的 它是分子中 版 亲油的和亲水的这两个相反的基
Groups 的大小和力量的平衡 z 对于聚乙二醇型非离子表面活性剂可根
明 据其亲水基和亲油基的分子量计算 戎宗 z 以此作为表面活性剂的一种分类法
有 Griffin的基本论点 1
z HLB是表面活性剂的一种分类法 按HLB分类可节
版权 HLB
=
7 + 11.7 log
MW M0
一般EO加成物
B不同值
HLB = 0.0980x + 4.02 浊点 PO-EO嵌段共聚物
戎宗明 HLB = 16.02 log A − 7.34 浊数 PO-EO嵌段共聚物
有 HLB的计算 2
z J.T. Davies (1957)
戎 z 单纯从表面活性剂的结构 不能确定其HLB
有 Griffin的基本论点 2
z HLB值只能在配置乳液时 确定所形成的乳液的类
所 型 权 z 乳化剂用量增加 则乳化能力增加 达到某一点后 版 增加用量也不能再增强乳化作用
z 两种或两种以上的乳化剂混合使用时 混合乳化剂 的HLB值可按其组成的重量百分比加以核算
浊数的测定 有
z浊数 Cloudy Number 又称苯酚指
权所 数 应用于油溶性非离子表面活性剂 版 z 将0.5克非离子表面活性剂溶于5ml
98%乙醇中 以2%苯酚水溶液滴定
明 至白浊即为终点 所用苯酚水溶液的 戎宗 ml数即为浊数
亲水H亲L版油B权平所衡有 戎宗明
有 HLB的定义 所 z Atlas公司-Griffin 1949 的定义
版 1 ~ 4
不分散
3~6
6~8
明 8 ~10
10 ~ 13
戎宗 > 13
分散的不好 剧烈振荡后成乳色分散体
稳定乳色分散体 半透明至透明的分散体
透明溶液
有 HLB的测定
z 乳化法 —— Gupta 1983
所 – 5%未知HLB值的乳化剂分散在15%已知HLB值的 权 油相中 版 – 由粗蒸松节油 HLB=16 和棉籽油 HLB=6
明 = 3 ×1× 36.1×10−3 /(8.60 ×102 ×10−8 ) = 12.6 kJ 宗 设十二烷基苯磺酸钠分别为1 所求表面活性剂为2 则 ∑戎 ∑ HLB1 = 7 + H − L = 7 + 11.0 − (12 × 0.475 + 1.662) = 10.638
w1HLB1 + (1 − w1)HLB2 = 12.5, HLB2 = 12.5 − 0.2 ×10.638 = 12.966
所 省选择表面活性剂的实验研究工作量 权 z HLB反映了表面活性剂分子中的平衡概念 即分子 版 结构中两个基的大小和力量的平衡 并以一些指定
数表示之
明 z HLB的指定数从1到40 其中非离子表面活性剂约 从1到20 HLB=1代表亲油性极强的乳化剂 宗 HLB=40代表亲水性最强的乳化剂 由亲油性转变 到亲水性的中点约为10
HO
HO
HO
2
2
2
O
O
O
CH CH
2
2
CH CH
2
2
CH CH CH
2
2
2
CH CH CH CH CH CH
2
2
2
2
2
2
用减弱 至一定温度以上 非离子 O
O
O
表面活性剂水溶液将分离出表面活
明 性剂相 外观由清亮变为混浊 这
个开始混浊的温度叫做浊点
宗 浊点越高的非离子表面活性剂适 戎 用温度范围越宽 性能较为优越
浊点测定的注意事项有
z 非离子表面活性剂的纯度愈高 浊点转变愈明显
所 少量阴离子表面活性剂存在 会造成无浊点转折 权 点 无机盐杂质会使浊点降低 醇和其它极性溶 版 剂会使浊点升高
z 当无明锐的转折点 则以其最大浊度时的温度为
准
明 z 样品溶液和水浴或油浴的温度须一致 在测定高 戎宗 浊点时 加热温度不得超过浊点5°C以上
所 基团加和法 HLB = 7 + ∑ 亲水基数 − ∑ 亲油基数
亲水基数 SO4Na
38.7
权 亲油基数
>CH
0.475
COOK COONa SO3Na
21.1 19.1 11.0
版CH2 CH3 =CH
0.475 0.475 0.475
N 叔胺 酯 失水山梨醇环 酯 自由
明9.4 6.8 2.4
该选用怎样结构的乳化剂与重量百分数为20%的十二烷基苯磺酸
权 钠混合使用
已知 甲苯和水的密度分别为8.60×102 kg⋅m-3和1.00×103 kg⋅m-3 界
版 面张力为36.1 mN⋅m-1 甲苯所需的HLB=12.5
解 WR' = σAs = σ(m / ρ)(4πr 3 / 3)−1 (4πr 2 ) = 3mσ / ρr
HO 2
HO
HO
2
2
曲折型 水溶状态
浊点的测定 有 所 z 一般采用低浓度(0.5~10%)溶液 以1%为基准 权 z 当浊点>95°C时 采用毛细管密封和油浴测定 版 z 测定高浊点时 可在10%NaCl溶液中进行 但须标明
Cl.P10
明 z 当非离子表面活性剂在水中的溶解度很小时 除降低表 面活性剂浓度外 还可采用混合溶剂 宗 50:50/V/V 水-丙醇 进行测定 但须用其它方法的结果 戎 校核
临界胶束浓度的含有义 所 当浓度超过cmc后 在溶液内部所生成的 权 胶束 往往能使一些不易溶于水的物质因进入 版 胶束而增加其溶解度 即所谓增溶作用 进一
步还可能增长为包裹了油的尺寸为几个到几十 个纳米的超微液滴
明 至于已属于胶体范畴的乳状液 微乳液和 宗 泡沫 也与这种表面活性物质在界面上的定向 戎 作用密切相关
有 表面活性剂的基本性质
权所 Kraft点 版 浊点
表面活性剂在 水中的溶解度
戎CH宗MLBC明
选择依据 使用浓度
Krafft点的定义有 z 表面活性剂在水中的溶解度与温度的关系与一般常见 化合物的情况有所不同
所 z 离子型表面活性剂的共同特点是 权 在温度足够低时 溶
版 解度有限并随温度上升而
增加 达到一定温度后 溶解度会陡然上升 这个
版权 值 戎宗明 W.C.Griffin, J.Soc.Cosm.Chem., 1:311 (1949).
有 表面活性剂的HLB值
z HLB指定值的标准
所
– 石蜡 HLB=0 – 油酸 HLB=1 – 油酸钾 HLB=20
版权
– 十二烷基硫酸钠 HLB=40 z 其它表面活性剂通过乳化实验对比其乳化效果 在
CF2
CF3 苯环
0.870 0.870 1.662
COOH OH 自由
宗 O
OH 失水山梨醇环
戎 CH2 CH2O
2.1 1.9 1.3 0.5 0.33
CH2 CH2 CH2O
0.15
CH(CH3) CH2O
0.15
CH2 CH(CH3) O 0.15
有 HLB的计算 3
z 混合物的HLB计算
明 C10H21O(C2H4O)8CH3 戎宗 C10H21O(C2H4O)8CH3
真正的溶解度 于是体系形成胶团 与之
明 平衡的分子溶液达不到固体析出的浓度 戎宗 表面活性剂的Krafft点越低 越有利于实用
Krafft点的测定有
所
z 溶解度的测定
z 固液平衡的测定 z cmc与温度关系的
测定
版权
戎宗明
浊点 有
非离子型表面活性剂
所
其亲水作用依赖于醚氧或其它
权 氧 氮等杂原子与水的极性相互作 版 用或氢键作用 温度升高使此类作
宗4
-
10 10.5
戎5 4
10-16 9
斯盘-60 HLB1=4.7 吐温-60 HLB2=14.9 配比
HLB=HLB1×w1+HLB2×w2
w1 = 48% w2 = 52%
例题 9
有
在25°C时 将1kg的甲苯分散至10kg的水中 形成半径为10-8 m
所 的液滴 1 计算所需的功 2 若要使其成为稳定的乳状液
明 z 对于一个已知的或给予的油品 用不同HLB的乳化 宗 剂将其乳化 必有一个HLB值为最适HLB 用混合 戎 乳化剂或 乳化剂对 时 最适HLB仍不变 此时
乳液最稳定
有 Griffin的基本论点 3 所 z 提出用乳化法测定表面活性剂的HLB值
z 提出一些经验式测算某些非离子表面活性剂的HLB
有 HLB 的应用
z 油品被乳化所需HLB
所 在确定被乳化物质所要求乳化剂的HLB后 可以选用具有该HLB
