苏教版高中化学《必修1》化学方程式汇总
高一化学必修1苏教版化学方程式完全总结

高一化学方程式专题1 化学家眼中的物质世界1、碱性氧化物与酸反应:CaO + 2HCl =CaCl2 + H2O2、酸性氧化物与见反应:CO2 + Ca(OH)2= CaCO3↓ + H2O3、单质→化合物:2H2O + O2==2H2O点燃4、碱性氧化物→碱:CaO + H2O==Ca(OH)25、酸性氧化物→酸:SO3 + H2O == H2SO46、酸→盐:H2SO4+BaCl2== BaSO4↓ + 2HCl7、置换反应:Fe + CuSO4 == Cu + FeSO48、化合反应:CaO + H2O==Ca(OH)29、分解反应:CaCO3 == CaO + CO2↑高温10、复分解反应:Ca(OH)2 + Na2CO3== CaCO3↓+ 2NaOH11、氧化铁高温下与CO反应:Fe2O3 + 3CO == 2Fe + 3CO2↑高温12、过氧化氢分解生成氧气和水:2H2O2 ====H2O + 2O2↑MnO213、粗盐提纯:MgCl2 + 2NaOH ==Mg(OH)2↓+ 2NaCl14、氯化铵与强碱溶液混合加热:NH4Cl + NaOH === NaCl + H2O + NH3↑△15、Cl-与硝酸银的反应:NH4Cl + AgNO3== AgCl↓+NH4NO316、SO42-与Ba2+的反应:(NH4)2SO4+ BaCl2== BaSO4↓ +2NH4Cl专题2 从海水中获得的化学物质1、工业制法——氯碱工业:2、氯的实验室制法:MnO2+4HCl (浓) =△ = MnCl2+2H2O+Cl2↑3、钠在氯气中燃烧,产生白烟:4、铁在氯气中燃烧,产生棕褐色烟:5、铜在氯气中点燃,产生棕黄色烟:Cu + Cl2 ===CuCl2点燃6、氢气在氯气中燃烧,发出苍白色火焰:H2 + Cl2 ===2HCl点燃7、P在氯气中燃烧产生大量白色烟雾:8、Cl2 与碱的反应: Cl2+2NaOH=NaCl+NaClO+H2O2Cl 2+2Ca(OH)2=CaCl 2+Ca(ClO)2+2H 2O 9、Ca(ClO)2与酸反应:Ca(ClO)2 + H 2O + CO 2 = CaCO 3↓ + 2HClO 漂白粉长时间放置于空气中将失效。
苏教版高中化学必修1化学方程式大全

苏教版化学必修1化学方程式总结1、铝及其化合物的转化关系①2Al +6HCl=2AlCl 3+3H 2↑ ②4Al +3O 2 △2Al 2O 32Al +6H +=2Al 3++3H 2↑※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3++3H 2O ※⑤Al 2O 3+2NaOH=2NaAlO 2+H 2O ⑥AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4ClAl 2O 3+2OH -=2AlO 2-+H 2O Al 3++3NH 3·H 2O = Al(OH)3↓+3NH 4+⑦Al(OH)3+3HCl=AlCl 3+3H 2O ⑧2Al(OH)3△Al 2O 3+3H 2OAl(OH)3+3H +=Al 3++3H 2O☆⑨NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 或NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+2H 2O +CO 2=Al(OH)3↓+HCO 3-※⑩Al(OH)3+NaOH = NaAlO 2+2H 2O ☆⑾Al 3++3H 2O Al(OH)3胶体+3H +Al(OH)3+OH -= AlO 2-+2H 2O 明矾净水⑿AlCl 3+4NaOH = NaAlO 2+3NaCl +2H 2O Al 3++4OH -= AlO 2-+2H 2O 2、铁及其化合物的转化关系 ① Fe 3O 4+4CO △ 3Fe +4CO 2 ※② 3Fe +4H 2O(g) Fe 3O 4+4H 2 ③ Fe +2HCl=FeCl 2+H 2↑ 或3Fe +2O 2点燃Fe 3O 4Fe +2H +=Fe 2++H 2↑④2Fe +3Cl 2点燃2FeCl 3※⑤2FeCl 2+Cl 2 = 2FeCl 3 ※⑥Fe +2FeCl 3 = 3FeCl 22Fe 2++Cl 2 = 2Fe 3++2Cl - Fe +2Fe 3+= 3Fe 2+⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl 2+2H 2OFe 2++2OH -= Fe(OH)2↓ Fe(OH)2+2H += Fe 2++2H 2OFe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 O 3 ①② ③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩ ⒁ 2O 3 A l (O H )3 KAl(SO 4)22AlCl 3 ④ ⑤ ⑥⑦⑧ ⑨⑩⑾※⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3++3OH -= Fe(OH)3↓⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +(净水) Fe(OH)3+3H += Fe 3++3H 2O ⑿2Fe(OH)3△Fe 2O 3+3H 2O⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KClFe 2O 3+6H += 2Fe 3++3H 2O Fe 3++3SCN -= Fe(SCN)3 3、钠及其化合物的转化关系①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2△Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3-※⒂2NaHCO 3△2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2OHCO 3-+OH -=CO 32-+H 2O⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO 3-=CaCO 3↓+H 2O②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2O 4、硫及其化合物的转化关系①S +O 2 点燃SO 2 ②2H 2S +SO 2=3S +2H 2O ※③SO 2+O 2 催化剂加热 2SO 3NaCl Na NaOH NaHCO Na 2Na 2① ② ③ ⑤⑾ ⑿ ⒁ ⒂④① S 4 ②④SO 3+H 2O = H 2SO 4 ⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O⑥SO 3+CaO = CaSO 4 SO 2+Ca 2++2OH -=CaSO 3↓+H 2O SO 3+Ca(OH)2 = CaSO 4+H 2O ⑦2CaSO 3+O 2 △2CaSO 4※⑧SO 2+Cl 2+2H 2O = H 2SO 4+2HCl ※⑨Cu +2H 2SO 4(浓)△CuSO 4+SO 2↑+2H 2OSO 2+Cl 2+2H 2O = 4H ++SO 42-+2Cl -Cu +2H 2SO 4(浓) △2++SO 42-+SO 2↑+2H 2O※⑩C +2H 2SO 4(浓)△CO 2↑+2SO 2↑+2H 2O5、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3 ②Cu +Cl 2 点燃CuCl 2 ③2FeCl 3+Cu = 2FeCl 2+CuCl 22Fe 3++Cu = 2Fe 2++Cu 2+④H 2+Cl 2 2HCl※⑤MnO 2+4HCl(浓) △MnCl 2+Cl 2↑+2H 2OMnO 2+4H ++2Cl - △Mn 2++Cl 2↑+2H 2O ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -+O 2↑※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2OCl 2+2OH -= Cl -+ClO -+H 2O 工业制漂白粉※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClOCa 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H += HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClOClO -+H 2O +CO 2 = HCO 3-+HClO6、氮及其化合物的转化关系 ※①N 2+O 2 2NO ※②2NO +O 2 = 2NO 2※③3NO 2+H 2O = 2HNO 3+NO 3NO 2+H 2O =2H ++2NO 3-+NO以上三个反应为“雷雨发庄稼”原理 扩展反应有:4NO 2+O 2+2H 2O = 4HNO 3 4NO +3O 2+2H 2O = 4HNO 3 ※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O 上面两个反应主要用于气体溶于水时的计算Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 或 4HNO 3 4NO 2↑+ O 2↑+ 2H 2OC +4HNO 3(浓)△2↑+2NO 2↑+2H 2O 浓硝酸见光易变黄的原因CuCl 2 HClO HCl Cl 2 FeCl 3NaClO Ca(ClO)2① ② ③ ④⑤ ⑥ ⑦⑧ ⑨ ⑩ ① ⑨ ⑧⑦ ⑥ N 2 NH 3 NH 4Cl NO NO HNO 3 ② ③ 点燃或光照 光照光照 高温或放电 光照※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂 高温高压2NH 33Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O 合成氨反应是人工固氮的主要途径 ⑦NH 3+HCl = NH 4Cl ⑧NH 4Cl△NH 3↑+HCl ↑NH 3+H += NH 4+(水溶液中) 补充:NH 4HCO 3 △NH 3↑+H 2O+CO 2↑氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐 (如浓HCl 、浓HNO 3)相遇时空气中有白烟 都分解出氨气,如NH 4NO 3、(NH 4)2SO 4※⑧NH 4Cl +NaOH△NaCl +NH 3↑+H 2O NH 4++OH-△NH 3↑+H 2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
化学必修1教材中的全部化学方程式分类归纳(7类59个方程式)

一、复分解反应(非氧化还原反应1、酸性氧化物与碱反应生成盐和水①.二氧化硅与氢氧化钠溶液反应SiO 2 + 2NaOH = Na2SiO 3 + H2O ②.三氧化硫与 Ca(OH2溶液反应: SO 3 + Ca(OH2 = CaSO4+H 2O2、碱性氧化物与酸反应生成盐和水①.氧化亚铁与盐酸反应:FeO +2HCl =FeCl 2+H 2O②.氧化铁与盐酸反应:Fe 2O 3 + 6HCl = 2FeCl3 + 3H2O 3、两性氧化物与酸反应生成盐和水Al 2O 3与盐酸反应:Al 2O 3 + 6HCl =2AlCl 3 + 3H2O 4、两性氧化物与碱反应生成盐和水Al 2O 3与氢氧化钠溶液反应:Al 2O 3 + 2NaOH =2NaAlO 2 + H2O 5、酸性氧化物的特殊反应二氧化硅与氢氟酸反应:SiO 2 + 4HF = SiF4↑+ 2H2O6、碱与酸反应生成盐和水①. Al(OH3与盐酸反应:Al(OH3 + 3HCl =AlCl 3 + 3H2O7、盐与酸反应生成新盐和新酸①.硅酸钠与盐酸反应:Na 2SiO 3 + 2HCl = 2NaCl + H2SiO 3↓②.漂白粉长期置露在空气中:Ca(ClO2 + H2O + CO2 = CaCO3↓ + 2HClO 8、盐水解生成新酸和新碱Fe(OH3胶体的制备:FeCl 3+3H 2O 加热 Fe(OH3(胶体+3HCl 9、两性氢氧化物与碱反应生成盐和水Al(OH3与氢氧化钠溶液反应:Al(OH3 + NaOH = NaAlO 2 + 2H2O10、盐与碱反应生成新盐和新碱①.实验室制取氢氧化铝(铝盐溶液加氨水: Al 2(SO4 3 + 6NH3•H 2O =2Al(OH3↓ + 3(NH4 2SO 4 ②.氯化铁与氢氧化钠溶液反应:FeCl 3 + 3NaOH =3NaCl + Fe(OH3↓ (红褐色③.硫酸亚铁与氢氧化钠溶液反应: FeSO 4 + 2NaOH = Na2SO 4 + Fe(OH2↓ (白色④.硝酸铵与氢氧化钠反应:NH 4NO 3 + NaOH 加热NH3↑ + NaNO3 + H2O ⑤.氨气的实验室制取法:2NH 4Cl + Ca(OH2加热CaCl2 + 2H2O + 2NH3↑ ⑥.硫酸铵与氢氧化钠反应:(NH4 2SO 4 + 2NaOH 加热2NH3↑ + Na2SO 4 + 2H2O二、置换反应(氧化还反应1、还原性非金属单质与氧化物反应置换金属单质碳还原氧化铜:2CuO +C 高温2Cu +CO 2↑2、金属单质置换出还原性非金属单质①.金属与水的反应:铁与水蒸气反应:3Fe + 4H2O(g 加热Fe 3O 4 + 4H2↑ 钠与水反应:2Na + 2H2O = 2NaOH + H2↑②.金属与酸的反应:Al 与盐酸反应:2Al +6HCl =2AlCl 3+3H2↑③.两性金属与碱溶液的反应:Al 与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O =2NaAlO 2 + 3H2↑三、属于氧化还原反应的化合反应1、金属与氧气发生的氧化反应①.常温下钠与氧气反应:4Na + O2 = 2Na2O (白色②.钠在空气中燃烧:2Na + O2加热 Na 2O 2(淡黄色③.铁在氧气中燃烧:3Fe +2O 2点燃 Fe 3O 4(黑色2、非金属单质与氧气的氧化反应①.硫的燃烧 S +O 2点燃 SO 2②.氮气与氧气在放电下反应:N 2 + O2放电 2NO3、低价非金属氧化物与氧气的氧化反应①.二氧化硫与氧气反应:2SO 2+O 2催化剂加热2SO 3②.一氧化氮与氧气反应:2NO + O2 = 2NO24、非金属氢化物与氧气的反应氨的催化氧化:4NH 3+5O 2催化剂△4NO +6H 2O5、低价碱的氧化反应氢氧化亚铁被氧化成氢氧化铁:4Fe(OH2 + 2H2O + O2 = 4Fe(OH36、单质与氯气发生的氧化反应①.氯气与金属反应:铁与氯气反应产生棕色烟2Fe + 3Cl2点燃 2FeCl 3铜与氯气反应产生棕黄色烟Cu + Cl2点燃 CuCl 2钠在氯气中燃烧有白烟2Na + Cl2点燃 2NaCl②.氯气与非金属反应:氢气在氯气中燃烧产生苍白色火焰有白雾 H 2+Cl 2加热 2HCl③.氯气与氯化亚铁反应生成氯化铁2FeCl 2 + Cl2 = 2FeCl37、高价铁盐的还原反应FeCl 3溶液与铁粉反应:2FeCl 3 + Fe = 3FeCl2 8、非金属与氢气的化合反应合成氨反应:N 2+3H 2 催化剂高温高压2NH 3四、不属于氧化还原反应的化合反应1、酸性氧化物与碱性氧化物反应生成含氧酸盐①.二氧化硅与氧化钙高温反应生成硅酸钙 SiO 2 + CaO高温 CaSiO3②.三氧化硫与氧化钙反应生成硫酸钙SO 3+CaO =CaSO 42、酸性氧化物与水反应生成含氧酸①.二氧化硫与水反应生成亚硫酸SO 2 + H2O H2SO 3②.三氧化硫与水反应生成硫酸SO 3 + H2O = H2SO 43、氨气与水的化合反应氨气溶于水生成氨水:NH 3 + H2O =NH 3•H 2O4、氨气与酸的化合反应氨气与氯化氢反应生成氯化铵:NH 3 + HCl = NH4Cl五、属于氧化还原反应的分解反应次氯酸光照分解:2HClO 光照2HCl + O2↑ 六、不属于氧化还原反应的分解反应1、铵盐受热分解①氯化铵受热分解:NH 4Cl 加热NH3↑ + HCl↑ ②.碳酸氢氨受热分解: NH 4HCO 3加热NH 3↑ + H2O↑ + CO2↑2、氨水受热分解氨水受热分解:NH 3•H 2O 加热NH 3↑ + H2O 3、不溶性碱受热分解①.氢氧化铁加热分解生成氧化铁和水: 2Fe(OH3 加热 3H 2O+ Fe2O 3②.氢氧化铝加热分解生成氧化铝和水: 2Al(OH3加热 Al 2O 3 + 3H2O七、不属于基本类型的氧化还原反应1、过氧化钠氯气二氧化氮的歧化反应①.过氧化钠与水反应生成氢氧化钠和氧气2Na 2O 2 + 2H2O = 4NaOH + O2↑②.过氧化钠与二氧化碳反应生成碳酸钠和氧气 2Na 2O 2 + 2CO2 = 2Na2CO 3 + O2③.氯气与水反应生成盐酸和次氯酸:Cl 2 + H2O = HCl + HClO④. 氯气与氢氧化钠溶液反应生成氯化纳和次氯酸钠:Cl 2 + 2NaOH = NaCl + NaClO + H2O⑤.氯气与消石灰反应制漂白粉:2Cl 2 + 2Ca(OH2 = CaCl2 + Ca(ClO2 + 2H2O ⑥.二氧化氮与水反应生成硝酸和一氧化氮: 3NO 2 + H2O = 2HNO3 + NO2、氧化性酸的还原反应①.浓硫酸与碳发生的还原反应C + 2H2SO 4(浓加热CO2↑+ 2SO2↑ + 2H2O ②.浓硫酸与铜发生的还原反应Cu + 2H2SO 4(浓加热CuSO 4 + 2H2O + SO2↑ ③.浓硝酸与铜发生的还原反应: Cu + 4HNO3(浓=Cu(NO3 2 + 2H2O + 2NO2↑ ④.稀硝酸与铜发生的还原反应: 3Cu + 8HNO3(稀=3Cu(NO3 2 + 4H2O + 2NO↑ 3、还原性酸的氧化反应氯气的实验室制法:MnO 2+4HCl (浓加热MnCl 2+Cl 2↑ +H 2O 4、高价金属化合物的还原反应: FeCl 3溶液与铜反应:2FeCl 3 + Cu = 2FeCl2+ CuCl 2。
苏教版必修一全册重点化学方程式_解读

NH3 ↑ + H2O
10、 Na+的检验:焰色反应,焰色为黄色
11、 k+的检验:焰色反应,焰色为浅2+11O2===2Fe2O3+8SO2
催化剂 2SO2+O2===2SO 3 △
高温
S+O2===SO2
点燃
SO3 + H2O===H2SO4
一、各种重要化工产品的制法
5、工业制取硝酸 4NH3+
催化剂 5O2 = == 4NO+6H2O 加热加压
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO 6、合成氨工业
CuO的硬质玻璃管后,再通入澄清石灰水,看是否变浑浊
△
CO+CuO=Cu+CO2,CO2+Ca(OH)2=CaCO3↓+2H2O 4、CO2的检验:通入到品红溶液,溶液不褪色,再通入到澄 CO2+Ca(OH)2=CaCO3↓+2H2O 清石灰水,看是否变浑浊
△
5、SO2的检验:通入品红溶液或(酸性KMnO4) ,看是否褪色 5SO2+2KMnO4 +2H2O =2MnSO4+2K2SO4+2H2SO4
② 向残留液(苦卤)中通入氯气并加热,蒸出溴蒸汽. 22、 海水中提取碘 Cl2+2KI=2KCl+I2
二、气体的实验室制法
1、实验室制取氯气 4 HCl(浓) + MnO2 = MnCl2 +Cl2↑+2H2O 16HCl+2KMnO4=2MnCl2+2KCl+5Cl2↑+8H2O 6HCl+ KClO3= KCl+3Cl2↑+3H2O 2、实验室制取HCl气体 △ 2NaCl+H2SO4 (浓)=Na2 SO4+2HCl↑ 3、实验室制取NO气体 △ 3Cu+8HNO3 = 3Cu(NO3)2+2NO↑+4H2O 4、实验室制取H2S,-启普发生器 FeS + H2SO4 = FeSO4 + H2S ↑ FeS + 2HCl = FeCl2 + H2S ↑
高一化学(苏教版)必修一必记化学方程式

化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2
10、钠与水反
应:2Na + 2H2O = 2NaOH + H2↑
11、铁与水蒸气反应:3Fe + 4H2O(
g) = F3O4 + 4H2↑
12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2
↑
57、氯气与氢气反应:Cl2 + H2 点燃 2HCl
58、硫酸铵与氢氧化
钠反应:(NH4)2SO4 + 2NaOH △ 2NH3↑ + Na2SO4 + 2H2O
59、SO2
+ CaO = CaSO3
60、SO2 + 2NaOH = Na2SO3 + H2O
61、SO2 + Ca(O
�
高一化学方程式
1、硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl
2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
3、碳酸
钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
4、木炭还原氧化铜: 2CuO + C 高温 2Cu + CO2↑
O = 2NaAlO2 + 3H2↑
13、氧化钙与水反应:CaO + H2O = Ca(OH)2
14、氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O
高中化学(苏教版 必修一)方程式及离子方程式汇总

高中化学(苏教版 必修一)方程式及离子方程式汇总从海水中获得的化学物质(1)工业制氯气(氯碱工业)—电解饱和食盐水:2NaCl + 2H 2O 2NaOH+H 2↑+Cl 2↑ 2Cl - +2H 2O 2OH -+H 2↑+Cl 2↑(2)实验室制氯气:MnO 2+4HCl(浓) MnCl 2+Cl 2↑+2H 2O MnO 2+4H + +2Cl -Mn 2+ +Cl 2↑+2H 2O(3)铁与氯气的反应:2Fe + 3Cl 2 2FeCl 3 (棕褐色的烟)(4)* 铜与氯气的反应:Cu + Cl 2 CuCl 2 (棕黄色的烟) (5)* 钠与氯气的反应:2Na + Cl 2 2NaCl (白烟) (6)氢气与氯气的反应:H 2 + Cl 2 2HCl (苍白色火焰) H 2 + Cl 2 2HCl (7) 氯气溶于水:Cl 2 +H 2O HCl +HClO Cl 2 + H 2OH + + Cl - + HClO (8)次氯酸见光分解: 2HClO 2HCl + O 2↑ (9)氯气的尾气处理:Cl 2+2NaOH =NaCl+NaClO+H 2O Cl 2 + 2OH - = Cl - + ClO - +H 2O(10)漂白粉的生产原理:2Ca(OH)2 + 2Cl 2 == Ca(ClO)2 + CaCl 2 + 2H 2OCl 2 + 2OH - =Cl - +ClO - +H 2O(11)漂白粉消毒原理:Ca(ClO)2+2HCl =CaCl 2+2HClO ClO - + H + = HClOCa(ClO)2 +CO 2 +H 2O == CaCO 3 ↓+ 2HClO Ca 2+ +2ClO - +CO 2 + H 2O= CaCO 3↓+2HClO(12)氯、溴、碘之间的置换反应:Cl 2 + 2KBr == Br 2 + 2KCl Cl 2 + 2Br - == Br 2 + 2Cl –(Cl 2使湿润的淀粉KI 试纸变蓝):Cl 2 + 2KI == I 2 + 2KCl Cl 2 + 2I - == I 2 + 2Cl –Br 2 + 2KI == I 2 + 2KBr Br 2 + 2I - == I 2 + 2Br –(13)氯、溴、碘离子的检验: KCl+AgNO 3 == AgCl ↓+KNO 3 Ag + +Cl - ==AgCl ↓(白色沉淀)NaBr+AgNO 3==AgBr ↓+NaNO 3 Ag + +Br - == AgBr ↓(淡黄色沉淀)NaI + AgNO 3 == AgI ↓+ NaNO 3 Ag + + I - == AgI ↓(黄色沉淀)(14)钠放置在空气中被氧化(常温):4Na + O 2 == 2Na 2O (氧化钠,白色固体)(15)钠在空气中燃烧:2Na + O 2 Na 2O 2 (过氧化钠,淡黄色固体) (16)钠与水的反应:2Na + 2H 2O == 2NaOH + H 2↑ 2Na + 2H 2O == 2Na + + 2OH -+H 2↑ (17)钠与四氯化钛的反应:TiCl 4 + 4Na Ti + 4NaCl (18)钠的工业制法:2NaCl(熔融) 2Na + Cl 2↑(19)氧化钠和水反应:Na 2O+H 2O ==2NaOH Na 2O+H 2O ==2Na + + 2OH -(20)氧化钠是碱性氧化物:Na 2O+CO 2=Na 2CO 3 (21)过氧化钠与二氧化碳的反应:2Na 2O 2 + 2CO 2 == 2Na 2CO 3 +O 2 (22) 过氧化钠与水的反应:2Na 2O 2 + 2H 2O == 4NaOH + O 2↑ (23)碳酸钠与氢氧化钙的反应:Na 2CO 3+Ca(OH)2==CaCO 3↓+2NaOH Ca 2++CO 32-==CaCO 3↓(24)碳酸钠与氯化钡的反应:Na 2CO 3+BaCl 2==BaCO 3↓+2NaCl Ba 2+ + CO 32-==BaCO 3↓(25)碳酸钠溶液中通入CO 2:Na 2CO 3+CO 2+H 2O==2NaHCO 3 CO 32- + CO 2 + H 2O==2HCO 3 –(26)NaHCO 3与NaOH 溶液反应:NaHCO 3+NaOH==Na 2CO 3+H 2O HCO 3 - +OH -==CO 32- +H 2O(27)少量 NaHCO 3与Ca(OH)2溶液反应:NaHCO 3+ Ca(OH)2==CaCO 3↓+NaOH +H 2OHCO 3 - + Ca 2+ + OH - == CaCO 3↓+ H 2O(28)过量NaHCO 3与Ca(OH)2溶液反应:2NaHCO 3+ Ca(OH)2==CaCO 3↓+ Na 2CO 3 +2H 2O2HCO 3 - + Ca 2+ + 2OH - == CaCO 3↓+ CO 32- +2H 2O(29)NaHCO 3与盐酸反应:NaHCO 3+HCl==Na 2CO 3+CO 2↑+H 2O HCO 3 - + H + == CO 2↑+ H 2O(30)碳酸钠(纯碱)与不足的盐酸反应:Na 2CO 3+HCl==NaHCO 3+NaCl CO 32- + H + == HCO 3-(31)碳酸钠与足量的盐酸反应:Na 2CO 3+2HCl==2NaCl+CO 2↑+H 2O CO 32-+2H +==CO 2↑+H 2O(32)少量CO 2通入碱溶液:CO 2+2NaOH =Na 2CO 3+H 2O CO 2 + 2OH - = CO 32- + H 2O(33)过量CO 2通入碱溶液:CO 2 + NaOH =NaHCO 3 CO 2 +OH - = HCO 3- 通电 通电 点燃 点燃 光照点燃 点燃光照 点燃700~800℃通电 Na 2O 2既是氧化剂又是还原剂(34)碳酸氢钠(小苏打)固体受热分解:2NaHCO 3Na 2CO 3+H 2O+CO 2↑(35)* 侯氏制碱法:NaCl + NH 3 + CO 2 + H 2O == NaHCO 3 + NH 4Cl(36)醋酸的电离方程式:CH 3COOH CH 3COO - + H +(37) Na 2CO 3溶液与过量醋酸溶液:2CH 3COOH+Na 2CO 3=2CH 3COONa+H 2O+CO 2↑2CH 3COOH+CO 32-=2CH 3COO - +H 2O+CO 2↑(38)一水合氨的电离方程式:NH 3·H 2O NH 4+ + OH -常见的弱酸:H 2CO 3、H 2SO 3、HClO 、H 2S 、HF 、CH 3COOH 、 H 2SiO 3(不溶)。
高一化学必修1苏教版化学方程式完全总结

高一化学必修1苏教版化学方程式完全总结高一化学方程式专题1 化学家眼中的物质世界1、 碱性氧化物与酸反应:CaO + 2HCl =CaCl 2 + H 2O2、 酸性氧化物与见反应:CO 2 + Ca(OH)2 = CaCO 3↓ + H 2O3、 单质→化合物:2H 2O + O 2==2H 2O点燃4、 碱性氧化物→碱:CaO + H 2O==Ca(OH)25、 酸性氧化物→酸:SO 3 + H 2O == H 2SO 46、 酸→盐:H 2SO 4+BaCl 2 == BaSO 4↓ + 2HC l7、 置换反应:Fe + CuSO 4 == Cu + FeSO 48、 化合反应:CaO + H 2O==Ca(OH)29、 分解反应:CaCO 3 == CaO + CO 2↑高温10、 复分解反应:Ca(OH)2 + Na 2CO 3 == CaCO 3↓+ 2NaOH 11、 氧化铁高温下与CO 反应:Fe 2O 3 + 3CO == 2Fe + 3CO 2↑高温12、过氧化氢分解生成氧气和水:2H 2O 2 ====H 2O + 2O 2↑MnO 213、 粗盐提纯:MgCl 2 + 2NaOH ==Mg(OH)2↓+ 2NaCl 14、氯化铵与强碱溶液混合加热:NH 4Cl + NaOH === NaCl + H 2O + NH 3↑△15、 Cl -与硝酸银的反应:NH 4Cl + AgNO 3 == AgCl ↓+NH 4NO 316、 SO42-与Ba 2+的反应:(NH 4)2SO 4 + BaCl 2 == BaSO 4↓ +2NH 4Cl专题2 从海水中获得的化学物质1、工业制法——氯碱工业 :阳极(石墨棒)2NaCl + 2H 2O通电2NaOH + H 2↑ + Cl 2↑阴极(铁棒)2、氯的实验室制法:MnO 2+4HCl (浓) =△ = MnCl 2+2H 2O +Cl 2↑3、钠在氯气中燃烧,产生白烟:2Na+Cl 2点燃2NaCl4、铁在氯气中燃烧,产生棕褐色烟:5、铜在氯气中点燃,产生棕黄色烟:Cu + Cl2 ===CuCl2点燃6、氢气在氯气中燃烧,发出苍白色火焰:H2 + Cl2 ===2HCl点燃7、P在氯气中燃烧产生大量白色烟雾:2P+3Cl 2点燃2PCl3PCl3+Cl2点燃PCl58、Cl2 与碱的反应:Cl2+2NaOH=NaCl+NaClO+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O9、Ca(ClO)2与酸反应:Ca(ClO)2+ H2O + CO2= CaCO3↓ + 2HClO漂白粉长时间放置于空气中将失效。
高一上学期化学方程式汇总【必修一(苏教版)】
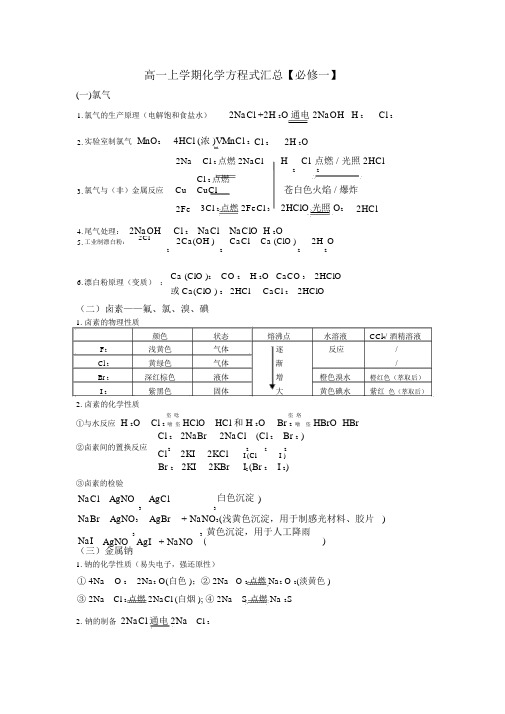
高一上学期化学方程式汇总【必修一】(一)氯气1. 氯气的生产原理(电解饱和食盐水)2NaCl +2H 2O 通电 2NaOH H 2 Cl 22. 实验室制氯气 MnO 24HCl (浓 )VMnCl 2 Cl 22H 2O2NaCl 2点燃 2NaClH2 Cl 点燃 / 光照 2HCl23. 氯气与(非)金属反应CuCl 2点燃 CuCl苍白色火焰 / 爆炸2Fe 3Cl 2点燃 2FeCl 3 2HClO 光照O 22HCl4. 尾气处理: 2NaOHCl 2 NaCl NaClO H 2O5. 工业制漂白粉: 2Cl22Ca(OH )2 CaClCa (ClO )22H O26. 漂白粉原理(变质) :Ca (ClO )2 CO 2 H 2O CaCO 3 2HClO或 Ca(ClO ) 2 2HClCaCl 22HClO(二)卤素——氟、氯、溴、碘1. 卤素的物理性质颜色状态 熔沸点水溶液 CCl 4/ 酒精溶液F 2 浅黄色 气体 逐 反应/ Cl 2 黄绿色 气体 渐/Br 2 深红棕色 液体 增 橙色溴水 橙红色(萃取后)I 2紫黑色固体大黄色碘水紫红 色(萃取后)2. 卤素的化学性质①与水反应 H 2O垐 唸HCl 和 H 2O垐 垎Cl 2 噲 垐 HClO Br 2 噲 垐 HBrO HBrCl 2 2NaBr 2NaCl (Cl 2 Br 2 ) ②卤素间的置换反应Cl 2 2KI2KCl 22 2I (ClI )Br 2 2KI2KBrI 2 (Br 2 I 2)③卤素的检验NaCl AgNOAgCl白色沉淀 )33NaBr AgNO 3AgBr+ NaNO 3(浅黄色沉淀,用于制感光材料、胶片 )NaI 3 3 ( 黄色沉淀,用于人工降雨) AgNO AgI + NaNO (三)金属钠 1. 钠的化学性质(易失电子,强还原性)① 4Na O 2 2Na 2 O(白色 );② 2Na O 2点燃 Na 2 O 2(淡黄色 )③ 2Na Cl 2点燃 2NaCl (白烟 ); ④ 2Na S 点燃 Na 2S2. 钠的制备 2NaCl 通电 2Na Cl 2① 4Na O;② Na O H O2NaOH2 2 22③ 2NaOHCO 2 2 3 H 2;3. 钠在空气中的反应Na CO O Na CO 10H O Na CO 10H )④ 风化,化学变化2 3 ? 2 2 3 2⑤2 2 2NaOH H 2 (浮、熔、游、消、变)Na 2H O①2 Na CuSO 4 2H 2O Na 2SO 4 Cu(OH )2 H 24. 钠与盐溶液反应FeCl 3 3H 2O3NaClFe(OH )33H 2②3Na5. 钠与熔融的盐反应 4NaTiCl 4700 ~ 800℃ Ti 4NaCl(四)碳酸钠的性质与应用Na 2CO 3 C a(OH )2 CaCO 3 2NaOH ; Na 2CO 3 C aCl 2 CaCO 3 2NaCl ;Na CO 3 C O 2 H 2 O 2NaHCO ;231. 一些基本反应V2NaHCOCOH O323 22 ; Na 2CO3 2HCl 2NaCl H 2O CO 2 ;NaHCO 3HClNaClH 2O CO 22.互滴法鉴别碳酸钠和碳酸氢钠Na 2CO 3 HCl (不足 ) NaHCO3NaCl ; NaHCO 3 HClNaCl H 2OCO 22NaHCO Ca(OH )CaCO2H ONa CO 2:3.碳酸氢钠与碱反应323223NaHCO Ca (OH )CaCO H O NaOH:32 32① N aCl NH 3 CO 2 H 2O NaHCO 3 NH 4Cl4.侯式制碱法②2NaHCO 3VNa 2CO 3 CO 2 H 2O(五)金属镁1. 镁的提取CaCO VCOCaO HO Ca(OH ) ;32;22MgCl 2 Ca (OH ) 2CaCl 2Mg (OH ) 2 ; Mg (OH )2 2HCl MgCl 2 H 2O;MgCl 2 ? 6H 2O HCl 气氛 MgCl 26H 2O ; MgCl 2通电 Mg Cl 2Mg O 2点燃 2MgO (黑色固体);3Mg N 2点燃 Mg 3 N (2白色固体);2. 镁的化学性质: Mg 3N 2 6H 2O Mg (OH ) 2NH 3 ;Mg CO 2点燃 2MgO C ; Mg 2H 2OVMg (OH )2H 2(六)金属铝1. 铝的提取2Al(OH) 3VAl 2 O 3 +3H 2O ; 2Al 2 O 3通电 4Al+3O 2冰晶石 NaOH 溶液CO 2Na 3AlF 6过滤熔融 铝土矿过滤 NaAlO 2Al(OH) 3 灼烧电解Al 2O 3溶液溶液Al2.铝的化学性质Al 2O 3+3H 2SO 4=Al 2 SO 4 3H 2O ; Al 2O 3+2NaOH=2NaAlO 2 H 2ONaAlO +CO 2H O=Al(OH) 3NaHCO 322AlCl +3NH 3? H O=Al(OH) 3 3NH Cl ; Al(OH) 3+3HCl=AlCl3 3H O3242Al(OH) 3+NaOH=NaAlO2 2H O ;2Al+Fe O 高温 2Fe+Al O322322Al+6H=AlCl 3+3H 2 ;2Al+2NaOH2H 2 O=2NaAlO 2+3H 23. 明矾的净水作用+3+2-3++KAl(SO 4)2 K +Al 2SO 4 和 Al 3H 2O=Al(OH) 3(胶体 )+3H(七)金属铁、铜1. 铁的冶炼(高炉炼铁)原料:(两石一炭)铁矿石、石灰石、焦炭 还原剂形成: C+O 2点燃 CO 2;CO 2+CV2CO还原铁矿石:3CO+Fe 2O 3高温 2Fe+3CO 2炉渣形成: CaCO 3 高温CaO+CO 2 ;CaO+SiO2高温CaSiO 3CaCO 3 +SiO2高温 CO 2 CaSiO 32. 铁的化学性质 3Fe+4H2O 高温 Fe O +4H2略3 4。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
苏教版《必修1》化学方程式汇总专题 1 化学家眼中的物质世界1) 2KClO 32KCl+3O 2↑ 2) 2H 2O 22H 2O+O 2↑3) 2KMnO 4K 2MnO 4+MnO 2+O 2↑4) NH 4HCO 3NH 3↑+H 2O+CO 2↑5) NH 4Cl+NaOH =NaCl+NH 3·H 2O6) (NH 4)2SO 4+2NaOH =Na 2SO 4+2NH 3·H 2O7) NH 4NO 3+NaOH =NaNO 3+NH 3·H 2O8) NH 4Cl+NaOH NaCl+NH 3↑+H 2O9) (NH 4)2SO 4+2NaOH Na 2SO 4+2NH 3↑+2H 2O 10) NH 4NO 3+NaOH NaNO 3+NH 3↑+H 2O11) NH 4Cl+AgNO 3=AgCl ↓+ NH 4NO 312) (NH 4)SO 4+BaCl 2=BaSO 4↓+2NH 4Cl专题2 从海水中获得的化学物质第一单元 氯、溴、碘及其化合物1) 2NaCl+2H 2O 2NaOH+H 2↑+Cl 2↑2) MnO 2+4HCl (浓) MnCl 2+Cl 2↑+2H 2O3) 2Fe+3Cl 2 2FeCl 3 (棕褐色的烟)4) Cu+Cl 2 CuCl 2 (棕黄色的烟)5) 2Al+3Cl 2 2AlCl 36) 2Na+Cl 2 =2NaCl (白烟)7) H 2+Cl 2 2HCl (苍白色火焰)8) Cl 2+H 2O HCl+HClO (Cl 2只有少量的与水反应,大量的Cl 2以分子形式存在于水溶液中,所以氯水呈黄绿色)9) 2HClO 2HCl+O 2↑10) Cl 2+2NaOH =NaCl+NaClO+H 2O11) 2Cl 2+2Ca(OH)2=CaCl 2+Ca(ClO)2+2H 2O (工业生产漂粉精)12) Ca(ClO)2+2HCl =CaCl 2+2HClO13) Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO14) Cl 2+2NaBr =2NaCl+Br 215) Cl 2+2KI =2KCl+I 216) Br 2+2KI =2KBr+I 217)* 2F 2+2H 2O =4HF+O 218) NaBr+AgNO 3=AgBr ↓+ NaNO 319) KI+AgNO 3=AgI ↓+ KNO 3点燃 点燃 点燃 点燃 铵离子 的检验通电 MnO 2 光照 漂白原理第二单元 钠、镁及其化合物1) 2Na+2H 2O =2NaOH+H 2↑2) 4Na+O 2=2Na 2O3) 2Na+O 2Na 2O 2 4) 2Na+Cl 2=2NaCl (白烟)5) 2Na+S =Na 2S (研磨爆炸)6) 4Na+TiCl 4 Ti+4NaCl7) 2NaCl 2Na+Cl 2↑8) Na 2O+H 2O =2NaOH9) 2Na 2O 2+2H 2O =4NaOH +O 2↑10) Na 2O+CO 2=Na 2CO 311) 2Na 2O 2+2CO 2=2Na 2CO 3+O 2↑12) Na 2CO 3+2HCl =2NaCl+H 2O+CO 2↑ 13) CaCO 3+2HCl =CaCl 2+H 2O+CO 2↑ CaCl 2或BaCl 2溶液中通入CO 2无CaCO 3或 BaCO 3沉淀生成,原因弱酸一般..不制强酸14) NaHCO 3+ HCl =NaCl+H 2O+CO 2↑(比Na 2CO 3和盐酸反应剧烈)15) 2NaHCO 3Na 2CO 3+H 2O+CO 2↑16) NaHCO 3+NaOH =Na 2CO 3+H 2O17) CO 2 +H 2O+Na 2CO 3=2NaHCO 318) CO 2+2NaOH =Na 2CO 3+H 2O 19) CH 3COOH+NaOH =CH 3COONa+H 2O20) 2CH 3COOH+Na 2CO 3=2CH 3COONa+H 2O+CO 2↑21) CH 3COOH CH 3COO -+H +常见的弱酸有H 2CO 3、H 2SO 3、HClO 、H 2S 、HF 、 CH 3COOH 、H 3PO 4(中强)、HCN (极弱)、H 2SiO 3(不溶) 常见的强酸有H 2SO 4、HNO 3、HCl 、HBr 、HI22) CaCO 3CaO+ CO 2↑23) CaO+H 2O =Ca(OH)2 24) Ca(OH)2+MgCl 2=Mg(OH)2↓+CaCl 2 25) Mg(OH)2+2HCl =MgCl 2+2H 2O 26) MgCl 2Mg+Cl 2↑27) 3Mg+N 2Mg 3N 228) 2Mg+CO 22MgO+C29)* Mg+2H 2O Mg(OH)2+H 2↑ 专题3 从矿物到基础材料第一单元 从铝土矿到铝合金 1) Al 2O 3+2NaOH =2NaAlO 2+H 2O 2) NaAlO 2+2H 2O+CO 2(过量)=Al(OH)3↓+NaHCO 3 3) 2Al(OH)3 Al 2O 3 +3H 2O 4) 2Al 2O 34Al+3O 2↑通电 从铝土矿中提取铝点燃 强酸制弱酸点燃 700~800℃ 通电 通电 点燃 高温 镁的提取5) 2Al+6HCl= 2AlCl 3+3H 2↑6) 2Al+2NaOH+2H 2O= 2NaAlO 2+3H 2↑Al 与冷的浓硫酸、冷的浓硝酸钝化 7) 2Al+Fe 2O 3 Al 2O 3+2Fe 利用铝热反应还可以把 其它过渡元素从它们的氧化物(如MnO 2、Fe 3O 4、Cr 2O 3、 V 2O 5等)中还原出来8) Al(OH)3+3HCl =AlCl 3+3H 2O9) Al(OH)3+NaOH =NaAlO 2+2H 2O 10) AlCl 3+3NaOH =Al(OH)3↓+3NaCl 11) Al(OH)3+NaOH =NaAlO 2+2H 2O 12)* AlCl 3+4NaOH (过量)=NaAlO 2+3NaCl+2H 2O 13)* 2NaAlO 2+3H 2O+CO 2(少量) =2Al(OH)3↓+ Na 2CO 314)* AlCl 3+ 3NaAlO 2+6H 2O =4Al(OH)3↓+3NaCl15) KAl(SO 4)2=K ++Al 3++2SO 42- (电离方程式)16) Al 3++3H 2O Al(OH)3(胶体)+3H + (水解方程式)第二单元 铁、铜的获取及应用1) H 2、CO 、Al 、C 都可以把铁从化合物(FeO 、Fe 3O 4、Fe 2O 3)中还原出来2) CaCO 3CaO+ CO 2↑3) SiO 2+CaO CaSiO 3 4) Fe+S FeS 5) 2Cu+S Cu 2S6) 2Fe+3Cl 22FeCl 37) Cu+Cl 2CuCl 28) FeSO 4+2NaOH=Fe(OH)2↓+Na 2SO 49)* 4Fe(OH)2+O 2+2H 2O =4Fe(OH)3白色沉淀迅速变成灰绿色最后变成红褐色10) FeCl 3+3KSCN =3KCl+Fe(SCN)3Fe 3++3SCN -=Fe(SCN)311) 2FeCl 2+Cl 2=2FeCl 312) 2FeBr 2+Br 2=2FeBr 32Fe 2++X 2=2Fe 3++2X - (X=Cl 、Br )13)* 2Fe 3++2I -=2Fe 2++I 2 (离子方程式)14) 2FeCl 3+Fe =2FeCl 315) 2FeCl 3+Cu =2FeCl 2+CuCl 2Al 是两性元素高温 高温高温 炼铁中的造渣反应点燃 点燃 AlCl 3中逐滴加入NaOH 溶液至过量Al(OH)3是两性元素第三单元 含硅矿物与信息材料1) Na 2SiO 3+2HCl =2NaCl+H 2SiO 3↓ 2) Na 2SiO 3+CO 2+H 2O =Na 2CO 3+H 2SiO 3↓ 3) 2NaOH+H 2SiO 3=Na 2SiO 3+2H 2O4) H 2SiO 3SiO 2+H 2O (SiO 2与水不反应)5) SiO 2+CaO CaSiO 36) SiO 2+2NaOH =Na 2SiO 3+H 2O7) SiO 2+4HF =SiF 4↑+2H 2O (用于雕刻玻璃)氢氟酸与玻璃反应因此氢氟酸保存在塑料瓶中8)* SiO 2+CaCO 3CaSiO 3+CO 2↑9)* SiO 2+ Na 2CO 3Na 2SiO 3+CO 2↑10) SiO 2+2C Si+2CO ↑ (工业制粗硅)11) Si+2Cl 2SiCl 4 12) SiCl 4+2H 2Si+4HCl 13) Si+2NaOH+H 2O =Na 2SiO 3+2H 2↑14)* Si+4HF =SiF 4↑+2H 2↑15) Si+O 2SiO 2 专题4 硫、氮和可持续发展 第一单元 含硫化合物的性质和应用1) SO 2+H 2O H 2SO 32) SO 2+2NaOH =Na 2SO 3+H 2O3) 2SO 2+O 22SO 34) SO 3+H 2O =H 2SO 45)* SO 2+X 2+2H 2O =H 2SO 4+2HX (X=Cl 、Br 、I )6)* Na 2SO 3+H 2SO 4(浓)=Na 2SO 4+H 2O+SO 2↑(实验室制取SO 2)7) 2H 2SO 3+O 2=2H 2SO 4 (亚硫酸变质)8) 2Na 2SO 3+O 2=2Na 2SO 4 (Na 2SO 3溶液变质)9) 2CaSO 3+O 2=2CaSO 410)* SO 2+2NaHCO 3=Na 2SO 3+ H 2O +2CO 2(除CO 2中SO 2用饱和的NaHCO 3溶液)11) Na 2SO 3+BaCl 2=BaSO 3↓+2NaCl 12) Na 2SO 3+2HCl =2NaCl+H 2O+SO 2↑13) NaHSO 3+HCl =NaCl+H 2O+SO 2↑14) Cu+2H 2SO 4(浓)CuSO 4+ SO 2↑+2H 2O15) C+2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O16)* 4FeS 2+11O 22Fe 2O 3+ 8SO 2↑17)* H 2S + H 2SO 4(浓)=S ↓+SO 2↑+ 2H 2O18)* 2H 2S +SO 2=3S + 2H 2O (若在溶液中进行的S 打↓)19) FeS+H 2SO 4(稀)=FeSO 4+H 2S ↑(实验室制取H 2S 用稀硫酸或稀盐酸)20) FeS+2HCl (稀)=FeCl 2+H 2S ↑21) S+ H 2 H 2SSi 不与硫酸、硝酸反应,SiO 2不与酸(除氢氟酸)反应 强酸制弱酸高温 粗硅的提纯高温 高温催化剂高温 高温 高温22) S+ Fe FeS23) S+ 2Cu Cu 2S24) S+ Hg =HgS25)* 3S+6KOH 2K 2S+K 2SO 3+3H 2O第二单元 生产生活中的含氮化合物1) N 2 + 3 H 2 2NH 3 (工业合成氨)2) N 2+O 22NO3) 2NO+O 2=2NO 2 (红棕色气体)4) 3NO 2+H 2O =2HNO 3+NO5) NH 3+H 2O NH 3·H 2O(大量NH 3已转化为一水合氨,一水合氨只有少量电离)6) NH 3+HCl =NH 4Cl (大量白烟)7) 4NH 3+ 5O 24NO+6H 2O (氨的催化氧化,工业制硝酸的基础)8) NH 3·H 2O NH 3↑+H 2O9) NH 3·H 2O+HCl =NH 4Cl+H 2O10) 2NH 3·H 2O+H 2SO 4=(NH 4)2SO 4+2H 2O 11) NH 3·H 2O+HNO 3=NH 4NO 3+H 2O 12) 2NH 3·H 2O+MgCl 2=Mg(OH)2↓+2NH 4Cl 13) 3NH 3·H 2O+AlCl 3=Al(OH)3↓+3NH 4ClAlCl 3溶液中滴入过量的氨水白色沉淀不溶解14) NH 4Cl NH 3↑+HCl ↑15) (NH 4)2CO 32NH 3↑+H 2O+CO 2↑16) 2NH 4Cl+Ca(OH)2CaCl 2+2NH 3↑+H 2O(实验室制氨气)NH 3与CaCl 2、CuSO 4、浓硫酸都反应,所以干燥NH 3不用CaCl 2、CuSO 4、浓硫酸而用碱石灰17) NH 4NO 3+NaOH =NaNO 3+NH 3·H 2O18) 4HNO 3 4NO 2↑+O 2↑+2H 2O19) Cu+4HNO 3(浓)=Cu(NO 3)2+2NO 2↑+2H 2O 20) 3Cu+8HNO 3(稀)=3Cu(NO 3)2+2NO↑+4H 2O Fe 、Al 遇冷的浓硝酸、或冷的浓硫酸钝化21) C+4HNO 3(浓)=4NO 2↑+CO 2↑+2H 2O22) HNO 3(常见强氧化剂)与某些还原性物质[如H 2S 、BaSO 3、HI 、HBr 、Fe 2+、S 2-、SO 32-、 I -、Br -(常见强还原剂)等] 发生氧化还原反应 高温、高压催化剂 放电碱的通性催化剂 光照。
