2012福建高考化学考试说明
福建高考理综化学试题详解与评析

C.片刻后甲池中c(SO42—)增大D.片刻后可观察到滤纸b点变红色9、解析:选A,Zn作原电池的负极,Cu作原电池的正极,Cu电极是发生还原反应。
B选项貌似正确,迷惑学生。
电子流向是负极到正极,但a→b这一环节是在溶液中导电,是离子导电,电子并没沿此路径流动。
C选项中硫酸根离子浓度基本保持不变。
D选项中是滤纸a点是阴极,氢离子放电,溶液中氢氧根暂时剩余,显碱性变红色。
这题是考查学生的电化学知识,装置图设计有些复杂,B 选项干扰作用明显,设问巧妙。
10.下列说法正确的是A.0.5molO3与11.2LO2所含的分子数一定相等B.25℃与60℃时,水的pH相等C.中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)相等D.2SO2(g)+O2(g)=2SO3(g)和4SO2(g)+2O2(g)=4SO3(g)的△H相等10、解析:选C,A选项中没有指明标况下,11.2L氧气不一定是0.5mol。
B选项中,水的电离受到温度的影响,温度不同,水电离的氢离子浓度不同,pH也不同。
D选项中△H数值是与方程式中化学计量数有关。
这题考查知识比较基础简单,但知识覆盖面比较广。
11.下列物质与水作用形成的溶液能与NH4Cl反应生成NH3的是A.二氧化氮B.钠C.硫酸镁D.二氧化硅11、解析:选B,钠与水作用得到氢氧化钠溶液,与氯化铵反应放出氨气。
其它选项不正确。
这题考查元素化合物知识,比较简单明了,基础题。
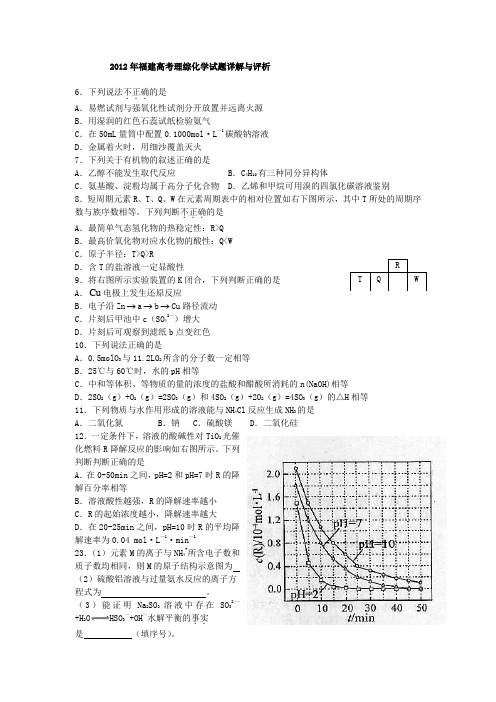
12.一定条件下,溶液的酸碱性对TiO2光催化燃料R降解反应的影响如右图所示。
下列判断判断正确的是A.在0-50min之间,pH=2和pH=7时R的降解百分率相等B.溶液酸性越强,R的降解速率越小C.R的起始浓度越小,降解速率越大D.在20-25min之间,pH=10时R的平均降解速率为0.04 mol·L—1·min—112、解析:选A,从图像中可以读出pH=2时,曲线下降是最快的,说明溶液的酸性越强,降解速率越大,所以B项错误。
2012年福建省高考考试说明(化学实验部分节选)

2012年福建省高考考试说明(化学实验部分节选)(三)考试范围和内容5.化学实验基础(1)实验要求①了解化学实验是科学探究过程中的一种重要方法。
②了解化学实验室常用仪器的主要用途和使用方法。
③掌握化学实验的基本操作。
能识别化学品安全使用标识,了解实验室一般事故的预防和处理方法。
④掌握常见气体的实验室制法(包括所用试剂、仪器,反应原理和收集方法)。
⑤了解常见离子的检验方法,能对常见的物质进行检验、分离和提纯。
⑥能根据要求配制一定溶质质量分数、物质的量浓度的溶液。
了解测定溶液pH 的方法。
⑦能根据实验试题要求,做到:ⅰ.设计、评价或改进实验方案;ⅱ.了解控制实验条件的方法;ⅲ.分析或处理实验数据,得出合理结论;ⅳ.识别典型的实验仪器装置图。
⑧以上各部分知识与技能的综合运用。
(2)实验内容化学11.萃取与分液2. 离子的检验(Cl-、Ag+、SO42-、CO32-、NH4+、Fe3+)3. 配制一定物质的量浓度的溶液4. 钠的性质5. 氢氧化铝的两性6. 铁及其化合物间的转化7. 碳酸钠与碳酸氢钠的性质8. 氨及铵盐的性质9. 二氧化硫和浓硫酸的性质。
化学210.探究钠、镁、铝单质的金属性强弱11. 影响化学反应速率的因素12. 化学反应中的热量变化13. 原电池的工作原理14. 乙醇的主要性质15. 乙酸乙酯的制取和乙酸乙酯(或油脂)的水解16. 葡萄糖与新制氢氧化铜的反应化学反应原理17.电解池工作原理18. 温度、浓度、催化剂对化学反应速率的影响19. 浓度、温度对化学平衡的影响20. 中和滴定21. 氯化铁(或氯化亚锡)水解的促进或抑制22. 沉淀的转化。
2012年福建高考理综化学部分解析

2012年高考福建卷理综化学详解与评析6、下列说法不正确的是不正确的是()A.易燃试剂与强氧化性试剂分开放置并远离火源B.用湿润的红色试纸检验氨气C.在50ml的量筒中配置0.1000mol/L碳酸钠溶液D.金属钠着火时,用细沙覆盖灭火【解析】答案:C由于量筒的精确度只到0.1ml,配出来的溶液只能精确到0.1mol/L,所以C不正确。
这题属于实验化学,常识题。
7、下列关于有机物的叙述正确的是()A.乙醇不能发生取代反应B.C4H10有三种同分异构体C.氨基酸、淀粉属于高分子化合物D.乙烯和甲烷可以用溴的四氯化碳溶液检验【解析】答案:D由于乙烯能使溴的四氯化碳溶液褪色而甲烷不能,B项正确;乙醇能与金属钠发生取代反应,乙醇和乙酸的酯化反应也是属于取代反应,A错误;C4H10比只有两种同分异构体,C错误。
氨基酸不是高分子化合物,D错误。
这题是有机基础题。
8、短周期元素R、T、Q、W在元素周期表中的相对位置如右图所示,其中T所属的周期序数与族序数相等。
下列判断不正确的是()A.最简单的气态氢化物的热稳定性:R>QB.最高级氧化物对应水化物的酸性:Q<WC.原子半径:T>Q>R+D.含T的盐溶液一定显酸性【解析】答案:B通过题干信息:T所属的周期序数与族序数相等,可以判断出T是Al,从而推出Q是Si、W是S,R是N。
最简单的气态氢化物的热稳定性:NH3>SiH4-,A正确;最高价氧化物对应水化物的酸性:H2SiO3<H2SO4,B正确;原子半径:Al>Si>N,C正确;含Al的盐溶液中,虽然由于铝离子会水解呈酸性,但若酸根离子的水解程度更大,根据谁强显谁性的规律,该盐溶液也可能显碱性,D错误。
这题的A、B、C三个选项是必修2专题1的元素周期律的内容,D选项考察了学生对水解的理解。
难度中下。
9、将右图所示实验装置的K闭合,下列判断正确的是()A.Cu电极上发生还原反应B.电子沿Zn a b Cu路径流动C.片刻后甲池中C(SO42-)增大D.片刻后观察到滤纸b变红色【解析】答案:A甲和乙构成原电池,滤纸是电解池。
2012年福建高考理综化学试题及答案解析
2012年福建高考理综化学试题详解与评析6.下列说法不正确...的是A.易燃试剂与强氧化性试剂分开放置并远离火源B.用湿润的红色石蕊试纸检验氨气C.在50mL量筒中配置0.1000mol·L—1碳酸钠溶液D.金属着火时,用细沙覆盖灭火7.下列关于有机物的叙述正确的是A.乙醇不能发生取代反应 B.C4H10有三种同分异构体C.氨基酸、淀粉均属于高分子化合物 D.乙烯和甲烷可用溴的四氯化碳溶液鉴别8.短周期元素R、T、Q、W在元素周期表中的相对位置如右下图所示,其中T所处的周期序数与族序数相等。
下列判断不正确...的是A.最简单气态氢化物的热稳定性:R>QB.最高价氧化物对应水化物的酸性:Q<WC.原子半径:T>Q>RD.含T的盐溶液一定显酸性9.将右图所示实验装置的K闭合,下列判断正确的是A.Cu电极上发生还原反应B.电子沿Zn→a→b→Cu路径流动C.片刻后甲池中c(SO42—)增大D.片刻后可观察到滤纸b点变红色10.下列说法正确的是A.0.5molO3与11.2LO2所含的分子数一定相等B.25℃与60℃时,水的pH相等C.中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)相等D.2SO2(g)+O2(g)=2SO3(g)和4SO2(g)+2O2(g)=4SO3(g)的△H相等11.下列物质与水作用形成的溶液能与NH4Cl反应生成NH3的是A.二氧化氮 B.钠 C.硫酸镁 D.二氧化硅12.一定条件下,溶液的酸碱性对TiO2光催化燃料R降解反应的影响如右图所示。
下列判断判断正确的是A.在0-50min之间,pH=2和pH=7时R的降解百分率相等B.溶液酸性越强,R的降解速率越小C.R的起始浓度越小,降解速率越大D.在20-25min之间,pH=10时R的平均降解速率为0.04 mol·L—1·min—123.(1)元素M的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为(2)硫酸铝溶液与过量氨水反应的离子方程式为。
2012年福建高考理综化学部分解析

2012年高考福建卷理综化学详解与评析6、下列说法不正确的是不正确...的是()A.易燃试剂与强氧化性试剂分开放置并远离火源B.用湿润的红色试纸检验氨气C.在50ml的量筒中配置0.1000mol/L碳酸钠溶液D.金属钠着火时,用细沙覆盖灭火【解析】答案:C由于量筒的精确度只到0.1ml,配出来的溶液只能精确到0.1mol/L,所以C 不正确。
这题属于实验化学,常识题。
7、下列关于有机物的叙述正确的是()A.乙醇不能发生取代反应B.C4H10有三种同分异构体C.氨基酸、淀粉属于高分子化合物D.乙烯和甲烷可以用溴的四氯化碳溶液检验【解析】答案:D由于乙烯能使溴的四氯化碳溶液褪色而甲烷不能,B项正确;乙醇能与金属钠发生取代反应,乙醇和乙酸的酯化反应也是属于取代反应,A错误;C4H10比只有两种同分异构体,C错误。
氨基酸不是高分子化合物,D错误。
这题是有机基础题。
8、短周期元素R、T、Q、W在元素周期表中的相对位置如右图所示,其中T所属的周期序数与族序数相等。
下列判断不正..确.的是()A.最简单的气态氢化物的热稳定性:R>QB.最高级氧化物对应水化物的酸性:Q<WC.原子半径:T>Q>R+D.含T的盐溶液一定显酸性【解析】答案:B通过题干信息:T所属的周期序数与族序数相等,可以判断出T是Al,从而推出Q是Si、W是S,R是N。
最简单的气态氢化物的热稳定性:NH3>SiH4,A正确;最高价氧化物对应水化物的酸性:H2SiO3<H2SO4,B正确;原子半径:Al>Si>N,C正确;含Al的盐溶液中,虽然由于铝离子会水解呈酸性,但若酸根离子的水解程度更大,根据谁强显谁性的规律,该盐溶液也可能显碱性,D错误。
这题的A、B、C三个选项是必修2专题1的元素周期律的内容,D选项考察了学生对水解的理解。
难度中下。
9、将右图所示实验装置的K闭合,下列判断正确的是()A.Cu电极上发生还原反应B.电子沿Zn a b Cu路径流动C.片刻后甲池中C(SO42-)增大D.片刻后观察到滤纸b变红色【解析】答案:A甲和乙构成原电池,滤纸是电解池。
福建省2012年高考理综考试说明

福建省2012年高考理综考试说明福建省2012年高考理综考试说明出炉,2012年福建高考注重体现高中新课程理念,坚持能力立意,突出主干知识,体现学科能力和素质要求;加强试题与社会实际、科技发展和学生生活的联系,重视对学生创新意识和实践能力的培养。
●理综5道选考题选3题作答理科综合关注科学与技术、经济、社会的联系,关注学科知识在生产、生活、科技中的应用,关注自然、社会与学科发展相关的热点问题,体现可持续发展要求。
设置选考内容,不同选考模块试题之间应有相当的难度值,体现公平性。
考试范围:生物考试范围分为必考部分和选考部分。
必考内容在生物1“分子与细胞”、生物2“遗传与进化”和生物3“稳态与环境”三个必修模块的范围内;选考内容在选修3“现代生物科技专题”模块的范围内。
化学考试范围分为必考内容和选考内容。
必考内容涵盖必修模块化学1、化学2和选修模块“化学反应原理”的内容。
其中,必考内容包括化学科学特点和化学研究基本方法、化学基本概念和基本理论、常见无机物及其应用、常见有机物及其应用和化学实验基础等五个方面;选考内容涵盖选修模块“物质结构与性质”“有机化学基础”的内容,考生从中任选一个模块考试。
物理分为必考内容和选考内容。
必考内容包括:物理1的质点的直线运动、相互作用与牛顿运动定律;物理2的机械能、抛体运动与圆周运动、万有引力定律;选修3-1的电场、电路、磁场;选修3-2的电磁感应、交变电流;选修3-4的机械振动与机械波、电磁振荡与电磁波、光、相对论。
选考内容包括:选修3-3的分子动理论与统计观点、固体、液体与气体、热力学定律与能量守恒;选修3-5的碰撞与动量守恒、原子结构、原子核、波粒二象性。
试卷结构:理科综合试卷满分300分,全卷难度值为0.6左右,其中必考题共27题,共265分;选考题共5题,考生作答3题,共35分。
物理试题总分120分,选考内容占10%;化学试题总分100分,选考内容占13%;生物试题总分80分,选考内容约占12%。
2012福建省高考试卷含解析最新版本图文

1、填入下面一段文字横线处的语句,最恰当的一句是(3分)辣,我们都不陌生,很多人无辣不欢甚至吃辣上瘾,这是因为辣椒素等辣味物质刺激舌头、口腔的神经末梢时,会在大脑中形成类似灼烧的感觉,机体就反射性地出现心跳加速、唾液及汗液分泌增多等现象,,内啡肽又促进多巴胺的分泌,多巴胺能在短时间内令人高度兴奋,带来“辣椒素快感”,慢慢地我们吃辣就上瘾了。
A.大脑在这些兴奋性的刺激下把内啡肽释放出来B.内啡肽因这些兴奋性的刺激而被大脑释放出来C.这些兴奋性的刺激使大脑释放出内啡肽D.这些兴奋性的刺激使大脑把内啡肽释放出来2、下列各项中,没有语病的一项是A.2015年3月1日正式实施了《湖北省全民阅读促进办法》,是我国首部关于全民阅读的地方政府规章,普通人的阅读权益因此获得了法律保障。
B.近年来,生态保护意识渐入人心,所以当社会经济发展与林地保护管理发生冲突时,一些地方在权衡之后往往会选择前者。
C.2014年底,我国探月工程三期“再入返回飞行”试验获得成功,确保嫦娥五号任务顺利实施和探月工程持续推进奠定坚实基础。
D.对血液和血液制品进行严格的艾滋病病毒抗体检测,确保用血安全,是防止艾滋病通过采血与供血途径传播的关键措施。
3、下面的文字有一处语病,请写出序号并加以修改。
(3分)①某科学研究所后院有座坟,②坟前竖着一块纪念碑,③碑上用中英文镌刻着“谨纪念为生命科学研究而献身的实验动物”的铭文。
④善待实验动物的尊严,是科学工作者的责任。
(1)有语病的一处的序号:(1分)(2)修改:。
(2分)4、说着,进入石洞来,只见佳木茏葱,奇花熌灼,一带清流,从花木深处曲折泻于石隙之下。
,皆隐于山坳树影之间。
俯而视之,则清溪泻雪,石磴穿云,白石为栏,环抱为沿,石桥三港,兽面衔吐。
桥上有亭。
3.语段中加点的字,读音全都正确的一组是A.熌灼shuò曲折q? 山坳ào 石磴chãngB.熌灼shuò曲折qū山坳yòu 石磴dângC.熌灼zhuó曲折q? 山坳yòu 石磴chãngD.熌灼zhuó曲折qū山坳ào 石磴dâng4.下列语句填入语段中画横线处,衔接最恰当的一项是A.再进数步,渐向北边,两边飞楼插空,平坦宽豁,雕甍绣槛B.渐向北边,再进数步,雕甍绣槛,两边飞楼插空,平坦宽豁C.再进数步,渐向北边,平坦宽豁,两边飞楼插空,雕甍绣槛D.渐向北边,雕甍绣槛,再进数步,平坦宽豁,两边飞楼插空5、下列词语中,字形和加点字的读音全都正确的一组是A.亲和力声名鹊起闹别(biâ)扭称(chēng)心如意B.倒胃口皇天后土瞭(liǎo)望哨金蝉脱壳(qiào)C.哈蜜瓜明眸皓齿撑(chēng)场面姹(chà)紫嫣红D.敞篷车异彩纷呈差(chà)不多白雪皑皑(ái)6、下列各句中加点词语的使用,不恰当的一项是A.“2015年度中国文化跨界论坛”日前在北京举行,届时来自世界各国的艺术家、企业家和媒体人围绕当前文化创意产业发展中的热点进行了交流。
2012年高考(福建)化学学科试卷说明 - 福建省同安第一中学

2012年高考(福建)生物学科试卷说明生物学科命题组2012年福建省高考生物试题严格遵循全国《考试大纲》和福建省《考试说明》的要求,按照既有利于高等学校选拔人才,又有利于中学实施素质教育的原则,结合我省普通高中新课程教学的实际情况进行命制。
试题以能力测试为主导,重视生物科学素养的考查,试题全部为原创,不超纲,选材公平、公正,体现了公平性、科学性和规范性。
试卷关注科学、技术、社会之间的联系,充分体现新课程理念。
整体难度力争达到《考试说明》设定的目标,并有较好的区分度。
一、以能力立意为主导,强调实验与理解能力的考查命题以能力立意为主导,能力考查涵盖了《考试说明》规定的四项能力。
在各项能力中,特别突出实验能力和理解能力的考查。
涉及实验能力考查的试题(第2、3、26题)总分值高达40分。
如第26题侧重考查考生的实验与探究能力,要求考生能灵活运用生物实验教学中获得的原理、方法和相关的理论知识,针对实际问题开展初步探究。
第26题中还设置了对《考试说明》要求的必做实验中具体的操作方法的考查,要求考生具备一定的实验经历,有利于引导中学开好课堂实验教学。
试题第1、3、4、5、26、27、32题从不同角度考查《考试说明》所规定理解能力。
如试题第1、26-Ⅱ、32题侧重考查“形成知识的网络结构”的能力;第3、26-Ⅰ侧重考查“以图表形式描述生物学方面的内容”的能力;第4、5、27题较深入考查考生“能运用所学知识对生物学问题进行解释、推理”的能力。
二、注重理论联系实际,体现科技和社会的联系试题注重理论联系实际,高度关注现代科技发展对人类生活的影响。
如第5题以“双脱氧核苷酸在DNA测序中的应用”为背景,将对“DNA结构和复制”等核心知识和能力的考查与现代科技进展有机结合;第32题则突出了“基因工程技术在医疗领域中的应用”。
试题还注重与生产实践,将基础知识与基本技能置于真实问题情景中进行考查。
如试题涉及豌豆栽培、茶园群落构建、海水鱼类养殖等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2012年福建省高考考试说明(化学)化学科考试以化学学习能力测试为主导,在测试考生进一步学习所必需的知识、技能和方法的基础上,全面检测考生的化学科学素养。
命题还应重视理论联系实际,关注与化学有关的科学技术、社会经济和生态环境的协调发展,以促进学生在知识与技能、过程与方法、情感态度与价值观等方面的全面发展。
(一)对化学学习能力的要求1.接受、吸收、整合化学信息的能力(1)能够对中学化学基础知识融会贯通,有正确复述、再现、辨认的能力。
(2)能够通过对实际事物、实验现象、实物、模型、图形、图表的观察,以及对自然界、社会、生产、生活中的化学现象的观察,获取有关的感性知识和印象,并进行初步加工、吸收、有序存储的能力。
(3)能够从试题提供的新信息中,准确地提取实质性内容,并经与已有知识块整合,重组为新知识块的能力。
2.分析问题和解决(解答)化学问题的能力(1)能够将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题的能力。
(2)能够将分析解决问题的过程和成果,用正确的化学术语及文字、图表、模型、图形等表达,并做出解释的能力。
3.化学实验与探究能力(1)了解并初步实践化学实验研究的一般过程,掌握化学实验的基本方法和技能。
(2)在解决简单化学问题的过程中,运用科学的方法,初步了解化学变化规律,并对化学现象提出科学、合理的解释。
(二)对知识内容的要求层次为了便于考查,将高考化学命题对各部分知识内容要求的程度,由低到高分为了解、理解(掌握)、综合应用三个层次,高层次的要求包含低层次的要求。
其含义分别为:了解:对化学知识有初步认识,能够正确复述、再现、辨认或直接使用。
理解(掌握):领会所学化学知识的含义及其适用条件,能够正确判断、解释和说明有关化学现象和问题,即不仅“知其然”,还能“知其所以然”。
综合应用:在理解所学各部分化学知识的本质区别与内在联系的基础上,运用所掌握的知识进行必要的分析、类推或计算,解释、论证一些具体化学问题。
(三)考试范围和内容根据普通高等学校对新生科学素养的要求,按照既保证与全国普通高校招生统一考试的要求基本一致,又有利于我省实施普通高中化学课程标准的原则,依据《普通高中化学课程标准(实验)》、《普通高等学校招生全国统一考试大纲(课程标准实验版)》、《福建省普通高中新课程选修I课程开设指导意见(试行)》和《福建省普通高中新课程教学要求(试行)》(化学),将我省高考化学科考试范围分为必考内容和选考内容。
必考内容必考内容涵盖必修模块“化学1”、“化学2”和选修模块“化学反应原理”的内容。
根据化学的学科体系和学科特点,必考内容包括:化学科学特点和化学研究基本方法、化学基本概念和基本理论、常见无机物及其应用、常见有机物及其应用和化学实验基础等五个方面。
1.化学科学特点和化学研究基本方法(1)了解化学的主要特点是在原子、分子水平上认识物质。
了解化学可以识别、改变和创造分子。
(2)了解科学探究的基本过程,学习运用以实验和推理为基础的科学探究方法。
(3)了解物质的组成、结构和性质的关系。
了解化学反应的本质、基本原理以及能量变化等规律。
(4)了解定量研究的方法是化学发展为一门科学的重要标志。
了解物质的量在定量研究中的重要作用。
(5)了解科学、技术、社会的相互关系(如化学与生活、材料、能源、环境、生命过程、信息技术的关系等)。
了解在化工生产中遵循“绿色化学”思想的重要性。
2.化学基本概念和基本理论(1)物质的组成、性质和分类①了解分子、原子、离子等概念的含义。
了解原子团的定义。
②理解物理变化与化学变化的区别与联系。
③理解混合物和纯净物、单质和化合物、金属和非金属的概念。
④理解酸、碱、盐、氧化物的概念及其相互联系。
(2)化学用语及常用计量①熟记并正确书写常见元素的名称、符号、离子符号。
②熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),或根据化学式判断化合价。
③了解原子结构示意图(1~18号元素)、分子式、结构式和结构简式的表示方法。
④了解相对原子质量、相对分子质量的定义,并能进行有关计算。
⑤理解质量守恒定律的含义。
⑥能正确书写化学方程式和离子方程式,并能进行有关计算。
⑦了解物质的量的单位——摩尔(mol)、摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗常数的含义,并能进行有关物质的量的计算(混合气体的平均相对分子质量的相关计算不作要求)。
(3)溶液①了解溶液的含义。
②了解溶解度、饱和溶液的概念。
③了解溶液的组成。
理解溶液中溶质的质量分数的概念,并能进行有关计算。
④了解胶体是一种常见的分散系。
了解丁达尔现象。
(4)物质结构和元素周期律①了解元素、核素和同位素的含义。
②了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
③了解原子核外电子排布规律的初步知识。
④掌握元素周期律的实质。
了解元素周期表(长式)的结构(周期、族)及其应用。
⑤以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
⑥以IA和VIIA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
⑦了解金属、非金属在元素周期表中的位置及其与性质的规律。
⑧了解化学键的定义。
了解离子键、共价键的形成。
(5)化学反应与能量①了解氧化还原反应的本质。
了解常见的氧化还原反应。
②了解化学反应中能量转化的原因,能说出常见的能量转化形式。
③了解化学能与热能的相互转化。
了解吸热反应、放热反应、反应热等概念。
④了解热化学方程式的含义,能正确书写热化学方程式,能用盖斯定律进行有关反应热的简单计算。
⑤了解能源是人类生存和社会发展的重要基础。
了解化学在解决能源危机中的重要作用。
⑥了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
了解常见化学电源的种类及其工作原理。
⑦理解金属发生电化学腐蚀的原因,了解金属腐蚀的危害和防止金属腐蚀的措施。
(6)化学反应速率和化学平衡①了解化学反应速率的概念、反应速率的定量表示方法。
②了解催化剂在生产、生活和科学研究领域中的重大作用。
③了解化学反应的可逆性。
④了解化学平衡建立的过程。
了解化学平衡常数的含义,能够利用化学平衡常数计算反应物的转化率。
⑤理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识其一般规律。
⑥了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。
(7)电解质溶液①了解电解质的概念、强电解质和弱电解质的概念。
②了解电解质在水溶液中的电离,以及电解质溶液的导电性。
③了解弱电解质在水溶液中的电离平衡。
④了解水的电离和水的离子积常数。
⑤了解溶液pH的定义。
能进行pH的简单计算。
⑥了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用(弱酸弱碱盐的水解不作要求)。
⑦了解离子反应的概念、离子反应发生的条件。
⑧了解难溶电解质的沉淀溶解平衡及沉淀转化的实质。
(8)以上各部分知识的综合应用。
3.常见无机物及其应用。
(1)常见金属元素(如Na、Al、Fe、Cu等)①了解常见金属的活动顺序。
②了解常见金属及其重要化合物的主要性质及其应用。
③了解合金的概念及其重要应用。
(2)常见非金属元素(如H、C、N、O、Si、S、Cl等)①了解常见非金属单质及其重要化合物的主要性质及应用。
②了解常见非金属单质及其重要化合物对环境质量的影响。
(3)以海水的综合利用为例,认识化学在自然资源综合利用方面的重要价值。
(4)以上各部分知识的综合应用。
4.常见有机物及其应用(1)了解有机化合物中碳的成键特征。
了解有机化合物的同分异构现象。
(2)了解甲烷、乙烯、苯等有机化合物的主要性质。
(3)了解乙烯、氯乙烯、苯的衍生物等在化工生产中的重要作用。
(4)了解乙醇、乙酸的组成和主要性质及重要应用。
(5)了解上述有机化合物发生反应的类型。
(6)了解糖类、油脂、蛋白质的组成和主要性质及重要应用。
(7)了解常见高分子材料的合成反应及重要应用(缩聚反应不作要求)。
(8)以上各部分知识的综合运用。
5.化学实验基础(1)实验要求①了解化学实验是科学探究过程中的一种重要方法。
②了解化学实验室常用仪器的主要用途和使用方法。
③掌握化学实验的基本操作。
能识别化学品安全使用标识,了解实验室一般事故的预防和处理方法。
④掌握常见气体的实验室制法(包括所用试剂、仪器,反应原理和收集方法)。
⑤了解常见离子的检验方法,能对常见的物质进行检验、分离和提纯。
⑥能根据要求配制一定溶质质量分数、物质的量浓度的溶液。
了解测定溶液pH的方法。
⑦能根据实验试题要求,做到:ⅰ.设计、评价或改进实验方案;ⅱ.了解控制实验条件的方法;ⅲ.分析或处理实验数据,得出合理结论;ⅳ.识别典型的实验仪器装置图。
⑧以上各部分知识与技能的综合运用。
(2)实验内容选考内容选考内容涵盖选修模块“物质结构与性质”、“有机化学基础”的内容,考生从中任选一个模块考试。
“物质结构与性质”1.原子结构与元素的性质(1)了解原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。
了解原子核外电子的运动状态。
(2)了解元素电离能的含义,并能用以说明元素的某些性质(如原子或离子失去电子难易、解释某些元素的主要化合价等)。
(3)了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。
(4)了解电负性的概念,了解元素的性质与电负性的关系。
2.化学键与物质的性质(1)理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。
(2)了解共价键的主要类型σ键和π键,能用键能、键长、键角等说明简单分子的某些性质(如反应热、分子的稳定性等)。
(3)了解简单配合物的成键情况。
(4)了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
(5)了解金属键的含义,能用金属键理论解释金属的一些物理性质。
(6)了解杂化轨道理论及常见的杂化轨道类型(SP,SP2,SP3),能用杂化轨道理论结石常见的简单分子或离子的空间结构。
3.分子间作用力与物质的性质(1)了解化学键和分子间作用力的区别。
(2)了解氢键的存在对物质性质的影响。
(3)了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。
“有机化学基础”1.有机化合物的组成与结构(1)能根据有机化合物的元素含量、相对分子质量确定有机化合物的分子式。
(2)了解常见有机化合物的结构。
了解有机物分子中的官能团,能正确地表示它们的结构。
(3)了解确定有机化合物结构的化学方法,知道某些物理方法(如红外光谱、核磁共振氢谱)可以确定有机化合物的结构。
(4)了解有机化合物存在异构现象,能判断简单有机化合物的同分异构体(不包括立体异构体)。
(5)能根据有机化合物命名规则命名简单的有机化合物(简单的烷烃、烯烃、炔烃和苯的同系物)。
