高三化学复习:常 见 防 倒 吸 装 置
高三化学专题复习常用仪器使用与试剂保存及化学实验安全

高三化学专题复习常用仪器使用与试剂保存及化学实验安全新考纲测试目标和能力要求1.了解化学实验室常用仪器的主要用途和使用方法。
2.能识别化学品安全使用标识,了解实验室一般事故的预防和处理方法。
知识体系和复习重点一、常用仪器1、中学化学常见化学仪器的识别:2、基本化学仪器及其使用1.能加热的仪器(l)试管:用来盛放少量药品、常温或加热情况下进行少量试剂反应的容器,可用于制取或收集少量气体。
使用注意事项:①可直接加热,用试管夹夹在距试管口 1/3处。
②放在试管内的液体,不加热时不超过试管容积的l/2,加热时不超过l/3。
③加热后不能骤冷,防止炸裂。
④加热时试管口不应对着任何人;给固体加热时,试管要横放,管口略向下倾斜。
(2)烧杯:用作配制溶液和较大量试剂的反应容器,在常温或加热时使用。
使用注意事项:①加热时应放置在石棉网上,使受热均匀。
②溶解物质用玻璃棒搅拌时,不能触及杯壁或杯底。
(3)烧瓶:用于试剂量较大而又有液体物质参加反应的容器,可分为圆底烧瓶、平底烧瓶和蒸馏烧瓶。
它们都可用于装配气体发生装置。
蒸馏烧瓶用于蒸馏以分离互溶的沸点不同的物质。
使用注意事项:①圆底烧瓶和蒸馏烧瓶可用于加热,加热时要垫石棉网,也可用于其他热浴(如水浴加热等)。
②液体加入量不要超过烧瓶容积的1/2。
(4)蒸发皿:用于蒸发液体或浓缩溶液。
使用注意事项:①可直接加热,但不能骤冷。
②盛液量不应超过蒸发皿容积的2/3。
③取、放蒸发皿应使用坩埚钳。
(5)坩埚:主要用于固体物质的高温灼烧。
使用注意事项:①把坩埚放在三脚架上的泥三角上直接加热。
②取、放坩埚时应用坩埚钳。
(6)酒精灯化学实验时常用的加热热源。
使用注意事项:①酒精灯的灯芯要平整。
②添加酒精时,不超过酒精灯容积的2/3;酒精不少于l/4。
③绝对禁止向燃着的酒精灯里添加酒精,以免失火。
④绝对禁止用酒精灯引燃另一只酒精灯。
⑤用完酒精灯,必须用灯帽盖灭,不可用嘴去吹。
⑥不要碰倒酒精灯,万一洒出的酒精在桌上燃烧起来,应立即用湿布扑盖。
高三化学一轮复习——常见气体的制备

B.ADG D.BCF
有机物制备
气体连接
利用如图所示装置进行下列实验,能得到相应实验结论的是
选项 ①
②
③
A 浓硫酸 Na2SO3 KMnO4溶液退色
实验结论 SO2有漂白性
B 浓盐酸 KMnO4 FeBr2溶液变为黄色 氧化性:Cl2>Br2
√C
稀硫酸
碳酸钠
CaCl2溶液无明显 变化
CO2不与CaCl2反应
D 浓硫酸 蔗糖
溴水退色
浓硫酸具有脱水 性、吸水性
强海行纳者 百有川志有。容乃大壁立千仞无欲则刚 心一志个要 人坚如,果意胸趣无要大乐志。,既使再有壮丽的举动也称不上是伟人。 治死天犹下 未者肯必输先心立去其,志贫。亦其能奈我何! 虽与长其不 当满一七辈尺子,乌而鸦心,雄莫万如丈当。一次鹰。 心燕志雀要 安坚知,鸿意鹄趣之要志乐哉。 并虽非长神 不仙满才七能尺烧,陶而器心,雄有万志丈的。人总可以学得精手艺。 志有之志所 始趋知,蓬无莱远近勿,届无,为穷总山觉复咫海尺不远能。限也;志之所向,无坚不摧。 顶海天纳立 百地川奇有男容子乃,大要壁把立乾千坤仞扭无转欲来则。刚 雄胸心无志 大四志海,,枉万活里一望世风。尘。 不卒怕子路 过远河,就意怕在志吃短帅。
试剂乙 CaCO3 Na2SO3 MnO2 KMnO4
试剂丙
Na2SiO3溶液 BaCl2溶液 酸性 KI-淀粉溶液
Na2S溶液
丙中的现象 有白色沉淀生成 有白色沉淀生成 溶液变为蓝色 有淡黄色沉淀生成
微诊断 判断正误,正确的画“√”,错误的画“×”。
1.因为氢气无毒,制备氢气时多余的尾气可以直接排放到空气中。( × )
找杂质?
实验原理:反应方程式
如何测量气 体体积?
2020届化学实验安全之防倒吸、防堵塞、防污染10ppt

9.实验安全: ★防爆:
①防爆炸 •可燃气体( 如H2、CO、CH4等 )在点燃或 加热 前, 需要验纯( 爆鸣实验 )或 赶走装置中的空气 , 以防爆炸
•加热液体时,要先 往容器中加入液体 ,再 加热 , 以防冷热相遇仪器炸裂
•实验结束时,要先 从溶液中撤走导管 ,再 熄灭酒精灯 , 或注意 酒精灯的熄灭顺序 ,以防倒吸仪器炸裂
化学实验安全基础知识之 防污染、防暴沸、防倒吸、防堵塞
9.实验安全: ★防污染:
①尾气处理
NH3 HCl SO2
针对:有毒有害气体(如SO2)、非空气成分(如H2)
方法:吸收法。吸收Cl2尾气,选用 (石灰水/Na√OH溶液)
燃烧法。 如H2、CO等可燃气体 收集法。如H2、CO、Cl2等气体可用气球/气囊收集 ②有害有毒气体的实验,需在 通风橱 内进行
食盐水
减缓NH3与空气的对流 防止产生的泡沫从导管口喷出
CaC2
多孔球泡:增大气体与溶液的接触面积 使反应充分进行
①漏斗等不要插入液面过深
a. b.
c. d.
e.
f.
g.
②安全瓶:瓶口朝上时,空瓶+短进; 瓶口朝下时,空瓶+长进
h.
i.
j.
k.
l.
③利用密度大于水的有机溶剂防倒吸,管口伸入有Hale Waihona Puke 层m.n.o.
p.
9.实验安全: ★防堵塞:
棉花团
①液封平衡式 ②恒压式 Cl2 Fe
③防阻式 防止固体粉末堵塞导气管
(棉花团置于出气口处) ④大口径式 防止升华的物质凝华时堵塞导管
基础(3)3.下列装置能达到实验目的的是( B )
A.熔化Na2CO3
中学化学常见过滤装置 ppt

Hale Waihona Puke -11.隔离式: 导气管末端不插入液体中,导气管与液体呈隔
离状态。
-
2
2.倒置漏斗式和肚容式: 由于漏斗容积较大,当水进入漏斗内时,烧杯中
液面显著下降而低于漏斗口,且漏斗中的吸收液受自 身重力的作用又流回烧瓶内,从而防止吸收液的倒吸 。
-
3
3.接收式(安全瓶式): 使用较大容积的容器将可能倒吸来的液体接收,
防止进入前端装置(气体发生装置等)。
-
4
4.分液式: 对于易溶于水难溶于有机溶剂的气体,让气体先
通过有机溶剂起到延时缓冲作用再与吸收液接触而防 止倒吸。
-
5
专题18- 安全瓶和防倒吸装置

A
B
c
d
Ⅲ
Ⅳ
Ⅴ C
D
稀NaOH 溶液
真题再现
解法剖析
真题演练
07 2007年江苏卷10题
用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目
的是( D)
Cl2
HCl
浓 H2SO4
H2O
(A)干燥Cl2 (B)吸收HCl (C)石油的分馏 (D)吸收NH3
【解析】氨气能和酸反应生成盐,四氯化碳和氨气不反应,且稀硫酸和四氯化碳不互溶,虽然氨气在稀硫 酸中的溶解度较多,但因为在四氯化碳中不溶解,所以不会产生倒吸现象。
防倒吸的改进装置
隔离式(如右图Ⅵ) 导管末端与液体吸收剂呈 隔离状态,导管内压强不 会减小,能起到防倒吸作 用。 Ⅶ图提高烧瓶的高度 溶液难以倒吸。
Ⅵ
Ⅶ
【解析】用HCOOH 浓硫酸 CO↑+H2O 制备CO气体时会有杂质酸性气体和水,c装置用来除去 CO中的酸性气体杂质时易发生倒吸,所以b装置的作用是防倒吸。
真题再现
解法剖析
真题演练
06 2014年山东卷31题
工业上常利用含硫废水生Na2S2O3•5H2O,实验室可用如下装置 (略去部分夹持仪器)模拟生产过程。
→ 气体
气体
Cl2 HCl H2S CO2
l体积水约能吸收 2 500 2.6 1 气体体积数
【解析】由四种气体的溶解度表可以看出,HCl溶解度最大,溶解的速率大于气体进入洗气管的速率,
导致左侧洗气管气压降低,出现如图所示情形
真题再现
解法剖析
真题演练
03 2019年全国卷I 9题
实验室制溴苯的装置如下图所示,关于实验操作或叙述错误的是(D)
专题4 实验条件的控制-备战2023年高考化学新编大一轮复习讲义(解析版)

专题6.4 实验条件的控制(1)排气方法为了防止空气中的成分氧气、CO2、水蒸气干扰实验,常用其他稳定的气体(如氮气)排尽装置中的空气;有时也可充分利用反应产物气体(如:氨气、氯气、二氧化硫)等排尽装置中的空气。
①防氧化、防水解为了防止空气的成分氧气、CO2、水蒸气干扰实验,常用其他稳定的气体(如氮气)排尽装置中的空气;有时也可充分利用反应物气体(如:氨气、氯气、二氧化硫)等排尽装置中的空气。
②定量测定气体实验中为了充分吸收某种需分析或测定的气体,常用其他稳定的气体(如氮气)作载气;有时也可充分利用反应物气体(如氧气)作载气,将生成的气体压入指定的吸收装置中。
(2)控制气体的流速及用量①用分液漏斗控制液体滴加的速度和用量。
②观察气泡,控制气流速度,如图,可观察气泡得到N2、H2的体积比约为1∶2的混合气。
③平衡气压如图,用长玻璃管平衡气压,防堵塞。
(3)压送液体根据装置的密封性,让反应生成气体或消耗气体,产生压强差,将液体压入或倒流入另一反应容器。
(4)温度控制①控制低温的目的:减少某些反应物或产品分解如H2O2、NH4HCO3等;减少某些反应物或产品挥发,如盐酸、氨水等;防止某物质水解,避免副反应发生等。
②采取加热的目的:加快反应速率或使平衡移动,加速溶解等。
③常考温度控制方式:a.水浴加热:均匀加热,反应温度100 ℃以下。
b.油浴加热:均匀加热,反应温度100~260 ℃。
c.冰水冷却:使某物质液化、降低产物的溶解度;减少其他副反应,提高产品纯度等。
d.保温:如中和热测定时,两烧杯之间填泡沫,真空双层玻璃容器等。
[巩固提升]1.ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得。
已知:无水草酸100 ℃可以升华。
在制备ClO2时实验需在60~100 ℃进行的原因是___________________________________________________________,控制所需温度的方法是___________________________________________________2.Cl2与NO在常温常压下可合成亚硝酰氯(NOCl),它的熔点为-64.5 ℃,沸点为-5.5 ℃,常温下是黄色的有毒气体,遇水易水解。
2021届高考化学复习:专题三 有机制备实验(综合实验)(有答案和详细解析)

专题三有机制备实验(综合实验)知识梳理:“有机实验”在高考中频频出现,主要涉及有机物的制备、有机物官能团性质的实验探究等。
常常考查蒸馏和分液操作、反应条件的控制、产率的计算等问题。
(1)分离液体混合物的方法方法适用条件实例说明萃取互不相溶的液体混合物分离CCl4和水等分液时下层液体从下口流出,上层液体从上口倒出蒸馏两种或两种以上互溶的液体,沸点相差较大分离酒精和水在蒸馏烧瓶中放少量碎瓷片,防止液体暴沸(2)典型装置①反应装置②蒸馏装置③高考真题中出现的实验装置特别提醒球形冷凝管由于气体与冷凝水接触时间长,具有较好的冷凝效果,但必须竖直放置,所以蒸馏装置必须用直形冷凝管。
强化训练1.(2020·全国卷Ⅱ,28)咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5 ℃,100 ℃以上开始升华),有兴奋大脑神经和利尿等作用。
茶叶中含咖啡因约1%~5%、单宁酸(K a约为10-6,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。
实验室从茶叶中提取咖啡因的流程如图所示。
索氏提取装置如图所示。
实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。
萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。
回答下列问题。
(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是__________________。
圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒__________。
(2)提取过程不可选用明火直接加热,原因是____________________。
与常规的萃取相比,采用索氏提取器的优点是______________________。
(3)提取液需经“蒸馏浓缩”除去大部分溶剂。
与水相比,乙醇作为萃取剂的优点是____________________。
“蒸馏浓缩”需选用的仪器除了圆底烧瓶、蒸馏水、温度计、接收管之外,还有________(填标号)。
中学化学常用实验装置归纳讲解
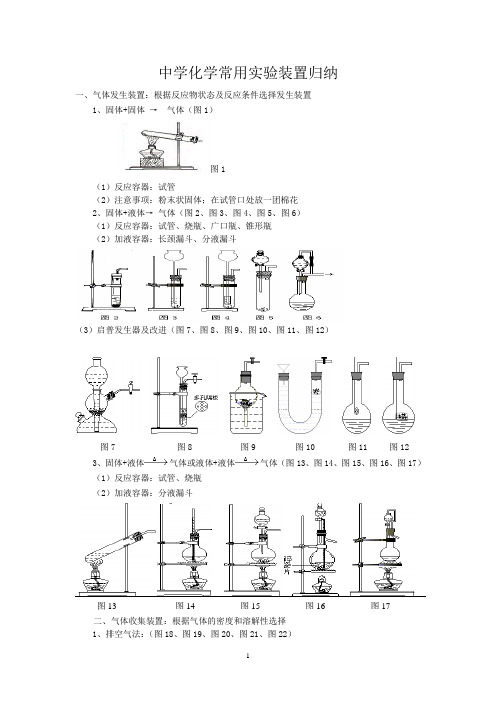
中学化学常用实验装置归纳一、气体发生装置:根据反应物状态及反应条件选择发生装置1、固体+固体→气体(图1)图1(1)反应容器:试管(2)注意事项:粉末状固体;在试管口处放一团棉花2、固体+液体→气体(图2、图3、图4、图5、图6)(1)反应容器:试管、烧瓶、广口瓶、锥形瓶(2)加液容器:长颈漏斗、分液漏斗(3)启普发生器及改进(图7、图8、图9、图10、图11、图12)图7 图8 图9 图10 图11 图123、固体+液体气体或液体+液体气体(图13、图14、图15、图16、图17)(1)反应容器:试管、烧瓶(2)加液容器:分液漏斗图13 图14 图15 图16 图17二、气体收集装置:根据气体的密度和溶解性选择1、排空气法:(图18、图19、图20、图21、图22)2、排水法图(图24、图25) (3)贮气瓶(图26)三、尾气处理装置:根据多余气体的性质选择 1、在水中溶解性不大的气体(图27)燃烧或袋装法 (图28、图29)3、在水中溶解性很大的气体:防倒吸(图30-图38)四、气体净化装置:根据净化剂的状态和条件选择(图39、图40、图41、图42)五、气体性质实验装置:根据反应物的状态及反应的条件选择 1、常温反应装置(图43、图44)图18 图19 图20 图21 图22 图23图24 图25图26图27 图28图29图30 图31 图32 图33 图34 图35 图36 图37 图38图39 图40 图41 图42图43图44 图45图46 图472、加热反应装置(图45、图46、图47)3、冷却装置(图48、图49、图50):图50六、排水量气装置:测量气体的体积(图51、图52、图53、图54)七、装置气密性检查:1、利用热源:用手捂或用酒精灯微热,看是否有气泡,移开热源,是否有一段水柱。
图55二、物质的分离与提纯方法方法适用范围主要仪器注意点实例固+液蒸发易溶固体与液体分开酒精灯、蒸发皿、玻璃棒①不断搅拌;②最后用余热加热;③液体不超过容积2/3NaCl(H2O)固+固结晶溶解度差别大的溶质分开NaCl(NaNO3) 升华能升华固体与不升华物分开酒精灯I2(NaCl)固+液过滤易溶物与难溶物分开漏斗、烧杯①一角、二低、三碰;②沉淀要洗涤;③定量实验要“无损”NaCl(CaCO3)液+液萃取溶质在互不相溶的溶剂里,溶解度的不同,把溶质分离出来分液漏斗①先查漏;②对萃取剂的要求;③使漏斗内外大气相通;④上层液体从上口倒出从溴水中提取Br2分液分离互不相溶液体分液漏斗乙酸乙酯与饱和Na2CO3溶液蒸馏分离沸点不同混合溶液蒸馏烧瓶、冷凝管、温度计、牛角管①温度计水银球位于支管处;②冷凝水从下口通入;③加碎瓷片乙醇和水、I2和CCl4 渗析分离胶体与混在其中的分子、离子半透膜更换蒸馏水淀粉与NaCl盐析 加入某些盐,使溶质的溶解度降低而析出烧杯用固体盐或浓溶液 蛋白质溶液、 硬脂酸钠和甘油气+气洗气 易溶气与难溶气分开洗气瓶长进短出 CO 2(HCl) 液化 沸点不同气分开U 形管常用冰水NO 2(N 2O 4)附:常见物质的分离和提纯装置:如图2方法 热分解法沉淀分离法酸碱分离法水解分离法氧化还原法实例NH 4Cl(NaCl) NaCl(BaCl 2)MgCl 2(AlCl 3) Mg 2+(Fe 3+)Fe 2+(Cu 2+)二、物质的鉴别物质的检验通常有鉴定、鉴别和推断三类,它们的共同点是:依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理。
