潮州2014二模化学
高考化学复习广东各地市二模汇编---化工流程
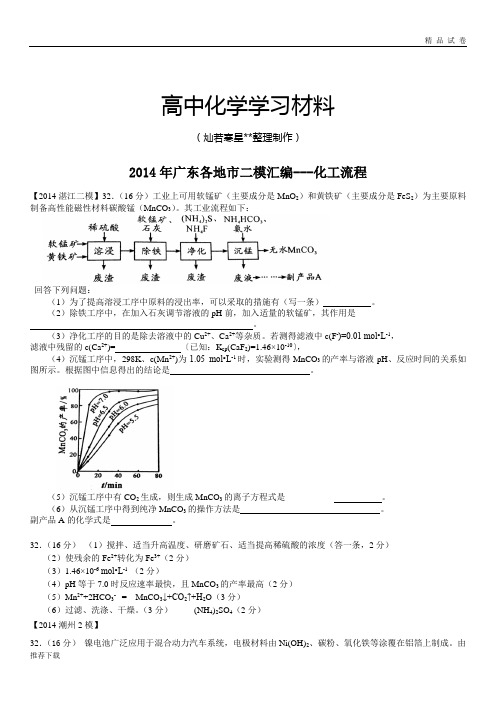
高中化学学习材料(灿若寒星**整理制作)2014年广东各地市二模汇编---化工流程【2014湛江二模】32.(16分)工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。
其工业流程如下:回答下列问题:(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有(写一条)。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。
若测得滤液中c(F-)=0.01 mol•L-1,滤液中残留的c(Ca2+)= 〔已知:K sp(CaF2)=1.46×10-10〕,(4)沉锰工序中,298K、c(Mn2+)为1.05 mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。
根据图中信息得出的结论是。
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是___________ 。
(6)从沉锰工序中得到纯净MnCO3的操作方法是。
副产品A的化学式是。
32.(16分)(1)搅拌、适当升高温度、研磨矿石、适当提高稀硫酸的浓度(答一条,2分)(2)使残余的Fe2+转化为Fe3+(2分)(3)1.46×10-6mol•L-1 (2分)(4)pH等于7.0时反应速率最快,且MnCO3的产率最高(2分)(5)Mn2++2HCO3- = MnCO3↓+CO2↑+H2O(3分)(6)过滤、洗涤、干燥。
(3分)(NH4)2SO4(2分)【2014潮州2模】32.(16分)镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。
由于电池使用后电极材料对环境有危害。
某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②Ksp (Ni(OH)2): 5.0×10-16 Ksp(NiC2O4): 4.0×10-10回答下列问题:(1)酸溶后所留残渣的主要成份(填物质名称)。
潮州市2014-2015学年高二上学期期末化学试题及答案模拟

潮州市2014~2015学年度第一学期期末高二级教学质量检测卷理科综合(化学·模拟)(考查范围:以选修4为主,兼顾必修1、必修2。
)本试卷共12页,共36小题,满分300分。
考试用时150分钟。
注意事项:1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名和考生号、试室号、座位号填写在答题卡上,并用2B铅笔在答题卡上的相应位置填涂考生号。
用2B铅笔将试卷类型(A)填涂在答题卡相应位置上。
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目选项的答案信息点涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,答案不能答在试卷上。
3.非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。
不按以上要求作答的答案无效。
4.考生必须保持答题卡的整洁。
考试结束后,将试卷和答题卡一并交回。
5.可能用到的相对原子质量:H:1 C:12 O:16 Ce:140一、单项选择题:本题包括16小题,每小题4分,共64分。
每小题给出的四个选项中,只有一个选项符合题目要求。
多选、错选均不得分。
7.乙烯是一种重要的化工原料,下列有关乙烯的说法中正确的是A.乙烯和苯的分子结构均含有碳碳双键B.右图石蜡油分解产生的气体只有乙烯,能使溴的CCl4溶液褪色C.乙烯的产量可以用来衡量一个国家的石油化工生产水平D.工业常用乙烯与水发生加成反应生产食用酒精8.下列各组离子,能在水溶液中大量共存的一组是A.K+、Al3+、NO3-、CO32- B.H+、Na+、Fe2+、NO3-C.Na+、Ba2+、Cl-、NO3- D.K+、NH4+、SO42-、OH-9.如右图是反应Br+H 2HBr+H的能量变化示意图,下列说法正确的是A.该反应的ΔH=+(E1-E2)kJ·mol-1B.加入催化剂,该化学反应的反应热变大C.反应物的总能量高于生成物的总能量D.该反应为放热反应10.将pH=13的强碱溶液与pH=2的强酸溶液混合后,pH=11,则强碱与强酸的体积比为A.11:1 B.9:1 C.1:1 D.1:911.已知HA为酸性略强于醋酸的一元弱酸,则在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是A.c(Na+)>c(A-)>c(H+)>c(OH-) B.c(Na+)+ c(H+) = c(A-)+ c(OH-)C.c(Na+)+ c(OH-)= c(A-)+ c(H+) D.c(Na+)>c(OH-)>c(A-)>c(H+)12.电瓶车所用的电池一般是铅蓄电池,右图是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-2PbSO4+2H2O,根据上述变化,下列说法中正确的是:A.放电时电极PbO2发生氧化反应B.放电时电子流向由A到BC.工作时蓄电池里电解质溶液的pH不变D.放电时正极反应是PbO2+2e-+4H++SO42- ===PbSO4+2H2O,二、双项选择题:本题包括9小题,每小题6分,共54分。
2014广东各地市模拟试题汇编 化学平衡移动

2014广东各地市模拟试题汇编 化学平衡移动2014广州一模)10.在恒容密闭容器中,反应CO 2(g)+3H 2(g) CH 3OH(g)+H 2O(g) △H <0达到平衡后,改变某一条件,下列说法正确的是A .升高温度,正反应速率减小,逆反应速率增加,平衡逆向移动B .升高温度,可提高CO 2转化率C .增加H 2的浓度,可提高CO 2转化率D .改用高效催化剂,可增大反应的平衡常数C(2014潮州二模)12.高炉炼铁过程中发生的反应:31Fe 2O 3(s)+CO(g)32Fe(s)+CO 2(g),已知该反应在不同温度下的平衡常数如下表,下列说法不正确的是A .△H <0B .该反应的平衡常数表达式是K =)()(2CO c CO c C .其他条件不变,向平衡体系充入CO 2气体,K 值减小D .其他条件不变,升高温度,可以降低CO 的平衡转化率C(2014佛山一模)11.己知N 2(g)+3H 2(g)2NH 3(g) △H =— 92.4kJ•mo1—1,下列结论正确的是A .在密闭容器中加入1mol N 2和3mol H 2充分反应放热92.4kJB .N 2(g)+3H 2(g) 2NH 3(l) △H =— QkJ•mo1—1,则Q>92.4C .增大压强,平衡向右移动,平衡常数增大D .若一定条件下反应达到平衡,N 2的转化率为20%,则H 2的转化率一定为60% B(2014佛山二模)12、下列有关说法错误的是A 为保护海轮的船壳,常在船壳上镶入锌块B 纯碱溶于热水中,去污效果增强,说明纯碱的水解反应是吸热反应C 已知工业合成氨气△H <0,达平衡后,升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动D NH 3(g) + HCl(g)=NH 4Cl(s) 较低温度下能自发进行,说明该反应的△H <0 C(2014韶关一模)12.对处于平衡状态的反应2A (g )+B(g)2C(g) △H <0,下列叙述正确的是A .增大A 浓度的瞬间,正V 增大,V 逆不变B .升高温度,正V 减小,V 逆增大C .增大压强.正V 增大,V 逆减小D .加入催化剂,正V 、V 逆都增大 A(2014韶关二模)11.已知可逆反应CO (g )+H 2O (g ) 催化剂加热CO 2(g )+H 2(g ) ΔH <0,反应达到平衡状态后,欲提高CO 的转化率,可以采取的措施为A .增大压强B .升高温度C .增大CO 的浓度D .分离出CO 2D。
2014届广东潮州高考化学二模试卷及答案解析

2013~2014学年度潮州市高三第二次模拟考试化学科试题相对原子质量:H--1、N--14、O--16、Ag--108一、单选题:每小题4分,在每小题给出的四个选项中,只有一个选项符合题目要求。
7.下列说法正确的是A .煤的液化和气化都是物理变化B .乙醇、乙酸和甲醛广泛应用于食品加工C .蛋白质、橡胶和塑料都是天然高分子D .高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 8.下列条件下,离子能大量共存或者离子方程式正确的是A .pH =1的溶液中:Fe 2+、ClO -、Na +、SO 42-B .在含较多Al 3+的溶液中:K +、Cl -、HCO 3-C .一小块钠投入到CuSO 4溶液中:2Na +Cu 2+=Cu +2Na +D .铜溶于稀硝酸:3Cu +8H ++2NO 3-=3Cu 2++2NO↑+4H 2O 9.N A 表示阿伏加德罗常数,下列叙述正确的是 A .常温下,9gH 2O 中含N A 个O –H 键B .1 molFe 2+与足量稀硝酸反应,转移3N A 个电子C .常温常压下,22.4LSO 2和O 2的混合气体中含2N A 个氧原子D .0.1mol·L –1KAl(SO 4)2溶液中含0.2N A 个SO 42-A .常温下浓硫酸能使铝发生钝化,故可在常温下用铝制容器贮藏运输浓硫酸B .二氧化硅不与任何酸反应,可用石英制造耐酸容器C .二氧化氯具有还原性,可用于自来水的杀菌消毒D .铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 12.高炉炼铁过程中发生的反应:31Fe 2O 3(s)+CO(g)32Fe(s)+CO 2(g),已知该反应在不同温度下的平衡常数如下表,下列说法不正确的是A .△H <0B .该反应的平衡常数表达式是K =)()(2CO c CO cC .其他条件不变,向平衡体系充入CO 2气体,K 值减小D .其他条件不变,升高温度,可以降低CO 的平衡转化率二.双选题:共2小题,每小题6分,有两个选项符合题目要求22YX Z WA--C.气态氢化物的稳定性:Z﹥W D.工业上电解X和W化合物的水溶液制备X 23.下列实验不能达到预期目的的是序号实验操作实验目的A取少量溶液滴加Ca(OH)2溶液,观察是否出现白色浑浊确定NaHCO3溶液中是否混有Na2CO3B向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液说明一种沉淀能转化为另一种溶解度更小的沉淀C 测定等浓度的HCl、HNO3两溶液的pH 比较氯、N的非金属性强弱D 将充满NO2的密闭玻璃球浸泡在热水中研究温度对化学平衡移动的影响三、非选择题30.(16分)萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。
2014年中考化学二模试题(含答案)

2014年高中阶段学校招生模拟考试(二)化学说明:1.全卷共6页。
满分100分,考试用时80分钟。
2.答案均填写在答题卡内3.可能用到的相对原子质量:H—l C—12 O—16 Ca—40一、选择题(本大题共14小题,每小题2分,共28分。
在每小题列出的四个选项中,只有一个是正确的。
请将所选的选项写在答题卡对应题目上)1.下列物质的性质属于化学性质的是A.颜色、状态B.溶解性C.密度、硬度D.可燃性2.下图所示的变化中,属于化学变化的是A.石油分馏 B.净化水 C.蒸发食盐水 D.高炉炼铁3.党的十八大报告中把“生态文明建设”首次提升到更高的战略层面,要求加大自然生态系统和环境保护力度。
下列做法不符合...这一要求的是A.合理开发洁净能源B.全面关停化工企业C.改进汽车尾气净化技术D.研发易降解的生物农药和塑料4.身边处处有化学,学习化学能帮助我们解决生活中遇到的一些问题。
下列做法可行的是A.家中盛开水的玻璃瓶内壁有水垢可用纯碱清洗B.鉴别硬水和软水可以用肥皂水C.用甲醛浸泡海产品可以保鲜D.内壁有植物油的玻璃杯可用食醋清洗5.物质的性质决定物质的用途,下列描述的物质性质与其对应用途不相符...的是A.浓硫酸有吸水性,可用作干燥剂B.石墨有导电性,可用作电池的电极C.氧气有助燃性,可用于登山和潜水D.一氧化碳有还原性,可用于冶炼金属6.在元素周期表中汞元素的某些信息如图所示,下列有关汞的说法正确的是A.元素符号为HgB.属于非金属元素C.原子核内中子数为80D.相对原子质量是200.6g7.下列各组物质中,按氯元素的化合价由低到高的顺序排列的是A.HCl、Cl2、Ca(ClO)2、KClO3 B.Ca(ClO)2、HCl、Cl2、KClO3C.Cl2、HCl、Ca(ClO)2、KClO3 D.KClO3、Ca(ClO)2、Cl2、HCl8.进行化学实验必须注意安全,下列实验操作中正确的是A.不慎将浓硫酸沾到皮肤上,应立即用稀氨水冲洗,再涂上硼酸溶液B.氢氧化钠有强烈的腐蚀性,实验使用时,最好戴上防护眼镜C. 酒精灯失火应立刻用灭火器扑灭D.为了便于观察,给试管里的液体加热时试管口应对着自己9.通过下列类型的反应:①化合反应,②分解反应,③置换反应,④复分解反应,能得到二氧化碳的是 A.只有① B.只有①② C.只有①②③ D.四种反应都可以 10.把等质量的X 、Y 、Z 、M 四种金属分别加入到同体积、同浓度的足量稀盐酸中,再把X 加入到Z (NO 3)2溶液中,M 加入到YNO 3溶液中。
2014广东各地市模拟试题汇编 化学实验设计

2014广东各地市模拟试题汇编化学实验设计1.(2014广州一模)硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2(该反应△H>0)某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。
(1)吸硫装置如图所示。
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是,表明SO2吸收效率低的实验现象是B中溶液。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是、。
(写出两条)(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。
(室温时CaCO3饱和溶液的pH=10.2)限选..试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。
则c(Na2S2O3)=_________________________mol·L-1。
(只列出算式,不作运算)已知:Cr2O72-+6I-+14H+=== 2Cr3++3I2+7H2O 2S2O32-+I2===S4O62-+2I-2.(2014广州二模)(1)某兴趣小组在实验室探究工业合成硝酸的化学原理。
①氨的催化氧化:图a是探究氨的催化氧化的简易装置,实验中观察到锥形瓶中铂丝保持红热,有红棕色气体生成或白烟产生。
白烟的成分是___________(填化学式)。
②NO2的吸收:如图b所示,将一瓶NO2倒置于水槽中,在水下移开玻璃片,可观察到的现象是___________________。
2014广东各地市模拟试题汇编 化学实验

2014广东各地市模拟试题汇编 化学实验(2014广州调研) 8.下列实验不能..达到目的的是 A .用饱和NaHCO 3溶液除去CO 2中混有的HClB .用加热蒸干CuCl 2溶液的方法制备无水CuCl 2固体C .用分液漏斗分离CCl 4萃取碘水后已分层的有机层和水层D .用加热分解的方法区分碳酸钠和碳酸氢钠两种固体B(2014广州调研)10.实验室中某些气体的制取、收集、尾气处理(或性质实验)装置如图所示,用此装置和下表中提供的物质完成相关实验,合理的选项是C(2014广州调研)BD(2014广州一模)I IIIIIBC(2014广州二模)(2014潮州二模)23.下列实验不能达到预期目的的是AC(2014东莞一模)AC(2014佛山一模)10、下列叙述正确的是A.图I装置中通入N2和O2的作用是相同的B.图Ⅱ中甲、乙两装置产生喷泉的原理一样C.图Ⅲ①装置中镁片是原电池的负极;②装置中镁片是原电池的正极D.图Ⅳ分液漏斗盛硝酸能证明非金属性N>C>Si,盛硫酸能证明非金属性S>C>Si C(2014佛山二模)(2014惠州一模)(2014江门调研)10.某同学用滤纸折成一个纸蝴蝶并喷洒一种溶液(保持湿润),挂在铁架台上。
另取一只盛某种溶液的烧杯,放在纸蝴蝶的下方(如右图)。
B(2014江门调研)(2014江门一模)BC(2014揭阳一模)(2014揭阳二模)A(2014茂名一模)11.下列实验方法正确且能达到目的的是温度计I II III IVA .用装置I 除去CO 2中的SO 2B .实验室用装置II 制备NH 3C .用装置III 制备乙烯D .装置IV 比较酸性H 2CO 3>苯酚C(2014茂名二模)12.下列实验能达到目的的是A .用浓FeCl 3溶液和NaOH 溶液混合制备Fe(OH)3胶体B .将混有少量HCl 的CO 2通入饱和NaHCO 3溶液中除去HClC .测定等浓度的Na 2CO 3和Na 2SO 3 溶液的pH 大小,可比较非金属性:S CD .用AgNO 3溶液鉴别Na 2SO 4溶液与NaCl 溶液 B(2014清远一模)C(2014清远一模)11.下列药品和装置合理且能完成相应实验的是A .喷泉实验Na2CO 3溶液B.实验室制取并收集氨气C.制备氢氧化亚铁并观察白色沉淀D.验证苯中是否有碳碳双键D(2014清远二模)10.如下实验操作正确且能达到实验目的的是A.将十水碳酸钠置于蒸发皿中,加热脱去结晶水B.用分液漏斗分离溴乙烷与氢氧化钠溶液发生反应后的生成物C.用铁粉与稀硝酸反应,制取少量氢气,用排水法收集D.用酸式滴定管量取6.55 mL的KMnO4溶液D(2014汕头一模)的是11.物质制备过程中离不开物质的提纯。
广东省潮州市2015届高三第二次模拟考试理综化学试题

潮州市2014-2015年高三第二模拟考考试理科综合化学.本卷用到的相对原子质量::H-1 C-12 O-167.化学与生活、社会密切相关,下列说法不正确的是()A.维生素在天然食品中含量丰富,所以加工后的食品中维生素的含量也高B.2M+N=2P+2Q ,2P+M=Q(M、N为原料,Q为期望产品)符合“化学反应的绿色化”的要求C.稀的双氧水可用于清洗伤口,以达到杀菌、消毒的目的D.可以用Si3N4、Al2O3制作高温结构陶瓷制品8.水溶液中能大量共存的一组离子是:()A.K+、Al3+、NO3-、HCO3- B.H+、Na+、Fe2+、ClO-C.Na+、Ba2+、Cl-、NO3- D.K+、NH4+、SO42-、OH-9.设N A表示阿伏加德罗常数的数值,下列叙述正确的是()A.25℃时,pH=13的1L Ba(OH)2溶液中含有OH-数目为0.2N AB.标准状况下,1.12 L NO与1.12 L O2的混合物中含有的原子数为0.2N AC.常温下,4.6g乙醇含有C-H键总数为0.6 N AD.常温下,1 L 0.1 mol·L-1的NH4NO3溶液中氧原子数为0.3N A10.下列各选项陈述I和陈述II均正确且二者有因果关系的是()11.下列说法正确的是()A.100℃时,K w=10-12,此温度下pH=6的溶液一定显酸性HSO-在水溶液中只存在电离B.25℃时,0.1 mol/L的NaHSO3溶液pH=4,说明3平衡C.NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用D.25℃时,10 mL0.1 mol/LCH3COOH溶液与5 mL0.1 mol/LNaOH溶液混合,所得溶液中有2c(Na+)=c(CH3COO-)+c(CH3COOH)12.下图是一套电化学装置,对其有关说法错误的是()A.装置A是原电池,装置B是电解池B.反应一段时间后,装置B中溶液pH增大C.a口若消耗1 mol CH4,d口可产生4 mol气体CO2-+12H2O D.a口通入C2H6时的电极反应为C2H6—14e-+18OH-=2322.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E 的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2013~2014学年度潮州市高三第二次模拟考试 化学科试题可能用到的原子量:H--1、N--14、O--16、Ag--108 一、单项选择题 7.下列说法正确的是A .煤的液化和气化都是物理变化B .乙醇、乙酸和甲醛广泛应用于食品加工C .蛋白质、橡胶和塑料都是天然高分子D .高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 8.下列条件下,离子能大量共存或者离子方程式正确的是A .pH=1的溶液中:Fe 2+、ClO -、Na +、SO 42-B .在含较多Al 3+的溶液中:K +、Cl -、HCO 3-C .一小块钠投入到CuSO 4溶液中:2Na +Cu 2+= Cu +2Na +D .铜溶于稀硝酸:3Cu + 8H ++ 2NO 3- = 3Cu 2++ 2 NO ↑+ 4H 2O 9.N A 表示阿伏加德罗常数,下列叙述正确的是 A .常温下,9g H 2O 中含N A 个O –H 键B .1 molFe 2+与足量稀硝酸反应,转移3 N A 个电子C .常温常压下,22. 4L SO 2和O 2的混合气体中含2N A 个氧原子D .0. 1 mol·L –1KAl(SO 4)2溶液中含0.2N A 个SO 42-10.下列陈述中,Ⅰ、Ⅱ都正确且两者间具有因果关系的一组是选项 陈述Ⅰ陈述ⅡA Na 2O 2使酚酞溶液变红Na 2O 2能漂白织物、纸浆 B SO 2可使石蕊溶液先变红后褪色 SO 2的水溶液具有酸性和漂白性 C NH 3、HCl 可用作喷泉实验 NH 3、HCl 都极易溶于水D晶体硅是良好的半导体材料晶体硅可制作太阳能电池和光导纤维11.下列有关物质的性质和该性质的应用均正确的是A .常温下浓硫酸能使铝发生钝化,故可在常温下用铝制容器贮藏运输浓硫酸B .二氧化硅不与任何酸反应,可用石英制造耐酸容器C .二氧化氯具有还原性,可用于自来水的杀菌消毒D .铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 12.高炉炼铁过程中发生的反应:31Fe 2O 3(s)+CO(g)32Fe(s)+CO 2(g),已知该反应在不同温度下的平衡常数如下表,下列说法不.正确的是A .△H <0B .该反应的平衡常数表达式是K =)()(2CO c CO cC .其他条件不变,向平衡体系充入CO 2气体,K 值减小D .其他条件不变,升高温度,可以降低CO 的平衡转化率 二、双项选择题22.下图是元素周期表的一部分,下列说法正确的是YXZ WA .可在灰色区域“甲”中寻找催化剂B .离子半径:W -﹥Y 3-﹥X +C .气态氢化物的稳定性:Z ﹥WD .工业上电解X 和W 化合物的水溶液制备X 23.下列实验不能..达到预期目的的是:序号 实验操作实验目的A 取少量溶液滴加Ca(OH)2溶液,观察是否出现白色浑浊确定NaHCO 3溶液中是否混有Na 2CO 3B 向盛有1mL 硝酸银溶液的试管中滴加NaCl 溶液,至不再有沉淀生成,再向其中滴加Na 2S 溶液 说明一种沉淀能转化为另一种溶解度更小的沉淀C 测定等浓度的HCl 、HNO 3两溶液的pH 比较氯、N 的非金属性强弱 D将充满NO 2的密闭玻璃球浸泡在热水中研究温度对化学平衡移动的影响三、非选择题30.(16分)萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。
合成a -萜品醇G 的路线之一如下:温度/℃ 1000 1150 1300 平衡常数4.03.73.5甲已知:RCOOC2H5请回答下列问题:(1)A所含官能团的名称是________________,B的分子式为。
(2)B →C、E →F的反应类型分别为_____________、_____________。
(3)C →D的化学方程式为________________________________________________。
(4)写出同时满足下列条件的B的链状同分异构体的结构简式:_____________。
①核磁共振氢谱有2个吸收峰②能发生银镜反应(5)试剂Y的结构简式为______________________。
(6)G与H2O催化加成得不含手性碳原子(连有4个不同原子或原子团的碳原子叫手性碳原子)的化合物H,写出H的结构简式:________________________。
31.(16分)I.已知在常温常压下:① 2CH3OH(l)十3O2(g) 2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol—1② H2O(l) H2O(g) △H=+ 44.0 kJ.mo—1写出表示甲醇燃烧热...的热化学方程式。
II.磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图:δ(1)在Na3PO4溶液中,c(Na+)/c(PO43-) 3(填“>”“=”“<”),向Na3PO4溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为。
(2)从图中推断NaH2PO4溶液中各种微粒浓度大小关系正确的是。
(填选项字母)A、 C(Na+)> C(H2PO4 -)> C(H+)> C(HPO4 2-)> C(H3PO4 )B、 C(Na+)> C(H2PO4 -)> C(OH-)> C( H3PO4)> C(HPO4 2- )C、 C(H+)+ C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-)+C(H3PO4 )D、 C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4 )(3)假设25℃条件下测得0.1 mol·L–1的Na3PO4溶液的pH=12 ,近似计算出Na3PO4的第一步水解的水解常数Kh(写出计算过程,忽略Na3PO4的第二、第三步水解,结果保留两位有效数字)。
III .化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染。
电化学降解NO 3-的原理如下图...所示。
电源正极为 (填A 或B ),阴极反应式为 。
32.(16分) 镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。
由于电池使用后电极材料对环境有危害。
某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:已知:①NiCl 2易溶于水,Fe 3+不能氧化Ni 2+。
②K sp (Ni(OH)2): 5.0×10-16 K sp (NiC 2O 4): 4.0×10-10回答下列问题:(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO 调节溶液的pH ,析出沉淀的成分为____________________(填化学式);用pH 试纸测定某溶液pH 的具体操作是 。
(3)写出加入Na 2C 2O 4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH 溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)沉淀Ⅲ可被电解所得产物之一 (填化学式)氧化生成Ni(OH)3 ,如何洗涤Ni(OH)3 沉淀? 。
33.(16分)为了探究AgNO 3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ. AgNO 3的氧化性将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。
为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。
可选用试剂:KSCN溶液、NaOH溶液、氯水、KMnO4溶液。
⑴请完成下表:操作现象结论取少量除尽Ag+后的溶液于试管中,加入,振荡存在Fe3+取少量除尽Ag+后的溶液于试管中,加入1~2滴KMnO4存在Fe2+溶液,振荡【实验结论】Fe的氧化产物为存在Fe2+和Fe3+Ⅱ. AgNO3的热稳定性用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。
当反应结束以后,试管中残留固体为黑色。
⑵装置B的作用是。
⑶经小组讨论并验证该无色气体为O2,其验证方法是。
⑷【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:①Ag;②Ag2O;③Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验。
实验编号操作现象a 加入足量氨水,振荡黑色固体不溶解b 加入足量稀硝酸,振荡黑色固体溶解,并有气体产生【实验评价】根据上述实验,不能确定固体产物成分的实验是(填实验编号)。
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的方程式为。
【实验拓展】取2.0g AgNO3样品充分受热分解,共收集到标况下气体的体积为336mL,则样品中AgNO3的百分含量为。
2013~1014学年度潮州市第二次模拟考试理科综合化学科答题卷30.(16分)(1)名称为,B的分子式为。
(2)反应类型分别为、。
(3)。
(4)。
(5)。
(6)H的结构简式:。
31.(16分)I.。
II.(1),。
(2)。
(3)计算过程为:III.,。
32.(16分)(1)(填物质名称)。
(2)____________________(填化学式);具体操作是。
(3)。
(4),平衡常数为。
(5)(填化学式),。
33.(16分)Ⅰ.(1)请完成下表:操作现象结论取少量除尽Ag+后的溶液于试管中,存在Fe3+加入,振荡取少量除尽Ag+后的溶液于试管中,存在Fe2+加入1~2滴KMnO4溶液,振荡Ⅱ. ⑵装置B的作用是。
⑶。
⑷【实验评价】(填实验编号)。
【实验结论】方程式为。
【实验拓展】AgNO3的百分含量为。
2013~2014学年度潮州市高三第二次模拟考试化学科试题参考答案7 8 9 10 11 12 22 23D D A C A C AB AC30 、(16分,每空2分)(1)羰基、羧基C8H14O3 (2)取代反应、取代(或酯化)反应(3)(4)(5)(6)31 、(16分)I.CH3OH(g)+3/2 O2(g)= CO2(g)+2H2O(l) △H=-725.8kJ/mol (2分)II.(1)> HPO4 2- + H+=== H2PO4 -(每空2分,共4分)(2)AD(2分)(3) PO43-+ H2O HPO4 2- + OH- (1分)起始浓度(mol·L–1):0.1 0 0变化浓度(mol·L–1):0.01 0.01 0.01平衡浓度(mol·L–1):0.09 0.01 0.01 (1分)Kh===C (HPO4 2-)× C(OH-)/C( PO43-)=== 0.01× 0.01 / 0.09 === 1.1 × 10 -3 mol·L–1(2分,共4分)III. A 2NO3-+10e-+12H+=6H2O +N2↑(每空2分,共4分)32.(16分,每空2分)(1)碳粉(2)Fe(OH)3、Al(OH)3把干燥pH试纸置于表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取待测液滴在pH 试纸上,待显色后立即与标准比色卡比对即可读数。
